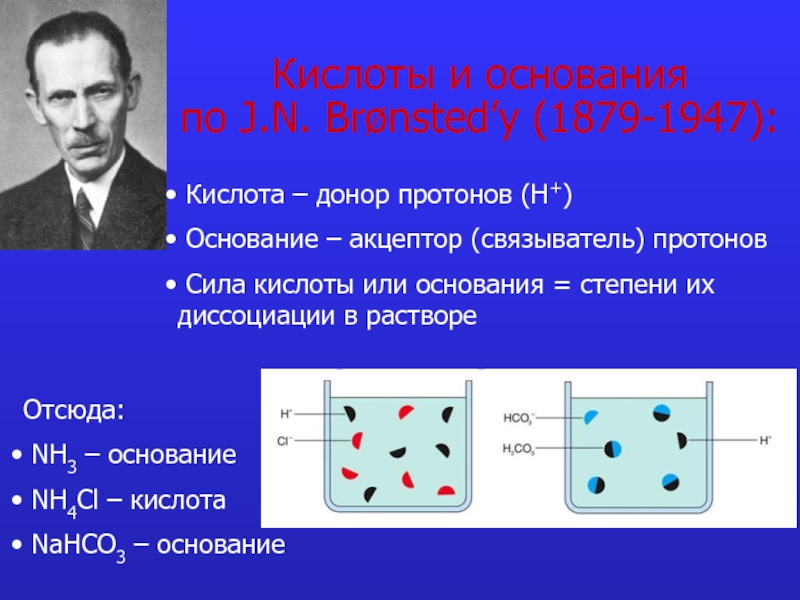
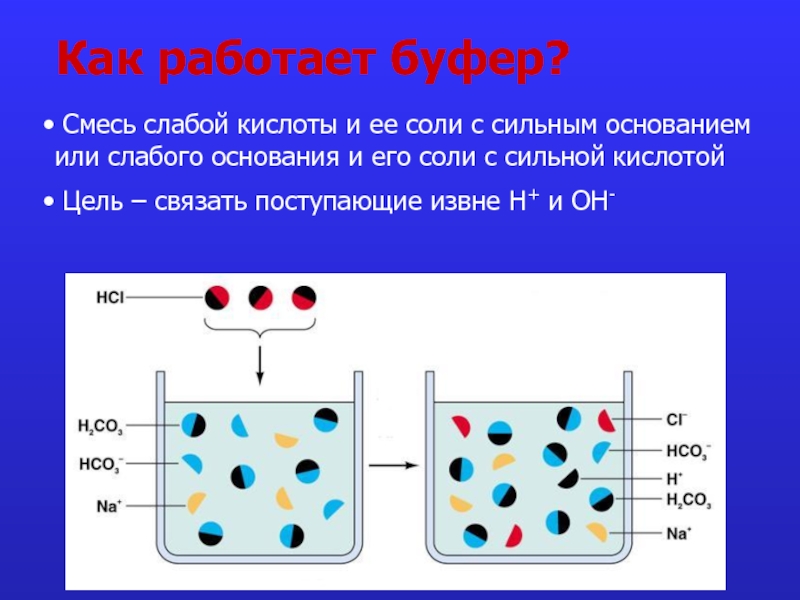
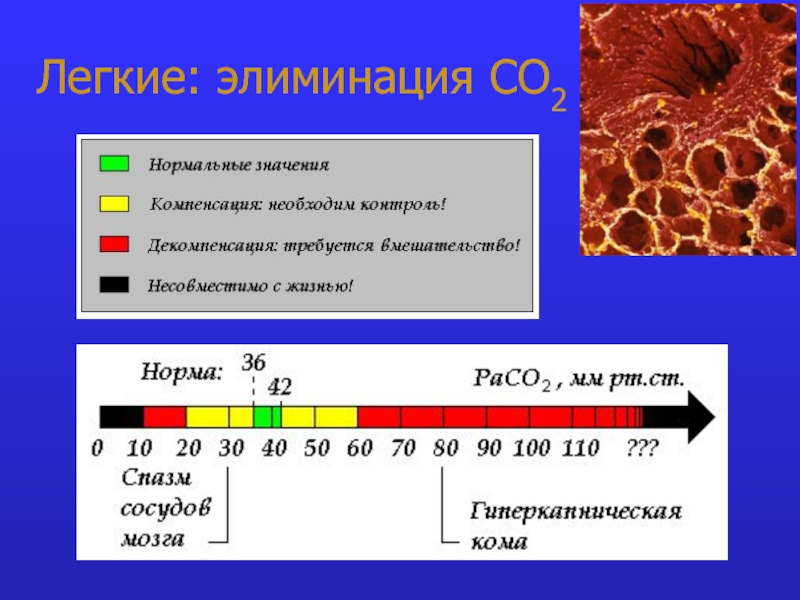
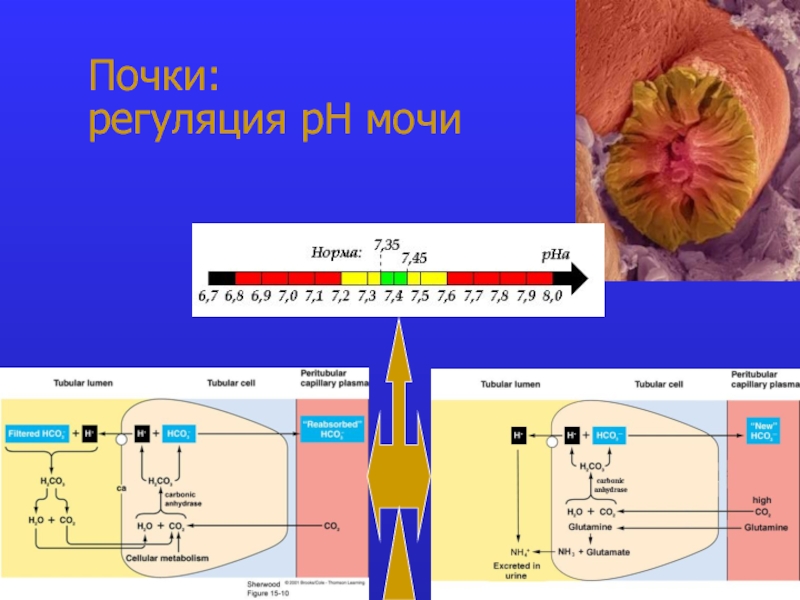
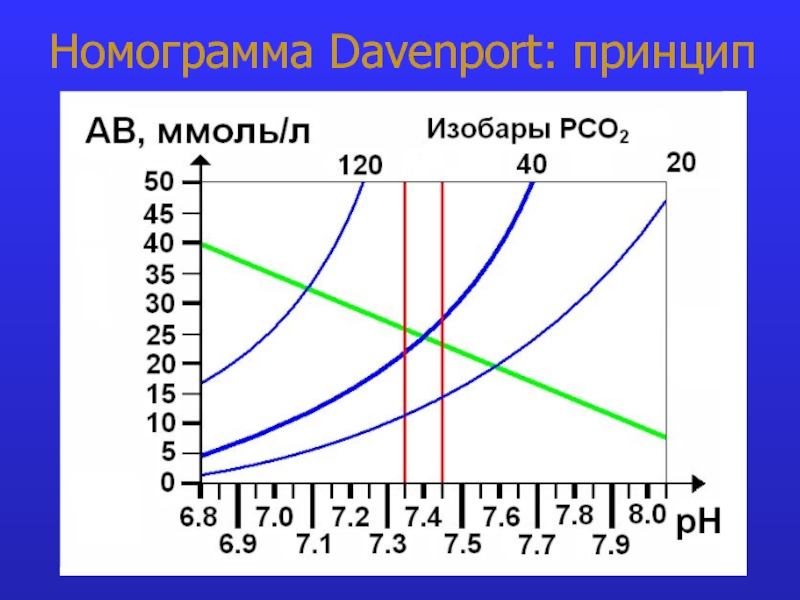
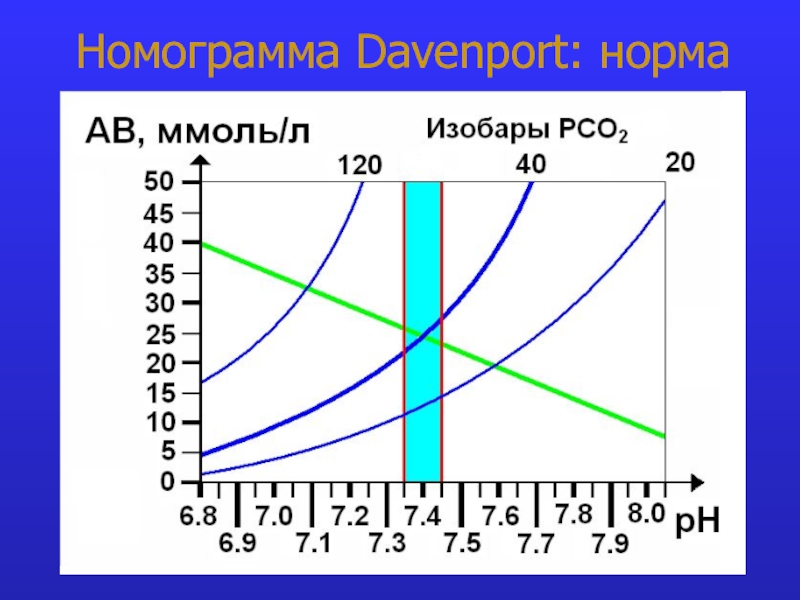
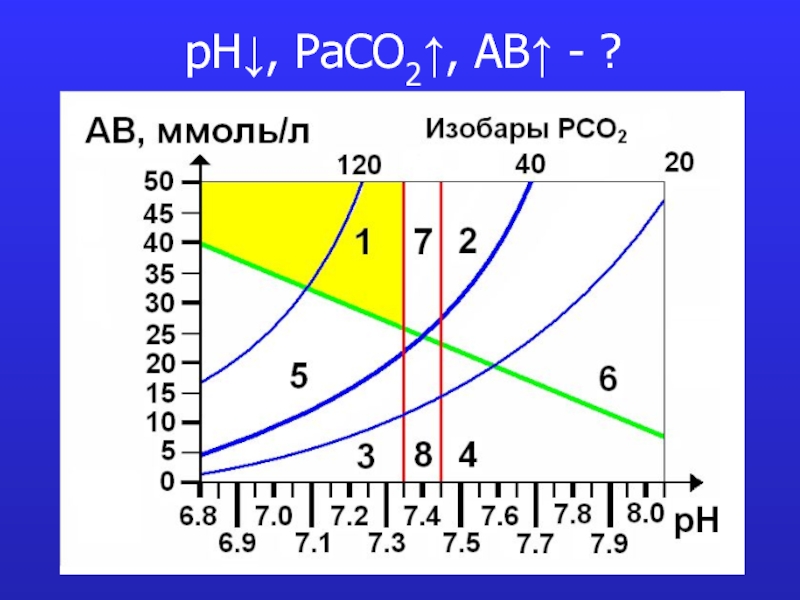
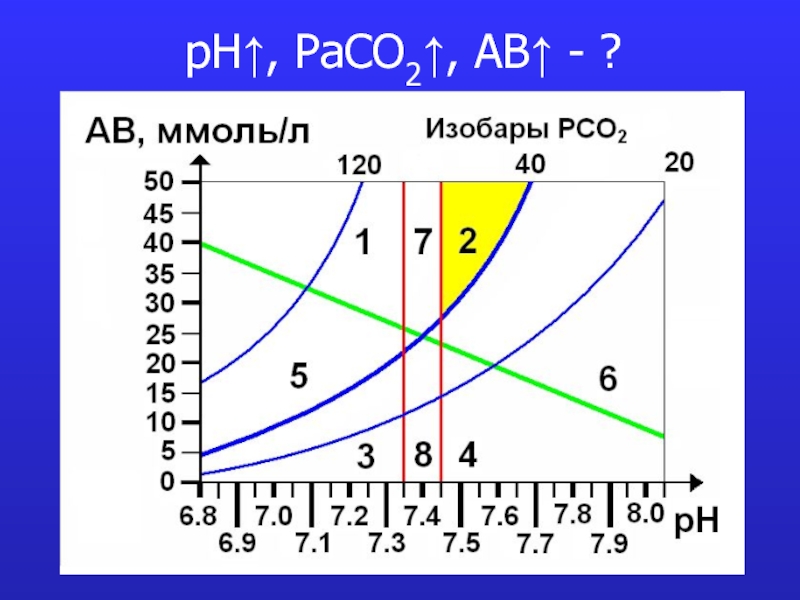
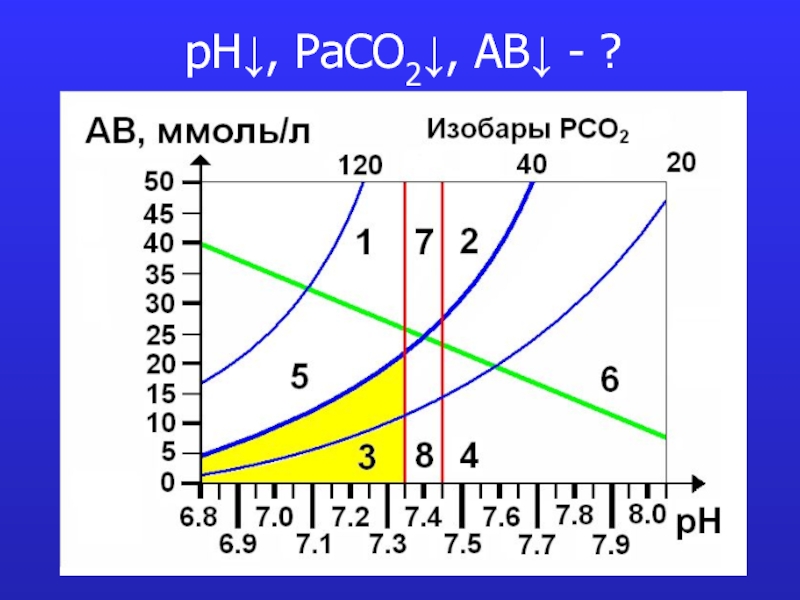
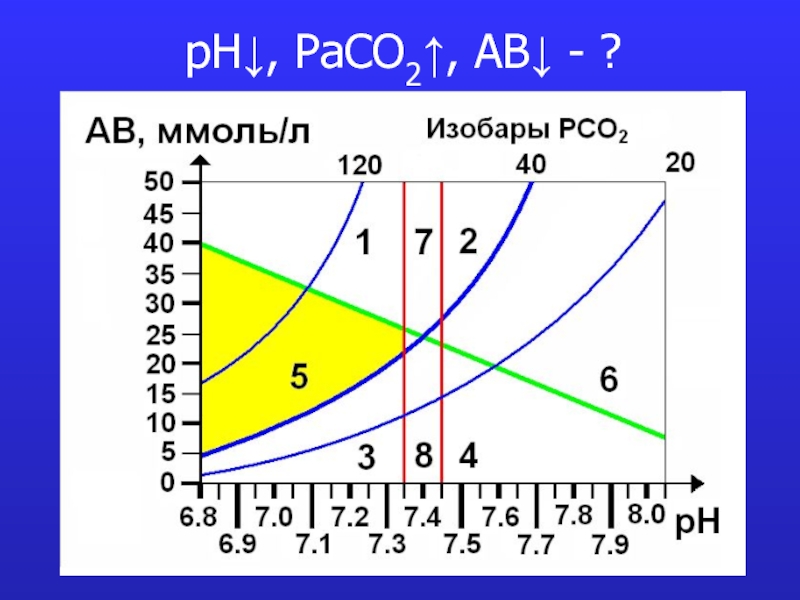
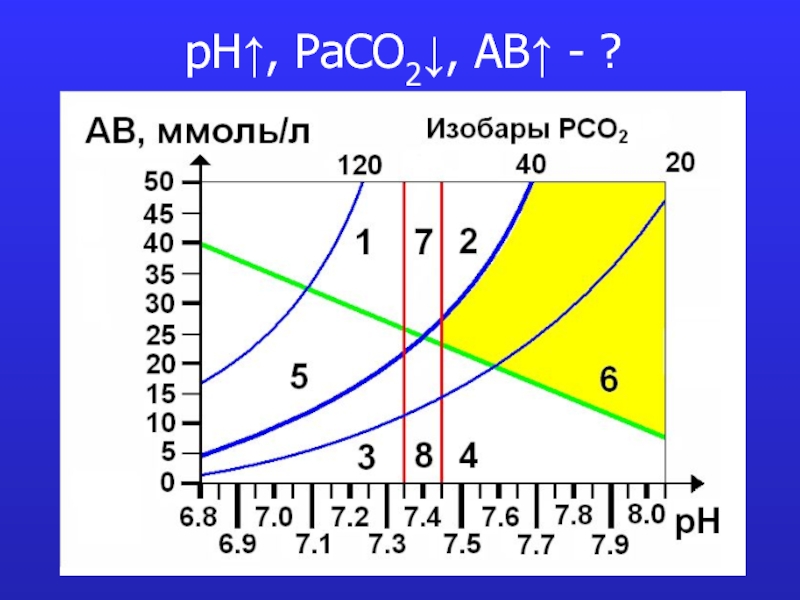
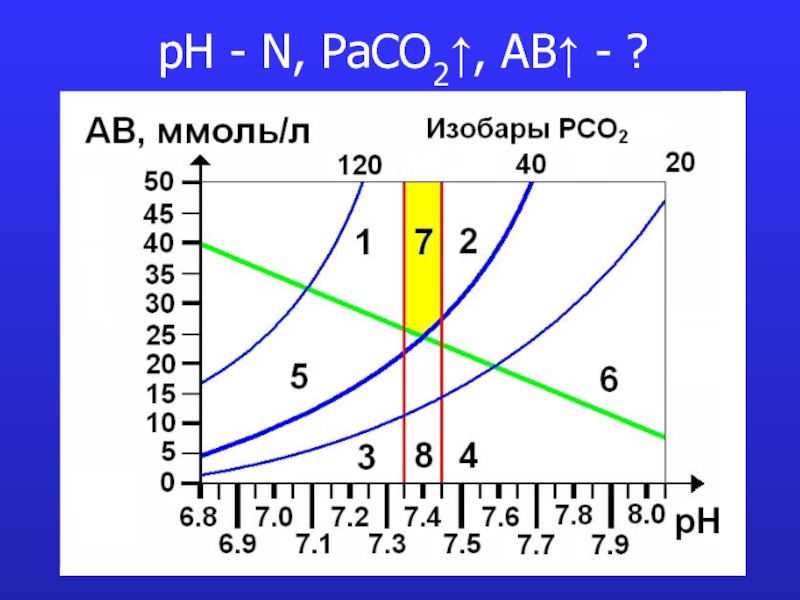
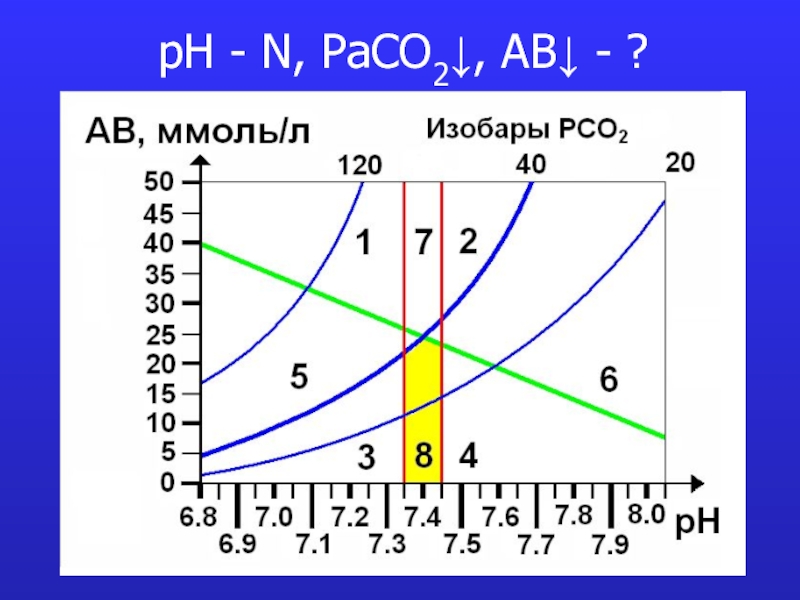
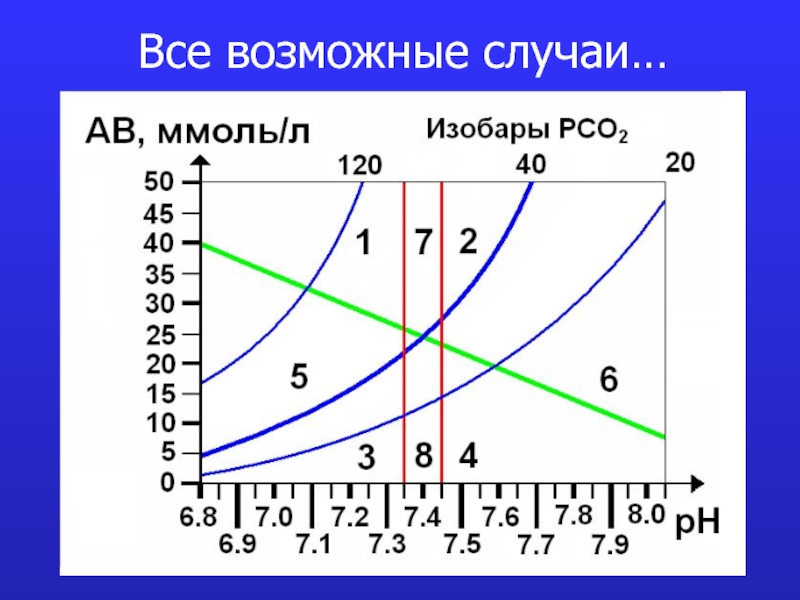
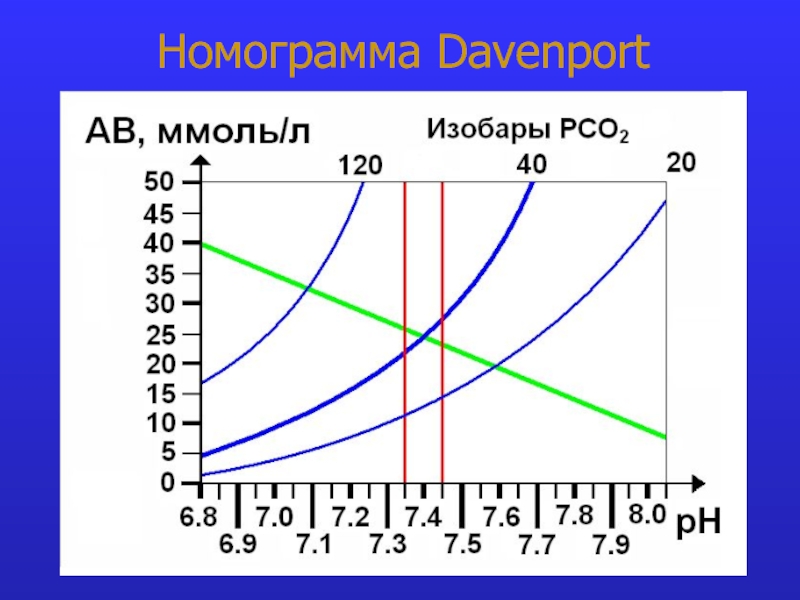
это число полярных группировок в макромолекулах, прежде всего белковых, а
значит:Активность всех ферментов
Емкость транспортных белков, в т.ч. Hb
Работа трансмембранных насосов
Функция ионных и других каналов
H+ и ОН- влияют на обмен других ионов:
Обмен протонов на К+
Иммобилизация Са2+ избытком ОН-