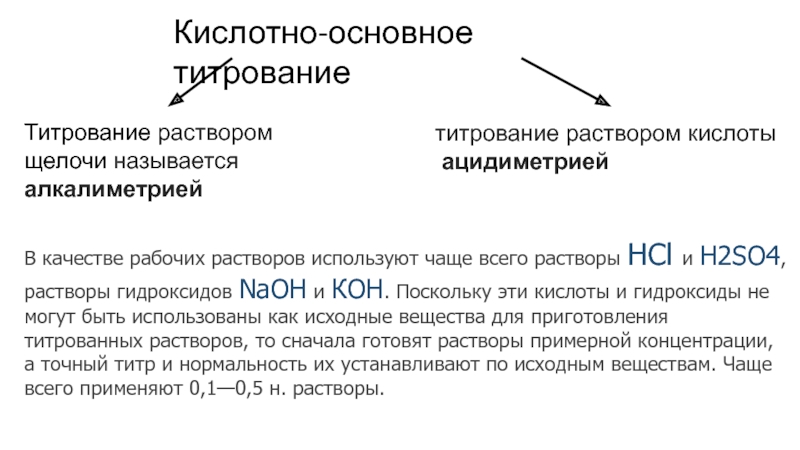
метод применяется для количественного определения
кислот (H2SO4, НNО3, НС1,
H3PO4, СН3СООН, Н2С2O4 и др.), гидроксидов (КОН, NaOH, Ba(OH)2 и др.)
солей, способных гидролизоваться в водных растворах (Na2CО3, К2СО3),
а также их смесей (смесь NH4C1 и NaOH) и т. п.