Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Классификация белков
Содержание
- 1. Классификация белков
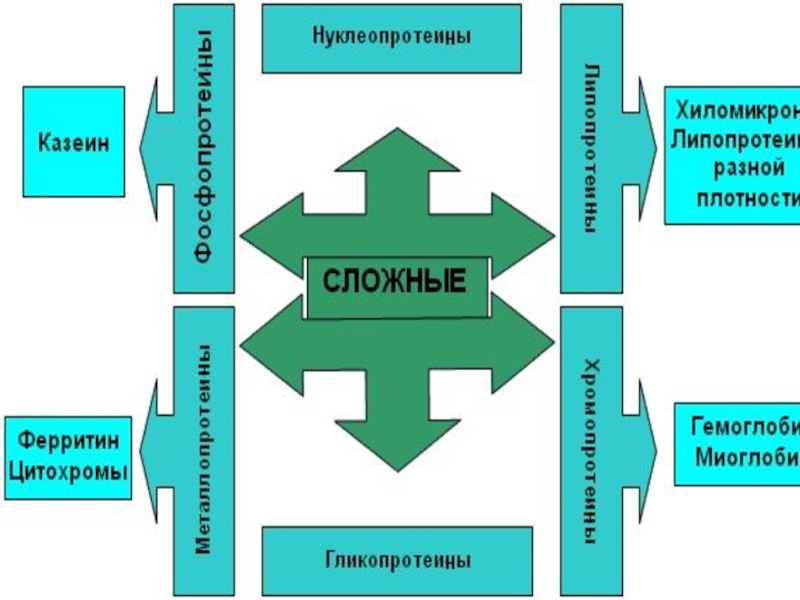
- 2. По химическому составу различают простые белки, сложные белки.
- 3. Классификация простых белков альбумины, глобулины, гистоны, протамины, протеиноиды.
- 4. Альбумины глобулярные белки, молекулярная масса 70 000,
- 5. Функции альбуминов депо белка в организме, осморегуляция,
- 6. Глобулины глобулярные белки, молекулярная масса 150 000
- 7. Функции глобулинов ферменты, транспорт витаминов, гормонов, металлов, защита (иммунитет), γ-глобулины являются антителами.
- 8. Гистоны связаны с ДНК, молекулярная масса 20
- 9. Гистоны
- 10. Протамины молекулярная масса 5000, ИЭТ 11, содержат
- 11. Проламины
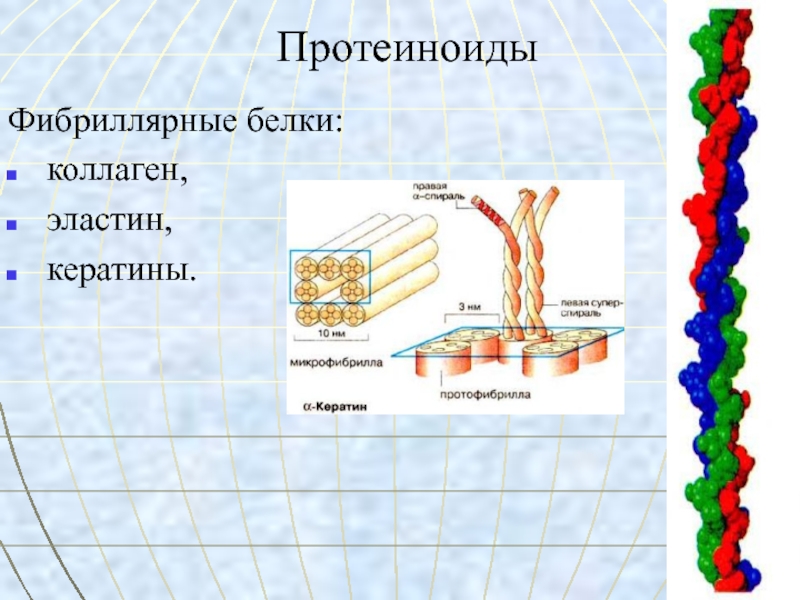
- 12. ПротеиноидыФибриллярные белки: коллаген, эластин, кератины.
- 13. Коллаген Треть общего белка организма
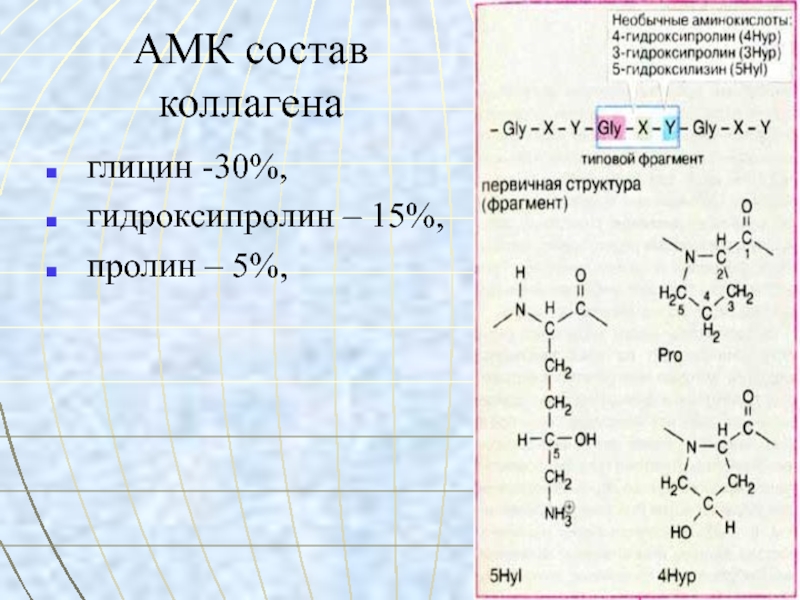
- 14. АМК состав
- 15. Строение коллагенамолекула коллагена состоит из 3 пептидных
- 16. Структура коллагена
- 17. Уникальная особенность метаболизма гидроксипролина эта АМК, входящая
- 18. Известно 19 типов коллагена.Определённую роль в синтезе
- 19. Заболевания, связанные с нарушением синтеза коллагена несовершенный остеогенез, хондродисплазии, семейная аневризма аорты.
- 20. По мере старения фибриллы коллагена становятся более жёсткими и хрупкими, меняются свойства хрящей, сухожилий, роговицы.
- 21. Эластингликопротеин с множеством гидрофобных АМК,сеть полипептидных цепей,
- 22. α-кератины образуют волосы, шерсть, перья, рога, когти, чешую, наружный слой кожи.
- 23. Строение
- 24. .
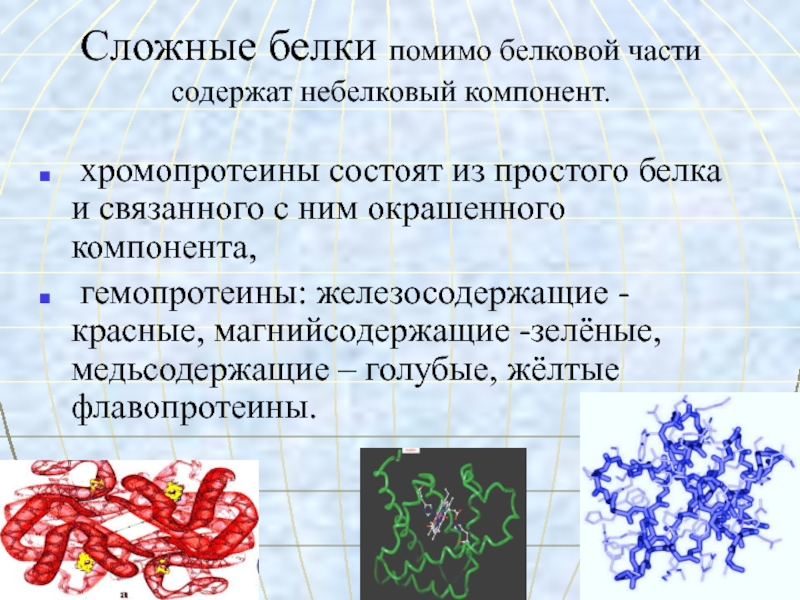
- 25. Сложные белки помимо белковой части
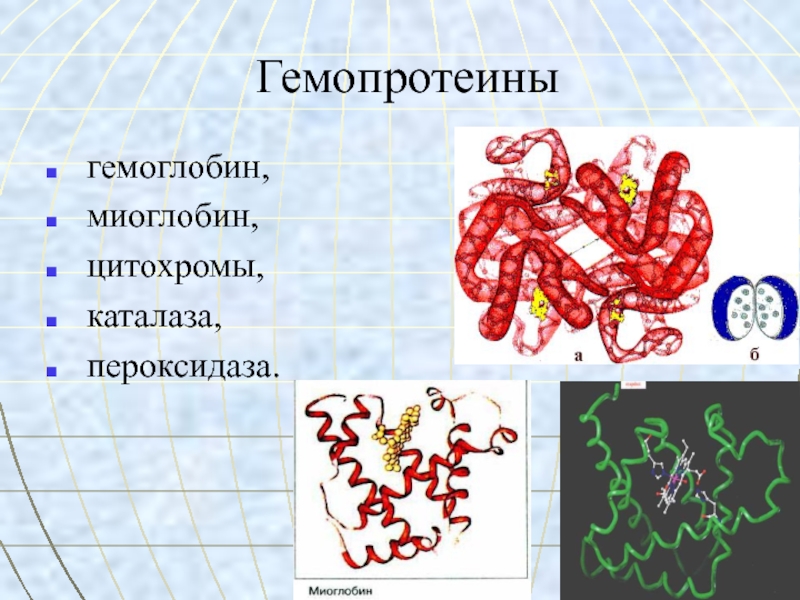
- 26. Гемопротеины гемоглобин, миоглобин, цитохромы, каталаза, пероксидаза.
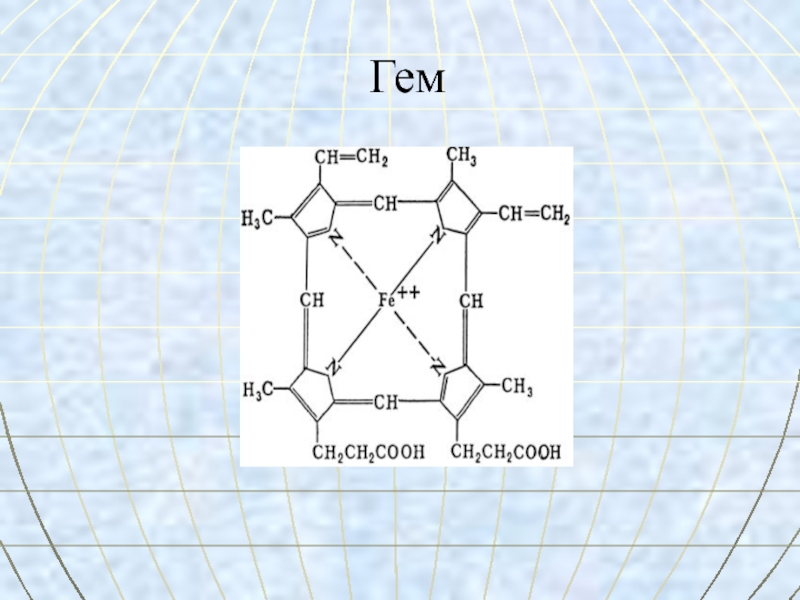
- 27. Гем
- 28. Характеристика
- 29. Структура гемоглобина
- 30. Аллостерические эффекты в гемоглобине
- 31. ГемГем - это соединение циклического
- 32. Глобин - белок типа
- 33. Миоглобин находится в красных мышцах, участвует в
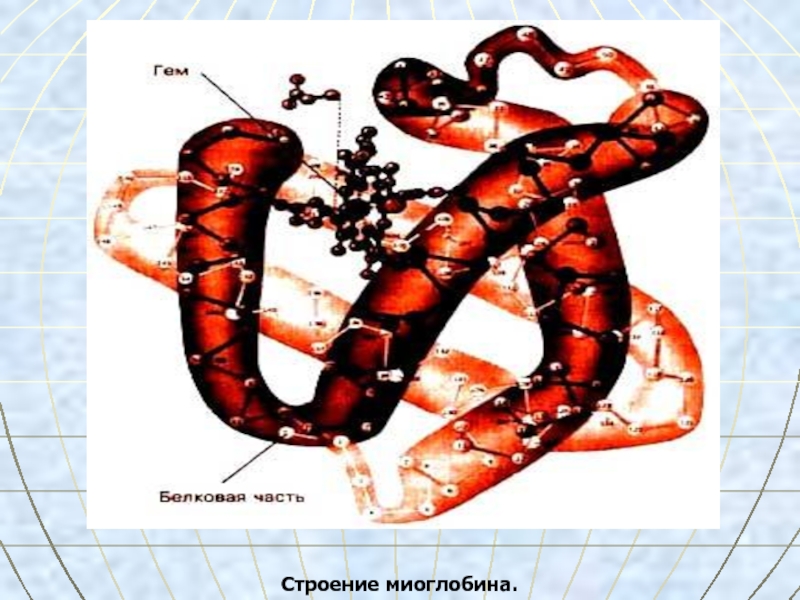
- 34. Строение миоглобина.
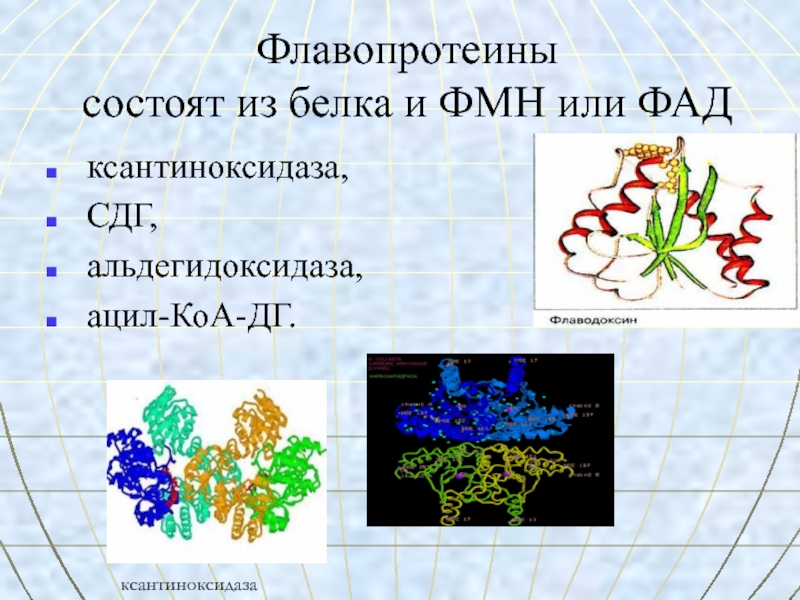
- 35. Флавопротеины
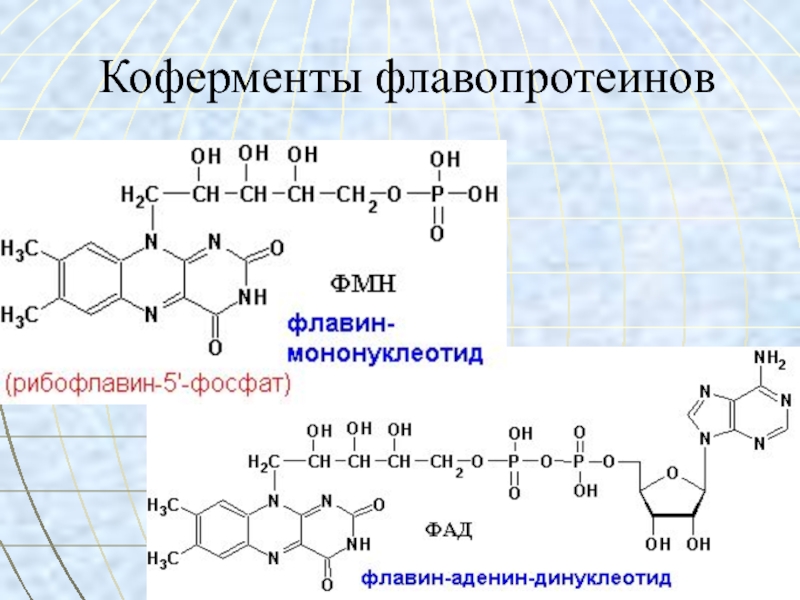
- 36. Коферменты флавопротеинов
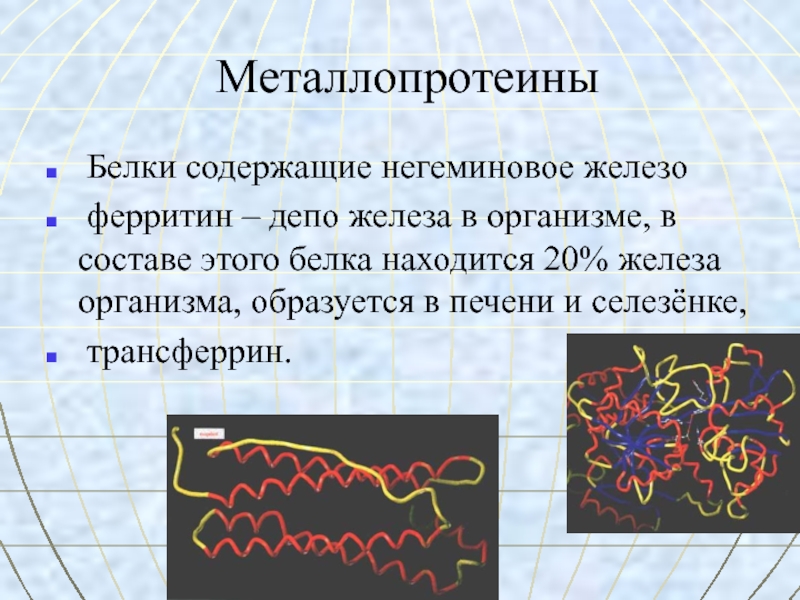
- 37. Металлопротеины Белки содержащие негеминовое железо ферритин –
- 38. Белки-ферменты - металлопротеины Сu-содержащие: цитохромоксидаза, церулоплазмин, тирозиназа, Mn-содержащие: аргиназа, Zn-содержащие: карбоангидраза, алкогольДГ.
- 39. Фосфопротеины состоят из белка и фосфорной кислоты, фосфорная кислота присоединяется через ОН-группу серина.
- 40. Фосфопротеины казеиноген в молоке, овальбумин и фосвитин
- 41. Биологическая роль фосфопротеинов входят в состав мозга,
- 42. Липопротеины в протестетическую группу входят ТАГ, фосфолипиды, стериды, синтезируются в печени или в слизистой оболочке кишечника.
- 43. Биологическая роль липопротеинов входят в состав
- 44. Гликопротеины (гликоконъюгаты) белки, содержащие олигосахаридные цепи,
- 45. Углеводный компонент галактоза, глюкоза, манноза, N-ацетилгалактозамин, N-ацетилглюкозамин, N-ацетилненйраминовая кислота, фукоза.
- 46. Функции гликопротеинов структурная (находятся в плазматических мембранах),
- 47. В организме человека гликопротеины содержатся в клеточных оболочках, костях, хрящах, слюне, секретах желёз, крови.
- 48. Интерфероны образуются в клетке в ответ на
- 49. Нуклеопротеины состоят из белка и нуклеиновой кислоты
- 50. Значение нуклеотидов синтез НК, энергетическая роль, коферменты, транспортная функция.
- 51. Структурные компоненты мононуклеотидов азотистые основания, пентоза, фосфорная кислота. дезоксирибонуклеотиды
- 52. Отличие нуклеотида от нуклеозида в состав нуклеотида входят 3 компонента, а в нуклеозиде нет фосфорной кислоты.
- 53. Правила Чаргаффа молярная доля пуринов равна молярной
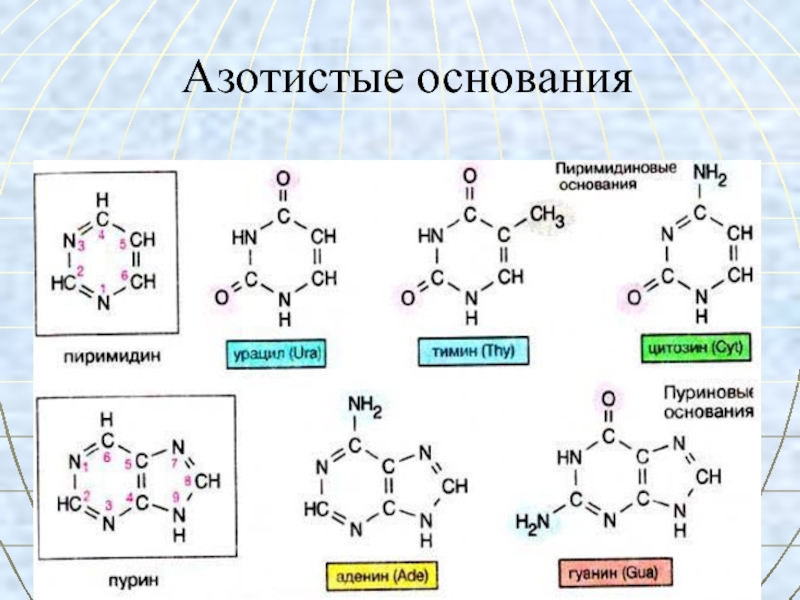
- 54. Азотистые основания
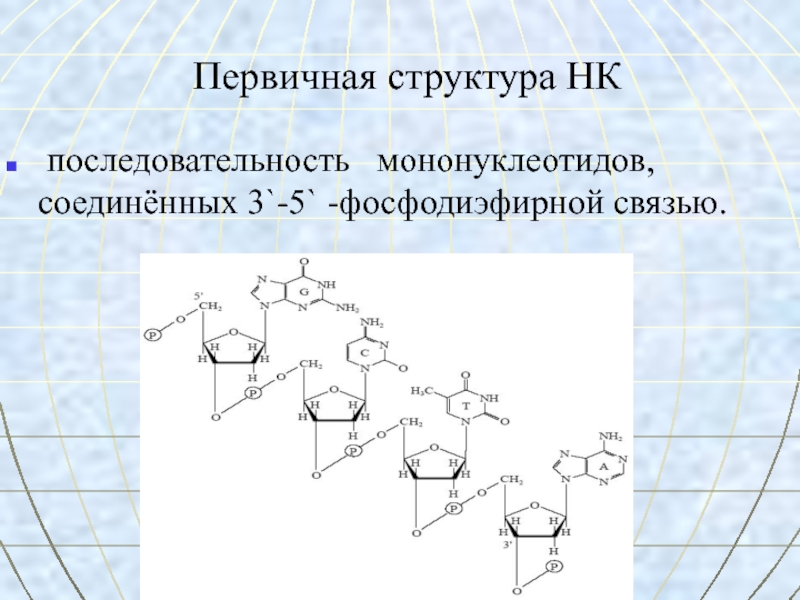
- 55. Первичная структура НК последовательность мононуклеотидов, соединённых 3`-5` -фосфодиэфирной связью.
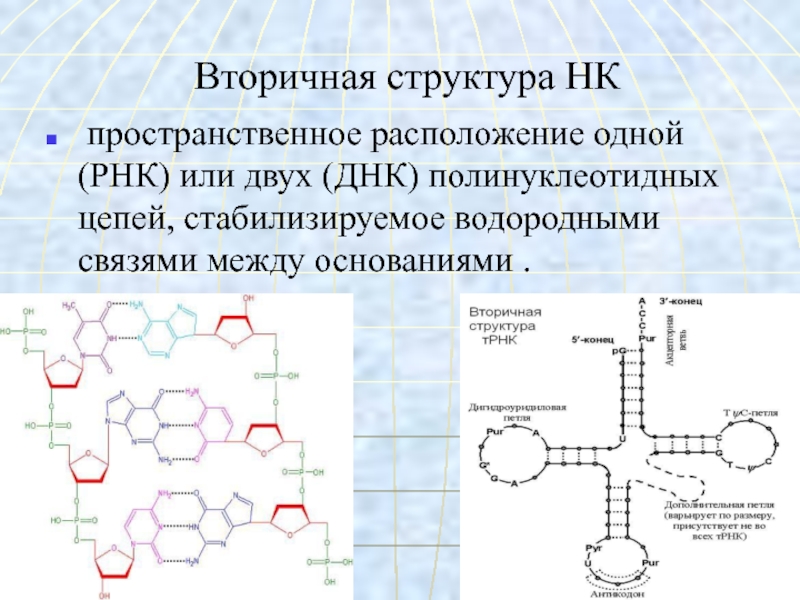
- 56. Вторичная структура НК пространственное расположение одной (РНК)
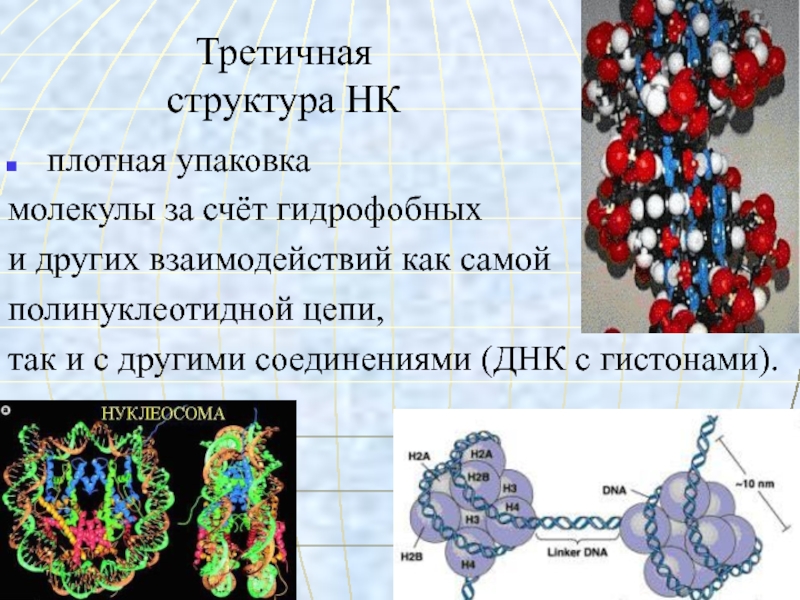
- 57. Третичная структура НК плотная упаковкамолекулы за
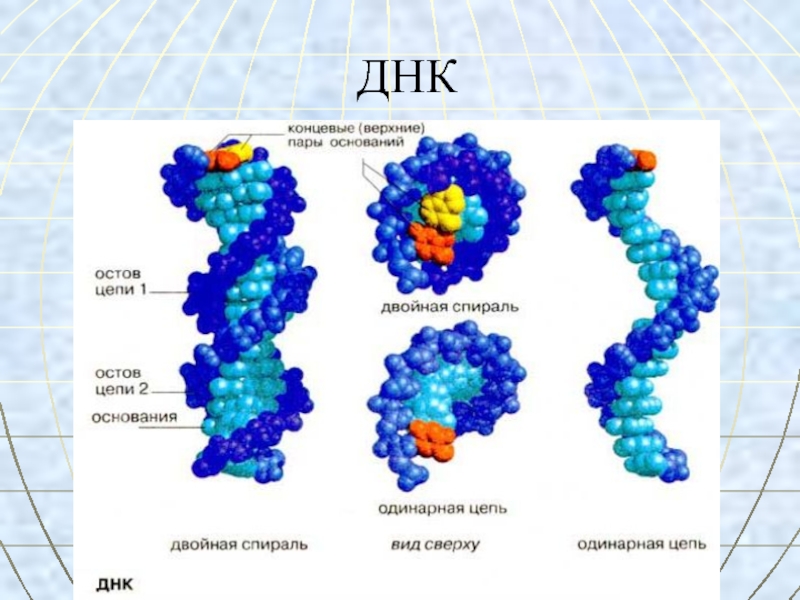
- 58. ДНК
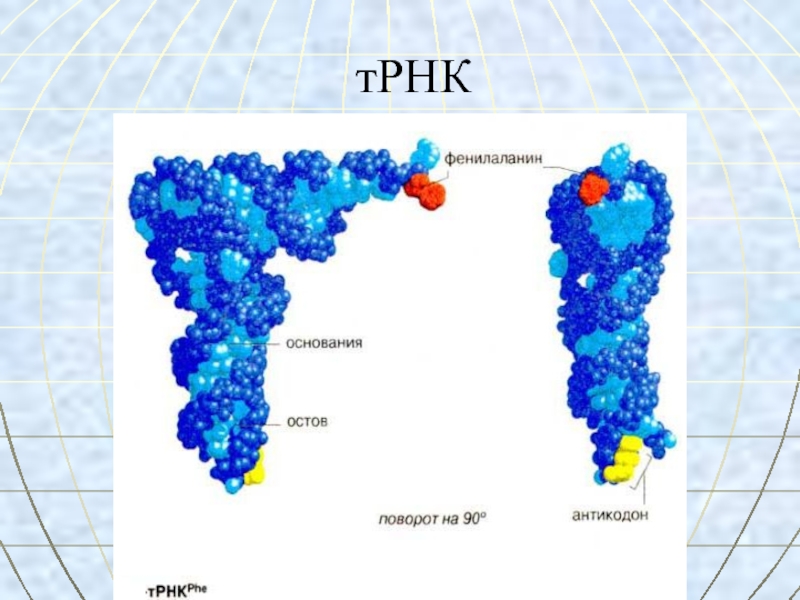
- 59. тРНК
- 60. Скачать презентанцию
Слайды и текст этой презентации
Слайд 5Функции альбуминов
депо белка в организме,
осморегуляция,
неспецифическая защита,
транспорт лекарств, металлов, холестерина, билирубина, желчных пигментов, гормонов.
Слайд 6Глобулины
глобулярные белки,
молекулярная масса 150 000 дальтон,
растворимы в
солевых растворах,
ИЭТ 7,
имеют ряд фракций,
высаливаются 50% сульфатом
аммония,синтезируются в печени и В-лимфоцитах.
Слайд 7Функции глобулинов
ферменты,
транспорт витаминов, гормонов, металлов,
защита (иммунитет),
γ-глобулины являются антителами.
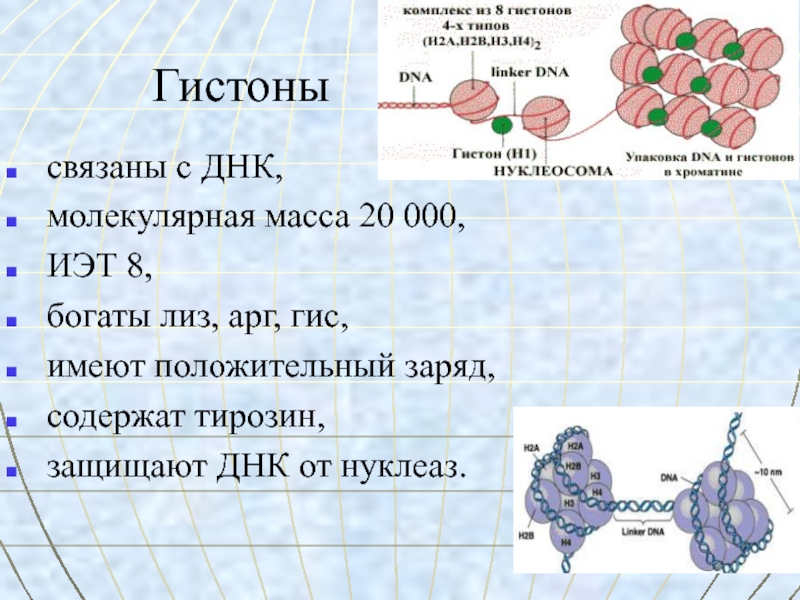
Слайд 8Гистоны
связаны с ДНК,
молекулярная масса 20 000,
ИЭТ 8,
богаты лиз, арг, гис,
имеют положительный заряд,
содержат тирозин,
защищают
ДНК от нуклеаз.Слайд 10Протамины
молекулярная масса 5000,
ИЭТ 11,
содержат много арг,
лиз,
имеют положительный заряд,
не содержат тирозин,
являются белковым компонентом
нуклеопротеинов.Слайд 11Проламины
и глютелины
белки растительного происхождения,
содержатся в семенах злаков,
растворимы в 60-80% водном растворе, а другие простые белки выпадают в осадок,
проламины содержат 20-25% глу и 10-15% пролина.
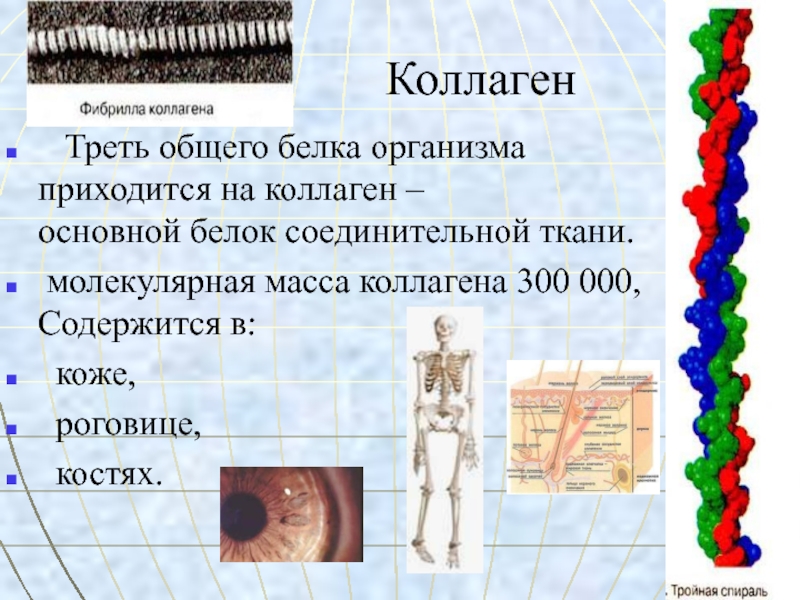
Слайд 13Коллаген
Треть общего белка организма
приходится на коллаген –
основной белок соединительной ткани.молекулярная масса коллагена 300 000, Содержится в:
коже,
роговице,
костях.
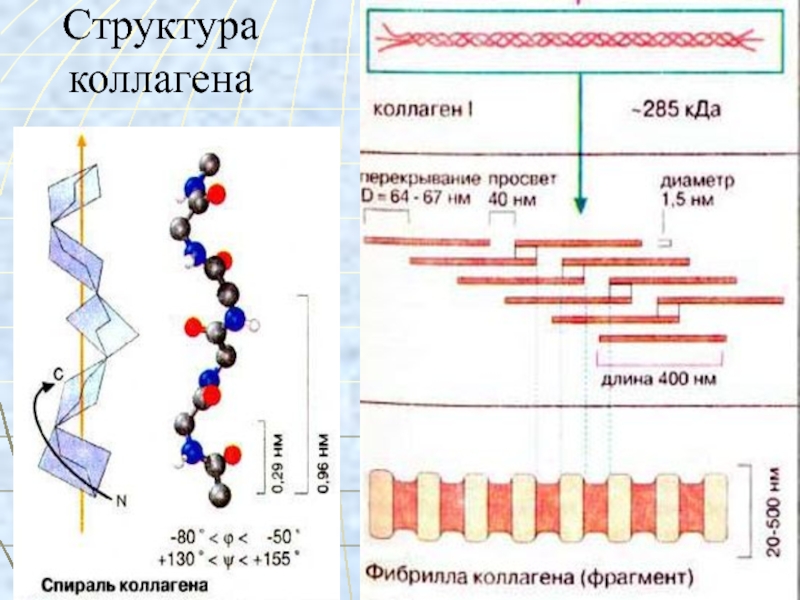
Слайд 15Строение коллагена
молекула коллагена состоит из 3 пептидных цепей, в каждой
примерно 1000 АМК,
вторичная структура коллагена – 3 спирали перевиты
друг с другом, образуя плотный жгут (тропоколлаген),все 3 цепи параллельны, то есть на одном конце коллагена N-концы цепей, а на другом С-концы.
Молекулы коллагена, соединяясь, образуют микрофибриллы, из них образуются пучки волокон.
Тройная спираль коллагена стабилизируется межцепочечными сшивками между лизиновыми и гидроксилизиновыми остатками.
Гидроксипролин стабилизирует тройную спираль коллагена по отношению к действию протеиназ и действию протеолитических ферментов.
Слайд 17Уникальная особенность метаболизма гидроксипролина
эта АМК, входящая в состав белков
пищи,
не включается в коллаген,пищевой пролин является предшественником гидроксипролина в составе коллагена.
На каждый моль гидроксилированного пролина декарбоксилируется 1 моль α-кетоглутарата с образованием сукцината. В результате реакции один атом кислорода поступает в сукцинат, а другой в пролин.
Слайд 18Известно 19 типов коллагена.
Определённую роль в синтезе
коллагена играют белки-шапероны, обеспечивающие «контроль качества» коллагена.
Ряд заболеваний связан с нарушением синтеза коллагена.
Основная причина - мутации.
Слайд 19Заболевания, связанные с нарушением синтеза коллагена
несовершенный остеогенез,
хондродисплазии,
семейная
аневризма аорты.
Слайд 20По мере старения
фибриллы коллагена становятся более жёсткими и хрупкими,
меняются свойства хрящей, сухожилий, роговицы.
Слайд 21Эластин
гликопротеин с множеством гидрофобных АМК,
сеть полипептидных цепей, поперечно-связанных остатками десмозина,
фибриллы эластина хорошо растягиваются,
эластичность возникает за счёт наличия гибкой
случайной конформации молекул эластина и большого количества эластичных сшивок, молекулярная масса 72 000 дальтон,
основной структурный компонент эластических волокон,
входит в состав кровеносных сосудов, связок, артерий.
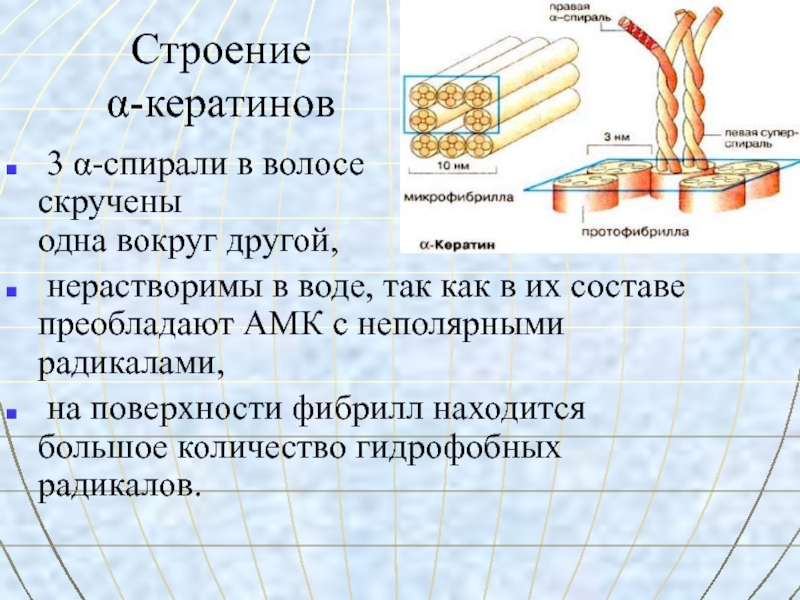
Слайд 23Строение
α-кератинов
3 α-спирали в волосе скручены одна вокруг другой,
нерастворимы в воде, так как в их составе преобладают АМК с неполярными радикалами,
на поверхности фибрилл находится большое количество гидрофобных радикалов.
Слайд 25Сложные белки помимо белковой части
содержат небелковый компонент.
хромопротеины состоят из простого белка и связанного с ним окрашенного компонента,гемопротеины: железосодержащие - красные, магнийсодержащие -зелёные, медьсодержащие – голубые, жёлтые флавопротеины.
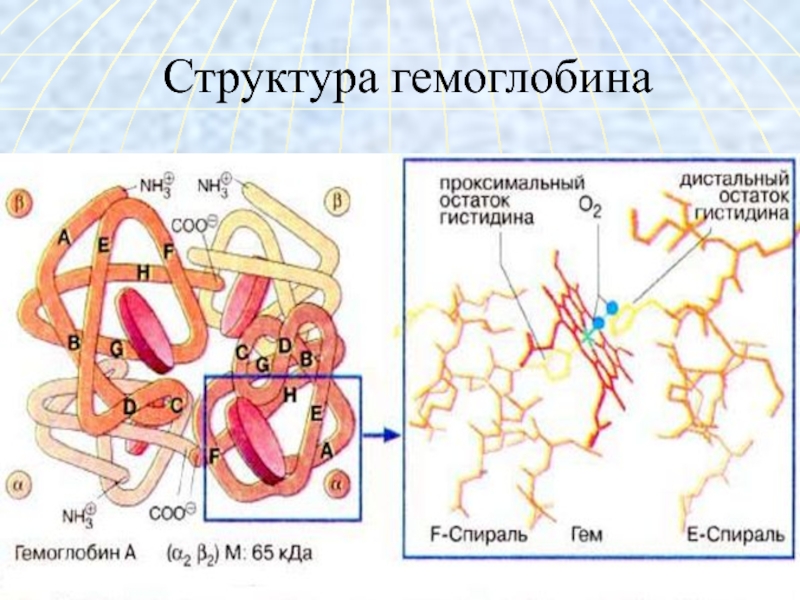
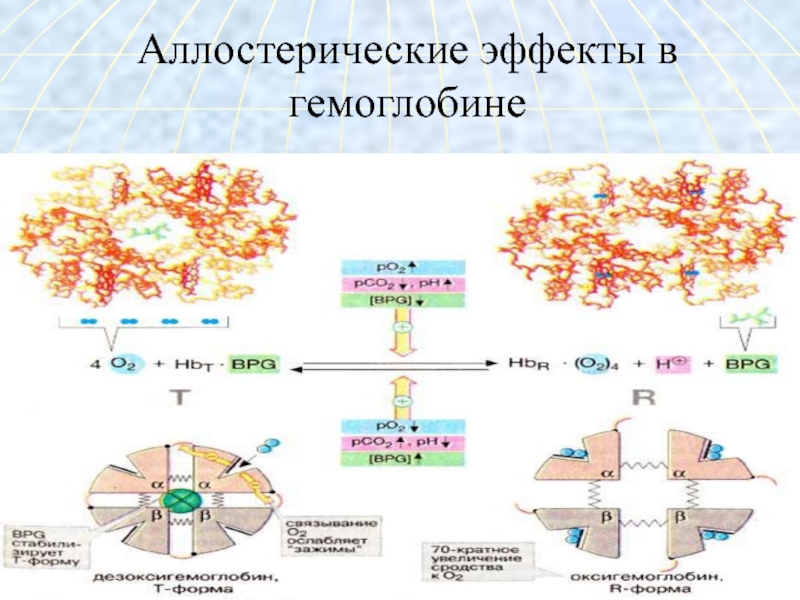
Слайд 28Характеристика
структуры гемоглобина
Гемоглобин – глобулярный белок, железосодержащий
хромопротеин.В состав гемоглобина входят 574 аминокислоты.
Молекулярная масса гемоглобина – 64500.
Гемоглобин состоит из 4 цепей белка глобина и четырёх гемов.
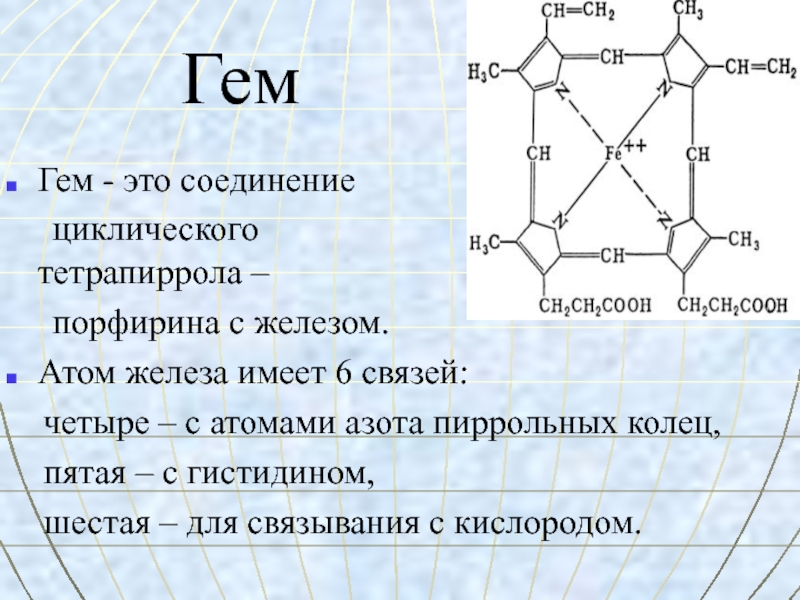
Слайд 31Гем
Гем - это соединение
циклического
тетрапиррола –
порфирина с железом.
Атом железа имеет 6 связей:
четыре – с атомами азота пиррольных колец,
пятая – с гистидином,
шестая – для связывания с кислородом.
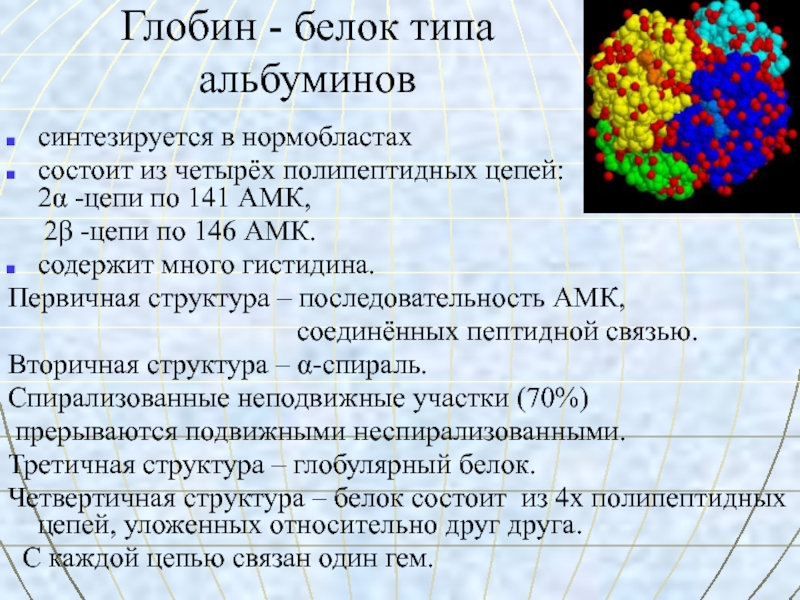
Слайд 32Глобин - белок типа
альбуминов
синтезируется в нормобластах
состоит из четырёх полипептидных
цепей: 2α -цепи по 141 АМК,2β -цепи по 146 АМК.
содержит много гистидина.
Первичная структура – последовательность АМК,
соединённых пептидной связью.
Вторичная структура – α-спираль.
Спирализованные неподвижные участки (70%)
прерываются подвижными неспирализованными.
Третичная структура – глобулярный белок.
Четвертичная структура – белок состоит из 4х полипептидных цепей, уложенных относительно друг друга.
С каждой цепью связан один гем.
Слайд 33Миоглобин
находится в красных мышцах,
участвует в запасании кислорода,
молекулярная
масса 17 000,
включает 153 АМК,
α-спираль уложена в глобулу.
Слайд 35Флавопротеины
состоят из белка и ФМН
или ФАД ксантиноксидаза,
СДГ,
альдегидоксидаза,
ацил-КоА-ДГ.
ксантиноксидаза
Слайд 37Металлопротеины
Белки содержащие негеминовое железо
ферритин – депо железа в
организме, в составе этого белка находится 20% железа организма, образуется
в печени и селезёнке,трансферрин.
Слайд 38Белки-ферменты - металлопротеины
Сu-содержащие: цитохромоксидаза, церулоплазмин, тирозиназа,
Mn-содержащие: аргиназа,
Zn-содержащие:
карбоангидраза, алкогольДГ.
Слайд 39Фосфопротеины
состоят из белка и фосфорной кислоты,
фосфорная кислота присоединяется
через ОН-группу серина.
Слайд 40Фосфопротеины
казеиноген в молоке,
овальбумин и фосвитин в яйцах,
ихтулин
в икре рыбы,
в большом количестве содержатся в клетках ЦНС.
Слайд 41Биологическая роль фосфопротеинов
входят в состав мозга,
в растущем организме
фосфор – пластический материал,
способны отдавать фосфорную кислоту для макроэргов
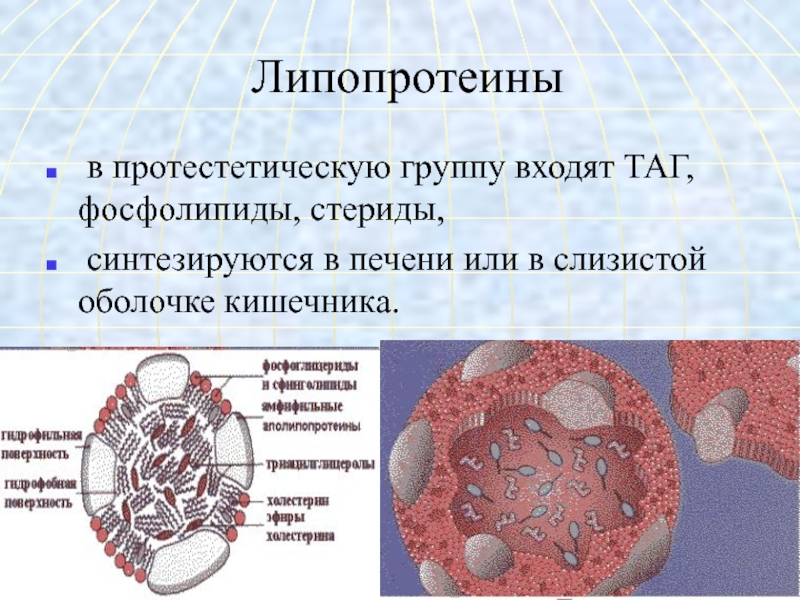
и ферментов.Слайд 42Липопротеины
в протестетическую группу входят ТАГ, фосфолипиды, стериды,
синтезируются в
печени или в слизистой оболочке кишечника.
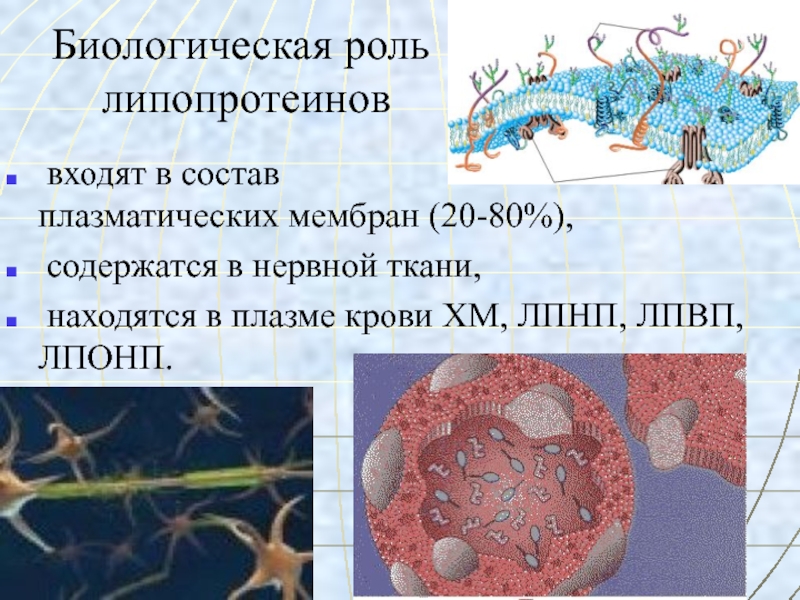
Слайд 43Биологическая роль
липопротеинов
входят в состав
плазматических мембран (20-80%),
содержатся в нервной ткани,
находятся в плазме крови ХМ, ЛПНП, ЛПВП, ЛПОНП.
Слайд 44Гликопротеины (гликоконъюгаты)
белки, содержащие
олигосахаридные цепи, ковалентно присоединённые к
полипептидной основе,
углеводные компоненты ковалентно соединены с азотом аспарагина молекулы
белка, при развитии ряда болезней (рак, астма, иммунодефицит, ревматоидный артрит) изменяются структуры гликоконъюгатов.
Слайд 45Углеводный компонент
галактоза,
глюкоза,
манноза,
N-ацетилгалактозамин,
N-ацетилглюкозамин,
N-ацетилненйраминовая кислота,
фукоза.
Слайд 46Функции гликопротеинов
структурная (находятся в плазматических мембранах),
смазочная и защитная
(муцины, слизь),
транспорт витаминов, липидов, микроэлементов (все белки плазмы крови,
кроме альбуминов, гликопротеины),иммунологическая (иммуноглобулины, антигены гистосовместимости, комплемент, интерферон),
гормоны (хорионический гонадотропин, ТТГ),
ферменты (протеазы, нуклеазы, гликозидазы, гидролазы, факторы свёртывания),
места клеточных контактов распознавания,
гормональные рецепторы,
лектины влияют на эмбриональное развитие и дифференцировку, могут влиять на выбор мест метастазирования раковых клеток.
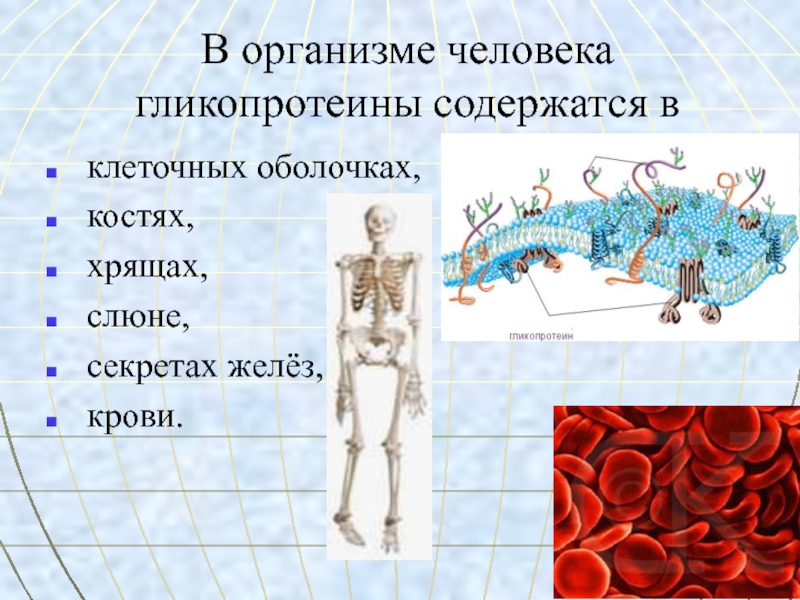
Слайд 47В организме человека гликопротеины содержатся в
клеточных оболочках,
костях,
хрящах,
слюне,
секретах желёз,
крови.
Слайд 48Интерфероны
образуются в клетке в ответ на внедрение вирусной НК,
ограничивая вирусную агрессию,
сложные белки,
молекулярная масса от 25 000
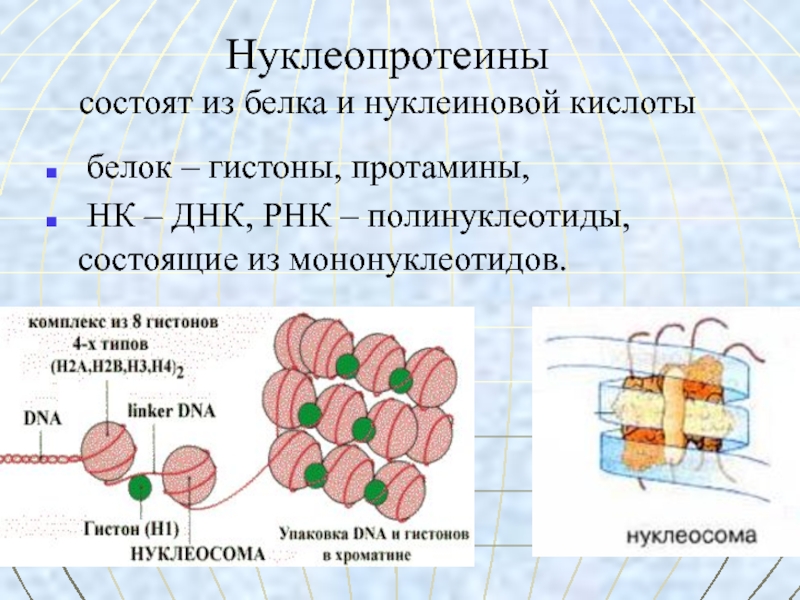
до 40 000.Слайд 49Нуклеопротеины
состоят из белка и нуклеиновой кислоты
белок – гистоны, протамины,
НК – ДНК, РНК – полинуклеотиды, состоящие из мононуклеотидов.
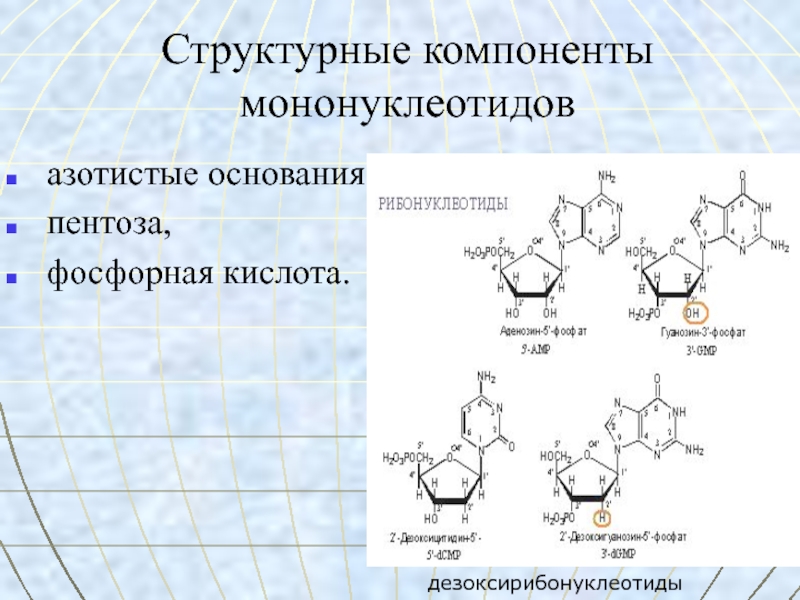
Слайд 51Структурные компоненты мононуклеотидов
азотистые основания,
пентоза,
фосфорная кислота.
дезоксирибонуклеотиды
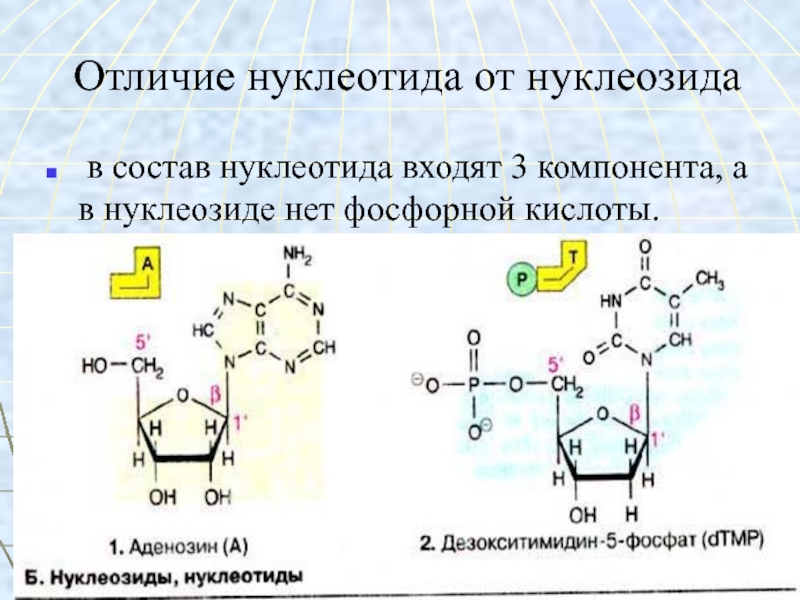
Слайд 52Отличие нуклеотида от нуклеозида
в состав нуклеотида входят 3 компонента,
а в нуклеозиде нет фосфорной кислоты.
Слайд 53Правила Чаргаффа
молярная доля пуринов равна молярной доле пиримидинов А+Г=Ц+Т,
количество аденина и цитозина равно количеству гуанина и тимина А+Ц=Т+Г,
количество аденина равно количеству тимина, количество гуанина равно количеству цитозина А=Т, Г=Ц,существенным для характеристики вида является коэффициент специфичности.
У человека К< 1.