Слайд 2«Классификация
химических реакций
8 класс
Слайд 3На уроке мы повторим и закрепим:
-классификацию веществ,
-типы химических реакций,
и признаки их классификации
Применять полученные знания о
о типах химических реакций на практике
– составлять уравнения химических реакций,
– расставлять коэффициенты,
–определять типы химических
реакций
– решать задачи по уравнениям
химических реакций
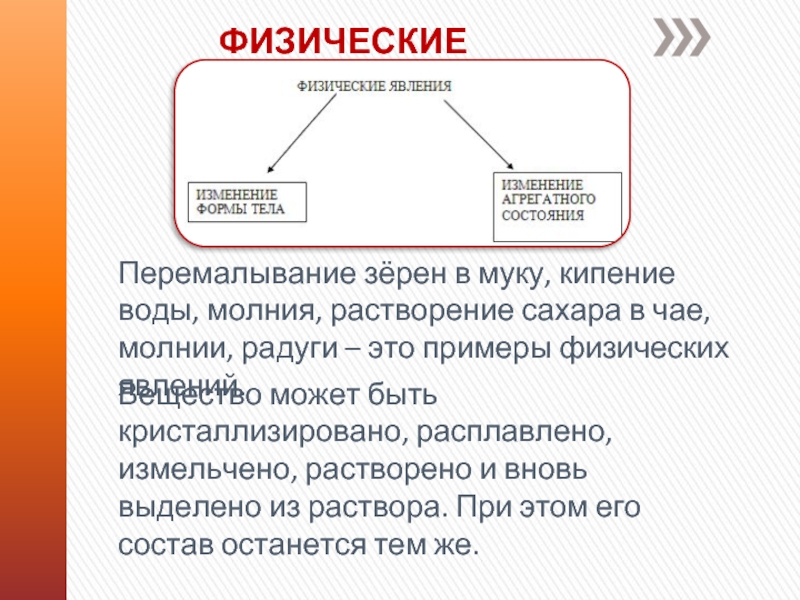
Слайд 4ФИЗИЧЕСКИЕ ЯВЛЕНИЯ
Перемалывание зёрен в муку, кипение воды, молния, растворение сахара
в чае, молнии, радуги – это примеры физических явлений.
Вещество может
быть кристаллизировано, расплавлено, измельчено, растворено и вновь выделено из раствора. При этом его состав останется тем же.
Слайд 5 Изменение окраски
Появление запаха
Образование осадка
(растворение)
Выделение газа
Выделение тепла
и
света
Слайд 61. Экзотермические реакции протекают с выделением энергии:
Классификация
химических реакций
4P + 5O2
= 2P2O5 + Q кДж
2. Эндотермические реакции протекают с поглощением
энергии:
2HgO = 2Hg↓ + O2↑ - Q кДж
Слайд 7С + O2 = СO2
СO2 +Н2О = Н2СО3
– реакции, при
которых из двух и более веществ образуется одно сложное вещество.
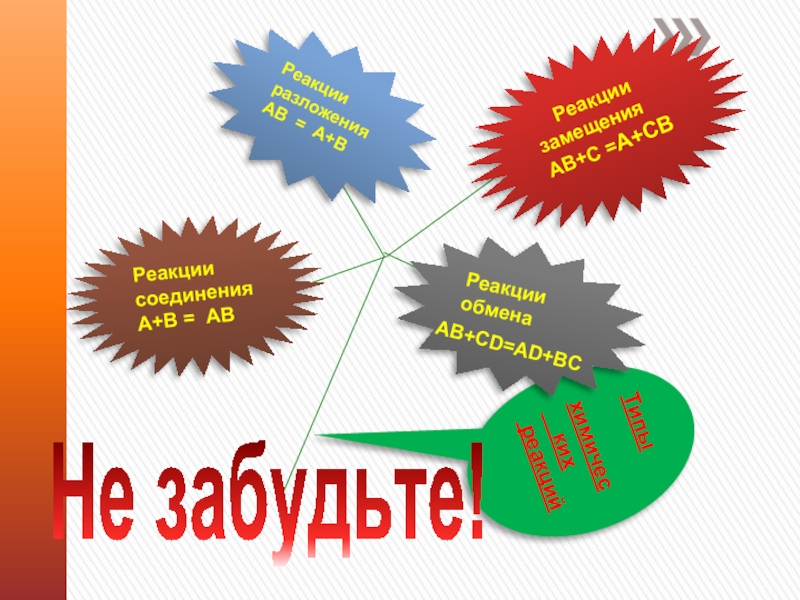
Реакции
соединения
Слайд 8– это такие реакции, при которых из одного сложного вещества
образуется несколько новых веществ.
2HgO = 2Hg + O2
2KNO3 = 2KNO2
+ O2
Реакции разложения
Слайд 9– это такие реакции, в результате которых атомы простого вещества
замещают атомы какого-нибудь элемента в сложном веществе.
Zn + 2HCl =
ZnCl2 + H2
2Na + 2H2O = 2NaOH + H2
Реакции замещения
Слайд 10– это такие реакции, при которых два сложных вещества обмениваются
своими составными частями.
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
NaOH
+ HNO3 = NaNO3 + H2O
Реакции обмена
Слайд 121.Реакции, протекающие с поглощением теплоты, называются:
А) эндотермическими;
Б) термическими;
В) экзотермическими.
2. Из нескольких простых или сложных веществ образуется одно
более сложное
вещество в реакции:
А) замещения;
Б) соединения;
В) разложения.
3. Уравнение реакции обмена:
А) CaO + SiO2= CaSiO3;
Б) 2 KClO3= 2KCl+3O2;
В) FeS+2HCl=FeCl2+H2S;
ТЕСТ
Слайд 134.Реакции, протекающие с выделением теплоты, называются:
А) экзотермическими;
Б) термическими;
В) эндотермическими;
5. Уравнение реакции разложения:
А)
CaO + SiO2= CaSiO3;
Б) 2 KClO3= 2KCl+3O2;
В) FeS+2HCl=FeCl2+H2S
Слайд 14Проверим
1 -
2 -
3 -
4 -
5 -
А) эндотермическими;
Б) соединения;
В) FeS+2HCl=FeCl2+H2S;
А) экзотермическими;
Б)
2 KClO3= 2KCl+3O2;
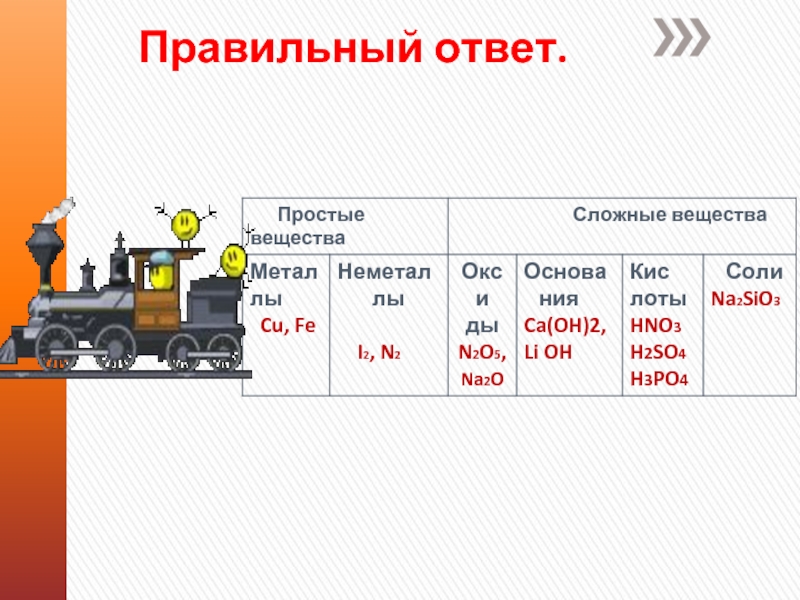
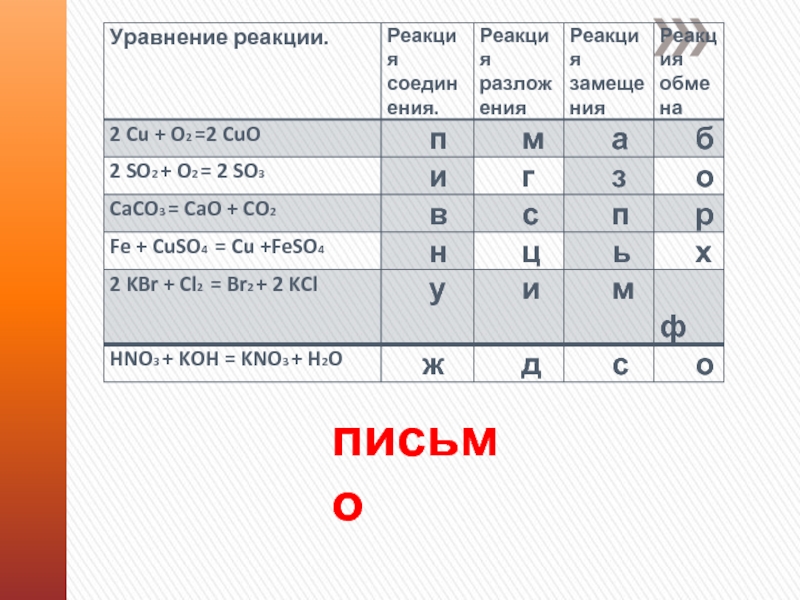
Слайд 15Химическая железная дорога.
Запишите формулы
веществ в соответствующие столбцы таблицы
N2O5, Са, HNO3, Ca(OH)2, Na2O,
Fe, H2SO4, H3PO4 ,N2, Na2SiO3, Н2, LiOH, Cu.
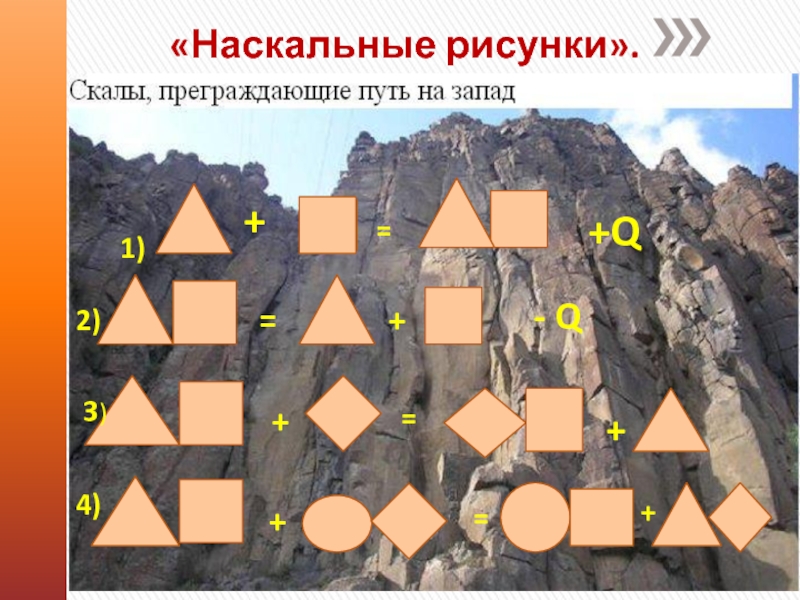
Слайд 18«Наскальные рисунки».
+Q
+
=
+
=
- Q
+
=
+
+
=
+
2)
3)
4)
1)
Слайд 191.Реакция соединения, экзотермическая.
2.Реакция разложения, эндотермическая.
3.Реакция замещения.
4.Реакция обмена
«Наскальные рисунки».
Правильный ответ
Слайд 21Составьте уравнения реакций, используя подходящие реактивы:
NaOH
a)Ba BaO
Ba(OH)2 BaSO4
Н2О
BaСl2
Слайд 23Задание игры «Крестики-нолики».
Необходимо найти выигрышный путь, состоящий из уравнений
реакций замещения
Слайд 24Царь зовет к себе Стрельца – удалого молодца,
И дает
ему поручение государственного значения: «Чтоб я стал опять богат, нужен
мне алюминия сульфат. Ночь даю тебе подумать, утром буду ждать доклад. Не смогешь – кого винить? Должен я тебя казнить. Запиши себе названье, чтоб со страху не забыть».
Напишите в тетради формулу уравнения
реакции взаимодействия сульфата
алюминия с гидроксидом калия
Укажите тип реакции.
Al2 (SO4 )3
Слайд 25Задание «Стрельба глазами».
1. В периодической системе найдите самый активный элемент-неметалл.
2. Переведите свой
взгляд влево, на элемент, стоящий в том же периоде в III
группе.
3. Переведите взгляд вниз и влево, на самый активный металл.
4. Переведите взгляд вверх и вправо, на элемент, атомы которого образуют вещество, поддерживающее горение.
5. Переведите взгляд вниз и влево, на элемент, атомы которого образуют металл, используемый в градусниках.
6. Переведите взгляд вверх и вправо, на элемент с относительной атомной массой 35,5.
1) P+O2=….
2)Al+…=Al2(SO4)3+H2
3)… +Cl2=AlCl3
4)Fe+…=FeCl3
5) H2+O2=….
Водопад реакций.
Слайд 27Водопад реакций.
1) 4P+5O2 = 2P2O5
2)2Al+3H2SO4 = Al2(SO4)3+3H2
3)2Al +3Cl2 = 2AlCl3
4)2Fe+3Cl2
= 2FeCl3
5) 2H2+O2 = 2H2O
Правильный ответ
Составьте уравнения реакций,
назовите продукты реакций
И определите тип
1вариант
1)NaOH+CuCl2 =
2)SO3+H2O=
3)HCl+Na=
2 вариант
1) CuSO4+KOH=
2) C+O2=
3) CuCl2 + Zn =
Река уравнений реакций
Правильный ответ.
1) 2NaOH+CuCl2=Cu(OH)2+2NaCl
2) SO3+H2O=H2SO4
3) 2HCl+2Na=2NaCl+H2
2 вариант
1)
CuSO4+2KOH=Cu(OH)2+K2SO4
C+O2=CO2
3) CuCl2 + Zn = ZnCl2 +Cu
Река уравнений
1 вариант
Слайд 31
Реактивы растворы :
серной кислоты,
карбоната натрия,
хлорида магния,
гидроксида натрия.
Слайд 321. Вычислите массу алюминия, необходимого для реакции с кислородом объемом
11,2 л
Схема реакции:
4Al + 3O2 → 2Al2O3
РЕШИТЕ ЗАДАЧИ
2.
Рассчитайте массу серной кислоты, которая взаимодействует с 5,6 г гидроксида калия. В результате реакции образуется сульфат калия и вода.
Слайд 33
ДОРОГА ДОМОЙ
Задание на «3». Расставьте коэффициенты в уравнениях химических реакций,
укажите типы химических реакций .
Таблица 1
Д/З
Каждый выбирает себе задание на
ту оценку, которая его устраивает.
Слайд 34Задание на «4». Допишите уравнения реакций, расставьте коэффициенты, укажите типы химических
реакций Таблица 2
Задание на «5». Допишите практически осуществимые уравнения реакций, расставьте
коэффициенты, укажите типы химических реакций. Таблица 3
Слайд 36Если хочешь ты учиться,
Запомни раз и навсегда:
Не стоит
слишком торопиться.
Ты слушай, все запоминай,
Ответы верные давай,
Всегда ты думай головой,
И знания будут тогда с тобой!!!
И помни – химия всегда вокруг,
Она - твой верный друг,
А знания тебе удачу принесут.
В Ы В О Д: