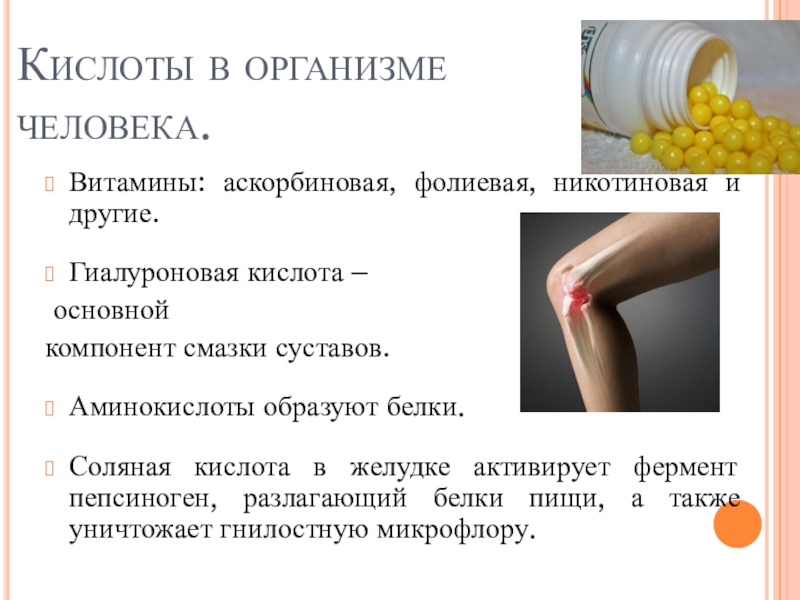
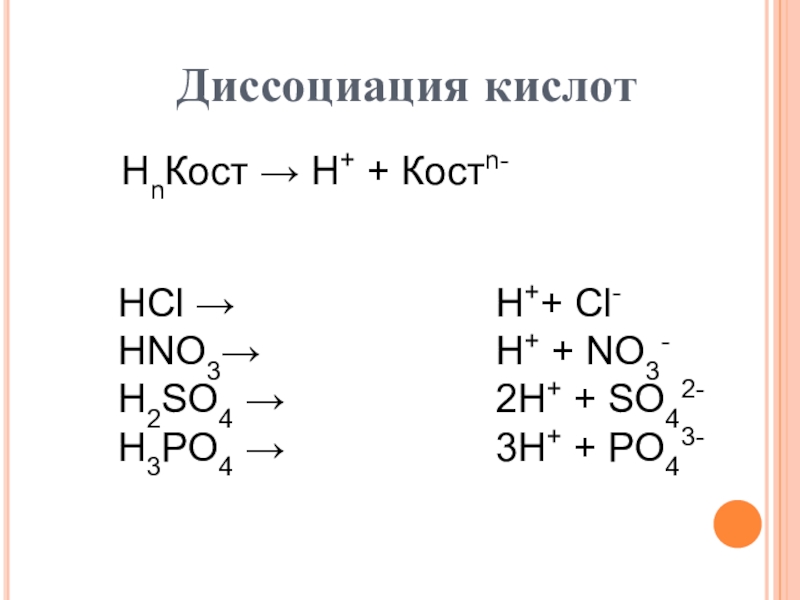
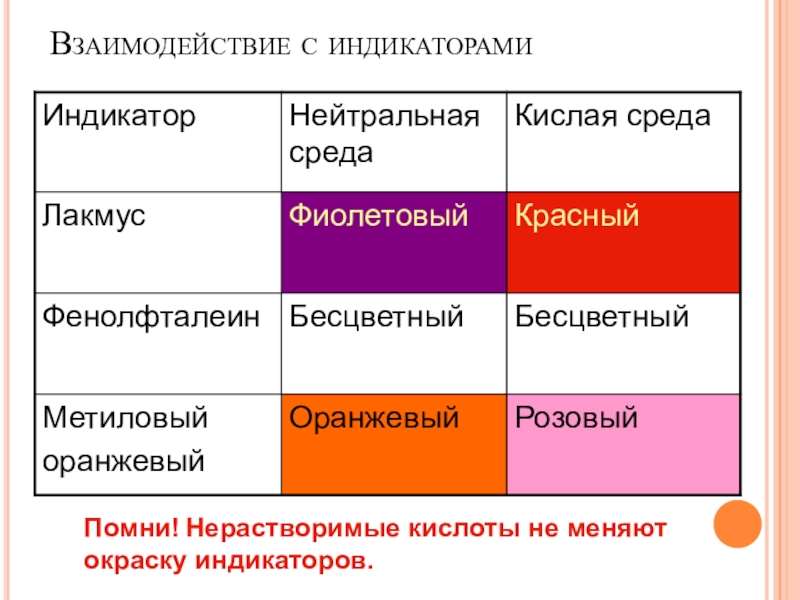
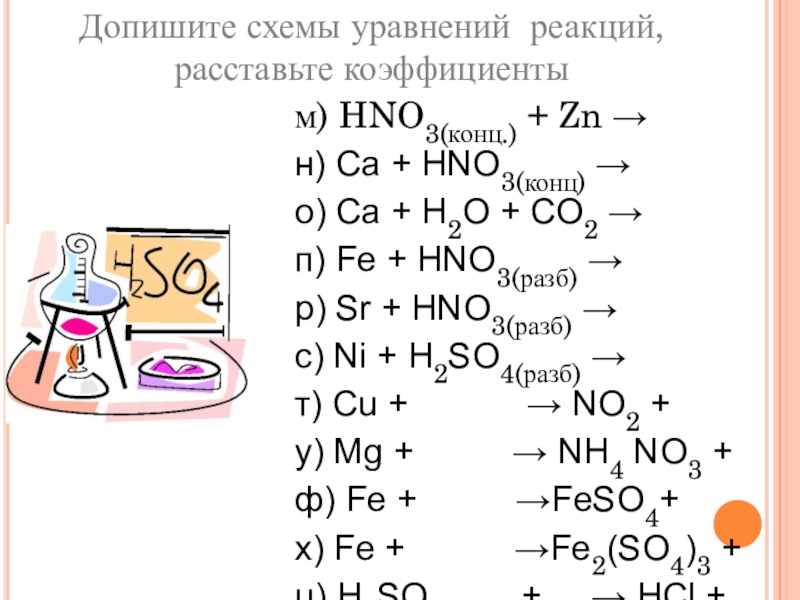
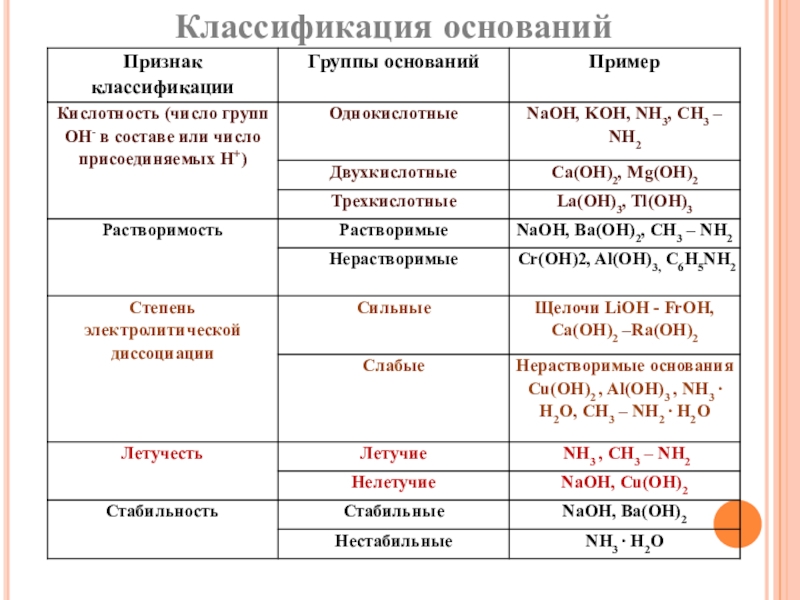
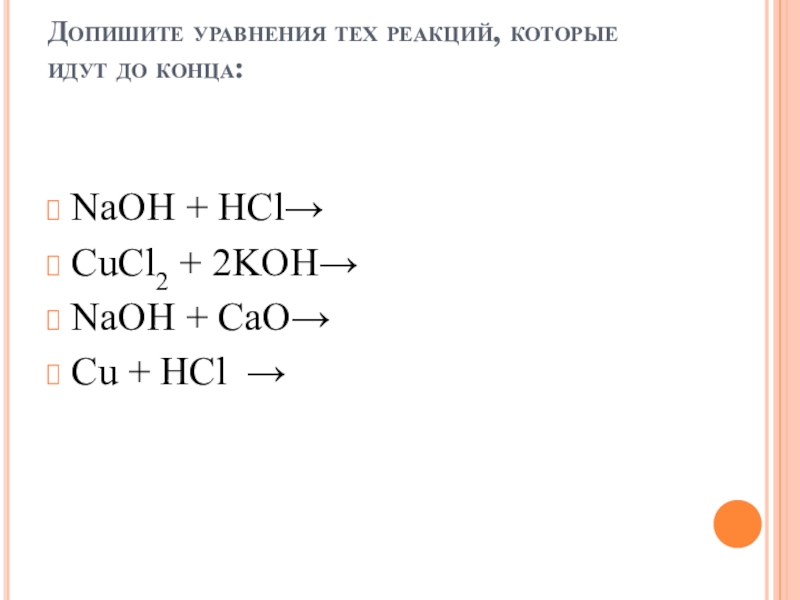
пище (яблочная, щавелевая, лимонная, молочная, масляная, кофейная и другие)
«Химическое оружие»
животных и растений.Муравей при укусе впрыскивает яд, содержащий муравьиную кислоту. Ее использует и крапива.