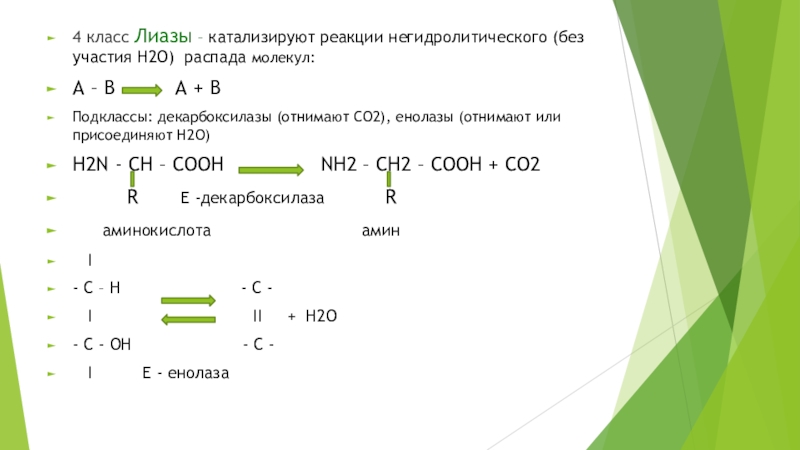
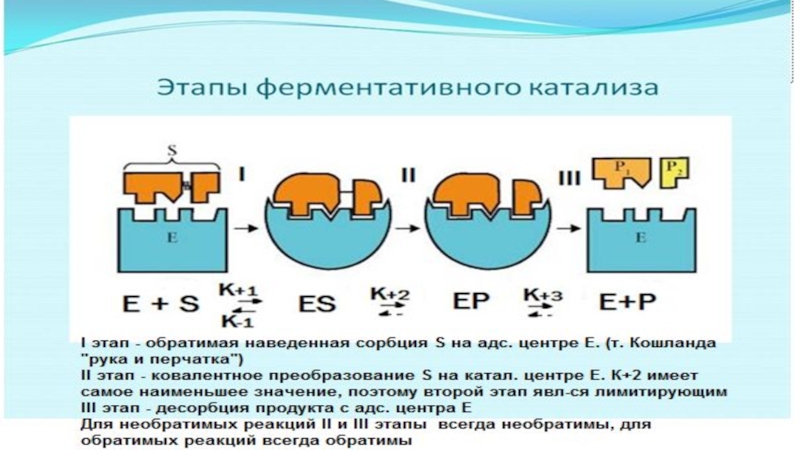
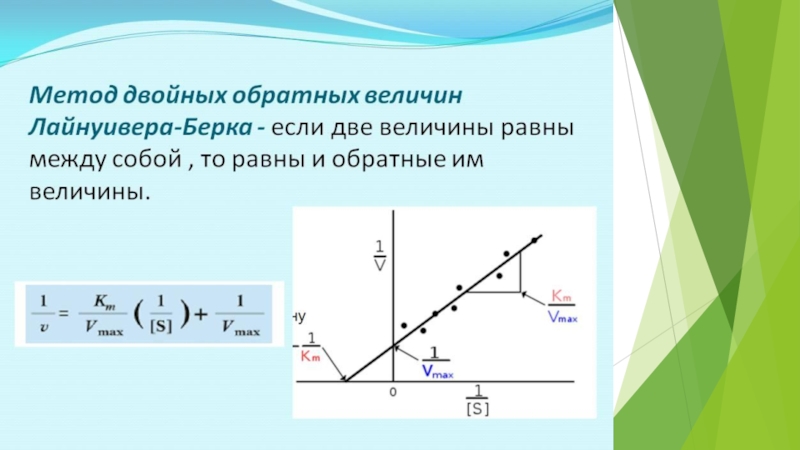
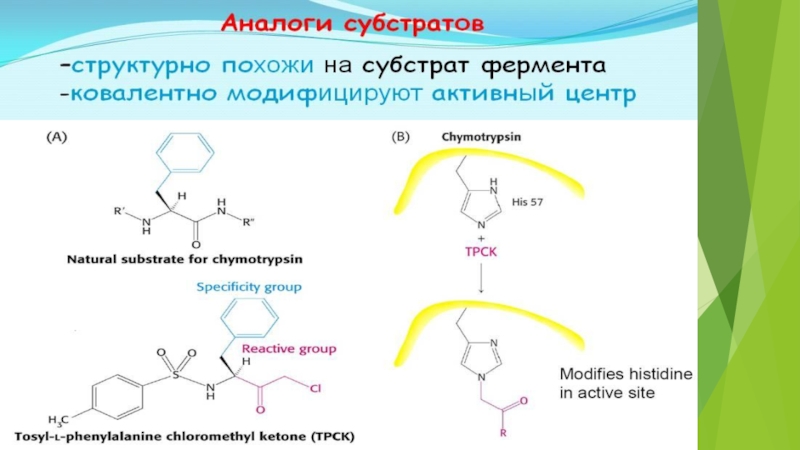
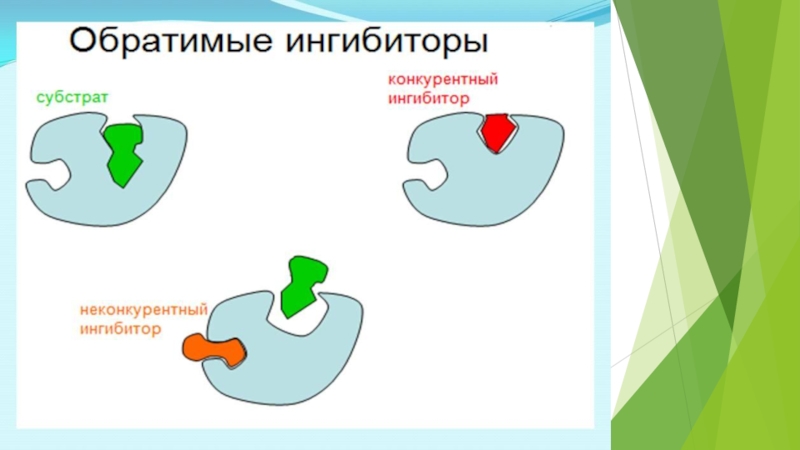
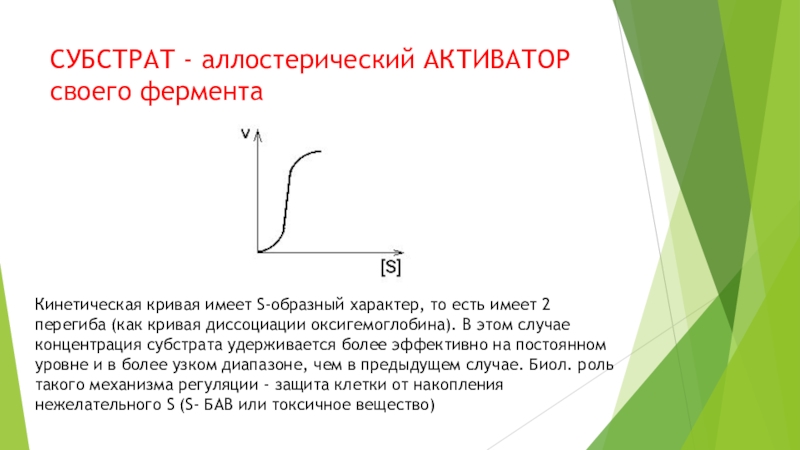
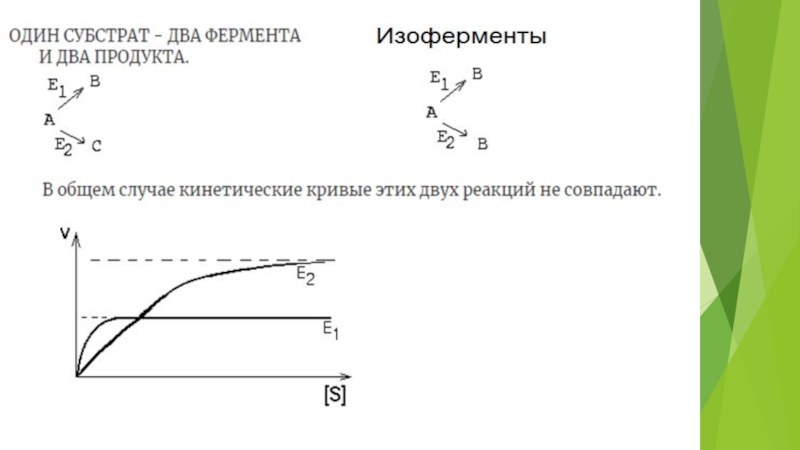
на подклассы , а подклассы – на подподклассы.
Название фермента
: название субстрата (или субстратов) и название класса или подкласса.1 класс. Оксидо-редуктазы – катализируют окислительно-восстановительные реакции (ОВР).
Окисление может идти путем отнятия водорода - ферменты (подклассы):
Дегидрогеназы
Оксидазы
Десатуразы
или путем присоединения кислорода
Оксигеназы – монооксигеназы или диоксигеназы
Восстановление идет путем присоединения водорода –
Ферменты редуктазы