Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Клеточная цитотоксичность
Содержание
- 1. Клеточная цитотоксичность
- 2. Цитотоксичность-убийство клетки-мишени с участием иммунных факторов (Ат,
- 3. Клеточная цитотоксичностьДля осуществления функции антигенспецифической цитотоксичности дифференцирована
- 4. Клеточная цитотоксичностьСпециализированный механизм киллинга локализован в в
- 5. Клеточная цитотоксичностьЦитотоксины неспецифичны, они одинаковы для всех
- 6. Условия необходимые для клеточной цитотоксичности живой эффекторный
- 7. Условия не влияющие на клеточную цитотоксичность Синтез ДНК и РНК, белкаАнтителаСинтез комплиментаСинтез лимфокиновМетаболизм клетки-мишени
- 8. Клеточная цитотоксичностьАктивация CD8+Т-к через активацию CD4+Т-л Запуск
- 9. Клеточная цитотоксичность. В результате активации, CD8+ выходят
- 10. Клеточная цитотоксичность.ИЛ-2- поддерживает длительность пролиферации ЦТЛ, усиливает
- 11. Клеточная цитотоксичность.После завершения делений происходит дифференцировка CD8+
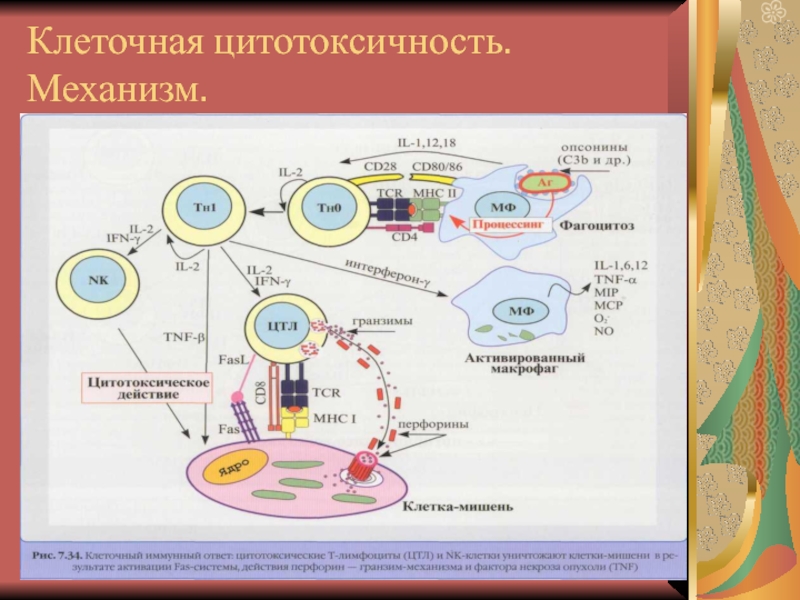
- 12. Клеточная цитотоксичность. Механизм.
- 13. Формирование зоны контакта интервейсРаспознавание комплекса Аг-
- 14. Зона контакта интервейсЦТЛ СD8+ реорганизуются (цитоплаз-матические гранулы
- 15. Зона контакта интервейс
- 16. Зона контакта интервейсЗатем происходит программирование клеток-мишеней к
- 17. Клеточная цитотоксичность.Далее происходит слияние мембран гранул, на
- 18. Клеточная цитотоксичность. Их 3 вида ЦТЛ –
- 19. Клеточная цитотоксичность.Клетка-мишень сама разрушается и вместе с
- 20. Клеточная цитотоксичность.На организацию сигнала на апоптоз для
- 21. Клеточная цитотоксичность.При реализации иммунного цитолиза Тх1 в
- 22. Клеточная цитотоксичность.Таким образом, СD8 ЦТЛ еще и
- 23. Клеточная цитотоксичность.активирует макрофаги и NK;является кофактором индукции
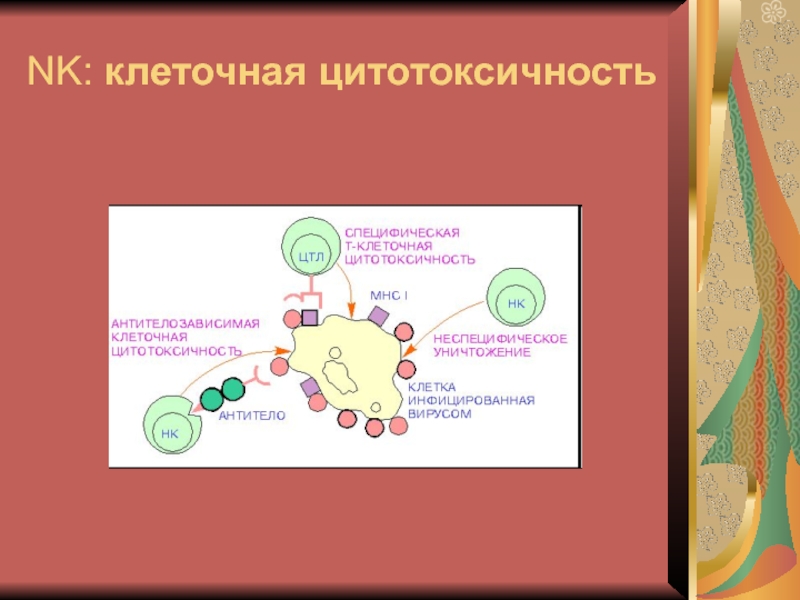
- 24. NK: клеточная цитотоксичность
- 25. NK: клеточная цитотоксичностьНормальные киллеры – дифференцируются из
- 26. NK: клеточная цитотоксичностьНа NK есть рецепторы, способные
- 27. NK: клеточная цитотоксичностьЕсли при контакте клетки эти
- 28. NK: клеточная цитотоксичностьМембранным маркером NK является мембранная
- 29. NK: клеточная цитотоксичностьNK имеют много экспрессированных интегринов,
- 30. NK: клеточная цитотоксичностьNK локализованные в синусоидах печени,
- 31. NK: клеточная цитотоксичностьЭффекторные функции NK – цитотоксичность
- 32. NK: клеточная цитотоксичностьМеханизм: секреция литических ферментов NK
- 33. Слайд 33
- 34. NK: клеточная цитотоксичностьNK могут уничтожать клетки покрытые
- 35. Антитело-зависимая клеточная цитотоксичность (АЗКТ)Рецептор NK распознает, то
- 36. Антитело-зависимая клеточная цитотоксичность
- 37. Комплемент опосредованная цитотоксичностьКомплементзависимые реакции. Существуют два механизма,
- 38. Комплемент опосредованная цитотоксичность
- 39. Комплемент опосредованная цитотоксичностьВо втором случае клетки фагоцитируются
- 40. Антителозависимая клеточная цитотоксичность: IgЕ –эозинофиллыАнтителозависимая клеточная цитотоксичность
- 41. Антителозависимая клеточная цитотоксичность: IgЕ –эозинофиллы
- 42. Антителозависимая клеточная цитотоксичность: IgЕ –эозинофиллыАктивируемый эозинофил секретирует
- 43. Цитотоксический эффект Тх1Цитотоксическим эффектом наделены также Тх1
- 44. Скачать презентанцию
Цитотоксичность-убийство клетки-мишени с участием иммунных факторов (Ат, лимфоцитов (NK, CTL)Виды:Клетка-мишень и ЦТЛ (через активацию CD4+Т-л)Клетка-мишень и Ат и НК (АЗКТ)Клетка-мишень и Ат и комплемент (бактериальные внутриклеточные Аг)Клетка –мишень и IgE и
Слайды и текст этой презентации
Слайд 1Клеточная цитотоксичность
важный механизм защиты против внутриклеточно локализованных возбудителей. Цитотоксическую активность
Слайд 2Цитотоксичность-убийство клетки-мишени с участием иммунных факторов (Ат, лимфоцитов (NK, CTL)
Виды:
Клетка-мишень
и ЦТЛ (через активацию CD4+Т-л)
Клетка-мишень и Ат и НК (АЗКТ)
Клетка-мишень
и Ат и комплемент (бактериальные внутриклеточные Аг)Клетка –мишень и IgE и эозинофиллы (гельминты)
Слайд 3Клеточная цитотоксичность
Для осуществления функции антигенспецифической цитотоксичности дифференцирована субпопуляция
CD8+
Т – ЦТЛ (α-β Т –л). TCR лимфоцитов распознает свой
Аг в комплексе с молекулой МНС1 кл на мембране клеток собственного организма, которые в данном случае называются клетками-мишенями для киллерной атаки со стороны ЦТЛ. Этот же молекулярный механизм убийства клеток- мишенией реализуется и у NK.Слайд 4Клеточная цитотоксичность
Специализированный механизм киллинга локализован в в гранулах CD8+Т-л. Неиммуные
CD8+Т-л после выхода из тимуса имеют программу для биосинтеза эффекторных
молекул, но не сами молекулы. После вовлечение их в иммунный ответ и распознавания антигена начинается синтез цитотоксинов-эффекторные молекулы накапливаются в гранулах. Гранулы находятся в локальной связи с TCR, что обеспечивает возможность строго направленного киллерного удара CD8+Т-л по клетке-мишени с Аг.Слайд 5Клеточная цитотоксичность
Цитотоксины неспецифичны, они одинаковы для всех Аг. Однако при
работе ЦТЛ не повреждаются сами ЦТЛ и здоровые клетки
тканей организма, а уничтожаются больные клетки, на которых экспрессированы Аг вирусов или др. внутриклеточных патогенов.Слайд 6Условия необходимые для клеточной цитотоксичности
живой эффекторный лимфоцит(CD8+Т-л)
межклеточный контакт –
зона контакта интервейс
связывание ТСR с Аг
катионы магния и кальция
глюкоза
общие продукты
генов МНС лимфоцита и клетки-мишени (обычно, но не всегда)система микрофиламентов и микротрубочек эффекторной клетки
Слайд 7Условия не влияющие на клеточную цитотоксичность
Синтез ДНК и РНК,
белка
Антитела
Синтез комплимента
Синтез лимфокинов
Метаболизм клетки-мишени
Слайд 8Клеточная цитотоксичность
Активация CD8+Т-к через активацию CD4+Т-л Запуск осуществляется Аг, который
инфицировал клетки организма. Презентация Аг Тхо происходит макрофагами или
дендритными клетками, через комплекс Аг пептид- МНС2класса и АПК обеспечививают активацию CD8+ через комплекс пептид-МНС1класс.При этом д.б. костимуляция -взаимодействие CD80\ CD86 АПК с корецептором CD28 Т-л.
Слайд 9Клеточная цитотоксичность.
В результате активации, CD8+ выходят из фазы покоя, подвергаются
бласт-трансформации и экспрессируют активационные молекулы (CD25, RIL2 и др.).
Источником
ИЛ-2, который необходим для активации CD8+, являтся Тхо, АПК и сами CD8+ могут вырабатывать Ил-2 (аутокринно). Далее CD8+ пролиферируют для создания необходимого количества клеток, для разрушения клеток –мишеней, на поверхности которых присутствует комплекс Аг-пептид- МНС 1 кл. Слайд 10Клеточная цитотоксичность.
ИЛ-2- поддерживает длительность пролиферации ЦТЛ, усиливает экспрессию рецепторов клеток
и обеспечивает повторное деление клеток.
Одновременно с Ил-2 действуют Ил-7,
4, 13, 15 и ряд медиаторов, они работают как кофакторы Т-ростовых цитокинов (ФНОальфа, Ил-1, 10,12).При цитотоксичном иммуном ответе происходит 4-5 делений CD8+ в первые 3-4 суток иммунного ответа.
Слайд 11Клеточная цитотоксичность.
После завершения делений происходит дифференцировка CD8+ Т-л, они готовы
к киллерной работе. У таких лимфоцитов:
сохраняется бластная формы
цитоплазменный аппарат для
синтеза белков почти не развиваетсяпроисходит активация генов, которые участвуют в образовании иммунного комплекса с клеткой-мишенью и они осуществляют цитолиз (за счет перфоринов, гранзимов, интегринов, поздних активационных молекул).
Слайд 13Формирование
зоны контакта интервейс
Распознавание комплекса Аг- пептид-МНС1 на клетке-мишени осуществляет
ТСR CD8+Т-л, корецептора СD8+ и далее происходит запуск уничтожения
клетки-мишени, за счет :вспомогательных молекул адгезии - интегрины CD11а, CD18(CD8+) и СD54
Т-кл распознают молекулы CD80\86 на клетке- мишени
TCR связывается с комплексом пептид-клетка-мишень-МНС1 кл
Слайд 14Зона контакта интервейс
ЦТЛ СD8+ реорганизуются (цитоплаз-матические гранулы с эффекторными молекулами
и компоненты цитоскелета).
Связанные с мембранами гранулы - одни плотные, другие
везикулярные, находятся строго над участками мембраны клеток –мишеней.На пространстве между ядром и этим участком, встраиваются клеточный центр и аппарат Гольджи. Здесь же сосредотачиваются белки цитоскелета – актин и тубулин.
Слайд 16Зона контакта интервейс
Затем происходит программирование клеток-мишеней к лизису (в основе
которого ионы магния и кальция). Магний необходим для связывания киллерной
клетки с клеткой-мишенью, а кальций нужен на более поздних этапах – адгезия и программирование лизиса.Слайд 17Клеточная цитотоксичность.
Далее происходит слияние мембран гранул, на них содержится молекулы
адгезии и везикулярные молекулы МНС1 класса и выход содержимого гранул
в зону межклеточного контакта. В гранулах содержатся перфорины и гранзимы. (Перфорины - представляют собой растворимый белок, который в присутствии кальция полимеризуется в мембране за 1 секунду, делая поры в клеточной стенке клетки-мишени). Через пору внутрь клетки-мишени ЦТЛ инъецирует гранзимы.Слайд 18Клеточная цитотоксичность.
Их 3 вида ЦТЛ – А, В, С.
Это специализированные сериновые пртеазы, которые несут специальные ферменты, предназначенные для
инициации программы апоптоза. Далее активируются каспазы (белки способствующие апоптозу), ядерные мишени становятся более уязвимыми, присоединяются эндонуклеазы, происходит фрагментация ДНК и апоптоз.Слайд 19Клеточная цитотоксичность.
Клетка-мишень сама разрушается и вместе с ней АГ. Но
если в клетке-мишени есть какие-то дефекты в механизмах апоптоза или
эта программа вовсе не поставлена, то ЦТЛ все равно разрушат клетку некрозом – осматическим лизисом через поры сформированные перфорином. Но при этом неповрежденные вирусные частицы и нуклеиновые кислоты разбегутся на свободу по организму и заразят другие клетки.Слайд 20Клеточная цитотоксичность.
На организацию сигнала на апоптоз для клетки-мишени ЦТЛ требуется
не более 5 мин., после чего он физически переходит к
другой клетке-мишени, т.е. ЦТЛ является серийным киллером.Кроме того, ЦТ- клетки экспрессируют Fas-лиганд и секретирует ФНО альфа и бетта, которые взаимодействует со спецефическими рецепторами гибели мембраны клетки-мишени и запускает апоптоз.
Слайд 21Клеточная цитотоксичность.
При реализации иммунного цитолиза Тх1 в передаче летального сигнала
участвуют ФНО альфа, лимфотоксин; рецептор р55(он же экспессирует клетки мишени-
опухоль), Интерферон альфа – усиливает экспрессию молекул МНС на поверхности клетки – мишени.Этот механизм может также срабатывать уже после отделения CD8 и перемещения его к другим клеткам-мишеням.
Слайд 22Клеточная цитотоксичность.
Таким образом, СD8 ЦТЛ еще и продуцируют цитокины. Большинство
иммунных ЦТЛ индуцирует интерферон альфа, бетта и гамма.
Гамма интерферон
–ингибирует реплекацию вирусов; индуцирует в клетках повышенную экспрессию молекул МНС1 класса и 2, пептидтранспортных белков – необходимых для представления антигенов в комплексе с молекулами МНС 1 класса, что способствует более эффективному представлению вирусных Аг для Т-л (как для распознания, так и для киллинга);Слайд 23Клеточная цитотоксичность.
активирует макрофаги и NK;
является кофактором индукции дифференцировки из CD4
Тхо –субпопуляции провоспалительных CD4 Т-л – Тх1. Что означает CD8
ЦТЛ вносят вклад в развитие других эффекторных механизмов иммунного ответа (Тх1).Слайд 25NK: клеточная цитотоксичность
Нормальные киллеры – дифференцируются из общей лимфоидной клетки-предшественницы.
NK не перестраивают гены TCR, но имеет тот же самый
цитотоксический аппарат убийства клетки-мишени, что и в ЦТЛ, без предварительной иммунизации. NK в циркулирующей крови составляют около 15% от всех мононуклеарных клеток. NK локализованы в печени, красной пульпе селезенки, слизистых оболочкахСлайд 26NK: клеточная цитотоксичность
На NK есть рецепторы, способные связывать молекулы МНС-1
собственных клеток. Эту ингибирующую киллерную функцию NK, обозначают KIR (рецепторы
ингибирующие киллерную активность). Гены KIR NK локализованы в хромосоме 19. Кроме того на NK экспрессирована молекула CD8, имеющая сродство к МНС-1.Слайд 27NK: клеточная цитотоксичность
Если при контакте клетки эти рецепторы не находят
достаточного количества своих лиганд (МНС-1), то ингибирующий сигнал с KIR-рецепторов
также оказывается недостаточным, и NK развивает в отношении этой клетки цитотоксическую атаку и убивает клетку. Но так как субнормальная экспрессия МНС 1 возникает при патологических процессах в клетках (при вирусных инфекциях, опухолевом перерождении) и NK могут убивать клетки опухолевые и инфицированные вирусом.Слайд 28NK: клеточная цитотоксичность
Мембранным маркером NK является мембранная молекула CD56 –
изоформа адгезивной молекулы из семейства молекул адгезии клеток нервной системы
из суперсемейства иммуноглобулинов.Имеется 2 субпопуляции NK: CD56 (много) =CD16- ( преобладает в печени, локализируется синусоидах, слизистой оболочки матки) и CD56 (мало)= CD16+ (является АЗКЦТ эффекторной, преобладает в крови и селезенке ).