Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Коллекция учебных динамических слайдов по химии 8 класс
Содержание
- 1. Коллекция учебных динамических слайдов по химии 8 класс
- 2. Содержание:1. Химический элемент.2. Тренировочный материал для изучения
- 3. Содержание:12. Степень окисления.13. Классификация неорганических веществ. 14.
- 4. Химический элемент – это определенная группа атомов.m
- 5. Урок 5-6Тема: Строение периодической системы. Знаки химических
- 6. Тема: Химические формулы.Урок 7Чтение химических формул.Примеры:NH3 –
- 7. Урок 11Составление химических формул по валентности. Правило
- 8. Урок 15Орбитально – планетарное модель строение атома. Тема: Строение атома.Ядро1s орбиталь2s орбиталь2p орбиталь3s орбиталь3p орбиталь3d орбитальЭЛЕКТРОННАЯОБОЛОЧКАДалееСодержаниеНазад
- 9. Урок 17Тема: Строение электронных оболочек атомов.Электронная оболочка
- 10. Урок 18Тема: Строение электронных оболочек атомов.- Энергетический
- 11. Урок 20Тема: Ионы и ионная химическая связь.Химическая
- 12. Урок 21Тема: Ковалентная связь между одинаковыми атомами
- 13. Тема: Ковалентная полярная химическая связь.Химическая связь, возникающая
- 14. Тема: Молярный объем газов.Урок 31Молярный объем (Vm)
- 15. Тема: Степень окисления.Урок 34Степень окисления – это
- 16. Классификация веществ.ВеществаПростыеСложныеОксидыОснованияСолиКислотыМеталлыНеметаллыОксидыОксиды – это сложные вещества, состоящие
- 17. Тема: Кристаллические решетки.Урок 44Схема: Строение веществ в
- 18. Тема: Чистые вещества и смеси.Урок 45Виды смесей.Схема:ВеществаЧистыеСмесиОднородныеНеоднородныеСодержат
- 19. Уравнение химической реакции – это условная запись
- 20. СОСТАВЛЕНИЕ УРАВНЕНИЙ ХИМИЧЕСКИХ РЕАКЦИЙПример: Составить уравнение реакции
- 21. Тема: Электролитическая диссоциация.Урок 72Электролиты – это вещества,
- 22. Тема: Реакции ионного обмена.Пример: Взаимодействие хлорида бария
- 23. Тема: Условия протекания реакций ионного обмена.I. Если
- 24. Коллекция учебных динамических слайдов по химии 8
- 25. Скачать презентанцию
Слайды и текст этой презентации
Слайд 12008
aleksei.bazhenov@mail.ru
Коллекция учебных динамических слайдов по химии 8 класс.
Разработал:
Учитель химии
– биологии первой квалификационной категории
Мансийский автономный округ. Нижневартовский район. МОУ Охтеурская ОСШСлайд 2Содержание:
1. Химический элемент.
2. Тренировочный материал для изучения знаков химических элементов.
3. Чтение химических формул.
4. Валентность.
5. Орбитально – планетарная
модель строения атома. 6. Строение электронной оболочки. (Часть 1)
7. Строение электронной оболочки. (Часть 2)
8. Ионы и ионная химическая связь.
9. Ковалентная неполярная связь.
10. Ковалентная полярная связь.
Далее
Содержание
Назад
Слайд 3Содержание:
12. Степень окисления.
13. Классификация неорганических веществ.
14. Кристаллические решетки.
15.
Чистые вещества и смеси.
16. Уравнения химических реакций.
17. Составление уравнений химических
реакций.18. Прибор для определения электролитов.
11. Молярный объем газов.
19. Реакции ионного обмена.
20. Условия протекания реакций ионного обмена.
Далее
Содержание
Назад
Примечание.
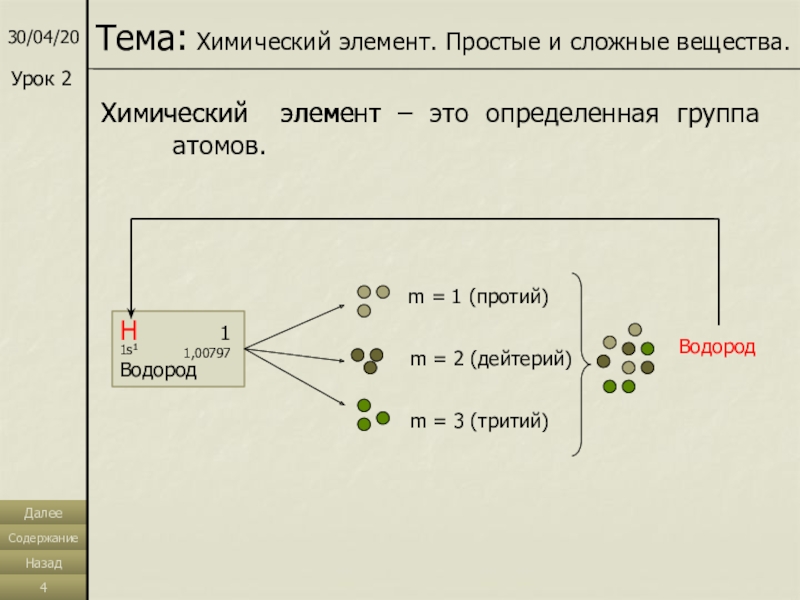
Слайд 4Химический элемент – это определенная группа атомов.
m = 1 (протий)
m = 2 (дейтерий)
m = 3 (тритий)
Водород
Химический элемент
Н
1
1,00797
1s1
Водород
Тема:
Химический элемент. Простые и сложные вещества.Урок 2
Далее
Содержание
Назад
Слайд 5Урок 5-6
Тема: Строение периодической системы. Знаки химических элементов.
Тренировочный материал к
изучению знаков химических элементов.
Сейчас на экране будут появляться знаки химических
элементов. Четко и правильно проговаривай название и произношение химического элемента. Желаю тебе удачи!
S
Al
Br
Ca
Na
P
N
C
Mg
Cu
I
Fe
Hg
O
Ba
Si
Au
Cl
Zn
K
H
B
Pb
Mn
Ag
F
Далее
Содержание
Назад
Слайд 6Тема: Химические формулы.
Урок 7
Чтение химических формул.
Примеры:
NH3 – молекула эн аш
три состоит из одного атома азота и трех
атомов водорода.
2.
Al(OH)3 – молекула алюминий о аш трижды состоит из одного атома алюминия, трех атомов кислорода и трех атомов водорода.3. K3BO3 – молекула калий три бор о три состоит из трех атомов калия, одного атома бора и трех атомов кислорода.
P2O5
Fe2O3
BaCO3
Na2SO4
Ca(OH)2
(NH4)3PO4
KHCO3
PbSiO3
AlCl3
CH3COOH
AgNO3
ZnMnO4
C8H18
Далее
Содержание
Назад
Слайд 7Урок 11
Составление химических формул по валентности.
Правило нахождения валентности:
-
У металла валентность ставится по номеру группы.
- У неметалла, стоящего
на первом месте в формуле, ставится высшая валентность.- У неметалла, стоящего на втором месте в формуле, ставится низшая валентность.
Na O
Пример:
I
II
2
Тема: Валентность.
Порядок действий:
1. Находим валентность химических элементов.
2. Находим наименьшее общее кратное.
3. Находим индексы.
:
2
I
=
2
2
2
:
II
=
1
1
S O
VI
II
6
1. Находим валентность химических элементов.
2. Находим наименьшее общее кратное.
3. Находим индексы.
:
6
VI
=
1
1
6
:
II
=
3
3
P O
V
II
10
1. Находим валентность химических элементов.
2. Находим наименьшее общее кратное.
3. Находим индексы.
:
10
V
=
2
2
10
:
II
=
5
5
Далее
Содержание
Назад
Слайд 8Урок 15
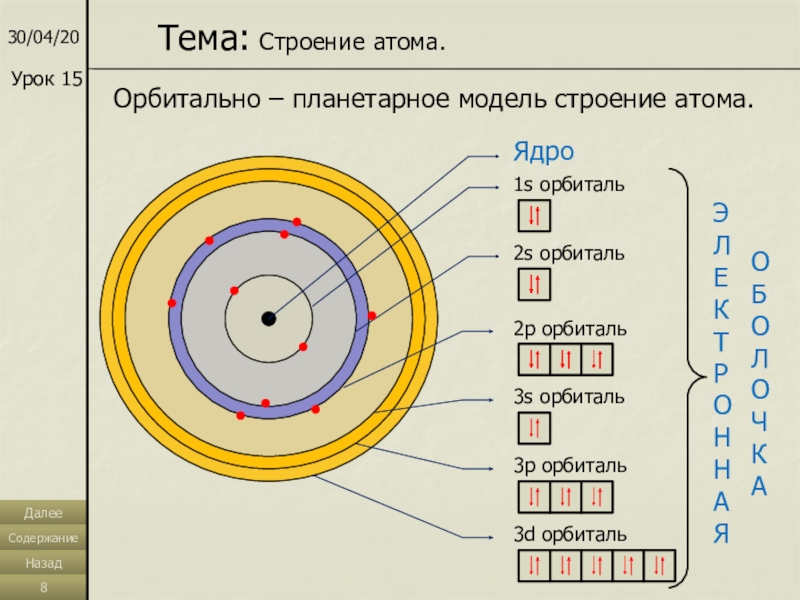
Орбитально – планетарное модель строение атома.
Тема: Строение атома.
Ядро
1s
орбиталь
2s орбиталь
2p орбиталь
3s орбиталь
3p орбиталь
3d орбиталь
Э
Л
Е
К
Т
Р
О
Н
Н
А
Я
О
Б
О
Л
О
Ч
К
А
Далее
Содержание
Назад
Слайд 9Урок 17
Тема: Строение электронных оболочек атомов.
Электронная оболочка – это совокупность
электронов, двигающихся вокруг ядра атома.
Электроны в электронной оболочке располагаются на
энергетических уровнях.n – главное квантовое число – определяет число энергетических уровней .
Номер периода совпадает с числом энергетических уровней элемента.
Период
3
Группа
V
3
Число электронов (N) на уровне рассчитывается по формуле.
N = 2n2
n = 1, N = 2 . 12 = 2
2
n = 2, N = 2 . 22 = 8
8
Номер группы совпадает с числом электронов на последнем энергетическом уровне.
5
Общее число электронов
е =
15
Проверка
15
Далее
Содержание
Назад
Слайд 10Урок 18
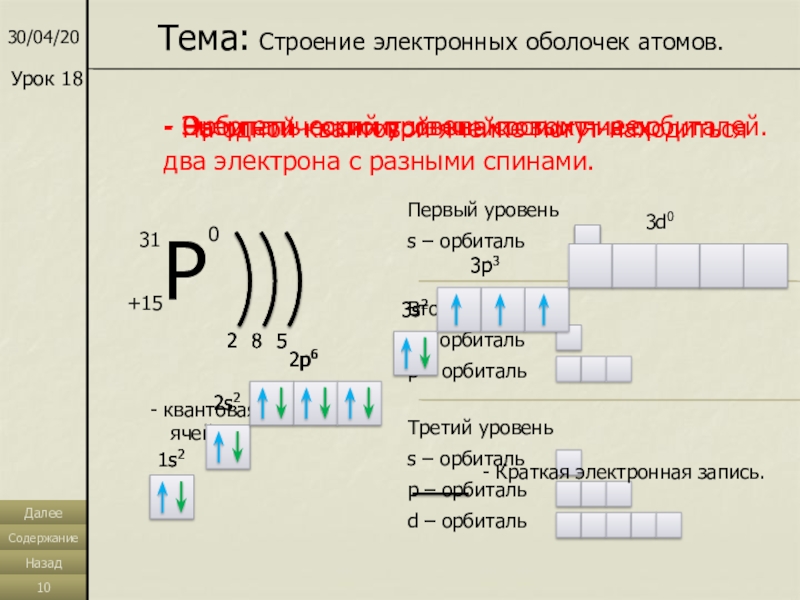
Тема: Строение электронных оболочек атомов.
- Энергетический уровень состоит из
орбиталей.
2
8
5
Первый уровень
s – орбиталь
Второй уровень
s – орбиталь
p – орбиталь
Третий уровень
s
– орбитальp – орбиталь
d – орбиталь
- Орбиталь состоит из квантовых ячеек.
квантовая
ячейка
- На одной квантовой ячейке могут находиться два электрона с разными спинами.
1s2
1s2
2s2
2s2
2p6
2p6
3s2
3s2
3p3
3p3
3d0
- Краткая электронная запись.
Далее
Содержание
Назад
Слайд 11Урок 20
Тема: Ионы и ионная химическая связь.
Химическая связь, образующуюся между
ионами, называется ионной.
Ион – это частица образующаяся в результате
отдачи или принятия электрона. Пример:
NaCl – хлорид натрия (поваренная, пищевая соль)
+
1e
Ионная связь как правило возникает между металлом и неметаллом.
Механизм:
Na
+
NaCl
Cl
Na
Cl
+1
-1
Далее
Содержание
Назад
Слайд 12Урок 21
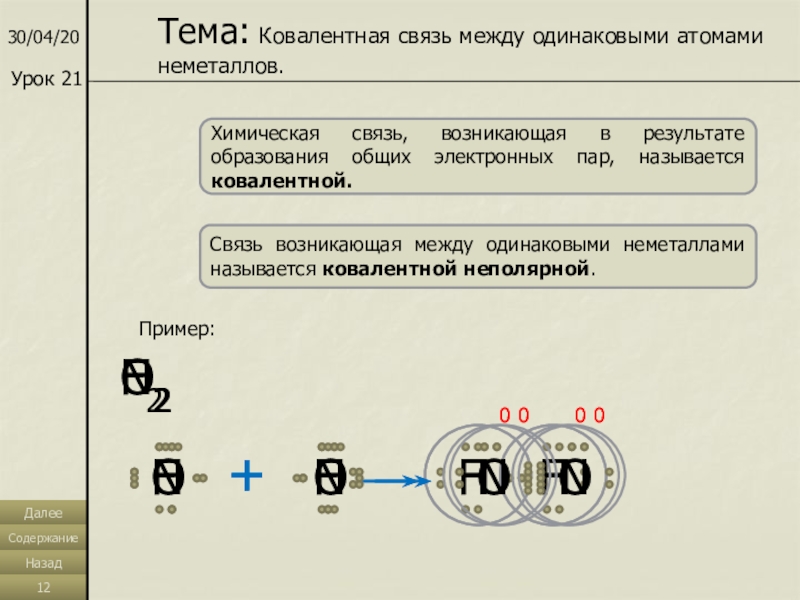
Тема: Ковалентная связь между одинаковыми атомами неметаллов.
Химическая связь, возникающая
в результате образования общих электронных пар, называется ковалентной.
Связь возникающая между
одинаковыми неметаллами называется ковалентной неполярной. Пример:
Н2
Н
Н
+
Н
Н
0
0
F2
F
F
+
F
F
0
0
O2
O
O
+
O
O
0
0
N2
N
N
+
N
N
0
0
Далее
Содержание
Назад
Слайд 13Тема: Ковалентная полярная химическая связь.
Химическая связь, возникающая в результате образования
общих электронных пар, называется ковалентной.
Связь возникающая между разными неметаллами называется
ковалентной полярной. Электроотрицательность (ЭО) – это способность атомов химического элемента притягивать к себе электроны.
Элемент с большей ЭО, при образовании ковалентной полярной связи, приобретает частично отрицательный заряд (- δ).
Элемент с меньшей ЭО, при образовании ковалентной полярной связи, приобретает частично положительный заряд (+ δ).
Ряд неметаллов.
F, O, N, Cl, Br, S, C, P, Si, H.
ЭО уменьшается
Пример:
НCl
Н
Cl
+
Н
Cl
- δ
+ δ
Н2О
Н
Н
О
+
Н
О
Н
- δ
+δ
+ δ
NН3
Н
Н
N
+
Н
N
Н
- δ
+ δ
+ δ
Н
Н
+ δ
Урок 22
Далее
Содержание
Назад
Слайд 14Тема: Молярный объем газов.
Урок 31
Молярный объем (Vm) (л/моль).
Vm – буквенное
обозначение молярного объема
л/моль – единицы измерения
Молярный объем – это объем
занимаемый 1 молем любого газа при нормальных условиях (22,4 л/моль). V – объем (л)
n – количество вещества (моль)
Нормальные условия (н.у.) – Т = 0оС ;
Р = 760 мм рт. ст. (101,3 кПа)
Vm
V
n
Vm
=
V
n
n
=
Vm
V
V
=
Vm
n
x
II. Задача.
Определите массу 89,6 л аммиака (NH3)
Дано:
V(NH3) = 89,6л
m(NH3) = ?
Решение:
1. n(NH3) - ?
n =
V
Vm
2. M(NH3) - ?
Mr(NH3) = Ar(N) + 3 . Ar(H) = 14 + 3 . 1 = 17
M(NH3) = 17 г/моль
3. m(NH3) = ?
m = M . n
m(NH3) = 17 г/моль . 4 моль = 61 г
Ответ: m(NH3) = 61 г
Далее
Содержание
Назад
Слайд 15Тема: Степень окисления.
Урок 34
Степень окисления – это заряд приобретаемый элементом
в соединении, в результате полной отдачи или принятия электрона.
Правила:
1. Степень
окисления элемента в простом веществе равна 0.H20 ; O20 ; F20 ; Cl20 ; Ca0.
2. Степень окисления некоторых элементов в соединении:
- H+1
- О-2
- степень окисления металла совпадает с его валентностью: Na+1 ; K+1 ; Ca+2 ; Mg+2 ; Ba+2 ; Al+3 .
3. Сумма степеней окисления элементов в соединении, с учетом коэффициентов, равна 0.
H+1; О-2; Na+1 ; K+1 ; Ca+2 ; Mg+2 ; Ba+2 ; Al+3 .
H2СO3
Пример:
1. Расставляем степени окисления элементов, которые можем определить по правилу 2.
H ;
+1
О
-2
2. Степень окисления элемента, у которого пока ее не можем определить , обозначим за X
3. Составляем и решаем уравнение. Правило 3.
+1
-2
Х
2 . (+1) + Х + 3 . (-2) = 0
2 + Х - 6 = 0
Х = +4
+4
Далее
Содержание
Назад
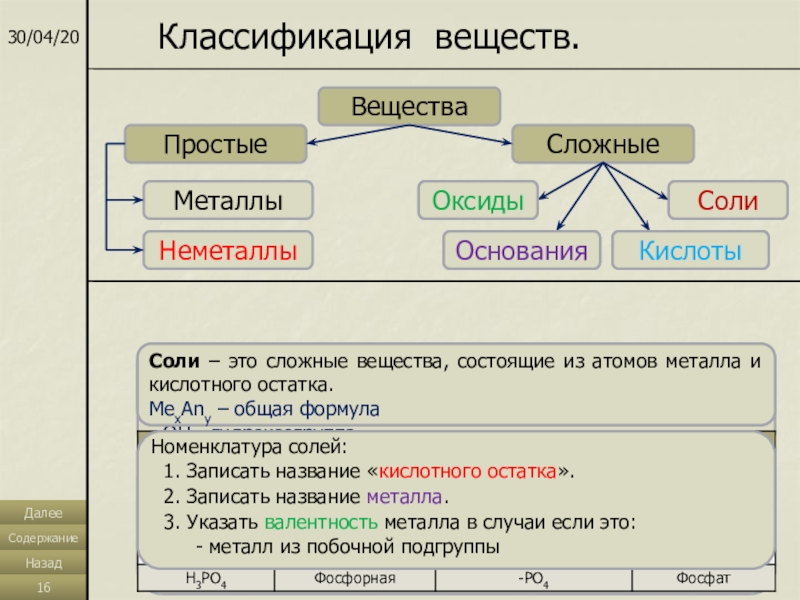
Слайд 16Классификация веществ.
Вещества
Простые
Сложные
Оксиды
Основания
Соли
Кислоты
Металлы
Неметаллы
Оксиды
Оксиды – это сложные вещества, состоящие из двух элементов,
один из которых кислород. ЭхОу – общая формула.
Основания
Основания – это
сложные вещества, состоящие из атомов металла и гидроксогрупп. Me(ОH)x – общая формула
- OH - гидроксогруппа
Кислоты
Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка.
HxAn – общая формула
Соли
Соли – это сложные вещества, состоящие из атомов металла и кислотного остатка.
MexAny – общая формула
Далее
Содержание
Назад
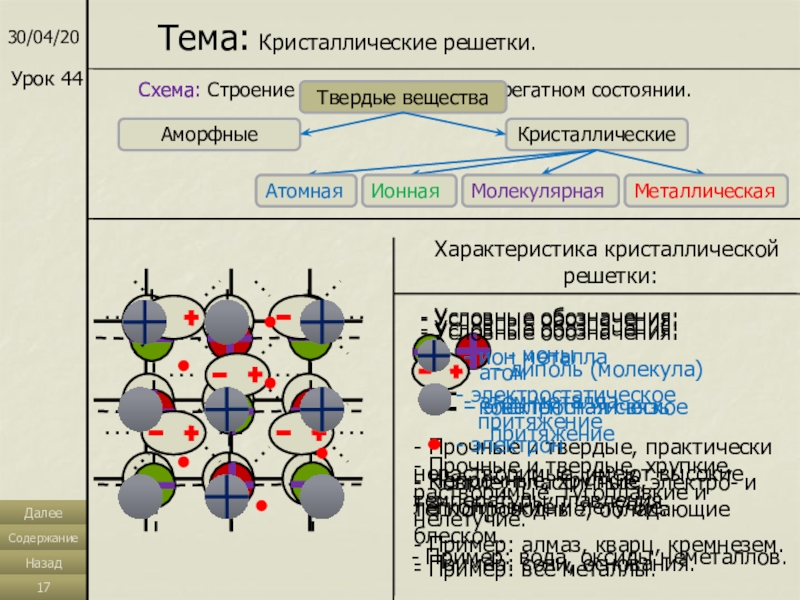
Слайд 17Тема: Кристаллические решетки.
Урок 44
Схема: Строение веществ в твердом агрегатном состоянии.
Твердые
вещества
Аморфные
Кристаллические
Атомная
Ионная
Молекулярная
Металлическая
Атомная
Характеристика кристаллической
решетки:
- Прочные и твердые, практически нерастворимые, имеют высокие
температуры плавления. - Пример: алмаз, кварц, кремнезем.
- Условные обозначения:
- Прочные и твердые, хрупкие, растворимые, тугоплавкие и нелетучие.
- Пример: соли, основания.
- Условные обозначения:
Ионная
Молекулярная
- Непрочные, хрупкие, легкоплавкие и летучие.
- Пример: вода, оксиды неметаллов.
- Условные обозначения:
- Ковкие, пластичные, электро- и теплопроводные, обладающие блеском.
- Пример: все металлы.
- Условные обозначения:
Металлическая
Схема:
Далее
Содержание
Назад
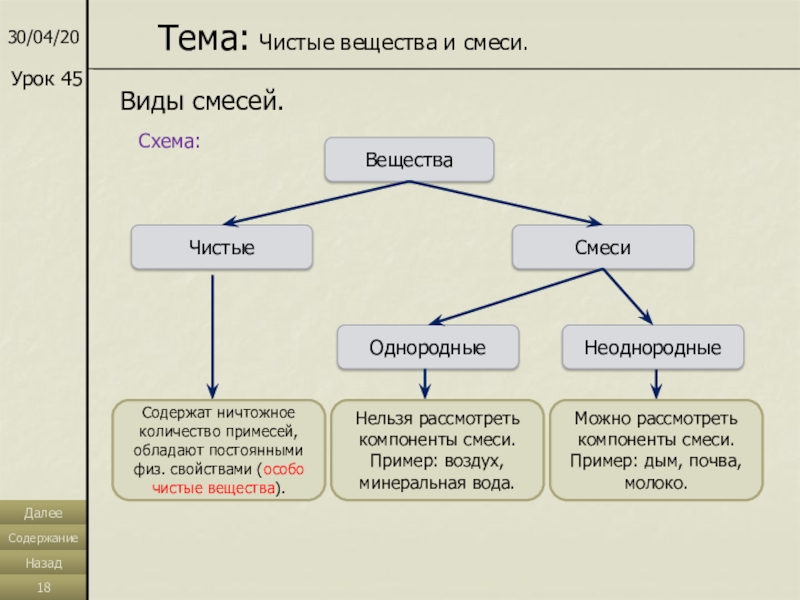
Слайд 18Тема: Чистые вещества и смеси.
Урок 45
Виды смесей.
Схема:
Вещества
Чистые
Смеси
Однородные
Неоднородные
Содержат ничтожное количество примесей,
обладают постоянными физ. свойствами (особо чистые вещества).
Нельзя рассмотреть компоненты смеси.
Пример: воздух, минеральная вода.Можно рассмотреть компоненты смеси. Пример: дым, почва, молоко.
Далее
Содержание
Назад
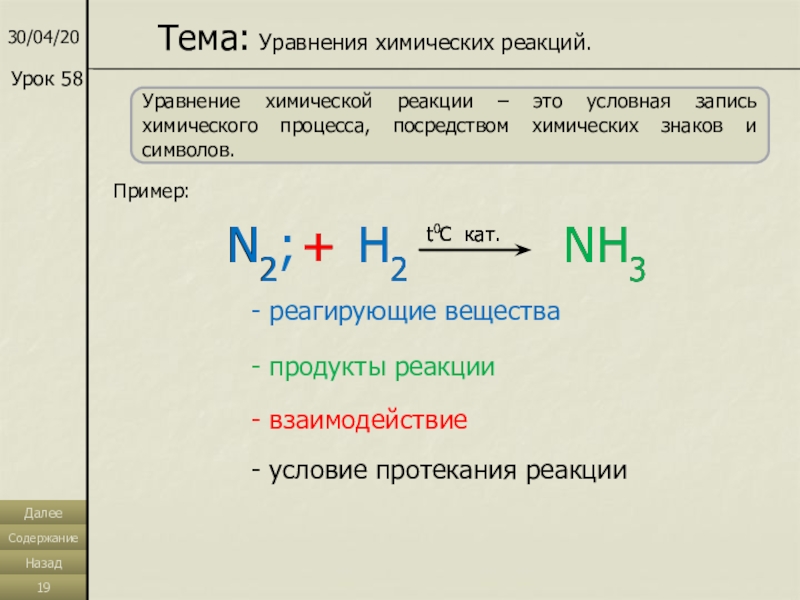
Слайд 19Уравнение химической реакции – это условная запись химического процесса, посредством
химических знаков и символов.
Пример:
Тема: Уравнения химических реакций.
N2;
+
H2
NH3
t0C кат.
- реагирующие
вещества- продукты реакции
- взаимодействие
- условие протекания реакции
Урок 58
Далее
Содержание
Назад
Слайд 20СОСТАВЛЕНИЕ УРАВНЕНИЙ ХИМИЧЕСКИХ РЕАКЦИЙ
Пример: Составить уравнение реакции взаимодействия фосфора и
кислорода.
1. В левой части уравнения запиши формулы веществ, которые вступают
в реакцию. (Формулы простых газообразных веществ состоят из двух атомов: Н2, О2, N2, Cl2 и.т.д.)2. В правой части уравнения запиши формулы веществ образующихся в результате реакции.
P2O5
3. Определи: атомов, какого элемента в левой части уравнения больше. (Вначале уравнивают число атомов, которых в левой части уравнения больше.)
4. Соедини фигурной стрелкой атомы этого элемента в левой и правой частях.
5. Определи Н.О.К. чисел атомов в левой и правой частях уравнения.
10
6. Запиши Н.О.К. в квадратике под стрелкой.
7. Раздели Н.О.К. на число атомов каждого соединенного элемента.
8. Запиши полученный коэффициент перед формулой.
5
2
9. Определи: есть ли еще не уравненные (не соединенные) атомы:
а) Если есть, то вернись к пункту 3.
б) Если нет, то ВСЁ.
4
4
Материал взят из презентации
Лебедева Сергея Николаевича
ГОУ школа-интернат V-VI вида. Костромской области.
Далее
Содержание
Назад
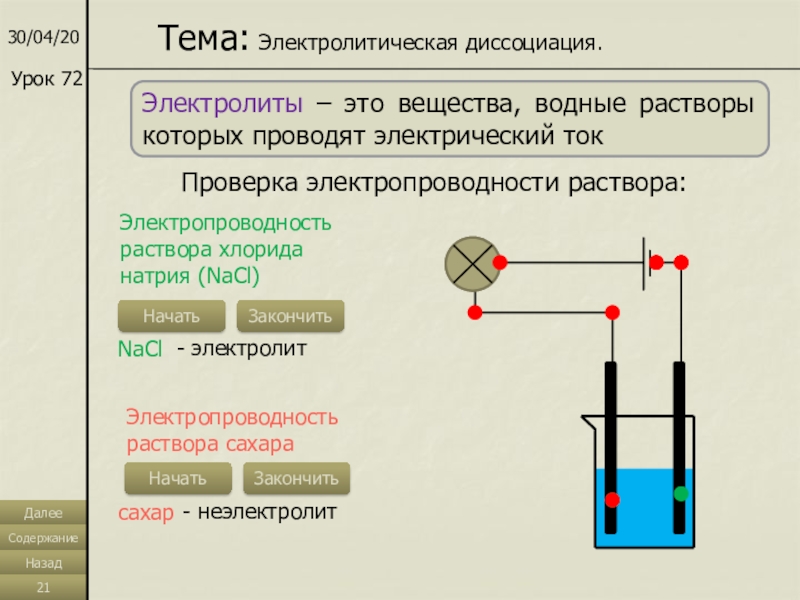
Слайд 21Тема: Электролитическая диссоциация.
Урок 72
Электролиты – это вещества, водные растворы которых
проводят электрический ток
Проверка электропроводности раствора:
Электропроводность раствора хлорида натрия (NaCl)
Начать
Закончить
NaCl
-
электролитЭлектропроводность раствора сахара
Начать
Закончить
сахар
- неэлектролит
Далее
Содержание
Назад
Слайд 22Тема: Реакции ионного обмена.
Пример: Взаимодействие хлорида бария с сульфатом натрия.
BaCl2
+ Na2SO4 BaSO4 + NaCl
Ba2+
2Cl-
+
+
2Na+
SO42-
+
1.
Записать уравнение реакции в молекулярном виде.Порядок действий:
2. Расставить коэффициенты.
2
3. По таблице растворимости, определить нерастворимые вещества. Обозначить их стрелкой вниз.
4. Составить полное ионное уравнение (растворимые вещества расписать на ионы.
BaSO4
+
2Na+
+
2Cl-
5. Сократить одинаковые ионы в левой и правой части полного ионного уравнения.
6. Составить сокращенное ионное уравнение.
Ba2+
+
SO42-
BaSO4
РИО (реакции ионного обмена) – это реакции протекающие между электролитами.
Далее
Содержание
Назад
Слайд 23Тема: Условия протекания реакций ионного обмена.
I. Если образуется осадок.
BaCl2 +
Na2SO4 BaSO4 + NaCl
Ba2+
2Cl-
+
+
2Na+
SO42-
+
2
BaSO4
+
2Na+
+
2Cl-
Ba2+
+
SO42-
BaSO4
Mg(NO3)2 + Na2CO3 MgCO3 + NaNO3
Mg2+
2NO3-
+
+
2Na+
CO32-
+
2
MgCO3
+
2Na+
+
2NO3-
Mg2+
+
CO32-
MgCO3
II. Если образуется газ.
Na2CO3 + H2SO4 Na2SO4 + H2CO3
H2O
CO2
2Na+
CO32-
+
+
2H+
SO42-
+
2Na+
SO42-
+
+
+
CO32-
+
2H+
H2O
CO2
+
III. Если образуется вода.
2NaOH + H2SO4 Na2SO4 + 2H2O
2H2O
2Na+
2OH-
+
+
2H+
SO42-
+
2Na+
SO42-
+
+
2OH-
+
2H+
2H2O
OH-
+
H+
H2O
Далее
Содержание
Назад
Слайд 24Коллекция учебных динамических слайдов по химии 8 класс.
Если, разработанные мною слайды, пригодятся Вам в работе, я
буду очень рад. По ходу просмотра могли возникнуть вопросы или замечания, которые стоит исправить, не поленитесь дайте знать.Возможно у вас есть собственные, подобные разработки. Я могу их обработать и разместить рядом с указанием вашего авторства. Может быть в будущем получится отличная разработка, которая поможет многим при подготовки к урокам. Надеюсь, что заинтересовал Вас, пишите aleksei.bazhenov@mail.ru
С Уважением Баженов А.А.
Верьте в себя и у Вас все получится
Далее
Содержание
Назад