Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Комунальний заклад Бердянський медичний коледж Запорізької обласної ради
Содержание
- 1. Комунальний заклад Бердянський медичний коледж Запорізької обласної ради
- 2. Головну підгрупу елементів третій групи періодичної
- 3. Бор — досить розповсюджений у природі
- 4. Кислота борна (Acidum boricum)Н3ВО3
- 5. Добування. Кислоту борну здобувають розкладанням бури
- 6. Властивості. Безбарвні, блискучі, ледь жирні лусочки
- 7. При тривалому нагріванні (до 100 °С)
- 8. Ідентифікація. 1. Суміш борної кислоти зі
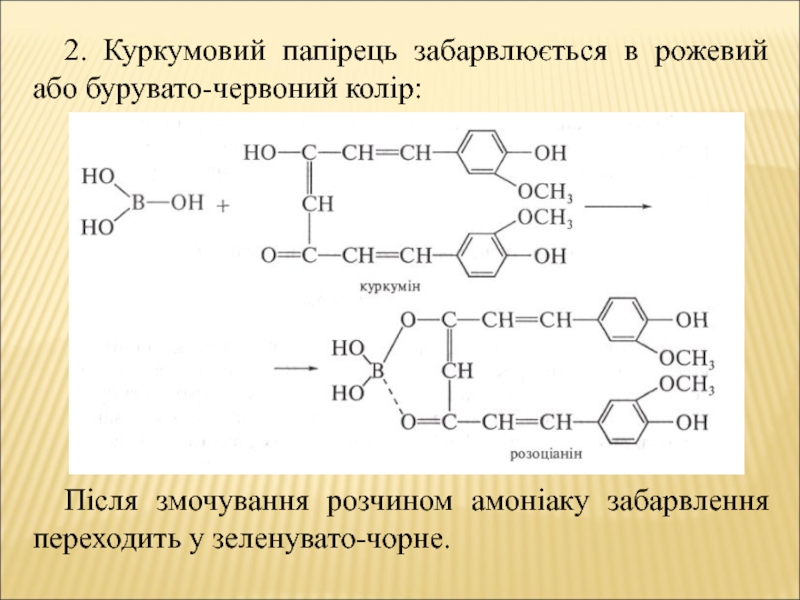
- 9. 2. Куркумовий папірець забарвлюється в рожевий
- 10. 3. Водний розчин субстанції має кислу
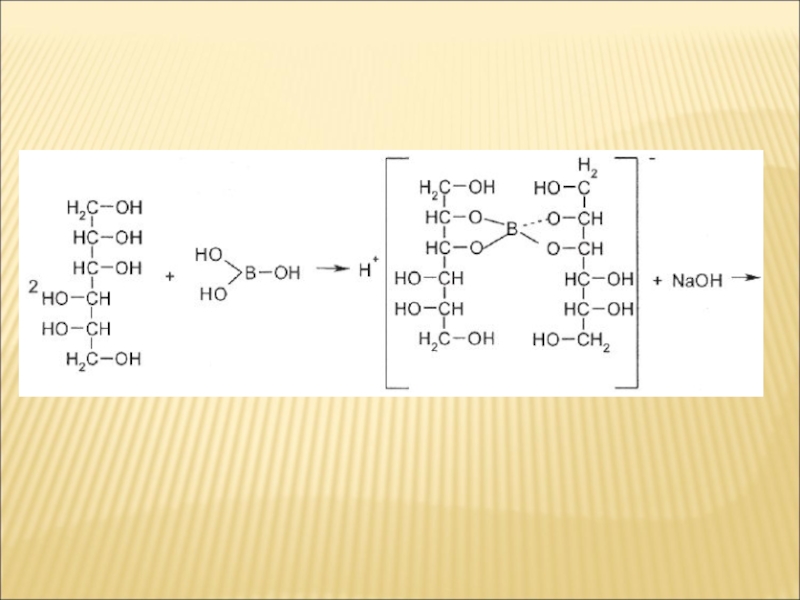
- 11. Слайд 11
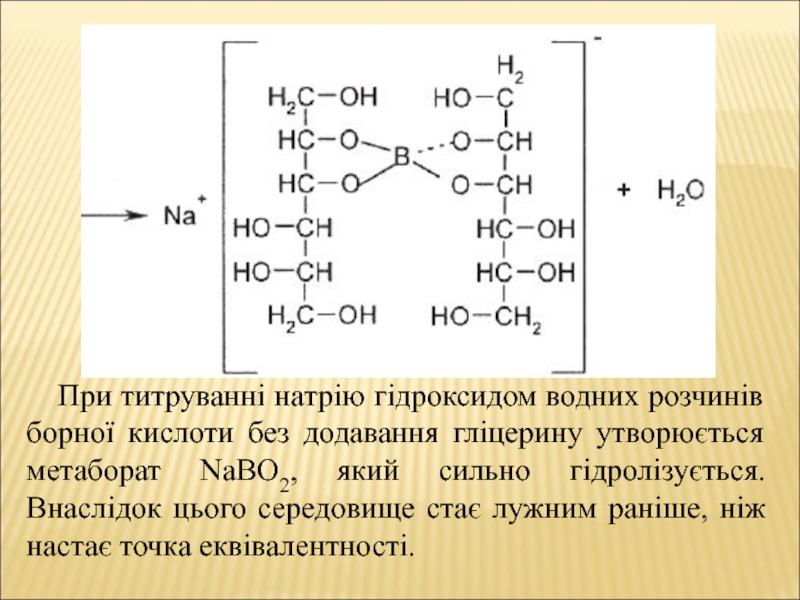
- 12. При титруванні натрію гідроксидом водних розчинів
- 13. Зберігання. У добре закупореній тарі.Застосування. Антисептичний
- 14. Натрію тетраборат (бура)(Natrii tetraboras) Borax
- 15. Добування. Буру отримують із борокальцитів або
- 16. Властивості. Кристалічний порошок білого кольору, або
- 17. Ідентифікація:1. З метанолом у присутності кислоти
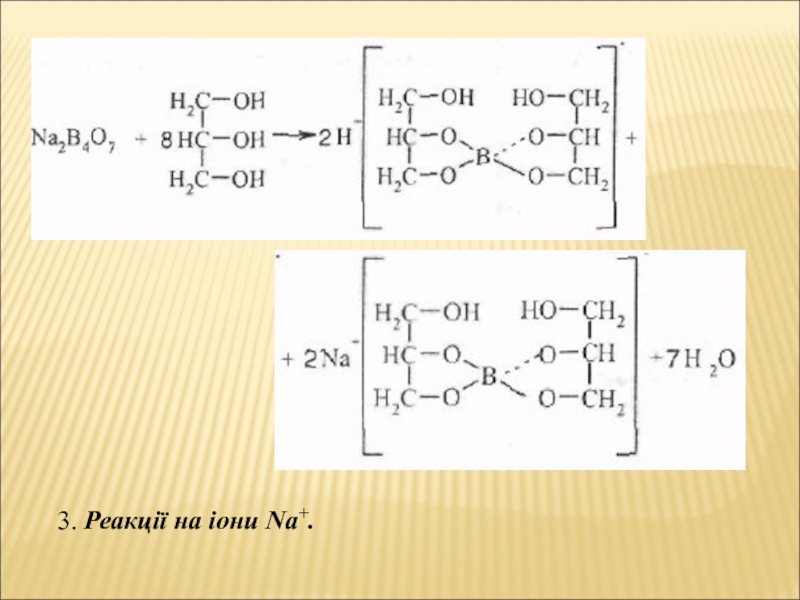
- 18. 3. Реакції на іони Na+.
- 19. 2. Ацидиметрія, пряме титрування, індикатор — метиловий оранжевий, Е = 1/2М. м.
- 20. Зберігання. У добре закупореній тарі.Застосування. Зовнішньо
- 21. Дякую за увагу !
- 22. Скачать презентанцию
Головну підгрупу елементів третій групи періодичної системи складають бор, алюміній, галій, індій та талій. Негативної ступені окислення вони у своїх сполученнях не проявляють. Зазвичай вона становить +3. Металеві властивості виявляються
Слайды и текст этой презентации
Слайд 1Комунальний заклад «Бердянський медичний коледж» Запорізької обласної ради лекція з ФАРМАЦЕВТИЧНОЇ
Слайд 2
Головну підгрупу елементів третій групи періодичної системи складають бор,
алюміній, галій, індій та талій. Негативної ступені окислення вони у
своїх сполученнях не проявляють. Зазвичай вона становить +3. Металеві властивості виявляються слабо, а у бора переважають неметалеві властивості.З елементів третій групи тільки бор та алюміній мають медичне значення.
Слайд 3
Бор — досить розповсюджений у природі елемент. Зараз відомо
близько 90 мінералів, до складу яких він входить. Бор є
одним із мікроелементів, необхідних для нормального функціонування живих організмів.У медицині знаходять застосування борна кислота і бура, які мають дезінфікуючі властивості.
Слайд 5
Добування. Кислоту борну здобувають розкладанням бури або борокальциту
гарячим розчином хлороводневої кислоти або із борвмісних мінералів (ашариту Mg2
B2O5 • H2O та ін.) дією на них концентрованою сірчаною кислотою: 3. CaB4O7 • 7H2O + 2HCl → 4H3BO3 + CaCl2 + 2H2O
Слайд 6
Властивості.
Безбарвні, блискучі, ледь жирні лусочки або дрібний кристалічний
порошок без запаху, леткий з парами води та спирту. Водні
розчини мають слабокислу реакцію. Розчинна у воді, 96 % спирті, легко розчинна у киплячій воді і гліцерині (85%).Слайд 7
При тривалому нагріванні (до 100 °С) втрачає частину води,
переходячи в метаборну кислоту НВО2, потім утворюється скловидна сплавлена маса,
яка при подальшому нагріванні спучується і, втративши всю воду, утворює борний ангідрид В2О3.Слайд 8
Ідентифікація.
1. Суміш борної кислоти зі спиртом і концентрованою
сульфатною кислотою горить полум'ям із зеленим окрайком:
Слайд 9
2. Куркумовий папірець забарвлюється в рожевий або бурувато-червоний колір:
Після змочування розчином амоніаку забарвлення переходить у зеленувато-чорне.
Слайд 10
3. Водний розчин субстанції має кислу реакцію. рН від
3,8 до 4,8. Розчин борної кислоти має бути прозорим, безбарвним.
Кількісне визначення.
Алкаліметрія, пряме титрування в середовищі маніту (за ДФУ) або в присутності інших багатоатомних спиртів, наприклад глюкози, гліцерину, індикатор — фенолфталеїн, Е= М. м.