Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Комунальний заклад Бердянський медичний коледж Запорізької обласної ради
Содержание
- 1. Комунальний заклад Бердянський медичний коледж Запорізької обласної ради
- 2. Натрію хлорид(Natrіi chloridum)NaCl
- 3. Добування. NaCl ─ єдиний з галогеноїдів,
- 4. Ідентифікація. 1. Реакції на іони Na+:а)
- 5. в) сіль натрію, змочена кислотою хлористоводневою
- 6. Випробування на чистоту. Броміди визначають спектрофотометрично
- 7. Барій визначають за реакцією з розчином
- 8. Кількісне визначення. Аргентометрія за методом Фольгарда,
- 9. 2. Аргентометрія за методом Мора, пряме титрування, індикатор — калію хромат, Е= М. м.
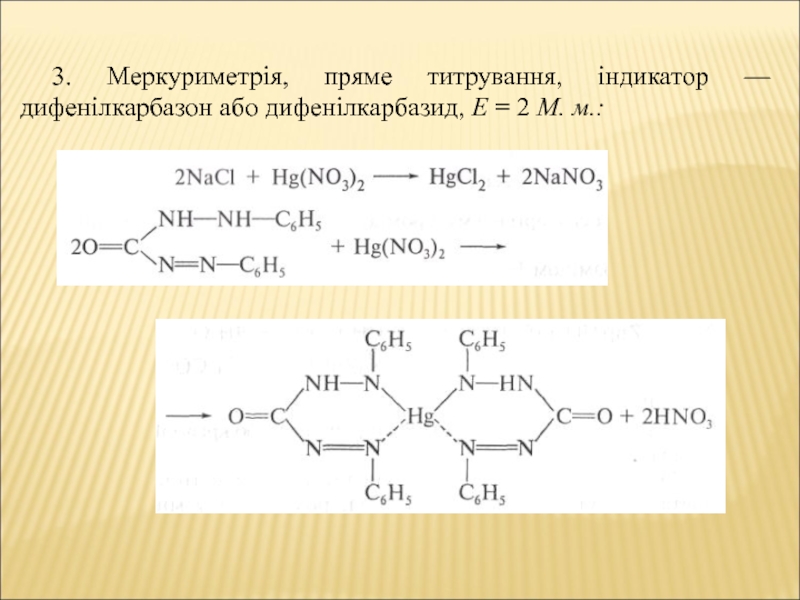
- 10. 3. Меркуриметрія, пряме титрування, індикатор — дифенілкарбазон або дифенілкарбазид, Е = 2 М. м.:
- 11. Точку еквівалентності також можна встановлювати
- 12. Зберігання. У добре закупореній тарі з
- 13. Дякую за увагу !
- 14. Скачать презентанцию
Натрію хлорид(Natrіi chloridum)NaCl
Слайды и текст этой презентации
Слайд 1Комунальний заклад «Бердянський медичний коледж» Запорізької обласної ради лекція з ФАРМАЦЕВТИЧНОЇ
Слайд 3
Добування. NaCl ─ єдиний з галогеноїдів, який широко розповсюджений
у природі у вигляді масивних відкладень каменої солі. Вона і
є основним джерелом для добування фармакопейного препарату. Водні розчини випаровують, після чого NaCl підвергають очищенню від супровідних його домішок. Далі NaCl перекристалізовують з води насиченою концентрованою хлороводневою кислотою, у котрій він погано розчинен.Властивості. Безбарвні кристали або білі кристалічні порошки без запаху, солоного смаку. Розчинні в 3 частинах води, нерозчинні в 95 %-ному спирті.
Слайд 4
Ідентифікація.
1. Реакції на іони Na+:
а) з розчином калію
піроантимонату (калію гексагідроксости-біату (V)) - утворюється білий осад:
б) з розчином
реактиву метоксифенілоцтової кислоти – утво-рюється об'ємний білий кристалічний осад:Осад розчиняється при додаванні розчину амоніаку розведеного і не випадає знову при наступному додаванні розчину амонію карбонату.
Слайд 5
в) сіль натрію, змочена кислотою хлористоводневою розведеною і внесена
в безбарвне полум'я, забарвлює його у жовтий колір.
2. Реакції на
іони С1─ (див. НCl)Слайд 6
Випробування на чистоту.
Броміди визначають спектрофотометрично після окиснення хлораміном
у присутності фенолового червоного і натрію тіосульфату (у випадку присутності
йодидів). Оптична густина одержаного розчину не повинна перевищувати оптичну густину еталону.Йодиди визначають з розчином натрію нітриту в кислому середовищі у присутності крохмалю; не повинне з'являтися блакитне забарвлення:
Слайд 7
Барій визначають за реакцією з розчином кислоти сульфатної розведеної.
Опалесценція одержаного розчину не повинна перевищувати опалесценцію суміші розчину S
і води дистильованої.Оскільки іони натрію та калію є антагоністами, то в солях натрію визначають домішки калію, а в солях калію — домішки натрію методом атомно-емісійної спектрометрії.
Такі домішки, як кальцій, залізо, тяжкі метали, сульфати, миш’як ДФУ допускає в межах еталонів, тому що допустима межа цих домішок не впливає на терапевтичний ефект і не викликає ніяких побічних явищ.