Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Корроз ия металлов и электролиз
Содержание
- 1. Корроз ия металлов и электролиз
- 2. КоррозияСамопроизвольное разрушение материалов под химическим воздействием окружающей
- 3. Химическая коррозияХимическое взаимодействие металла с агрессивной средойZn
- 4. Электрохимическая коррозияВоздухКапля водыЖелезо(Анод)Микродефект(Катод)Fe – 2ē = Fe2+O2
- 5. Способы защиты от коррозииКонструкционныйКортеновская стальСодержит ~ 2% CuПлотная оксидная пленкаНержавеющая стальОдин из составов:18% Cr, 10% Ni
- 6. Способы защиты от коррозииАнимацияПассивный Нанесение защитных покрытийлакокрасочныеполимерныеметаллическиеЕсть и другие…ZnSn
- 7. Способы защиты от коррозииАктивныйЭлектрохимическая защитаКатодная защитаАнодная защитаВ основном для AlОбразование оксидной пленкиЗащитный токАнодное заземление
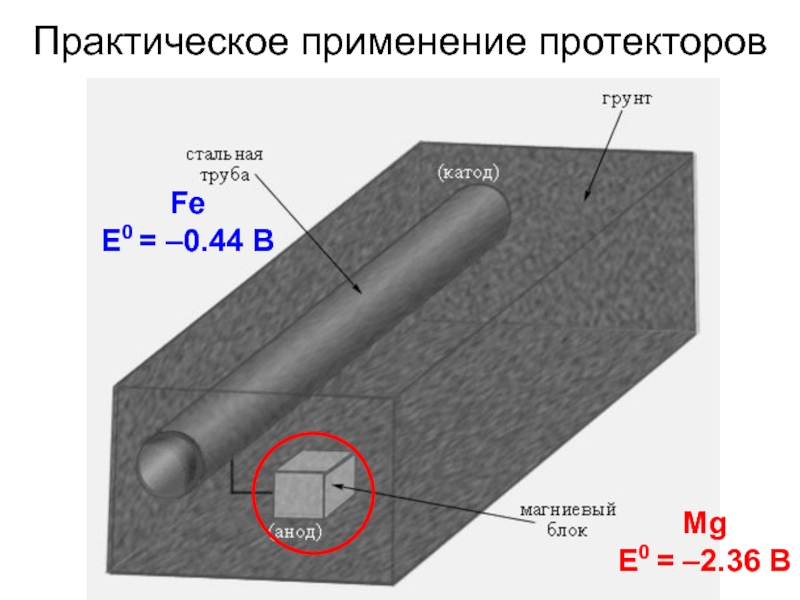
- 8. Практическое применение протекторовFeE0 = –0.44 ВMgE0 = –2.36 В
- 9. ЭлектролизОкислительно-восстановительные реакции в растворе или расплаве электролитов
- 10. Электролиз расплавов: алгоритмНаписать уравнение диссоциации вещества в
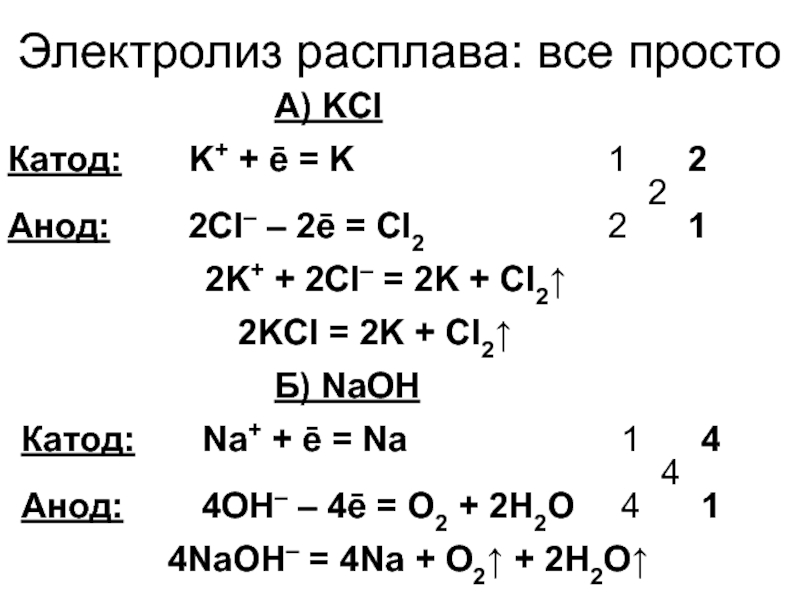
- 11. Электролиз расплава: все просто А) KClКатод:Анод:K+ +
- 12. Электролиз растворов: алгоритмНаписать уравнения диссоциации всех присутствующих
- 13. Электролиз растворовА) Раствор KClКатод:K+ + ē =
- 14. Электролиз растворовБ) Раствор CuSO4Катод:2H2O + 2ē =
- 15. Правила электролиза растворовКатодные процессыАнодные процессы
- 16. Участие материала анодаТолько металлы до Cu включительноА)
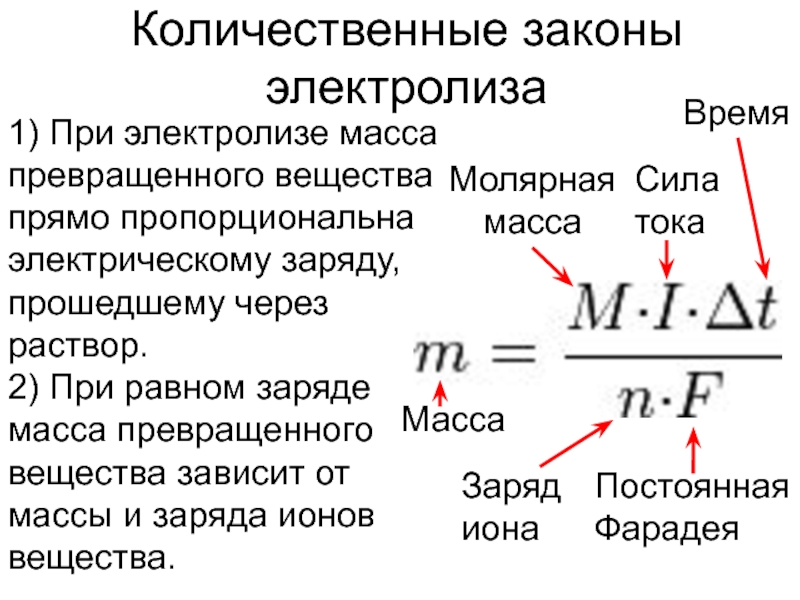
- 17. Количественные законы электролиза1) При электролизе масса превращенного
- 18. Количественные законы электролиза1) При электролизе масса превращенного
- 19. Скачать презентанцию
Слайды и текст этой презентации
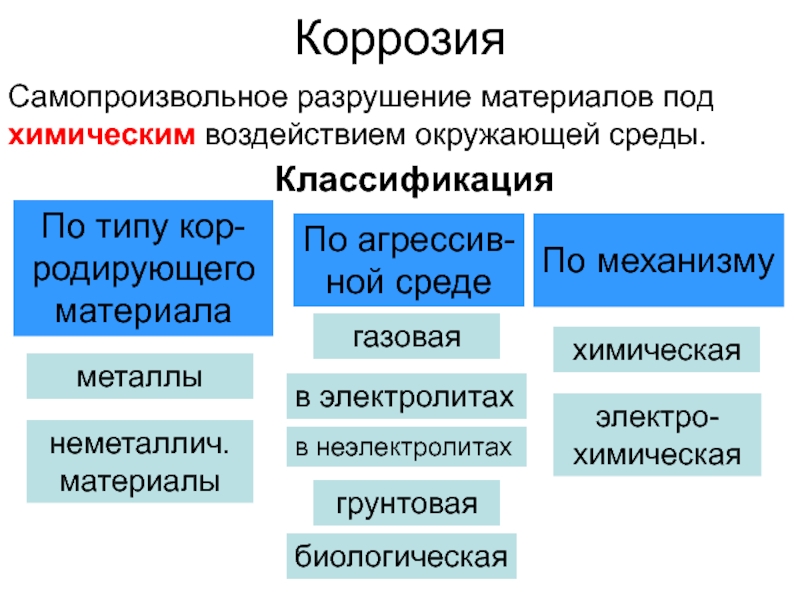
Слайд 2Коррозия
Самопроизвольное разрушение материалов под химическим воздействием окружающей среды.
Классификация
По типу кор-родирующего
материала
Слайд 3Химическая коррозия
Химическое взаимодействие металла с агрессивной средой
Zn + 2CH3CH(OH)COOH =
= Zn(CH3CH(OH)COO)2 + H2
в кислородсодержащей
атмосфере при высокой
температуре
4Fe +
3O2 = 2Fe2O3
3Fe + 2O2 = Fe3O4Cu + RCl =
= CuCl2 + R–R
При воздействии органи-
ческих хлорпроизводных
(фреонов и т.п.)
Если подойник из оцинкованной стали
Примеры
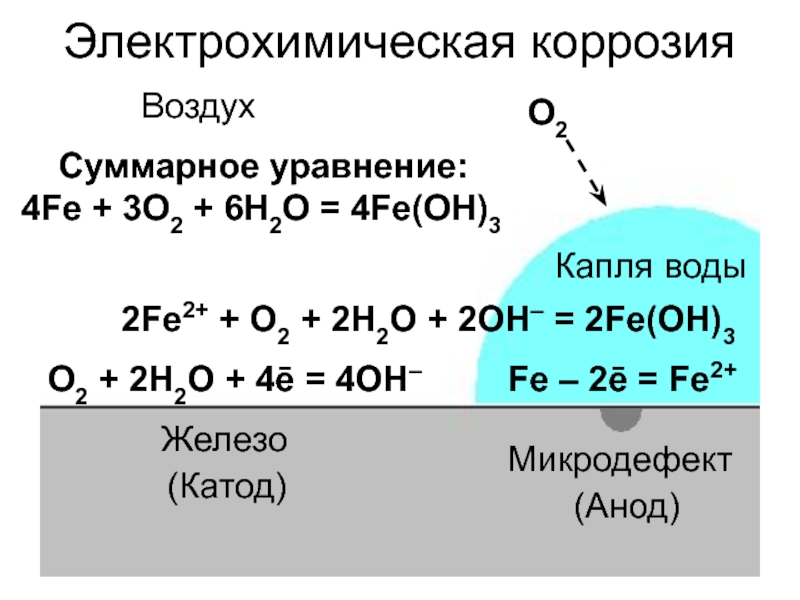
Слайд 4Электрохимическая коррозия
Воздух
Капля воды
Железо
(Анод)
Микродефект
(Катод)
Fe – 2ē = Fe2+
O2 + 2H2O +
4ē = 4OH–
O2
2Fe2+ + O2 + 2H2O + 2OH–
= 2Fe(OH)3 Суммарное уравнение:
4Fe + 3O2 + 6H2O = 4Fe(OH)3
Слайд 5Способы защиты от коррозии
Конструкционный
Кортеновская сталь
Содержит ~ 2% Cu
Плотная оксидная пленка
Нержавеющая
сталь
Один из составов:
18% Cr, 10% Ni
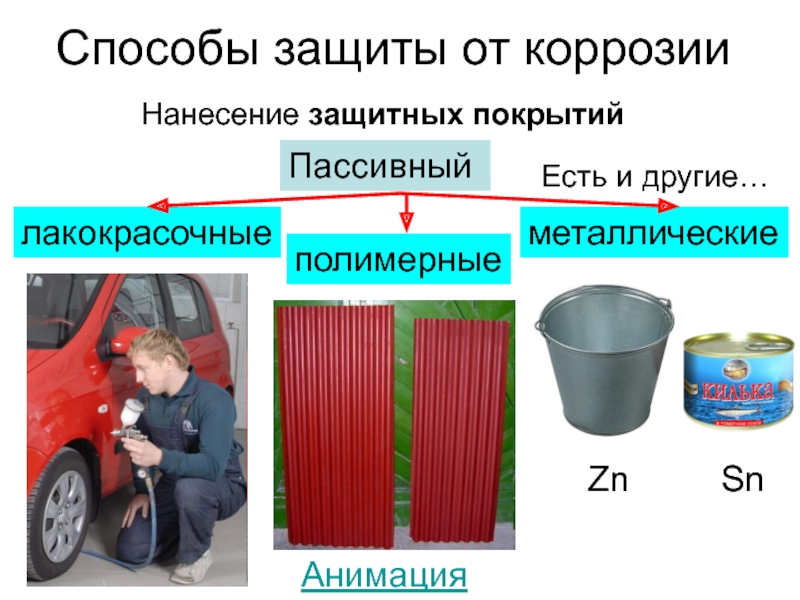
Слайд 6Способы защиты от коррозии
Анимация
Пассивный
Нанесение защитных покрытий
лакокрасочные
полимерные
металлические
Есть и другие…
Zn
Sn
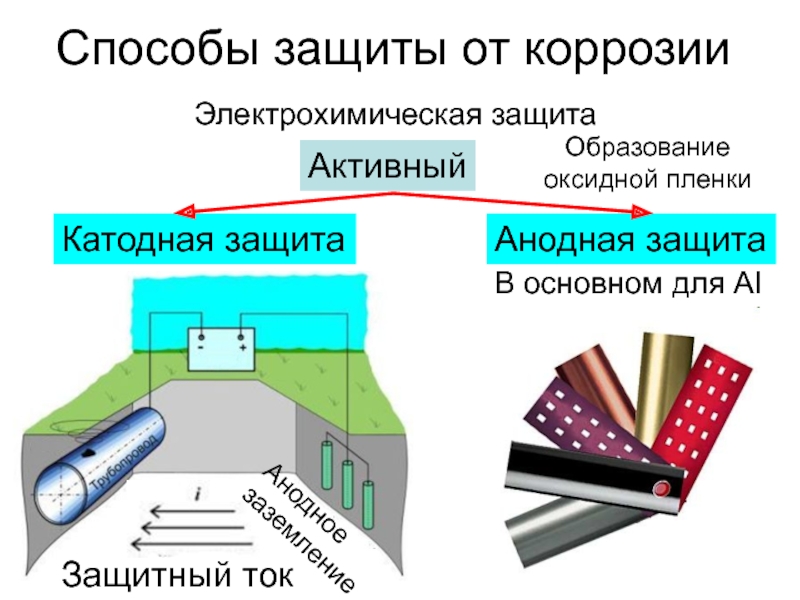
Слайд 7Способы защиты от коррозии
Активный
Электрохимическая защита
Катодная защита
Анодная защита
В основном для Al
Образование
оксидной пленки
Защитный ток
Анодное
заземление
Слайд 9Электролиз
Окислительно-восстановительные реакции в растворе или расплаве электролитов под действием электрического
тока.
Водные растворы
Неводные растворы
Расплавы
Окислитель: анод
Восстановитель: катод
Не материал анода и катода,
а электрический ток!Катионы металлов
Катионы Н+ и вода
Восстанавливаются:
Катионы металлов
Окисляются:
Анионы кислот и ОН–
Материал анода
Вода
Анионы
Материал анода
Слайд 10Электролиз расплавов: алгоритм
Написать уравнение диссоциации вещества в расплаве;
Написать полуреакцию восстановления
катиона;
Написать полуреакции окисления для аниона и/или материала анода;
Сложить полученные полуреакции
(если материал анода окисляется – может быть 2 параллельных процесса);Превратить ионное уравнение в молекулярное, если нужно.
Слайд 11Электролиз расплава: все просто
А) KCl
Катод:
Анод:
K+ + ē = K
2Cl–
– 2ē = Cl2
2
1
2
2
1
2K+ + 2Cl– = 2K + Cl2
Б)
NaOHКатод:
Анод:
Na+ + ē = Na
4OH– – 4ē = O2 + 2H2O
4
1
4
4
1
4NaOH– = 4Na + O2 + 2H2O
2KCl = 2K + Cl2
Слайд 12Электролиз растворов: алгоритм
Написать уравнения диссоциации всех присутствующих сильных электролитов;
Что может
реагировать на катоде?
Написать полуреакции восстановления для всего, найти по справочнику
Е0;Стандартны ли условия (Е = Е0)?
Выбрать преобладающую полуреакцию (с наибольшим значением Е) для катода;
Повторить шаги 2-5 для анодных процессов (выбрать полуреакцию с наименьшим Е);
Сложить выбранные полуреакции.
Слайд 13Электролиз растворов
А) Раствор KCl
Катод:
K+ + ē = K
(E0 = –2.924В)
2H2O + 2ē = 2OH– + H2
(E = –0.414
В)Анод:
2Cl– – 2ē = Cl2
(E0 = 1.359В)
2H2O – 4ē = O2 + 4H+
(E0 = 1.228 В)
H2O намного легче восстанавливается, чем K+
Сравнимые стандартные потенциалы,
Условия не стандартные (pH = 7), Е = 1.642 В
НО!
2Cl– + 2H2O = Cl2 + 2OH– + H2
2KCl + 2H2O = Cl2 + 2KOH + H2
Слайд 14Электролиз растворов
Б) Раствор CuSO4
Катод:
2H2O + 2ē = 2OH– + H2
(E
= –0.414 В)
Cu2+ + 2ē = Cu
(E0 =
0.337 В)Анод:
2H2O – 4ē = O2 + 4H+
(E0 = 1.359В, Е = 1.642 В с учетом pH)
2SO42– – 2ē = 2S2O82–
(E0 = 2.010 В)
Cu2+ легче восстанавливается, чем H2O
2Cu2+ + 2H2O = 2Cu + O2 + 4H+
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
Слайд 16Участие материала анода
Только металлы до Cu включительно
А) Окисление электрическим током
Cu
– 2ē = Cu2+
А на катоде – обратный процесс!
Б) Окисление
продуктами электролизаЭлектролиз Al2O3, графитовые аноды
O2– + 2 ē = O
2O + C = CO2
Слайд 17Количественные законы электролиза
1) При электролизе масса превращенного вещества прямо пропорциональна
электрическому заряду, прошедшему через раствор.
2) При равном заряде масса превращенного
вещества зависит от массы и заряда ионов вещества.М. Фарадей
Слайд 18Количественные законы электролиза
1) При электролизе масса превращенного вещества прямо пропорциональна
электрическому заряду, прошедшему через раствор.
2) При равном заряде масса превращенного
вещества зависит от массы и заряда ионов вещества.Масса
Молярная
масса
Сила тока
Время
Заряд иона
Постоянная Фарадея