Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Курс Биология опухолевой клетки (20 19 г. ) Лекция 3 Иммортализация
Содержание
- 1. Курс Биология опухолевой клетки (20 19 г. ) Лекция 3 Иммортализация
- 2. Неограниченное делениестволовых клеток опухолейСтимуляция деления,потеря чувствительности крост-ингибирующим сигналамИммортализация(приобретение бессмертия)
- 3. Старение организма (Ageing, senescence) – исчерпание пула
- 4. Иммортализация – отмена репликативного
- 5. Феномен:“Репликативное старение” и “иммортализация” клеток in vitro
- 6. Феномен:“Репликативное старение” и “иммортализация” клеток in vitro
- 7. Иммортализация – отмена репликативного
- 8. 60 делений 1018 клеток
- 9. Adapted from R.Weinberg, The Biology of Cancer (© Garland Science 2007)
- 10. Наиболее общие признаки репликативного старения клетокНеобратимый арест
- 11. Четыре функции клеточного старенияRodier and Campisi J Cell Biol. 2011
- 12. стадия М0стадии М1, М2
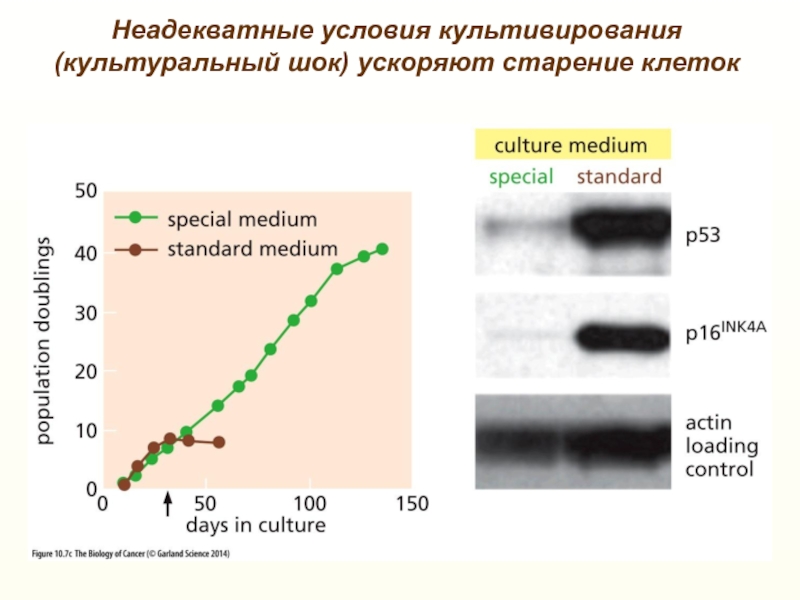
- 13. Неадекватные условия культивирования(культуральный шок) ускоряют старение клеток
- 14. стадия М0стадии М1, М2
- 15. Число делений 3 18
- 16. Adapted from R.Weinberg, The Biology of Cancer
- 17. Роль р16Ink4a в «старении» гемопоэтическихcтволовых клеток (ГСК)
- 18. Репликативное старение стволовых инедифференцированных клеток in vivoКлючевой
- 19. p16Ink4a-positive cells shorten healthy lifespanBaker et al.,
- 20. Раунды деленияклетокCdk4Cdk2Остановка в G1P16INK4APRC1/2 (Bmi1 и др.)?Дефосфорилирование pRbE2FHes1ДифференцировкаTwist
- 21. Локус INK4А кодирует два негомологичных белка, инактивирующих сигнальные пути, регулируемые pRb и p53
- 22. Adapted from R.Weinberg, The Biology of Cancer
- 23. Раунды деленияклетокp21Cip1Остановка в G1,дифференцировкаp16Ink4aBmi1,Twistp53p14ArfОтмена остановкиклеточного цикла Е7
- 24. Другие функции Bmi1Компонент PRC1 комплекса, участвующего в
- 25. ИММОРТАЛИЗАЦИЯОтмена рост-инигибирующихсигналов и/илинечувствительность к их действиюВысокая активность
- 26. Adapted from R.Weinberg, The Biology of Cancer
- 27. Строение теломерMaciejowski and de Lange, 2017, doi: 10.1038/nrm.2016.171
- 28. Проблема недорепликации концов ДНКТеломеры теряют 50-100 пар нуклеотидов за один раунд репликации
- 29. «Репликативное старение»(стадия М1),остановка деления как при повреждениях
- 30. кризисмортальныеиммортальныеУвеличивающееся число деленийдлина (kbp)Укорочение длины теломерной ДНК
- 31. Как при укорочении/нарушении структуры 3’-конца теломерной ДНК
- 32. Теломерный кризис и хромосомные перестройкиMaciejowski and de Lange, 2017, doi: 10.1038/nrm.2016.171
- 33. Механизмы поддержания постоянной длины теломер Активация теломеразы(эмбрионы,
- 34. Введение гена hTERT повышает репликативный потенциал нормальных
- 35. Усовершенствованная теломерная модельклеточного старенияТеломерныеповторы ДНКОднонитчатая
- 36. Возможная связь между дисфункцией теломер и воспалениемWang
- 37. + Теломераза(TERT)Поддержаниеструктуры теломерОтмена остановкиклеточного цикла - INK4aЕ7
- 38. Функция TERT в стволовых и недифференцированныхклетках
- 39. Функция hTERT в стволовых и недифференцированныхклетках
- 40. Активация сигнальных путей факторов роста, Wnt, NF-κBУсиление
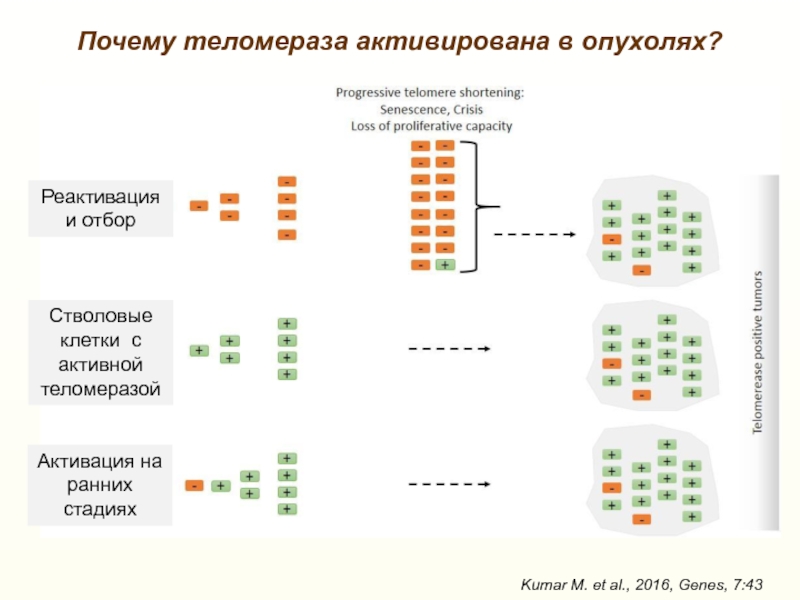
- 41. Почему теломераза активирована в опухолях?Kumar M. et al., 2016, Genes, 7:43
- 42. Механизмы, определяющие удлинение теломер в опухолевых клеткахGaspar et al., Gene, 2018, doi: 10.3390/genes9050241Ets site
- 43. Возможные стратегии антителомеразной терапииПрямое ингибирование теломеразы (ингибирование
- 44. Неограниченное делениестволовых клеток опухолейСтимуляция деленияИммортализацияTERTBmi1p16Ink4a? Myтации протоонкогенов,опухолевых супрессоров Myтации,метилированиеПерепрограммированиехроматина Myc, р53и др.
- 45. Нестабильность генома(мутации и эпигенетические изменения)Нечувствительность крост-ингибирующим сигналам(приобретение
- 46. Способы программируемой гибели клеток:Апоптоз2. Митотическая катастрофа 3. Аутофагия4. Некроптоз5. Энтоз
- 47. Курс «Биология опухолевой клетки»(2019 г.)Лекция 4Подавление программируемой клеточной смерти в опухолевых клеткахН.Л. Лазаревич
- 48. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Курс «Биология опухолевой клетки»
(2019 г.)
Лекция 3
Иммортализация (неограниченный репликативный
потенциал) опухолевых клеток
Н.Л.
Лазаревич
Слайд 2Неограниченное деление
стволовых клеток опухолей
Стимуляция деления,
потеря чувствительности к
рост-ингибирующим сигналам
Иммортализация
(приобретение бессмертия)
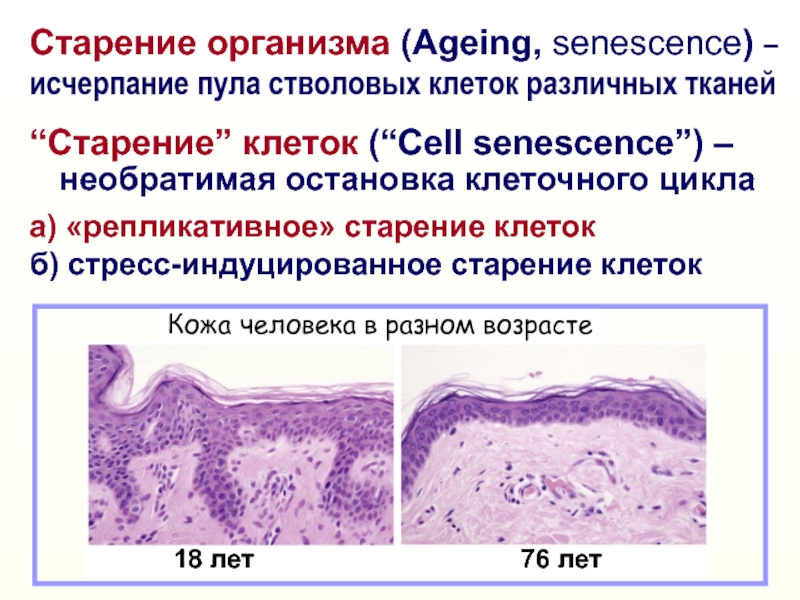
Слайд 3Старение организма (Ageing, senescence) – исчерпание пула стволовых клеток различных
тканей
“Старение” клеток (“Cell senescence”) –
необратимая остановка клеточного
циклаа) «репликативное» старение клеток
б) стресс-индуцированное старение клеток
Кожа человека в разном возрасте
18 лет
76 лет
Слайд 4Иммортализация – отмена репликативного
клеточного старения
Нормальные клетки могут быть иммортальны – эмбриональные стволовые клетки
Старение организма (Ageing, senescence) – исчерпание пула стволовых клеток различных тканей
“Старение” клеток (“Cell senescence”) –
необратимая остановка клеточного цикла
а) «репликативное» старение клеток
б) стресс-индуцированное старение клеток
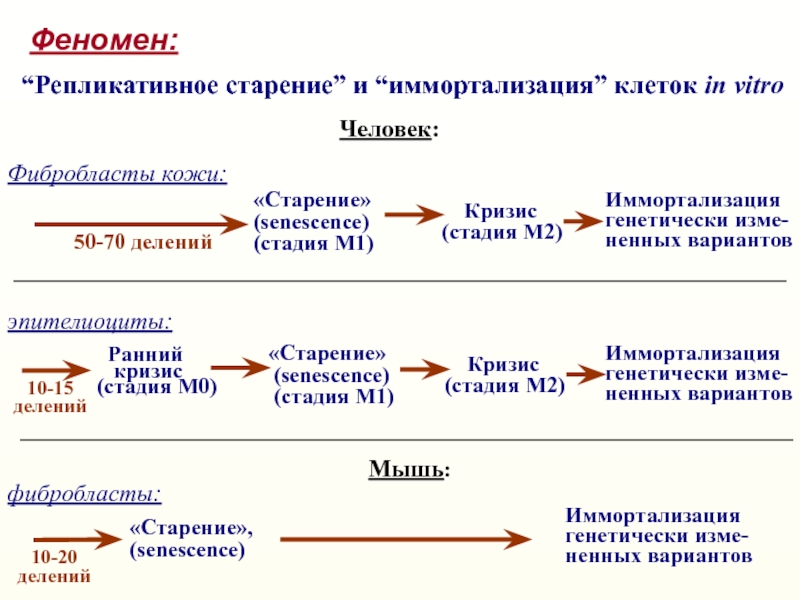
Слайд 5Феномен:
“Репликативное старение” и “иммортализация” клеток in vitro
Человек:
50-70 делений
(Число Хейфлика;
Hayflick
& Moorhead, 1961,
Exp. Cell Res. 25, 595-621)
Фибробласты кожи:
«Старение» (senescence)
(стадия М1)
Слайд 6Феномен:
“Репликативное старение” и “иммортализация” клеток in vitro
Человек:
50-70 делений
Фибробласты кожи:
Иммортализация
генетически
изме-
ненных вариантов
«Старение»
(senescence)
(стадия М1)
Кризис(стадия М2)
«Старение»
(senescence)
(стадия М1)
Кризис
(стадия М2)
10-15
делений
Ранний
кризис
(стадия М0)
эпителиоциты:
Иммортализация
генетически изме-
ненных вариантов
Слайд 7Иммортализация – отмена репликативного
клеточного старения
Опухолевые клетки иммортальны – перевиваемые линии клеток (асцит Эрлиха, HeLa и др.) – делятся неограниченно долго
Старение организма (Ageing, senescence) – исчерпание пула стволовых клеток различных тканей
“Cтарение” клеток (“Cell senescence”) –
необратимая остановка клеточного цикла
а) «репликативное» старение клеток
б) стресс-индуцированное старение клеток
Слайд 10Наиболее общие признаки
репликативного старения клеток
Необратимый арест пролиферации (не может
быть отменен физиологическими стимулами)
Увеличение клеток в размере
Экспрессия β-галактозидазы
Экспрессия Ink4A (ведет
к активации pRB)Секреция факторов роста, протеаз, цитокинов, хемокинов и других белков с аутокринной и паракринной активностью - senescence-associated secretory phenotype (SASP), например:
CXCL1 – стимулируют пролиферацию «предопухолевых» эпителиальных клеток
IL-6, 8 – стимулируют инвазию эпителиальными опухолевыми клетками базальной мембраны
VEGF – стимулирует миграцию и инвазию эндотелиальных клеток
Металлопротеиназы (MMPs) – стимулируют инвазию опухолевых клеток
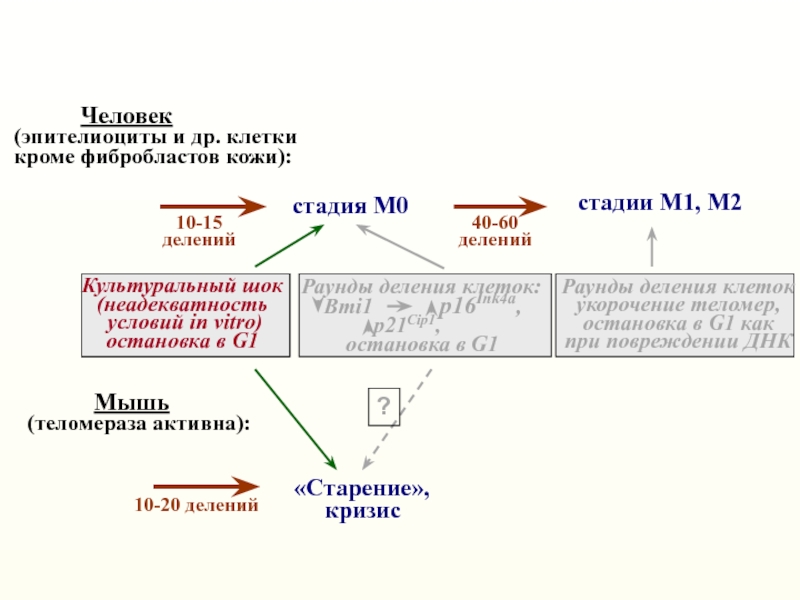
Слайд 12стадия М0
стадии М1, М2
Человек
(эпителиоциты
и др. клетки
кроме фибробластов кожи):
«Старение»,
кризис
Мышь(теломераза активна):
10-20 делений
Культуральный шок
(неадекватность
условий in vitro)
остановка в G1
Раунды деления клеток
укорочение теломер,
остановка в G1 как
при повреждении ДНК
40-60
делений
Раунды деления клеток:
Bmi1 p16Ink4a,
p21Cip1,
остановка в G1
10-15
делений
?
Слайд 14стадия М0
стадии М1, М2
Человек
(эпителиоциты
и др. клетки
кроме фибробластов кожи):
«Старение»,
кризис
Мышь(теломераза активна):
10-20 делений
Культуральный шок
(неадекватность
условий in vitro)
остановка в G1
Раунды деления клеток
укорочение теломер,
остановка в G1 как
при повреждении ДНК
40-60
делений
Раунды деления клеток:
PRC1/2 p16Ink4a,
p21Cip1,
остановка в G1
10-15
делений
?
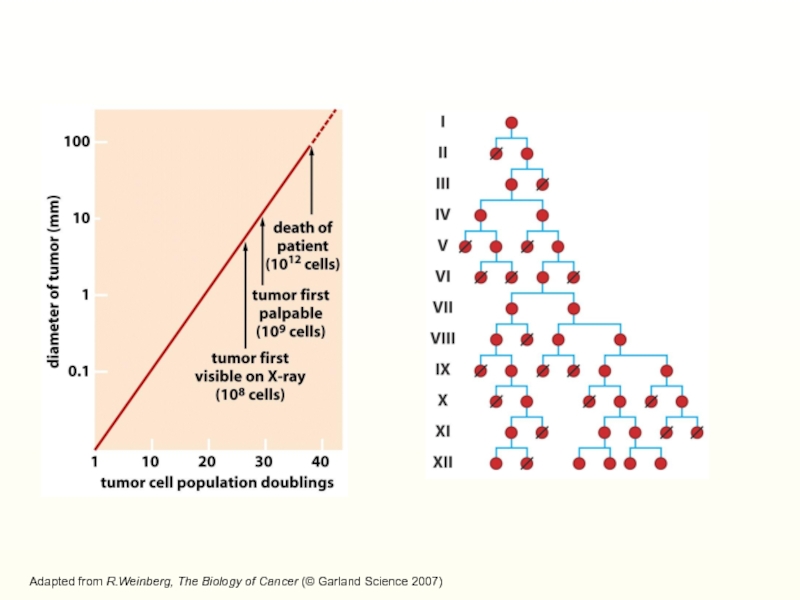
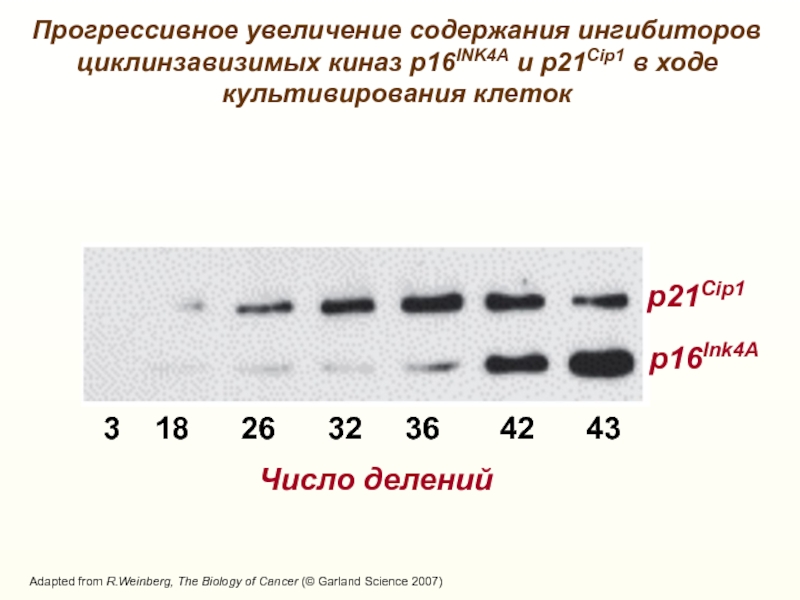
Слайд 15Число делений
3 18 26
32 36 42
43p21Cip1
p16Ink4А
Adapted from R.Weinberg, The Biology of Cancer (© Garland Science 2007)
Прогрессивное увеличение содержания ингибиторов циклинзавизимых киназ р16INK4А и p21Cip1 в ходе культивирования клеток
Слайд 16Adapted from R.Weinberg, The Biology of Cancer (© Garland Science
2007)
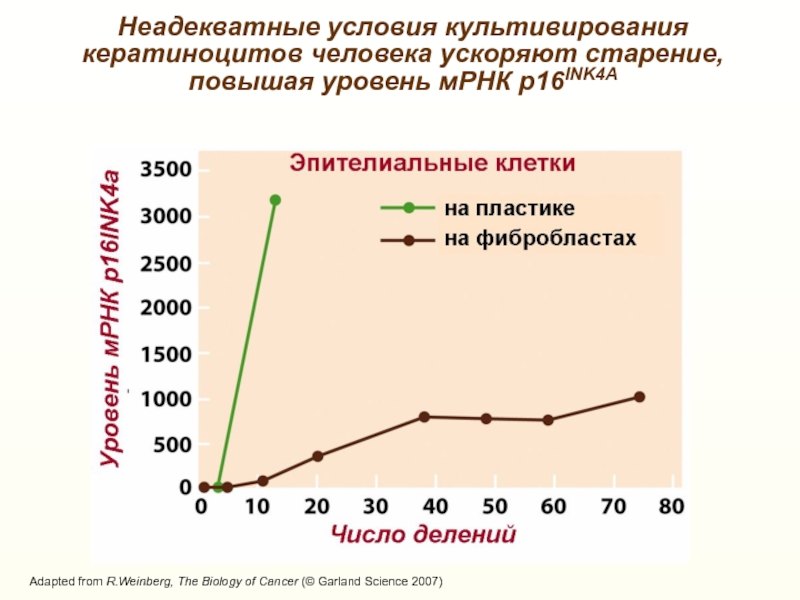
Неадекватные условия культивирования кератиноцитов человека ускоряют старение, повышая уровень мРНК
р16INK4АСлайд 17Роль р16Ink4a в «старении» гемопоэтических
cтволовых клеток (ГСК) in vivo
1. В
популяции отсортированных ГСК уровень мРНК р16Ink4a
повышается с увеличением
возраста;2. При нокауте гена р16Ink4a возрастное уменьшение пула
ГСК в костном мозге замедляется, а репопуляционная
способность таких ГСК и их жизнеспособность при стрессе
увеличиваются
Yanzen et al.., Nature, 2006, 28, v.443, p.421-426
Слайд 18Репликативное старение стволовых и
недифференцированных клеток in vivo
Ключевой механизм – увеличение
содержания p16Ink4a
вследствие инактивации Polycomb Repressive Complex PRC1/2
(Bmi1 и др.), Twist1/2 и,
вероятно, других событий
Слайд 19p16Ink4a-positive cells shorten healthy lifespan
Baker et al., Nature. 2016 doi:
10.1038/nature16932
Gil J and Withers DJ. Nature. 2016. doi: 10.1038/nature16875
INK–ATTAC mice
produce a caspase enzyme specifically in cells that express the p16Ink4a gene. Injection of AP20187 (AP) activate caspase that triggers cell death, eliminating senescent cells in which it is expressed.Elimination of p16Ink4a-expressing cells increased lifespan (17-35%) and ameliorated a range of age-dependent, disease-related abnormalities. Senescent-cell removal also delayed the onset of cancer, without affecting the range of observed tumor types.
"Senescence-associated macrophages" (SAMs), описанные у старых мышей, имеют те же маркеры, что и сенесцентные клетки - экспрессируют бета-галактозидазу и ген p16(Ink4a); возможно скопления SAMs могли в прошлом ошибочно приниматься за скопления сенесцентных клеток.
Hall BM et al., Aging, 2016
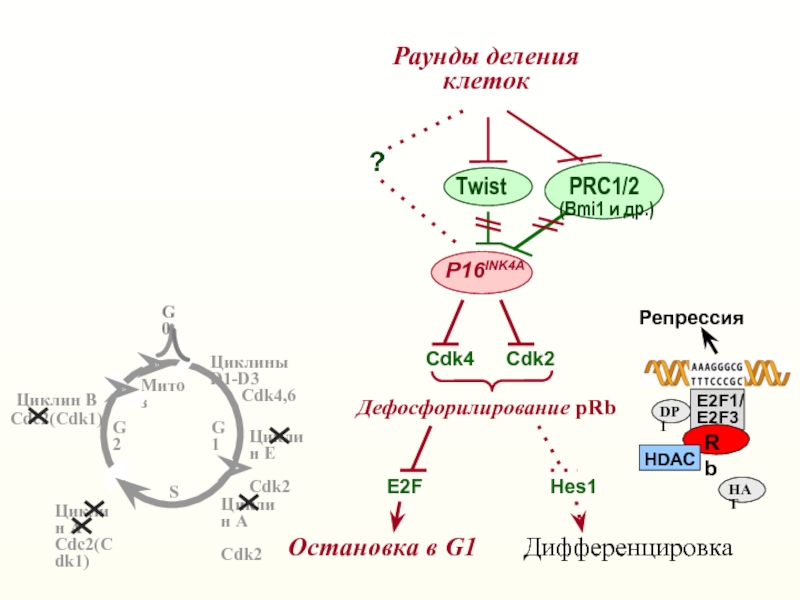
Слайд 20Раунды деления
клеток
Cdk4
Cdk2
Остановка в G1
P16INK4A
PRC1/2
(Bmi1 и др.)
?
Дефосфорилирование pRb
E2F
Hes1
Дифференцировка
Twist
Слайд 21Локус INK4А кодирует два негомологичных белка, инактивирующих сигнальные пути, регулируемые
pRb и p53
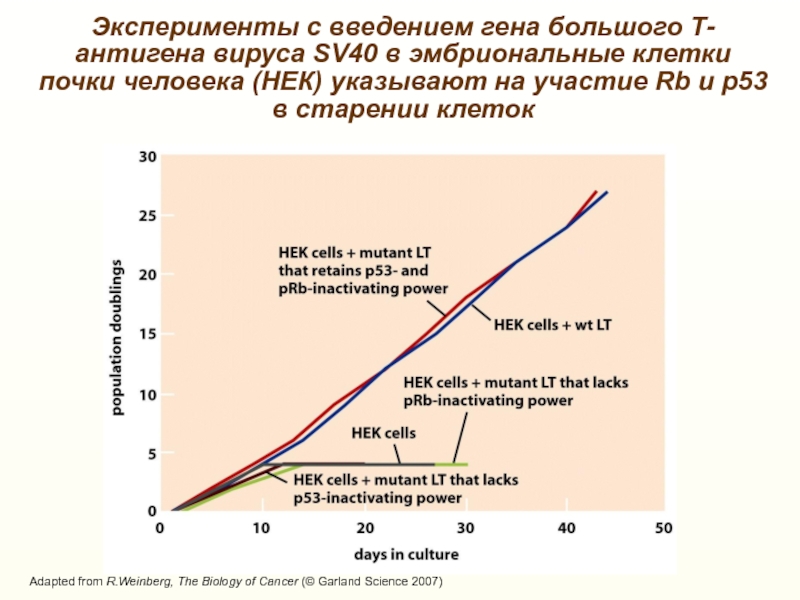
Слайд 22Adapted from R.Weinberg, The Biology of Cancer (© Garland Science
2007)
Эксперименты с введением гена большого Т-антигена вируса SV40 в эмбриональные
клетки почки человека (НЕК) указывают на участие Rb и р53 в старении клеток
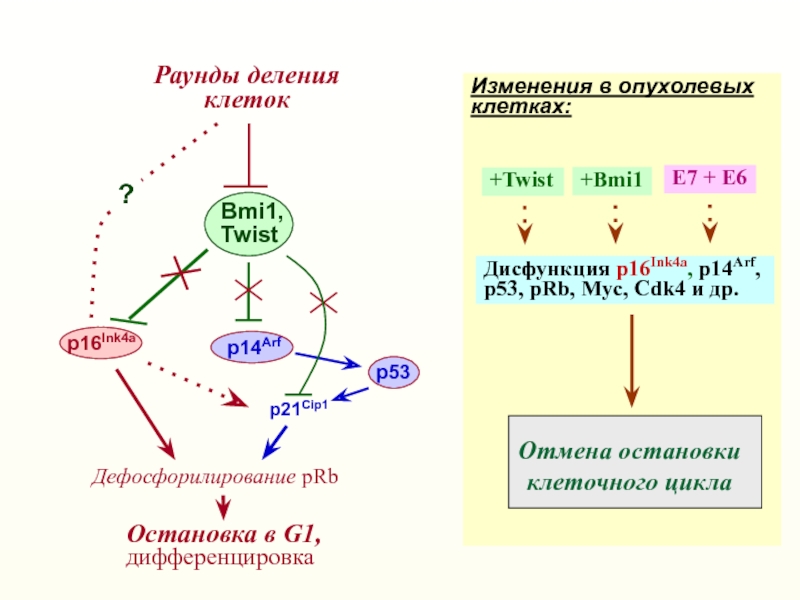
Слайд 23Раунды деления
клеток
p21Cip1
Остановка в G1,
дифференцировка
p16Ink4a
Bmi1,
Twist
p53
p14Arf
Отмена остановки
клеточного цикла
Е7 + Е6
Дисфункция p16Ink4a,
p14Arf,
р53, pRb, Myc, Cdk4 и др.
Изменения в опухолевых клетках:
+Bmi1
?
Дефосфорилирование
pRb+Twist
Слайд 24Другие функции Bmi1
Компонент PRC1 комплекса, участвующего в ремоделировании структуры хроматина
и модификации гистонов
Активирован во многих опухолях и стволовых опухолевых клетках
Ингибирует
TGFβ-сигнализациюИндуцирует пролиферацию, эпителиально-мезенхимальный переход, инвазию in vitro, размер опухолей in vivo, количество метастазов, устойчивость к химиотерапии
Активация теломеразы (TERT)
Ингибитор Bmi1 блокирует рост колоректальной карциномы человека, привитой иммунодефицитным мышам
Kreso et al., Nat Med. 2014;20(1):29-36
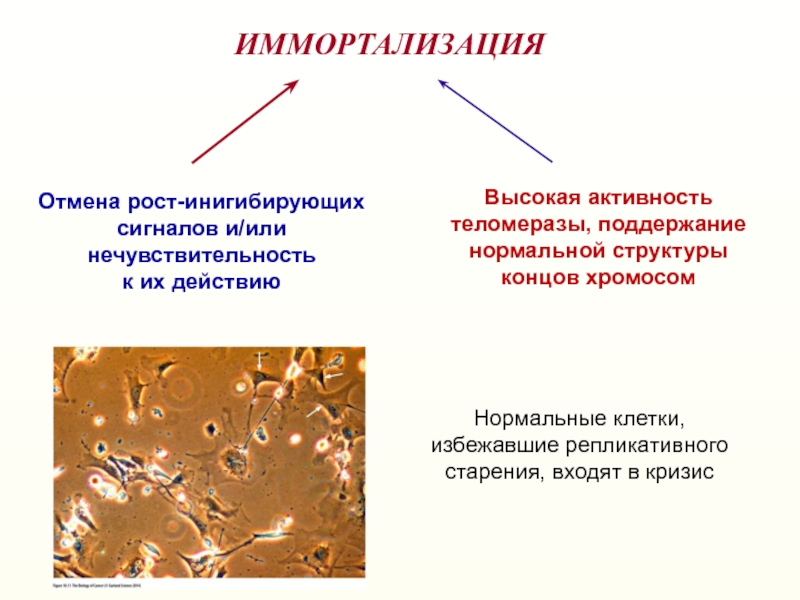
Слайд 25ИММОРТАЛИЗАЦИЯ
Отмена рост-инигибирующих
сигналов и/или
нечувствительность
к их действию
Высокая активность теломеразы, поддержание
нормальной
структуры
концов хромосом
Нормальные клетки, избежавшие репликативного старения, входят в
кризисСлайд 26Adapted from R.Weinberg, The Biology of Cancer (© Garland Science
2007)
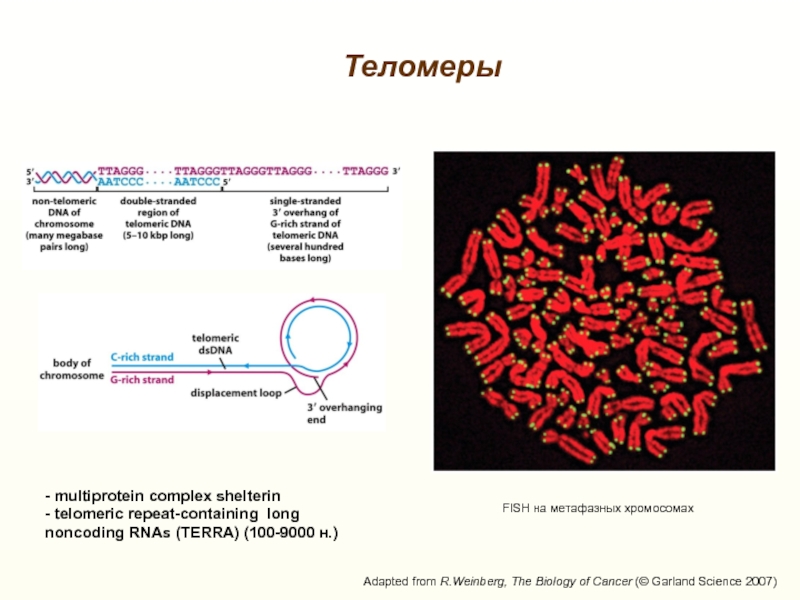
FISH на метафазных хромосомах
Теломеры
- multiprotein complex shelterin
- telomeric repeat-containing long
noncoding
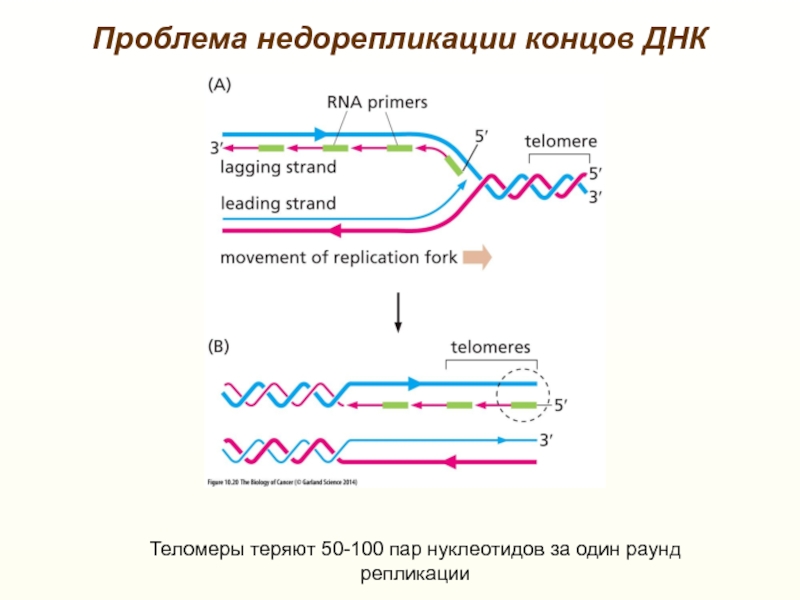
RNAs (TERRA) (100-9000 н.) Слайд 28Проблема недорепликации концов ДНК
Теломеры теряют 50-100 пар нуклеотидов за один
раунд репликации
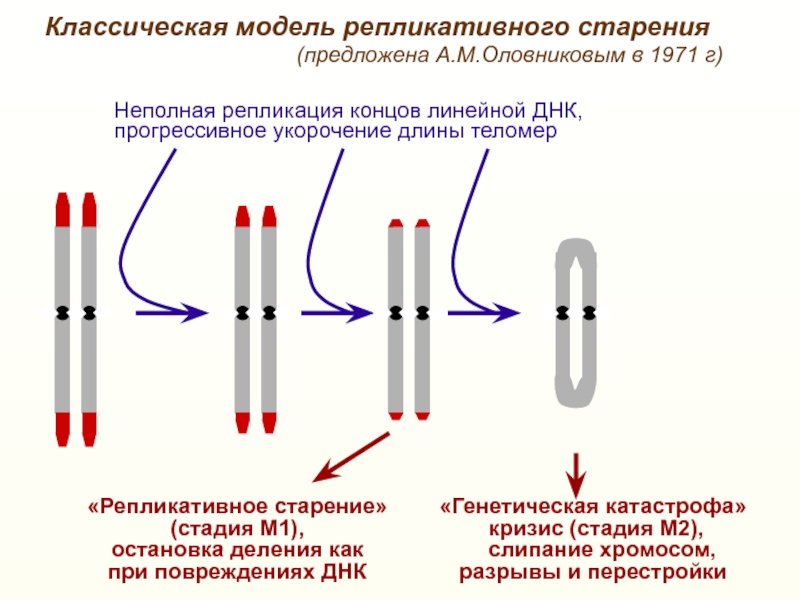
Слайд 29«Репликативное старение»
(стадия М1),
остановка деления как
при повреждениях ДНК
«Генетическая катастрофа»
кризис (стадия М2),
слипание хромосом,
разрывы и перестройки
Неполная репликация концов линейной ДНК,
прогрессивное укорочение длины теломер
Классическая модель репликативного старения
(предложена А.М.Оловниковым в 1971 г)
Слайд 30кризис
мортальные
иммортальные
Увеличивающееся число делений
длина (kbp)
Укорочение длины теломерной ДНК при культивировании лифоцитов
человека
(TRF-assay – обработка набором рестриктаз,
не имеющих сайтов в повторах TTAGGG,
шаг – 6 клеточных делений) С увеличением возраста
длина теломерной ДНК
укорачивается
Adapted from R.Weinberg, The Biology of Cancer (© Garland Science 2007)
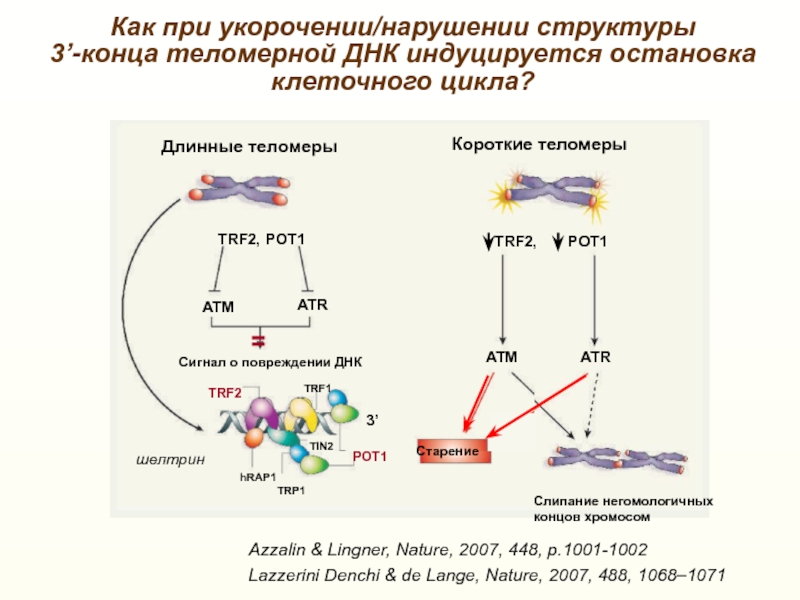
Слайд 31Как при укорочении/нарушении структуры
3’-конца теломерной ДНК индуцируется остановка клеточного
цикла?
Azzalin & Lingner, Nature, 2007, 448, p.1001-1002
Lazzerini Denchi &
de Lange, Nature, 2007, 488, 1068–1071TRF2, POT1
TRF2, POT1
ATM
ATR
Сигнал о повреждении ДНК
ATM
ATR
POT1
TRF2
TRF1
TRP1
hRAP1
TIN2
Старение
3’
Длинные теломеры
Короткие теломеры
Слипание негомологичных концов хромосом
шелтрин
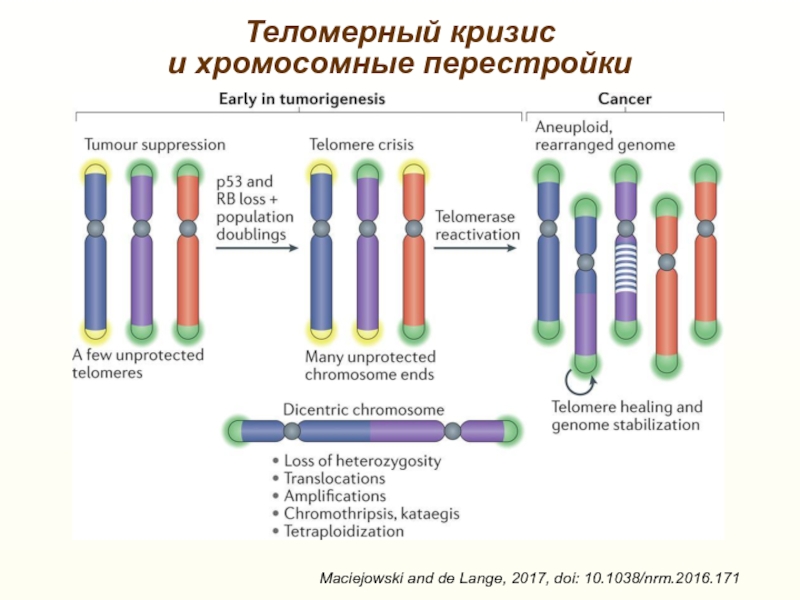
Слайд 32Теломерный кризис
и хромосомные перестройки
Maciejowski and de Lange, 2017, doi:
10.1038/nrm.2016.171
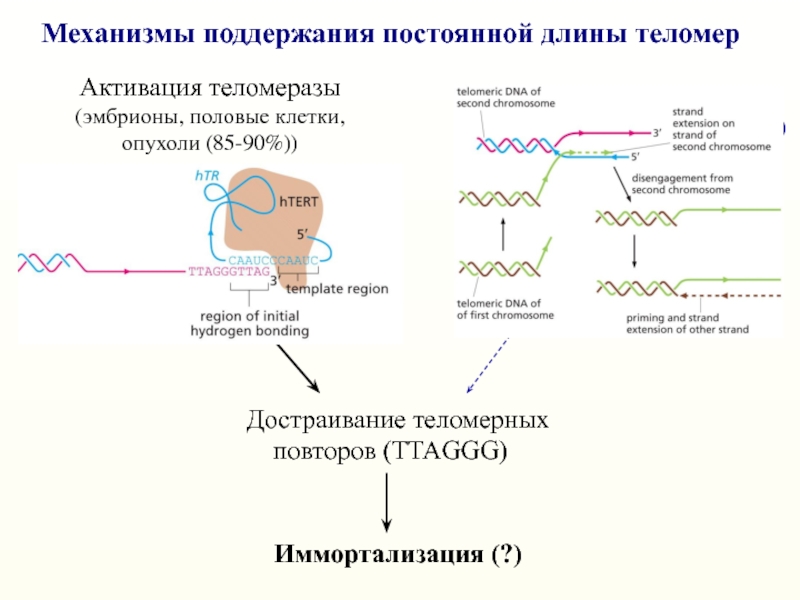
Слайд 33Механизмы поддержания постоянной длины теломер
Активация теломеразы
(эмбрионы, половые клетки,
опухоли
(85-90%))
ALT
(Alternative Lengthening of Telomeres)
10-15% опухолей
(остеосаркомы, глиомы)
(РНК-матрица)
TERT
Telomerase
Reverse Transcriptase
Достраивание теломерных
повторов (TTAGGG)
Гомологичная рекомбинация (?)
Иммортализация (?)
TR
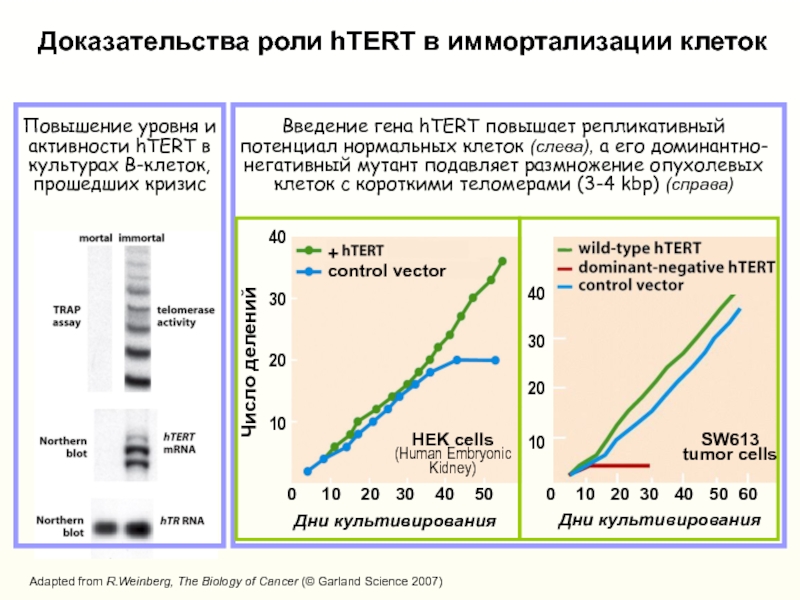
Слайд 34Введение гена hTERT повышает репликативный потенциал нормальных клеток (слева), а
его доминантно-негативный мутант подавляет размножение опухолевых клеток с короткими теломерами
(3-4 kbp) (справа)Повышение уровня и активности hTERT в культурах В-клеток, прошедших кризис
Доказательства роли hTERT в иммортализации клеток
0 10 20 30 40 50
+
control vector
HEK cells
(Human Embryonic Kidney)
SW613
tumor cells
40
10
20
30
40
10
20
30
0 10 20 30 40 50 60
Число делений
Дни культивирования
Дни культивирования
Adapted from R.Weinberg, The Biology of Cancer (© Garland Science 2007)
Слайд 35Усовершенствованная теломерная модель
клеточного старения
Теломерные
повторы ДНК
Однонитчатая
петля»
ТTAGGGTTAGGG
5’
3’
AATCCCAATCCC
5’
3’
Деление клеток,
генотоксические стрессы
Остановка деления
клеток (стадия М1)
Уменьшение длины и/или
нарушения структуры однонитчатой петли
5’
3’
Теломераза
Продолжение пролиферации
(R.Weinberg, 2003)
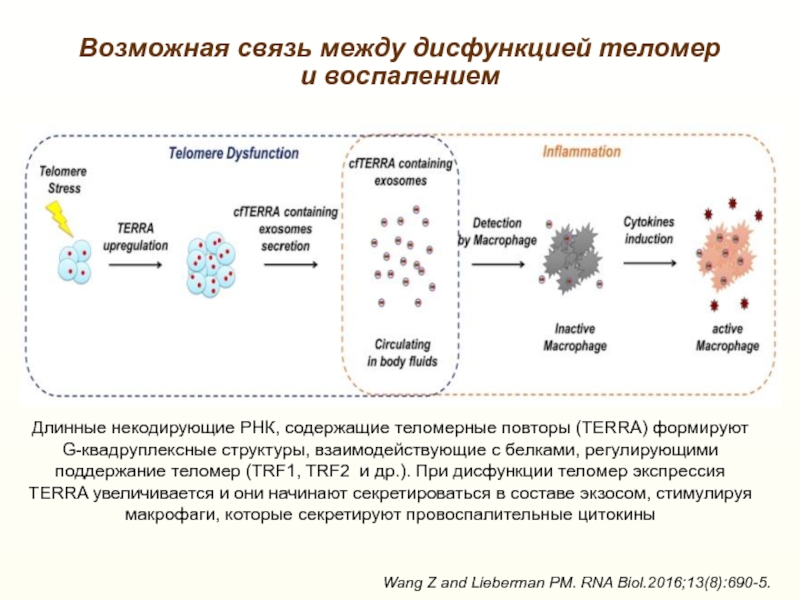
Слайд 36Возможная связь между дисфункцией теломер и воспалением
Wang Z and Lieberman
PM. RNA Biol.2016;13(8):690-5.
Длинные некодирующие РНК, содержащие теломерные повторы (TERRA) формируют
G-квадруплексные структуры, взаимодействующие с белками, регулирующими поддержание теломер (TRF1, TRF2 и др.). При дисфункции теломер экспрессия TERRA увеличивается и они начинают секретироваться в составе экзосом, стимулируя макрофаги, которые секретируют провоспалительные цитокиныСлайд 37+ Теломераза
(TERT)
Поддержание
структуры теломер
Отмена остановки
клеточного цикла
- INK4a
Е7 + Е6
+
Myc,
-p53, -pRb
Иммортализация
+ Bmi1
Ряд характерных для
опухолевых клеток измененийгенома могут обеспечить оба важных компонента
иммортализации клеток
Слайд 38 Функция TERT в стволовых и недифференцированных
клетках не ограничивается поддержанием
структуры теломер
Choi et al., 2008, PLoS Genetics, 4:124-138
Экспрессия TERT с
дефектной RT-функцией в клетках кожи мышей активирует транскрипционные программы, схожие с активацией Myc и Wnt сигнализации, и изменение экспрессии большой группы генов (функция Myc), что ведет к стимуляции пролиферации клеток, подавлению в них ряда чекпойтов клеточного цикла (активируемых повреждениями ДНК) и ряду других клеточных реакцийСлайд 39 Функция hTERT в стволовых и недифференцированных
клетках не ограничивается поддержанием
структуры теломер
Экспрессия TERT с дефектной RT-функцией активирует транскрип-ционные программы, схожие
с активацией Myc и Wnt сигнализации, и изменение экспрессии большой группы генов (функция Myc), что ведет к стимуляции пролиферации клеток, подавлению в них ряда чекпойтов клеточного цикла и ряду других клеточных реакций Теломерная и нетеломерные функции hTERT вносят существенный вклад в образование пролиферирующих «бессмертных» стволовых неопластических клеток и определяют клиническое течение опухолей
(hTERT экспрессируется в 90% опухолей человека)
Слайд 40Активация сигнальных путей факторов роста, Wnt, NF-κB
Усиление стволовых характеристик клетки
Улучшение
рибосомного биогенеза
Подавление апоптоза и блока репликации при укорочении теломер
Усиление адгезии
и миграцииПовышение частоты возникновения опухолей
Предполагаемые «неканонические» функции теломеразы
(экспрессия каталитически неактивной TERT)
Однако нокаут TERT и TR у мышей с длинными теломерами не влияет на профиль экспрессии генов и ответ на повреждения ДНК
Возможное объяснение – существование альтернативных изоформ TERT с различными свойствами
Kumar M. et al., 2016, Genes, 7:43
Слайд 42Механизмы, определяющие удлинение теломер в опухолевых клетках
Gaspar et al., Gene,
2018, doi: 10.3390/genes9050241
Ets site
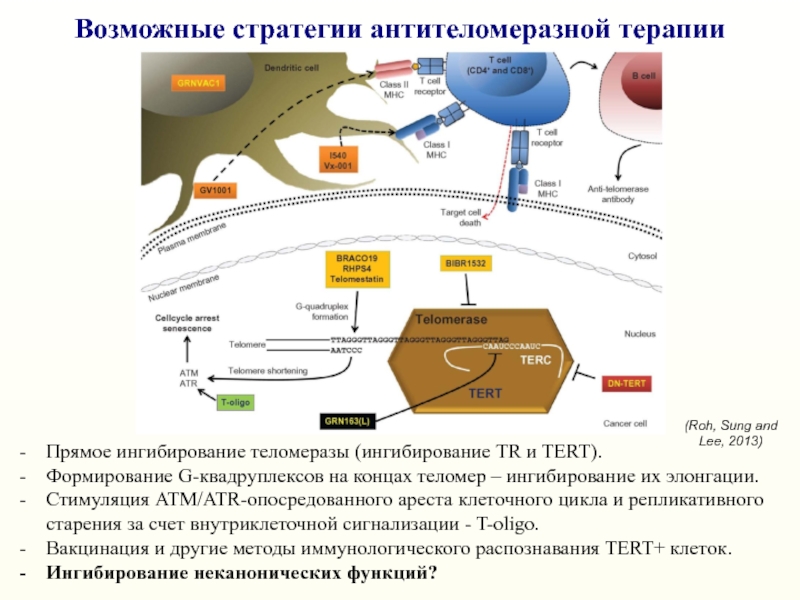
Слайд 43Возможные стратегии антителомеразной терапии
Прямое ингибирование теломеразы (ингибирование TR и TERT).
Формирование
G-квадруплексов на концах теломер – ингибирование их элонгации.
Стимуляция ATM/ATR-опосредованного
ареста клеточного цикла и репликативного старения за счет внутриклеточной сигнализации - T-oligo. Вакцинация и другие методы иммунологического распознавания TERT+ клеток.
Ингибирование неканонических функций?
(Roh, Sung and Lee, 2013)
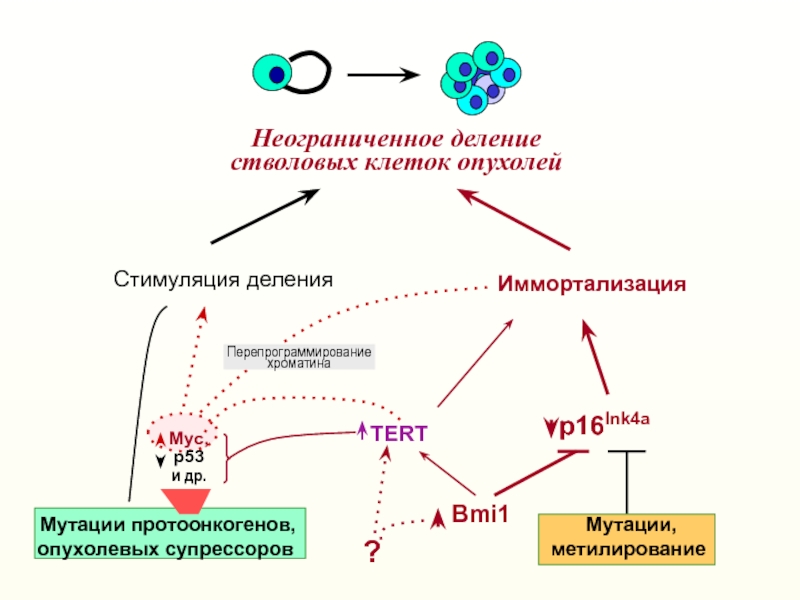
Слайд 44Неограниченное деление
стволовых клеток опухолей
Стимуляция деления
Иммортализация
TERT
Bmi1
p16Ink4a
?
Myтации протоонкогенов,
опухолевых супрессоров
Myтации,
метилирование
Перепрограммирование
хроматина
Myc,
р53
и др.
Слайд 45Нестабильность генома
(мутации и эпигенетические изменения)
Нечувствительность к
рост-ингибирующим сигналам
(приобретение бессмертия и др.)
Постоянная
инициация митотических циклов
Интенсивное и
неограниченное во времени деление клеток
Подавление
программируемой
гибели
клеток(апоптоза и др.)