Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Курс лекций Физико-химические и физические методы аналитической химии
Содержание
- 1. Курс лекций Физико-химические и физические методы аналитической химии
- 2. Характеристическое свойство Аналитическую химию интересуют корреляции в
- 3. Вольтамперометрические методыАналитическая информативность зависимости силы тока от
- 4. Вольтамперометрические методыПри измерениях электропроводности растворов, как функции
- 5. Вольтамперометрические методыДля того, чтобы через электрохимическую цепь
- 6. Вольтамперометрические методыПодобные реакции, протекающие на электродах, обычно
- 7. Вольтамперометрические методыПока величина приложенной внешней разности потенциалов
- 8. Вольтамперометрические методыПри этом величина возникшего в цепи
- 9. Вольтамперометрические методыДля того, чтобы сделать зависимость I
- 10. Прямая вольтамперометрияВ электрохимических ячейках, используемых в вольтамперометрических
- 11. Прямая вольтамперометрияВ основе прямой вольтамперометрии лежит эффект
- 12. Прямая вольтамперометрияЭтот эффект находит отражение в характере
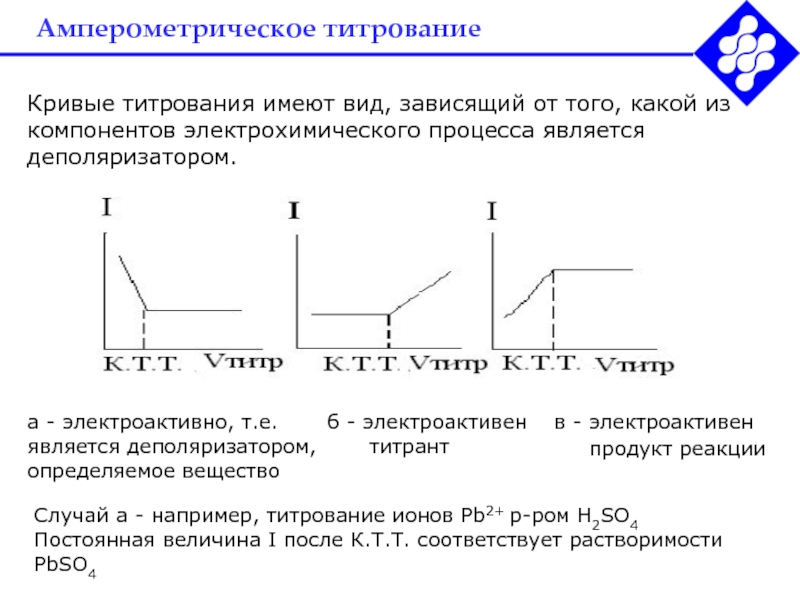
- 13. Прямая вольтамперометрияВклад ic зависит от типа индикаторного
- 14. Прямая вольтамперометрияИоны, вызывающие рост силы тока, называются
- 15. Прямая вольтамперометрияСобственно эффект обеднения приэлектродного слоя раствора
- 16. Прямая вольтамперометрияПоступление ионов из объема раствора к
- 17. Прямая вольтамперометрияСитуация изменится, если в раствор ввести
- 18. Прямая вольтамперометрияПо мере роста величины (j)M ,
- 19. Прямая вольтамперометрияВ стационарном режиме, когда (Ni)э =
- 20. Прямая вольтамперометрияТаким образом, мы пришли к аналитической
- 21. Прямая вольтамперометрияДля того чтобы подойти к решению
- 22. Прямая вольтамперометрияE = E1/2 – 0,059/n lgI/(ID-I)
- 23. Следствие 1Первое следствие относится к выбору состава
- 24. Следствие 1Наконец, фоновый электролит может выполнять и
- 25. Следствие 2Второе следствие определяет подходы к выбору
- 26. Следствие 2Если S будет большой, то при
- 27. Следствие 2Второе следствие дополнительно касается проблемы выбора
- 28. Следствие 3В качестве третьего следствия из приведённого
- 29. Следствие 4Четвертое и важнейшее следствие определяет критерий
- 30. Следствие 4Чаще всего в качестве материала индикаторного
- 31. Следствие 4Ртутный электрод, благодаря высокому перенапряжению разряда
- 32. ПолярографияИстория открытия метода прямой вольтамперометрии(1922 год) связана
- 33. ПолярографияСогласно общей схеме прямого вольтамперометрического анализа измерения
- 34. Дифференциальная полярографияПредложен целый ряд способов улучшения аналитических
- 35. Импульсная полярографияКак и в кондуктометрии, в полярографии
- 36. Импульсная полярография
- 37. Импульсная полярографияПоляризующие импульсы налагаются на плавную развертку
- 38. Импульсная полярографияИзвестны и другие варианты улучшения аналитических
- 39. Инверсионная вольтамперометрияВ основе инверсионной вольтамперометрии лежит двухстадийный
- 40. Инверсионная вольтамперометрияПример ИВА-определения нескольких ионов металлов. После
- 41. Инверсионная вольтамперометрияПлощади пиков и их амплитуда пропорциональны
- 42. Инверсионная вольтамперометрияВ отличие от каталиметрии здесь исключается
- 43. Амперометрическое титрованиеКривые титрования имеют вид, зависящий от того, какой из компонентов электрохимического процесса является деполяризатором.
- 44. Спасибо за внимание! Алексей Леонидович Москвин moskvin-al@rosanalyt.ru
- 45. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Курс лекций «Физико-химические и физические методы аналитической химии». ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Слайд 2Характеристическое свойство
Аналитическую химию интересуют корреляции в
системе: химический состав -
характеристические свойства, чтобы на основе найденных условий проявления последних и
функциональной зависимости величины аналитического сигнала от концентраций или абсолютных количеств определяемых веществ (аналитов): А = f ( C ) создавать методы химического анализа. Аналитическая химия на основании результатов изучения закономерностей проявления веществами характеристических свойств стремится сделать измеряемым химический состав любых объектов материального мира, который мы сейчас не можем измерить.Слайд 3Вольтамперометрические методы
Аналитическая информативность
зависимости силы тока от разности потенциалов, приложенной
к электрохимической ячейке,
позволила создать группу методов,
названных вольтамперометрическими.
Слайд 4Вольтамперометрические методы
При измерениях электропроводности растворов, как функции концентрации электролитов, выбираются
такие условия, которые позволяют исключить влияние электродных процессов на перенос
зарядов вэлектрохимической цепи.
В свою очередь, процессы, происходящие на электродах, связанные с переходом от электронной к ионной проводимости и наоборот, несут в себе аналитическую информацию, причем более обширную и разнообразную, чем информация об электропроводности раствора.
Слайд 5Вольтамперометрические методы
Для того, чтобы через электрохимическую
цепь начал проходить электрический
ток, обязательным условием является протекание электрохимических реакций на электродах: реакций
восстановления на катоде и реакций окисления на аноде.На катоде протекают реакции разряда и выделения ионов или их восстановле-
ния в растворе:
Men+ + ne = Meo или Men+ + me = Me(n-m)+
На аноде могут протекать реакции анодного растворения или разряда анионов:
Meo = Men+ + ne или An- - ne = Ao
Слайд 6Вольтамперометрические методы
Подобные реакции, протекающие на
электродах, обычно называются полуреакциями, подразумевая,
что каждая из них может рассматриваться как половина единой химической
окислительно-восстановительной реакции.Каждая такая полуреакция характеризуется определенным значением окислительно-восстановительного потенциала пары из окисленной и восстановленной формы.
Слайд 7Вольтамперометрические методы
Пока величина приложенной внешней
разности потенциалов не достигнет значения,
необходимого для протекания любой из электро-химических реакций, обеспечивающей перенос заряда
из фазы электрода в фазу раствора или наоборот, электрохимический ток в цепи будет отсутствовать.В свою очередь, появление тока в цепи при определенном значении разности потенциалов будет свидетельствовать о присутствии в растворе тех или иных окисленных или восстановленных форм, окислительно-восстановительный потенциал которых соответствует приложенной разности потенциалов.
Слайд 8Вольтамперометрические методы
При этом величина возникшего в цепи тока будет
связана
с содержанием этих ионных форм в растворе.
Таким образом, измерение
силы тока в цепи как функции приложенной разности потенциалов может рассматриваться как аналитическая информация.
Но чтобы получить аналитическую информацию о присутствующих в растворах ионах необходимо выполнять определенные условия при измерении зависимости I от E.
По мере увеличения Е и соответствующего включения в
процесс переноса заряда всё новых сочетаний окисленных и восстановленных форм мы будем получать некий суммарный аналитический сигнал, без разделения вклада процессов, происходящих на катоде и аноде.
Слайд 9Вольтамперометрические методы
Для того, чтобы сделать зависимость I от E информативной,
предложен целый ряд методических решений.
В наиболее общем случае таких
методических решений выделяются прямая, инверсионная и косвенная вольтамперометрия (амперометрическое титрование). Причем каждая из этих разновидностей вольт-амперометрического метода имеет свои подвиды.
Слайд 10Прямая вольтамперометрия
В электрохимических ячейках, используемых в вольтамперометрических методах один из
электродов является индикаторным, а второй электродом сравнения.
Здесь имеет место
терминологическая общность с потенциометрией, но принципы функционирования электродов и их роль в получении аналитической информации существенно отличаются. Оба электрода работают в неравновесном режиме. На индикаторном электроде происходят окислительно-восстановительные превращения, определяющие величину силы тока в цепи.
При этом электрод сравнения в условиях выполнения измерений не должен оказывать заметного влияния на величину силы тока. Выбор материалов электродов и их электрохимических характеристик определяются основополагающими принципами методов.
Слайд 11Прямая вольтамперометрия
В основе прямой вольтамперометрии лежит
эффект концентрационной поляризации электрода,
выступающего в роли индикаторного.
Эффект концентрационной, а чаще говорят просто
поляризации электрода проявляется в обеднении прилегающего к электроду слоя раствора веществом - деполяризатором, определяющим протекание на нем электрохимической реакции, необходимой для прохождения тока в цепи. Слайд 12Прямая вольтамперометрия
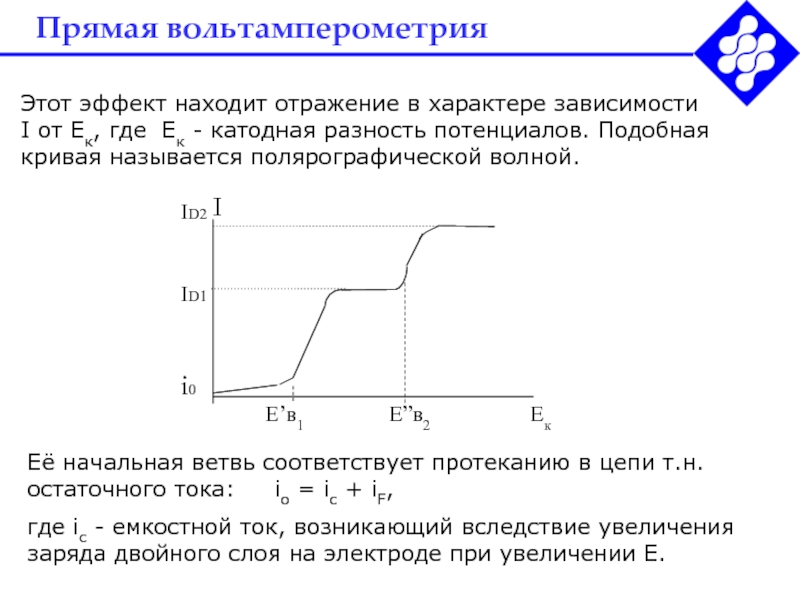
Этот эффект находит отражение в характере зависимости
I от
Ек, где Ек - катодная разность потенциалов. Подобная кривая называется
полярографической волной.Её начальная ветвь соответствует протеканию в цепи т.н. остаточного тока: io = ic + iF,
где ic - емкостной ток, возникающий вследствие увеличения заряда двойного слоя на электроде при увеличении Е.
Слайд 13Прямая вольтамперометрия
Вклад ic зависит от типа индикаторного электрода.
iF -
фарадеев ток, определяемый присутствием в растворе неконтролируемых примесей, восстанавливаемых на
катоде при меньших потенциалах, чем ионы-деполяризаторы, вызывающие дальнейший рост тока в цепи.К числу таких примесей относится растворенный в воде кислород. Поэтому при катодной пoляризации электрода всегда тщательно удаляется из раствора кислород, но всегда остаётся какое-то количество О2. От величины io зависит чувствительность метода.
При достижении некоторого значения E’в1 величины катодного потенциала Еk , называемого потенциалом выделения, для ионов-деполяризаторов первого типа (индекс 1), имеющих наименее отрицательное значение этого потенциала, начинается резкий рост силы тока. Он связан с протеканием реакции восстановления этих ионов.
Слайд 14Прямая вольтамперометрия
Ионы, вызывающие рост силы тока, называются деполяризаторами. Рост силы
тока продолжается до тех пор, пока не восстановятся все ионы
этого типа, находящиеся у поверхности электрода.Величина силы тока стабилизируется на значении ID1, называемом предельным диффузионным током, когда число ионов Nэ, восстанавливающихся на электроде в единицу времени, сравнивается с числом ионов, поступающих к поверхности электрода из объема раствора Nр: Nэ = Nр.
Когда значения приложенного потенциала Ек достигает величины Ев2, начинается следующий цикл роста и последующей стабилизации силы тока на значении ID2, который соответствует разряду ионов, имеющих более электроотрицательное значение потенциала выделения.
Слайд 15Прямая вольтамперометрия
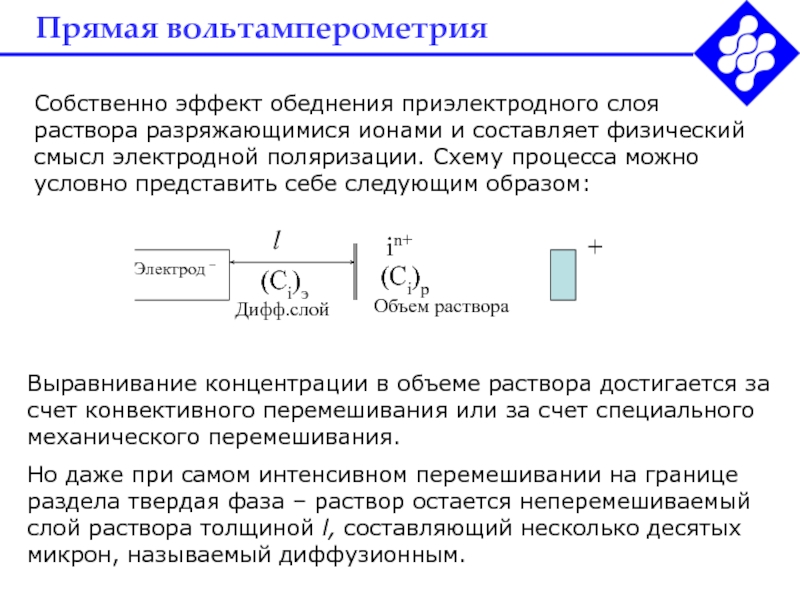
Собственно эффект обеднения приэлектродного слоя
раствора разряжающимися ионами и
составляет физический смысл электродной поляризации. Схему процесса можно условно представить
себе следующим образом:Выравнивание концентрации в объеме раствора достигается за счет конвективного перемешивания или за счет специального механического перемешивания.
Но даже при самом интенсивном перемешивании на границе раздела твердая фаза – раствор остается неперемешиваемый слой раствора толщиной l, составляющий несколько десятых микрон, называемый диффузионным.
Слайд 16Прямая вольтамперометрия
Поступление ионов из объема раствора к поверхности электрода может
осуществляться одновременно за счет диффузии и за счет электромиграции.
Т.е.
суммарный поток ионов из объема раствора i= (i)D + (i)M. Скорость электромиграционного движения ионов всегда больше скорости диффузии и, соответственно, (i)M >>(i)D .
Поэтому, если в растворе будут присутствовать только ионы-деполяризаторы, то их поток из объёма раствора в приэлектродный слой будет определяться только миграционной составляющей i = (i)M.
В этом случае подвод необходимого числа разряжающихся ионов к поверхности электрода будет обеспечиваться проходящим в цепи электрическим током. Никакой концентрационной поляризации электрода не будет.
Слайд 17Прямая вольтамперометрия
Ситуация изменится, если в раствор ввести фоновый электролит, диссоциирующий
с образованием ионов, не способных восстанавливаться при потенциалах выделения ионов
- деполяризаторов.Чем больше концентрация этих посторонних ионов, тем большая доля электрического тока будет расходоваться на их электромиграционный перенос из объема раствора к поверхности электрода в ущерб переносу ионов-деполяризаторов.
Поскольку ионы фонового электролита не могут разряжаться на электроде, их концентрация в приэлектродном слое будет расти до тех пор, пока не установится стационарное состояние, соответствующее равенству их миграционного потока (j)M и их встречного диффузионного потока из приэлектродного пространства в объем раствора (i)D .
Слайд 18Прямая вольтамперометрия
По мере роста величины (j)M , определяемой
концентрацией j-ионов
в растворе величина (i)M 0 .
Подвод ионов - деполяризаторов
к поверхности электрода начинает определяться только диффузионными процессами: i = (i)D.
Согласно 1-му закону Фика:
(i)D = k1[(Ci)р - (Ci)э]
где k1 = DiS/l,
Di - коэффициент диффузии i-иона,
S - сечение потока,
l - толщина диффузионного слоя.
Слайд 19Прямая вольтамперометрия
В стационарном режиме, когда
(Ni)э = (Ni)р, (Ci)э =
0;
(Pi)D = k1(Ci)p
Соответствующая величина силы тока в цепи, обеспечивающая
(Ni)э
= (Ni)р, называется предельным диффузионным током
ID = k2 .(Pi)D=k2k1(Ci)p,
где k2 – коэффициент преобразования единиц диффузионного потока ионов I в единицы электрического тока.
Окончательно получаем аналитическую зависимость
ID = К (Ci)p, где К = k2k1
Слайд 20Прямая вольтамперометрия
Таким образом, мы пришли к аналитической зависимости, связывающей концентрацию
i-иона в объеме раствора с измеряемой величиной ID .
Величина
ID позволяет определить содержание i-иона в растворе, но не связана с какими-либо параметрами, характеризующими природу этого иона. Мы не можем отнести измеренную величину ID к какому-либо определенному иону. Индивидуальность иона связана с величинами потенциалов, при которых происходит его восстановление.
Потенциал выделения не является достаточно характеристичным параметром, т.к. его величина связана с концентрацией деполяризатора в растворе:
RT Свф
Е = Ео + ---- ln ---
z F Соф
Слайд 21Прямая вольтамперометрия
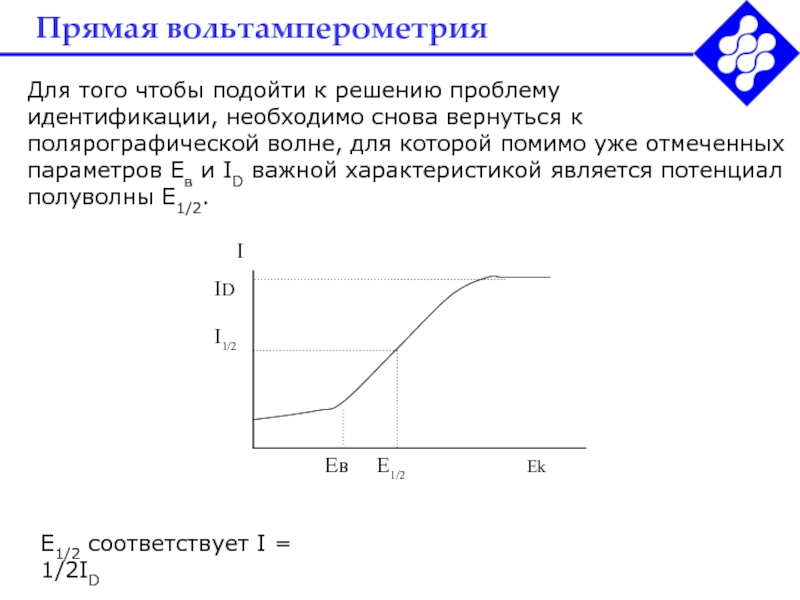
Для того чтобы подойти к решению проблему
идентификации, необходимо
снова вернуться к полярографической волне, для которой помимо уже отмеченных
параметров Ев и ID важной характеристикой является потенциал полуволны Е1/2.Е1/2 соответствует I = 1/2ID
Слайд 22Прямая вольтамперометрия
E = E1/2 – 0,059/n lgI/(ID-I) – уравнение обратимой
полярографической волны.
Величина Е1/2 является характеристическим параметром для каждого вида ионов.
Таким
образом, в прямой вольтамперометрии мы имеем два аналитических сигнала – ID и E1/2. Величина ID служит количественной характеристикой,
позволяющей определять концентрацию соответствующих
ионов в растворе.
Величина Е1/2 позволяет идентифицировать эти ионы. Рассмотренная физикохимическая модель прямого вольтамперометрического процесса имеет ряд практических следствий, важных для выбора условий анализа.
Слайд 23Следствие 1
Первое следствие относится к выбору состава фонового электролита.
Для
того, чтобы проявился эффект концентрационной поляризации электрода и можно было
измерять величину предельного диффузионного тока в качестве аналитического сигнала, соответствующего разряду на индикаторном электроде ионов i, в анализируемый раствор необходимо вводить фоновый электролит, ионы которого не способны к электрохимическим превращениям при потенциале выделения i-иона.Его главное назначение – нивелировать электромиграционную составляющую подвода определяемых ионов из объема раствора к поверхности электрода, т.е. создать условия для того, чтобы (i)M 0.
Второе очевидное назначение фонового электролита - уменьшить омическое сопротивление раствора.
Слайд 24Следствие 1
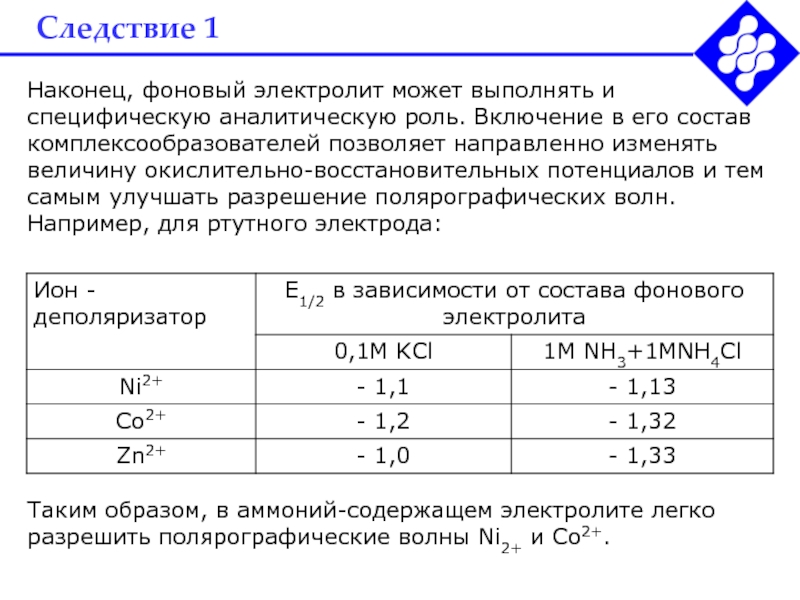
Наконец, фоновый электролит может выполнять и специфическую аналитическую роль.
Включение в его состав комплексообразователей позволяет направленно изменять величину окислительно-восстановительных
потенциалов и тем самым улучшать разрешение полярографических волн. Например, для ртутного электрода:Таким образом, в аммоний-содержащем электролите легко разрешить полярографические волны Ni2+ и Co2+.
Слайд 25Следствие 2
Второе следствие определяет подходы к выбору площади индикаторного электрода
и электрода сравнения.
Это следствие вытекает из зависимости величины предельного
диффузионного тока от диффузионного потока ионов-деполяризаторов из объема раствора к поверхности электрода:k2.DiS(Ci)p
ID = ---------------
l
где S - площадь сечения диффузионного потока ионов к индикаторному электроду, определяемая площадью его поверхности.
Слайд 26Следствие 2
Если S будет большой, то при тех же значениях
потенциалов будет большая величина силы тока в цепи и ID,
в частности. Соответственно в единицу времени будет больше восстанавливаться ионов на электроде и, соответственно, будет быстрее уменьшаться их концентрация в объеме раствора, что нежелательно, так как соотношение ID = k (Ci)p можно использовать для аналитических целей только в том случае, когда за время проведения эксперимента величина (Ci)p=const.
Отсюда следует целесообразность минимизации площади индикаторного электрода.
Слайд 27Следствие 2
Второе следствие дополнительно касается проблемы
выбора электрода сравнения.
Главное
требование к нему, чтобы поверхность была существенно большей поверхности индикаторного
электрода. В этом случае величина силы тока в целом будет лимитироваться площадью индикаторного электрода.При минимальных величинах силы тока и большей площади электрода сравнения по отношению к индикаторному на нем практически исключается проявление концентрационной поляризации и, тем самым, влияния на величину силы тока в цепи.
Общепринятым методическим решением для электродов сравнения является использование в их роли емкостей из электропроводящего электрохимически инертного материала, такого как платина или стеклоуглерод.
Слайд 28Следствие 3
В качестве третьего следствия из приведённого выше уравнения средует,
что необходимым условием вольтамперометрического эксперимента является обеспечение постоянства величины l,
что достигается равномерным перемешиванием раствора.Слайд 29Следствие 4
Четвертое и важнейшее следствие определяет критерий выбора материала индикаторного
электрода.
Проявление эффекта концентрационной поляризации и сама возможность регистрации полярографических
волн появляется в том случае, если в условиях проведения эксперимента на индикаторном электроде исключается протекание электрохимических реакций разряда ионов, входящих в состав фонового электролита. В первую очередь речь идет об ионах водорода и величине перенапряжения, требуемой для его выделения. Это условие весьма ограничивает выбор материала индикаторных электродов.
Слайд 30Следствие 4
Чаще всего в качестве материала индикаторного
электрода используется металлическая
ртуть, на которой проявляется максимальное перенапряжение выделения водорода, реже платина,
золото, графит, стеклоуглерод. Это связано с протяженностью интервалов поляризации электродов:Слайд 31Следствие 4
Ртутный электрод, благодаря высокому перенапряжению разряда ионов водорода, можно
использовать в качестве индикаторного в максимально широком диапазоне катодных потенциалов.
В кислых растворах, в зависимости от концентрации кислоты, до -1,2 -1,5 В.
В нейтральных и щелочных растворах до -2 -2,2 В.
На графите и платине разряд ионов водорода начинается при значительно более низких значениях катодного потенциала. В области же анодных потенциалов применение ртутного электрода ограничено величиной потенциала окисления металлической ртути 0 В в щелочной среде и +0,2 0,4 В в кислой.
Платиновый и графитовый электроды в анодной области функционируют до +1,4 1,6 В.
Слайд 32Полярография
История открытия метода прямой вольтамперометрии
(1922 год) связана с именем чешского
электрохимика Гейровского.
Начиная с его работ, отмеченных в 1939 году
Нобелевской премией, и в течение многих лет этот метод был представлен только одним типом индикаторного электрода - ртутным капающим электродом. Это направление вольтамперометрии вошло в историю под самостоятельным название - полярографии. И сегодня полярографию часто рассматривают как самостоятельный электрохимический метод в отрыве от других направлений прямой вольтамперометрии, связанных с использованием других типов индикаторных электродов, включая стационарные ртутные. Со спецификой ртутного капающего электрода вы будете иметь возможность познакомиться в лекционном курсе и практикуме по электрохимии.
Слайд 33Полярография
Согласно общей схеме прямого вольтамперометрического анализа измерения силы тока проводятся
в режиме автоматического изменения потенциала, т.н. развертки потенциала.
В классической
полярографии скорость развертки составляет 0,1 - 0,4 В/мин. Учитывая, что максимальный диапазон изменения потенициала около 2-х В, можно утверждать, что вольтамперометрия является достаточно экспрессным методом анализа.Нижние границы определения концентраций для классической полярографии находятся на уровне n.10-5 М. Очевидно, что такие показатели сегодня малопривлекательны. К тому же раздельные полярографические волны получаются при Е1/2 0,1 В, да и то при соизмеримых концентрациях определяемых веществ. При существенных концентрационных различиях определяемых веществ разрешающая способность существенно хуже.
Слайд 34Дифференциальная полярография
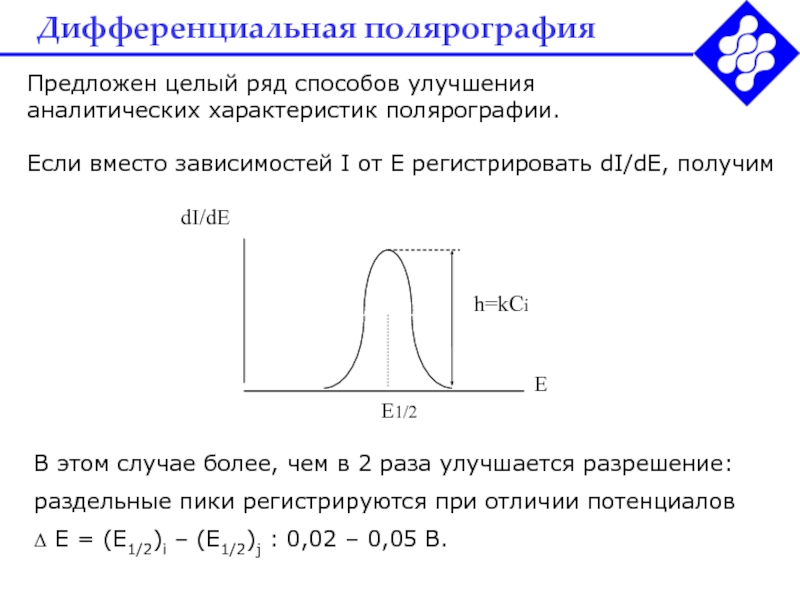
Предложен целый ряд способов улучшения
аналитических характеристик полярографии.
Если вместо зависимостей I от Е
регистрировать dI/dE, получимВ этом случае более, чем в 2 раза улучшается разрешение:
раздельные пики регистрируются при отличии потенциалов
Е = (Е1/2)i – (E1/2)j : 0,02 – 0,05 В.
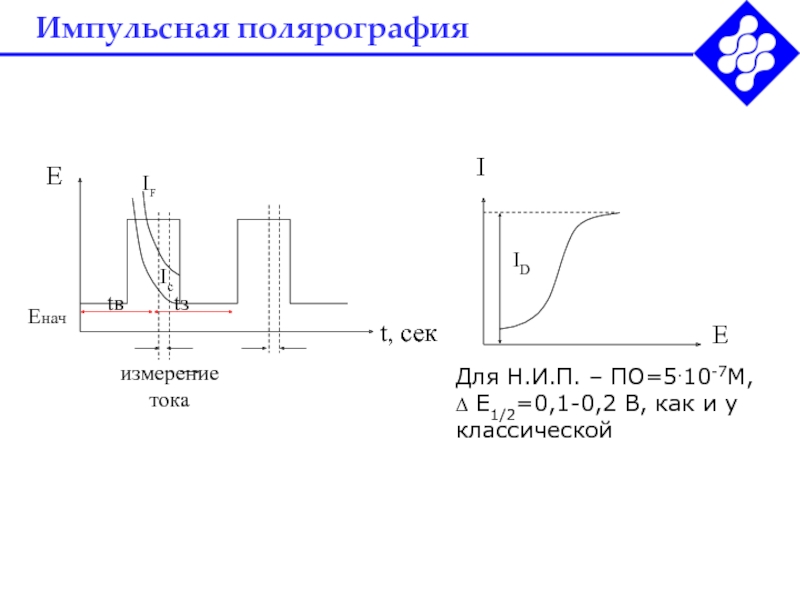
Слайд 35Импульсная полярография
Как и в кондуктометрии, в полярографии существенную
роль играет
соотношение фарадеевского и емкостного тока: IF/Ic.
Есть два варианта метода
импульсной полярографии, позволяющих уменьшить влияние Ic: нормальный и дифференциальный.В нормальном варианте поляризующие импульсы постоянного напряжения длительностью 50 сек налагают на постоянный начальный потенциал; а ток измеряют в конце импульса. При этом:
Ic~e-kt, IF~t-1/2
И соответственно быстрее затухает Ic. В момент измерения через 30-40 сек от начала подачи импульса Ic=0, а I=IF.
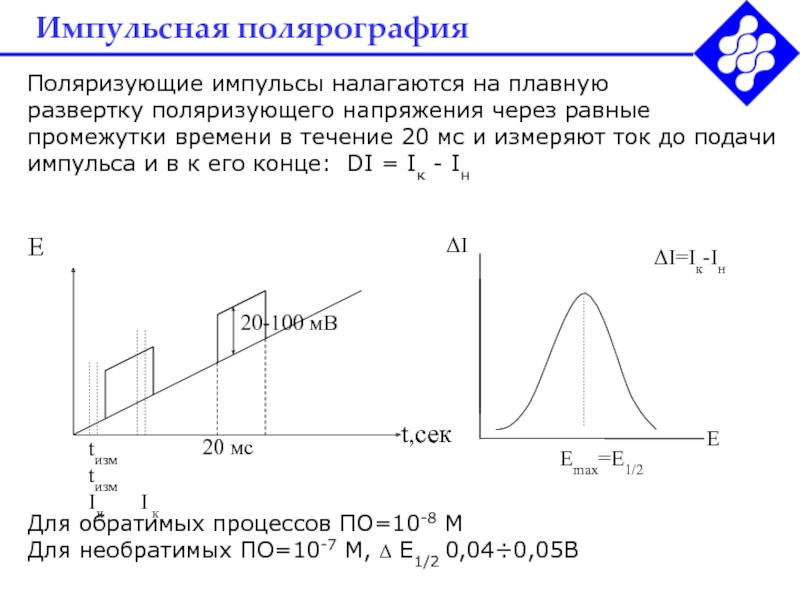
Слайд 37Импульсная полярография
Поляризующие импульсы налагаются на плавную
развертку поляризующего напряжения через
равные промежутки времени в течение 20 мс и измеряют ток
до подачи импульса и в к его конце: DI = Iк - IнДля обратимых процессов ПО=10-8 М
Для необратимых ПО=10-7 М, Е1/2 0,040,05В
Слайд 38Импульсная полярография
Известны и другие варианты улучшения аналитических характеристик прямой вольтамперометрии:
осциллографическая и переменнотоковая полярография, но они
не дают значимых преимуществ
по сравнению с импульсной.
Слайд 39Инверсионная вольтамперометрия
В основе инверсионной вольтамперометрии лежит двухстадийный процесс.
Определяемое вещество
сначала концентрируется электролизом при потенциале предельного тока его восстановления.
Если
присутствует несколько веществ, то концентрирование осуществляется при самом электроотрицательном потенциале выделения наиболее трудновосстанавливающегося компонента анализируемой смеси. При этом выделяется только незначительная доля или доли веществ, находящихся в растворе. Воспроизводимость обеспечивается поддержанием постоянства условий эксперимента при построении градуировочной зависимости и при анализе.
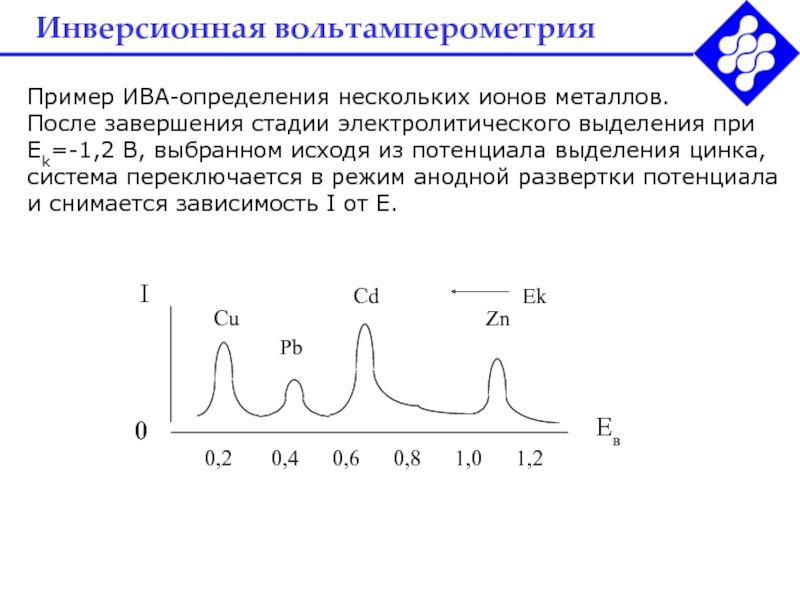
Слайд 40Инверсионная вольтамперометрия
Пример ИВА-определения нескольких ионов металлов.
После завершения стадии электролитического
выделения при Ek=-1,2 В, выбранном исходя из потенциала выделения цинка,
система переключается в режим анодной развертки потенциала и снимается зависимость I от Е.Слайд 41Инверсионная вольтамперометрия
Площади пиков и их амплитуда пропорциональны концентрациям определяемых веществ
в растворе и времени их накопления tk на электроде:
I
= k . Ci . TkСоответственно, увеличивая tk, можно снижать пределы обнаружения. При разумных временах накопления (минуты) пределы обнаружения многих металлов находятся на уровне 10-9М.
Инверсионная вольтамперометрия - один из самых чувствительных методов определения тяжелых металлов
в водных растворах.
Слайд 42Инверсионная вольтамперометрия
В отличие от каталиметрии здесь исключается неконтролируемое влияние мешающих
примесей, т.к. метод позволяет одновременно идентифицировать вещества и определять их
содержание.Остается проблема пробоподготовки - перевода аналитов в определенные ионные формы с соответствующими потенциалами выделения.
Отсюда необходимость выполнения жестких требований к выполнению условий пробоподготовки, обеспечивающих перевод всех химических форм аналитов в ионные формы и разрушение комплексообразователей.
Селективность метода определяется выбором составов фоновых электролитов для стадии анодного растворения.