Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Курс лекций по энзимиологии
Содержание
- 1. Курс лекций по энзимиологии
- 2. Основные вопросы по 3-й лекции1. Единицы измерения
- 3. Лекция 4 Лекция 51. Необратимые реакции первого
- 4. Определить порядок реакции и значение константы скорости (A0 – начальная концентрация, А-концентрация в момент времени tA0A
- 5. РешениеЕсли построить график в координатах ln A0/A
- 6. V=[A]k A=B Уравнение скорости первого порядка
- 7. 2A=B График для реакций второго порядка
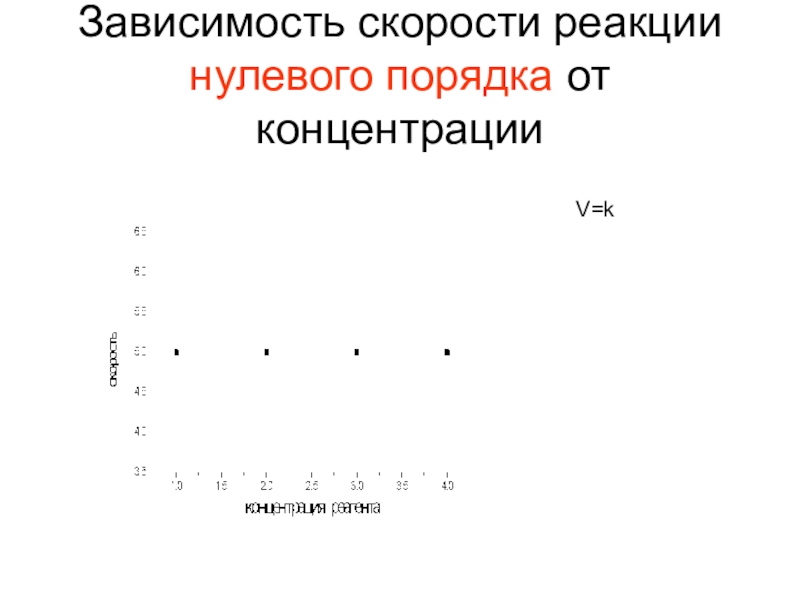
- 8. Реакции нулевого порядка V=k Время полупревращения
- 9. Зависимость скорости реакции нулевого порядка от концентрацииV=k
- 10. Характеристические функции кинетики необратимых химических реакцийПорядок 0
- 11. Характеристические функции кинетики необратимых химических реакцийПорядок 1 (реакции
- 12. Характеристические функции кинетики необратимых химических реакцийПорядок 2 (реакции
- 13. Обратимые реакции Химические реакции, которые при одних
- 14. Обратимые реакции mA+nBpC+qD k1 [A]m [B]n =
- 15. Для ферментативных реакций Кравн = k1/ k-1
- 16. Обратимые реакцииКонстанты скорости прямой и обратной реакций
- 17. Обратимые реакцииKр= k1/ k -1 =[C]p[D]q /
- 18. Смещение химического равновесия. . Принцип Анри Луи
- 19. Факторы, влияющие на смещение равновесияКонцентрация. При
- 20. Факторы, влияющие на смещение равновенсияДавление (для газовых
- 21. Факторы, влияющие на смещение равновесияТемпература. При повышении
- 22. *Интегральное определение порядка реакции и констант скоростей
- 23. * Интегральное определение порядка реакции и констант
- 24. * Интегральное определение порядка реакции и констант
- 25. * График обратимой реакции первого порядка
- 26. Константа скорости обратной реакции k-1 может быть
- 27. * Обратимые реакции разных порядков Константы скорости обратимых химических реакцийA BИнтегральное уравнение(xравн /a)ln(xравн/ [xравн- x])=k1t
- 28. *Константы скорости обратимых химических реакцийТип реакции A
- 29. * Константы скорости обратимых химических реакцийТип реакции
- 30. * Константы скорости обратимых химических реакцийТип реакции
- 31. *Реакция n-го порядкаДля состояния равновесия различных обратимых
- 32. Влияние температуры на скорость реакцииСкорость любой химической
- 33. Изменение константы скорости в зависимости от температурыВлияние
- 34. Константу скорости реакции при температуре, превышающей исходную
- 35. Исключением из этого правила является уменьшение скорости
- 36. Уравнение Вант-Гоффа выражает скорость изменения величины lnK
- 37. Я.Х. Вант-Гофф Якоб Хендрик Вант-Гофф (нидерл. Jacobus Henricus
- 38. Наиболее существенным фактором, определяющим характер влияния температуры
- 39. Казалось бы, такая зависимость связана с увеличением
- 40. Энергия активацииЧтобы объяснить наблюдаемые расхождения Сванте Аррениус
- 41. Энергия активацииЭнергия активации - это некоторое избыточное
- 42. Kр= k1/ k -1Поскольку константа равновесия представляет
- 43. Уравнение Вант-Гоффа выражает скорость изменения величины lnK
- 44. Уравнение АррениусаСогласно Аррениусу, константа скорости химической реакции
- 45. Различные формы уравнения Аррениуса ln k =-
- 46. Уравнение Аррениусаln k =- Ea /RT +
- 47. Зависимость логарифма константы скорости от обратной температурыln
- 48. Влияние температуры на скорость ферментативной реакции. Определение
- 49. Если начальные концентрации всех компонентов реакционной смеси
- 50. Энергия активации в отличие от H (изменение
- 51. Энергия активации Еа представляет собой критическую (минимальную)
- 52. В уравнении k=A e -Eа/(RT) k константа
- 53. По теории Аррениуса отношение числа активных молекул
- 54. Профиль реакции. Сравнительные графики
- 55. Процесс активации можно представить как переход через
- 56. ЗадачаВо сколько раз увеличится доля активных молекул,
- 57. РешениеПо теории Аррениуса отношение числа активных молекул
- 58. k=A e -E/(RT)Энергия активации Ea равна активационной энтальпии H# с обратным знакомEa =- H #
- 59. k=A e H # /(RT)Энергия активации
- 60. k=A e -Ea/(RT) Если известна зависимость константы
- 61. Теория Эйринга (теория переходных состояний)Кинетический анализ степеней
- 62. Теория Эйринга (1935 г.) В 1935 г.
- 63. Слайд 63
- 64. Энергетические кривые для простых ферментативных реакциях при различных относительных величинах констант скоростей
- 65. Изменение свободной энергии при переходе от субстратов
- 66. Активированным комплексом называют короткоживущее соединение фермента с
- 67. Связь энтальпии активации с энергией активацииH* =Ea –RTH* - энтальпия активацииG = -2.3 RT lg Kравн
- 68. Термодинамические уравнения для процесса активацииG=RT lnKs или
- 69. Термодинамические уравнения для процесса активации. Уравнение Эйринга
- 70. По теории переходного состояния зависимость ln k
- 71. k=kb T/h e S*/R e -
- 72. Если константу скорости реакции k и величину
- 73. Уравнение Вант-Гоффа ln K2/K1= H (T2-T1)/
- 74. Скачать презентанцию
Основные вопросы по 3-й лекции1. Единицы измерения скорости первого и второго порядка. 2. Размерность констант скоростей реакций различных порядков.3.Кинетические закономерности реакций первого и второго порядков. 4. Определение порядка реакции с помощью
Слайды и текст этой презентации
Слайд 1Курс лекций по энзимиологии
Лектор
Шумянцева Виктория Васильевна, д.б.н. профессор кафедры
биохимии МБФ РНИМУ,
499 246 5820Слайд 2Основные вопросы по 3-й лекции
1. Единицы измерения скорости первого и
второго порядка.
2. Размерность констант скоростей реакций различных порядков.
3.Кинетические закономерности
реакций первого и второго порядков. 4. Определение порядка реакции с помощью графиков.
5. Экспериментальный расчет константы скорости мономолекулярной и бимолекулярной реакции.
6. Уравнение скорости первого порядка в интегральной форме 7. Время полупревращения реагента (субстрата) t1/2 для реакций первого и второго порядка
8. Реакции псевдопервого порядка
Слайд 3Лекция 4
Лекция 5
1. Необратимые реакции первого и второго порядка.
2.
Время полупревращения реакций нулевого и дробного порядка.
3. Обратимые реакции .
4.
Принцип Ле Шателье.5. Влияние температуры на скорость реакции. Правило Вант-Гоффа.
6.Уравнение Аррениуса.
Слайд 4Определить порядок реакции и значение константы скорости (A0 – начальная
концентрация, А-концентрация в момент времени t
A0
A
Слайд 5Решение
Если построить график в координатах
ln A0/A , t,
(2,303 lg A0/A = kt) то можно определить порядок реакции
по изобутил литию n=1.k=3.06 10-5 сек -1
Слайд 6 V=[A]k A=B Уравнение скорости первого порядка в интегральной форме 2,303 lg A0/A
= kt или lg A0/A = 0,434 kt (если разделить обе части
уравнения на 2,303)По оси ординат 2,303 lg A0/A
tg =k
Слайд 72A=B График для реакций второго порядка 1/(a-x) = kt
+1/a
в координатах 1/(a-x), t
tg =k
1/a
x –
концентрация образовавшегося продукта, а –начальная концентрация реагента
Слайд 8Реакции нулевого порядка V=k Время полупревращения реагента (субстрата) t1/2 для
реакций нулевого порядка
dx/dt = k
dx=kdt
Проинтегрировав, получаем
x=kt
(x – концентрация образовавшегося продукта, а –начальная концентрация реагента)t1/2 = a/2k
Слайд 10Характеристические функции кинетики необратимых химических реакций
Порядок 0 (реакции нулевого порядка)
Дифференциальное
уравнение -d(a-x) / dt
Константа скорости к, найденная из
интегральных уравнений x / t Период полупревращения t1/2 =a / 2k
При t=0, [A]=a, а в момент времени t [A]=a-x
Слайд 11Характеристические функции кинетики необратимых химических реакций
Порядок 1 (реакции первого порядка) V=[A]k
A=B
Дифференциальное уравнение -d(a-x) / dt = k(a-x)
Интегральное уравнение 2,303 lg
a/(a-x) = ktКонстанта скорости к, найденная из интегральных уравнений (1 / t) ln [a/(a-x)]
Период полупревращения t1/2 =0.693/k или ln2/k
При t=0, [A]=a, а в момент времени t [A]=a-x
Слайд 12Характеристические функции кинетики необратимых химических реакций
Порядок 2 (реакции второго порядка) 2A=B
(A+A)
Дифференциальное уравнение -d(a-x) / dt = k(a-x)
2Интегральное уравнение 1/(a-x) =kt +1/a
Константа скорости к, найденная из интегральных уравнений
(1/t [1 / (a-x) -1/a]
Период полупревращения t1/2 = 1/ak
(A+B)
Дифференциальное уравнение -d(a-x)/dt=k(a-x) (b-x)
Константа скорости к, найденная из интегральных уравнений
ln[(a-x)/a][(b-x)/t(a-b)
Период полупревращения t1/2 = ln (2-a/b) / k(b-a)
Слайд 13Обратимые реакции
Химические реакции, которые при одних и тех же
условиях могут идти в противоположных направлениях, называются обратимыми.
A
B H2 +J2 2HJ
Состояние, в котором скорость обратной реакции равна скорости прямой реакции, называется химическим равновесием.
mA+nBpC+qD
v1 = k1 [A]m [B]n
v-1 = k-1 [C]p[D]q
Ферментативные реакции
k1
K-1
Слайд 14Обратимые реакции mA+nBpC+qD
k1 [A]m [B]n = k-1[C]p[D]q
Kравн= k1/ k -1
=[C]p[D]q / [A]m [B]n
- математическое выражение закона действующих масс
при химическом равновесии. Kравн - константа равновесия, представляющая собой отношение констант скоростей прямой и обратной реакции (отношение равновесных концентраций продуктов к исходным веществам).
Константы скорости k1 и k-1 относят к кинетическим параметрам
Kравн - константа равновесия – это термодинамический параметр
Слайд 15Для ферментативных реакций
Кравн = k1/ k-1 = [ES] /
[E] [S]
Kдисссоциации =1/Кравн =Кs= [E] [S]/ [ES]
Кs – субстратная
константа или константа диссоциации фермент-субстратного комплексаСлайд 16Обратимые реакции
Константы скорости прямой и обратной реакций k1 и k2
характеризуют
1. химическую природу реагирующих веществ
2. их способность вступать в
химические реакцииСлайд 17Обратимые реакции
Kр= k1/ k -1 =[C]p[D]q / [A]m [B]n
Kр -
константа равновесия, представляющая собой отношение констант скоростей прямой и обратной
реакции (отношение равновесных концентраций продуктов к исходным веществам).Чем больше скорость прямой реакции, тем больше константа равновесия, и наоборот
Слайд 18Смещение химического равновесия.
.
Принцип Анри Луи Ле Шателье – Ф.
Брауна (1884-1888 гг) (Принцип смещения подвижного равновесия). Внешнее воздействие на систему,
находящуюся в состоянии равновесия приводит к смещению этого равновесия, при котором эффект проведенного воздействия ослабляетсяСлайд 19Факторы, влияющие на смещение равновесия
Концентрация. При увеличении концентрации одного
из реагирующих веществ равновесие смещается в сторону расхода этого вещества,
при уменьшении концентрации равновесие смещается в сторону образования этого вещества.H2 +J2 2HJ
Слайд 20Факторы, влияющие на смещение равновенсия
Давление (для газовых систем). При увеличении
давления равновесие смещается в сторону уменьшения молекул газообразных веществ, т.е.
в сторону понижения давления.2NO+O2 2NO2
3 об. 2 об.
при повышении давления равновесие сместится в сторону прямой реакции, в сторону образования NO2
Слайд 21Факторы, влияющие на смещение равновесия
Температура. При повышении температуры равновесие смещается
в сторону эндотермической реакции (идущей с поглощением тепла). При понижении
температуры - в сторону экзотермической реакции.2NO+O2 2NO2 + Q
Прямая реакция экзотермическая,
Обратная – эндотермическая
При повышении температуры равновесие смещается в сторону обратной реакции
Слайд 22*Интегральное определение порядка реакции и констант скоростей обратимых реакций
Мономолекулярные реакции
первого порядка
A B
k1 – константа скорости прямой реакции
k
-1 – константа скорости обратной реакцииt= 0, [A]=a, [B]=0,
а в момент времени t [A]=a-x, [B]=x,
x - продукта образовалось
Слайд 23* Интегральное определение порядка реакции и констант скоростей обратимых реакций
При
достижении равновесия
v1=v-1
x=x равн (x - продукта
образовалось)k1 (a- xравн)=k-1 xравн
a- xравн =(k-1 /k1) xравн
(разделим на k1)
Слайд 24* Интегральное определение порядка реакции и констант скоростей обратимых реакций
dx/dt=(k1a/ xравн)(xравн- x)
После интегрирования получим
(xравн /a)ln(xравн/ [xравн- x])=k1t
a – начальная
концентрация x– концентрация в момент времени t
xравн - равновесная концентрация
Слайд 25
* График обратимой реакции первого порядка
(xравн /a)ln(xравн/ [xравн- x])=k1t
(x равн
/a)ln(x равн/ [x равн- x])
tg =k1
a - начальная
концентрация вещества Аt
Слайд 26Константа скорости обратной реакции
k-1 может быть вычислена из константы
равновесия Кравн по известной k1
(k1 вычисляем по графику,
tg =k1 )Kравн = k1/k-1 = x равн /(a-x равн)
k-1 = Kравн/k1 = x равн /(a-x равн) k1
Слайд 27* Обратимые реакции разных порядков
Константы скорости обратимых химических реакций
A
B
Интегральное уравнение
(xравн /a)ln(xравн/ [xравн- x])=k1t
Слайд 28*Константы скорости обратимых химических реакций
Тип реакции
A B+C
k1
=[x равн./t (2a-xравн)] ln{[ ax равн +x(a-
xравн )]/a (xравн –
x)}Слайд 29* Константы скорости обратимых химических реакций
Тип реакции
A +B
C
Если [A]=[B]
k1 =[x равн / t(a2-xравн 2)] ln{ [ x
равн (a2-xxравн )]/a2 (xравн –x)}Слайд 30* Константы скорости обратимых химических реакций
Тип реакции
A +B
C
Если [A] не равно [B]
k1 =[x равн./t (ab-xравн 2)] ln{
[ x равн (ab-xxравн )]/ab (xравн –x)}Слайд 31*Реакция n-го порядка
Для состояния равновесия различных обратимых реакций в общем
случае для n-молекулярной реакции n-го порядка можно записать
a +b+c
+….. h+l+m+Vпр =Vобр
K=k1(пр)/k2(обр)
Слайд 32Влияние температуры на скорость реакции
Скорость любой химической реакции при повышении
температуры увеличивается, если при этом не происходит вторичных изменений реагентов
или катализатора.В биохимии много реакций, имеющих отрицательные температурные коэффициенты, т.е. когда реакции при повышении температуры замедляются. Это связано с необратимыми структурными изменениями биомолекул. Однако, существуют термофильные организмы, живущие при температуре 100о С
Слайд 33Изменение константы скорости в зависимости от температуры
Влияние температуры на скорость
реакции. Правило Вант-Гоффа.
При повышении температуры на каждые десять градусов скорость
реакции возрастает в 2 - 4 раза. v(T2)/v(T1)= (T2-T1)/10,
-температурный коэффициент скорости реакции.
Слайд 34Константу скорости реакции при температуре, превышающей исходную на T можно
рассчитать
k (T+ T) = kT T/10
-температурный коэффициент скорости реакции
Слайд 35Исключением из этого правила является уменьшение скорости ферментативной реакции при
температурах, вызывающих денатурацию (необратимые структурные изменения) фермента
Слайд 36Уравнение Вант-Гоффа выражает скорость изменения величины lnK в зависимости от температуры
(уравнение изобары Вант-Гоффа
Дифференциальная форма
d(lnK)/dT= H0 / R ·1/T2
Интегральная форма
ln
K2/K1 =H0 (T2-T1)/R(T2T1)K2, K1 – константы равновесия обратимых реакций при температурах T2 и T1 соответственно.
H0– энтальпия реакции, равная разности энергий активации прямой и обратной реакций
H0 = E1 – E -1 = E (Дж/моль)
Слайд 37Я.Х. Вант-Гофф
Якоб Хендрик Вант-Гофф (нидерл. Jacobus Henricus (Henry) van 't Hoff;
30 августа 1852, Роттердам — 1 марта 1911, Берлин) —
голландский химик, один из основателей стереохимии и химической кинетики первый лауреат Нобелевской премии по химии (1901 год) «В знак признания огромной важности открытия законов химической динамики и осмотического давления в растворах».Слайд 38Наиболее существенным фактором, определяющим характер влияния температуры на скорость реакции,
является кинетическая энергия реагентов, так как из кинетической теории следует,
что она зависит только от абсолютной температуры.Слайд 39Казалось бы, такая зависимость связана с увеличением молекулярных столкновений, но
при повышении температуры на десять градусов общее число столкновений возрастает
на несколько процентов, тогда как число прореагировавших молекул возрастает на 200-400 %.Слайд 40Энергия активации
Чтобы объяснить наблюдаемые расхождения Сванте Аррениус показал, что влияние
температуры сводится к увеличению числа активных молекул, т.е. таких молекул,
которые в момент столкновения обладают энергией, не меньше определенной для данной химической реакции величины, называемой энергией активации химической реакции.Слайд 41Энергия активации
Энергия активации - это некоторое избыточное количество энергии (по
сравнению со средой), необходимое для вступления молекул в реакцию.
Слайд 42Kр= k1/ k -1
Поскольку константа равновесия представляет собой отношение констант
скоростей прямой и обратной реакции, С. Аррениус предположил, что аналогичная
математическая форма описывает влияние температуры на константу скорости реакции.Слайд 43Уравнение Вант-Гоффа выражает скорость изменения величины lnK в зависимости от температуры
(уравнение изобары Вант-Гоффа
Дифференциальная форма
d(lnK)/dT= H0 / R ·1/T2
Интегральная форма
ln
K2/K1 =H0 (T2-T1)/R(T2T1)K2, K1 – константы равновесия обратимых реакций при температурах T2 и T1 соответственно.
H0– энтальпия реакции, равная разности энергий активации прямой и обратной реакций
H0 = E1 – E -1 = E (Дж/моль)
Слайд 44Уравнение Аррениуса
Согласно Аррениусу, константа скорости химической реакции зависит от температуры
экспоненциально
k=A e -Eа/(RT)
Еа - энергия активации (Дж/моль) или величина
потенциального барьера, который нужно преодолеть, чтобы началась реакция,R -универсальная газовая постоянная,1,987 кал/моль град или 8.314 Дж/моль град
Т-температура в К,
А – константа (множитель Аррениуса, предэкспоненциальный множитель, вероятностный фактор).
e –основание натуральных логарифмов 2,71828
Энергия активации для каждой реакции своя, поэтому в уравнение Аррениуса входит константа скорости
Слайд 45Различные формы уравнения Аррениуса
ln k =- Ea /RT +ln
A
ln kT2/kT1 =Ea (T2-T1) / R(T2T1)
d(lnk)/dT= Еa / R ·1/T2
(дифференциальная форма уравнения Аррениуса)k - константа скорости химической реакции
Ea – энергия активации
Или в случае ферментативной реакции V=k[Enz]0
ln V= -Ea /RT +const
Слайд 46Уравнение Аррениуса
ln k =- Ea /RT + ln A
(А- константа)
Эта форма уравнения Аррениуса очень удобна для графического выражения
данных в координатах ln k и 1/T Ea =-4,576 tg
Еа - энергия активации (Дж/моль) или величина потенциального барьера, который нужно преодолеть, чтобы началась реакция,
R -универсальная газовая постоянная,1,987 кал/моль град или 8.314 Дж/моль град
Т-температура в К,
А – константа (множитель Аррениуса, предэкспоненциальный множитель, вероятностный фактор).
Слайд 47Зависимость логарифма константы скорости от обратной температуры
ln k =- Ea
/RT +ln A
tg =-Ea/R
На оси ординат часто
вместо константы скоростиоткладывают логарифм скорости ln V
(V=k[Enz]0)
Слайд 48Влияние температуры на скорость ферментативной реакции. Определение энергии активации ln k
=- Ea /RT +ln A
(уравнение Аррениуса)
Слайд 49Если начальные концентрации всех компонентов реакционной смеси поддерживаются постоянными и
изменяют только температуру, то скорости реакций будут подчиняться уравнению Аррениуса.
Слайд 50Энергия активации в отличие от H (изменение энтальпии ) всегда
имеет положительный знак и равна молярному увеличению энергии, которое необходимо
сообщить реагирующим молекулам для образования продуктов.Слайд 51Энергия активации Еа представляет собой критическую (минимальную) энергию активации.
Выражение
e -Eа/(RT) отражает долю молекул, обладающих такой энергией.
Аррениус полагал, что
скорость реакции определяется не только экспоненциальным членом, но и частотой молекулярных столкновений и вероятностью того, что сталкивающиеся молекулы будут иметь благоприятную ориентациюСлайд 52В уравнении k=A e -Eа/(RT)
k константа скорости химической реакции
А
– предэкспоненциальный или вероятностный фактор
А часто принимают равным 1
Слайд 53По теории Аррениуса отношение числа активных молекул Nак к общему
числу молекул N , т.е. доля активных молекул =
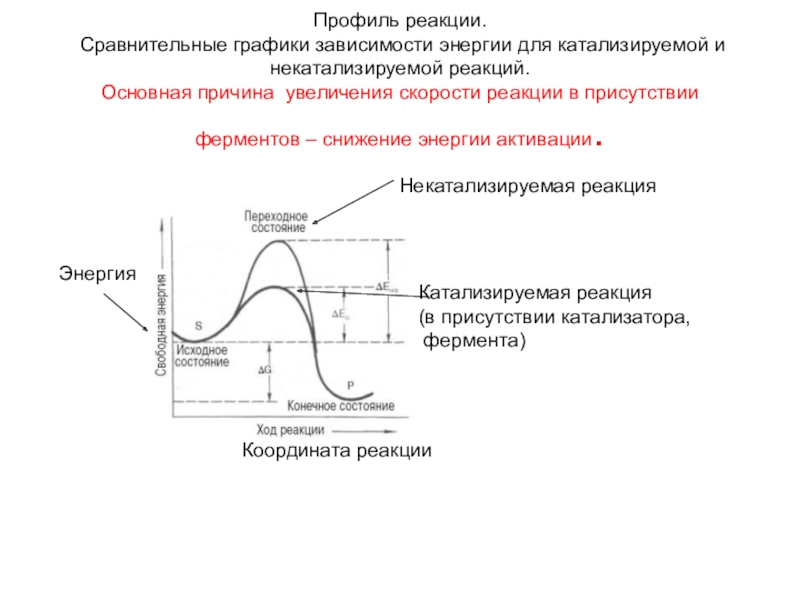
N ак /N = e -Eа/(RT)Слайд 54 Профиль реакции. Сравнительные графики зависимости энергии для катализируемой и некатализируемой
реакций. Основная причина увеличения скорости реакции в присутствии ферментов – снижение
энергии активации.Некатализируемая реакция
Катализируемая реакция
(в присутствии катализатора,
фермента)
Энергия
Координата реакции
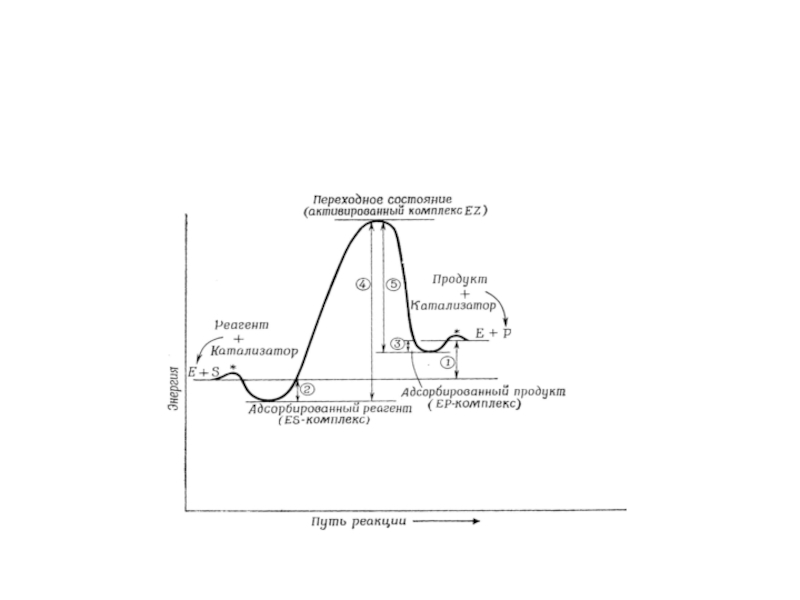
Слайд 55Процесс активации можно представить как переход через гору из одной
долины в другую. Высота горного перевала, измеренная от уровня дна
одной из долин, - аналог энергии активации.Активированный комплекс представляет собой молекулу в процессе разрыва старых и образования новых связей, но не промежуточное соединение.
Слайд 56Задача
Во сколько раз увеличится доля активных молекул, если температура возрастет
от 00 до 1000 С при средних значениях энергии активации
Еа =20 ккал,
R=1,985 кал./град,
е=-2,71828
Слайд 57Решение
По теории Аррениуса отношение числа активных молекул Nак к общему
числу молекул N , т.е. доля активных молекул =
N ак /N = e -E/(RT) 100 / 0= e 20000·100 /1, 985 ·273·373 = 20 000
Слайд 58k=A e -E/(RT)
Энергия активации Ea равна активационной энтальпии H#
с обратным знаком
Ea =- H #
Слайд 59k=A e H # /(RT)
Энергия активации Ea всегда имеет
положительный знак
Активационная энтальпия H# может иметь разные знаки
(Дж/моль)Слайд 60k=A e -Ea/(RT)
Если известна зависимость константы скорости реакции от температуры,
то энергию активации можно рассчитать по формуле
ln k2 – lnk1
= -Ea/R (1/T2-1/T1)к1 – константа скорости при температуре Т1
к2 - константа скорости при температуре Т2
Слайд 61Теория Эйринга (теория переходных состояний)
Кинетический анализ степеней свободы сталкивающихся молекул
позволил теоретически вывести уравнение Аррениуса. В теории столкновений химической кинетики
предполагается, что для реакции молекулы должны столкнуться. С ростом температуры увеличивается доля молекул, имеющих энергию больше, чем Еа (энергия активации), а скорость реакции соответственно увеличивается k=A e -E/(RT)ln k =- Ea /RT +ln A (уравнение Аррениуса)
Однако, основной недостаток теории столкновений заключается в том, что она не подходит для описания кинетики мономолекулярных реакций.
Слайд 62Теория Эйринга (1935 г.) В 1935 г. Эйринг, Эванс и Поляни
предложили теорию переходного состояния (теория активированного комплекса)
Теорию Эйринга называют теорией
переходного состояния, т.к. в ней в качестве основного процесса рассматривается распад активированного комплекса на вершине энергетического барьера.Субстрат связывается с ферментом и образует с ним слабый комплекс (иначе субстрат никогда нельзя было бы вытеснить из комплекса). При этом молекулы субстрата изменяются под влиянием фермента таким образом, что достигают максимально нестабильного переходного состояния. Реакция завершается после того, как переходное состояние нарушится и образуется продукт.
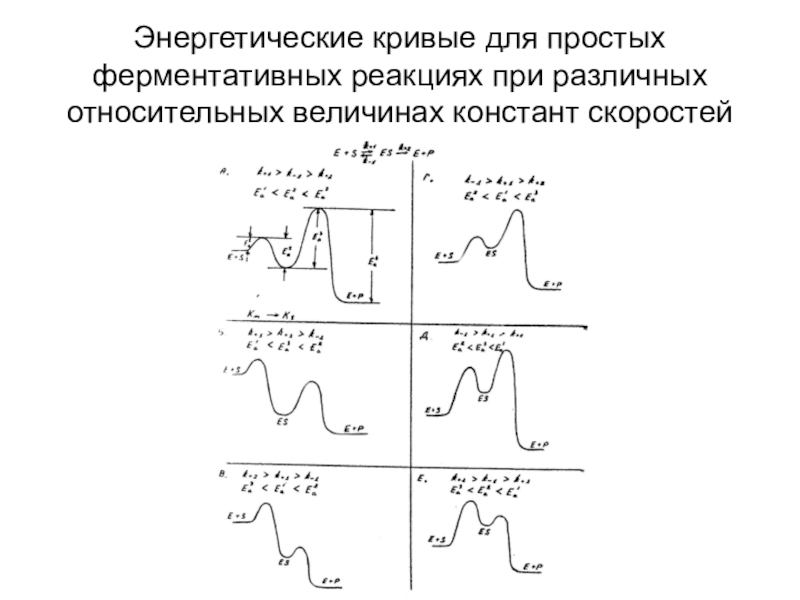
Слайд 64Энергетические кривые для простых ферментативных реакциях при различных относительных величинах
констант скоростей
Слайд 65Изменение свободной энергии при переходе от субстратов и фермента к
активированному состоянию ES*, а также при переходе от ФСК (ES)
ко второму активированному состоянию (если есть) соответствует энергии активации для соответствующих стадий.Слайд 66Активированным комплексом называют короткоживущее соединение фермента с субстратом ES* (переходное
состояние), которое возникает при их сближении и затем переходит в
обычный фермент-субстратный комплекс ESВ настоящее время с помощью лазерных импульсов длительностью до фемтосекунды (10 -15) переходные состояния охарактеризованы спектрально
Слайд 67Связь энтальпии активации с энергией активации
H* =Ea –RT
H* - энтальпия
активации
G = -2.3 RT lg Kравн
Слайд 68Термодинамические уравнения для процесса активации
G=RT lnKs или G=-RT lnKравн
G*=-RT
lnK*равн
G*= H*-T S*
G*= – свободная энергия активации
S*
- энтропия активации H*- энтальпия активации
Ea = H*+ RT
Слайд 69Термодинамические уравнения для процесса активации. Уравнение Эйринга
k –константа скорости
(произведение двух экспонент)
k=kb T/h e S*/R e -
H*/RTh – постоянная Планка,
kb – константа Больцмана (газовая константа в расчете на одну молекулу)
Из этого уравнения видно, что теория переходного состояния предсказывает несколько иную, чем у Аррениуса, зависимость от температуры, хотя в обоих случаях она имеет экспоненциальный характер
ln k =- Ea /RT +ln A. По Аррениусу, зависимость ln k от 1/Т дает прямую линию с наклоном =- Ea /R.
Слайд 70По теории переходного состояния зависимость ln k от 1/Т дает
прямую линию с наклоном –( H*+ RT)R
Для большинства реакций
H* значительно больше, чем RT, поэтому наклон приблизительно равен –( H*)R в соответствии с теорией АррениусаТогда H* = Ea
Слайд 71k=kb T/h e S*/R e - H*/RT
Уравнение Эйринга:
Экспоненциальный член
представлен произведением двух экспонент
1) вероятностный или ориентационный член S*/R
2) вторая экспонента содержит теплоту активации - H*/RT
Слайд 72Если константу скорости реакции k и величину энергии активации Еа
определить экспериментально, то можно рассчитать энтропию активации.
Энтальпию активации
H можно определить по уравнению Вант-Гоффа (ln K2/K1= H (T2-T1)/R(T2T1)
или экспериментально методом микрокалориметрии.
Для ферментативных реакций Кравн=1/Кs





![Курс лекций по энзимиологии V=[A]k A=B Уравнение скорости первого порядка в интегральной форме 2,303 V=[A]k A=B Уравнение скорости первого порядка в интегральной форме 2,303 lg A0/A = kt или](/img/tmb/7/653899/2a758c7230196c08f37ae361e72dbe8b-800x.jpg)



![Курс лекций по энзимиологии Характеристические функции кинетики необратимых химических реакцийПорядок 1 (реакции первого порядка) V=[A]k A=B Характеристические функции кинетики необратимых химических реакцийПорядок 1 (реакции первого порядка) V=[A]k A=B Дифференциальное уравнение -d(a-x) / dt =](/img/tmb/7/653899/6dd119acf476c2f02f3d0c6667cb5591-800x.jpg)


![Курс лекций по энзимиологии Обратимые реакции mA+nBpC+qD k1 [A]m [B]n = k-1[C]p[D]qKравн= k1/ k -1 Обратимые реакции mA+nBpC+qD k1 [A]m [B]n = k-1[C]p[D]qKравн= k1/ k -1 =[C]p[D]q / [A]m [B]n - математическое](/img/tmb/7/653899/b238a3a1bf2b7f7f83dadc3505fb7459-800x.jpg)
![Курс лекций по энзимиологии Для ферментативных реакций Кравн = k1/ k-1 = [ES] / [E] Для ферментативных реакций Кравн = k1/ k-1 = [ES] / [E] [S]Kдисссоциации =1/Кравн =Кs= [E] [S]/ [ES]](/img/tmb/7/653899/1cf6f6823ed8c351a80b654e28af6de9-800x.jpg)

![Курс лекций по энзимиологии Обратимые реакцииKр= k1/ k -1 =[C]p[D]q / [A]m [B]nKр - константа Обратимые реакцииKр= k1/ k -1 =[C]p[D]q / [A]m [B]nKр - константа равновесия, представляющая собой отношение констант скоростей](/img/tmb/7/653899/b6733be0843e3bcce95f8bf686f72f8a-800x.jpg)







![Курс лекций по энзимиологии * График обратимой реакции первого порядка (xравн /a)ln(xравн/ [xравн- x])=k1t * График обратимой реакции первого порядка (xравн /a)ln(xравн/ [xравн- x])=k1t (x равн /a)ln(x равн/ [x](/img/tmb/7/653899/8a0f1cd6d3c2f86b253139b68e6438b3-800x.jpg)

![Курс лекций по энзимиологии * Обратимые реакции разных порядков Константы скорости обратимых химических реакцийA BИнтегральное уравнение(xравн /a)ln(xравн/ [xравн- x])=k1t * Обратимые реакции разных порядков Константы скорости обратимых химических реакцийA BИнтегральное уравнение(xравн /a)ln(xравн/ [xравн- x])=k1t](/img/tmb/7/653899/74cca5850c0a1d5789d1105de7c354f6-800x.jpg)
![Курс лекций по энзимиологии *Константы скорости обратимых химических реакцийТип реакции A B+C k1 =[x *Константы скорости обратимых химических реакцийТип реакции A B+C k1 =[x равн./t (2a-xравн)] ln{[ ax равн +x(a-xравн](/img/tmb/7/653899/95c8897b4c7c86ddd03554b07022f7aa-800x.jpg)
![Курс лекций по энзимиологии * Константы скорости обратимых химических реакцийТип реакции A +B CЕсли * Константы скорости обратимых химических реакцийТип реакции A +B CЕсли [A]=[B]k1 =[x равн / t(a2-xравн 2)]](/img/tmb/7/653899/5f5896536a14becae6f2a1d93789bff8-800x.jpg)
![Курс лекций по энзимиологии * Константы скорости обратимых химических реакцийТип реакции A +B CЕсли * Константы скорости обратимых химических реакцийТип реакции A +B CЕсли [A] не равно [B]k1 =[x равн./t](/img/tmb/7/653899/90e13c41933fb8836f75bb335e925043-800x.jpg)