Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Курс Общая химия Лектор: проф. Майстренко Валерий Николаевич Башкирский
Содержание
- 1. Курс Общая химия Лектор: проф. Майстренко Валерий Николаевич Башкирский
- 2. Лекция № 16Комплексные соединения(метод валентных связей)
- 3. Слайд 3
- 4. Слайд 4
- 5. Комплексные соединения (лат. complexus — сочетание,
- 6. Слайд 6
- 7. Если в состав комплекса
- 8. Константа нестойкости характеризует термодинамическую устойчивость
- 9. Устойчивость комплексных соединений
- 10. Слайд 10
- 11. Слайд 11
- 12. Многие органические лиганды присоединяется
- 13. Слайд 13
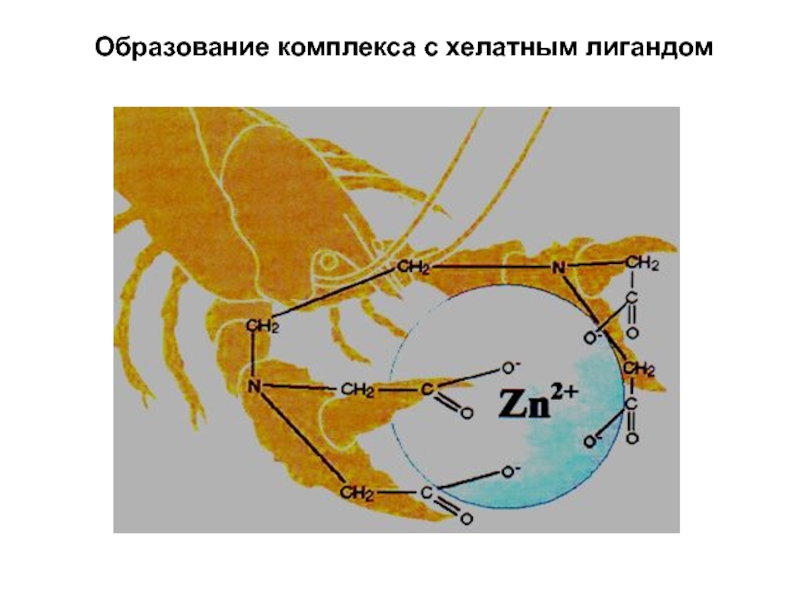
- 14. Образование комплекса с хелатным лигандом
- 15. Слайд 15
- 16. Слайд 16
- 17. Слайд 17
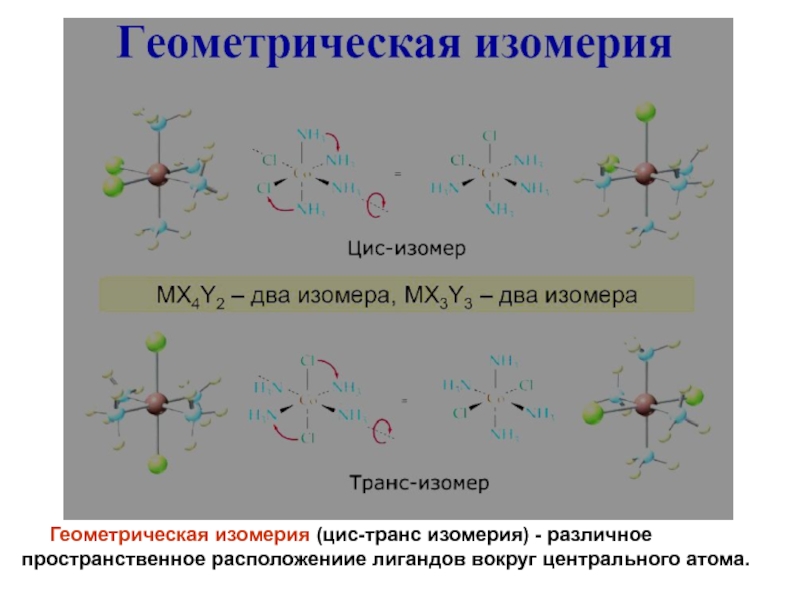
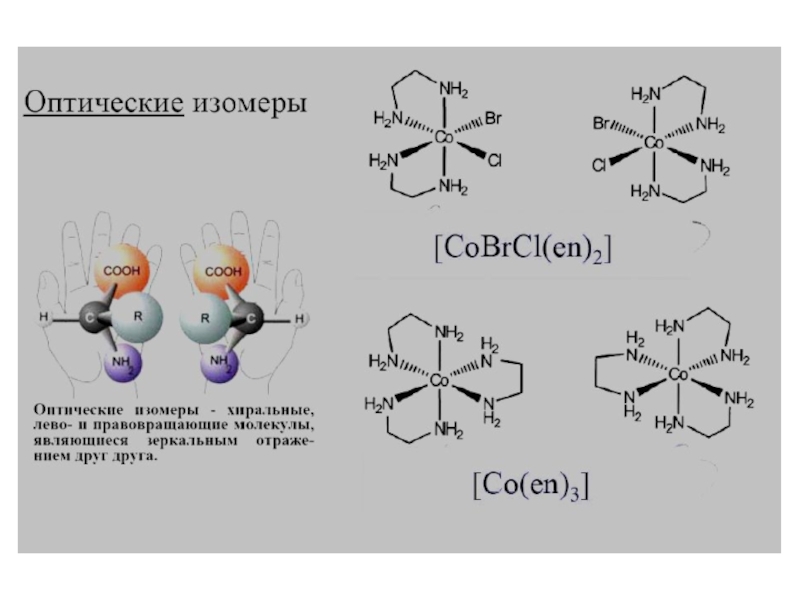
- 18. Геометрическая изомерия (цис-транс изомерия) - различное пространственное расположениие лигандов вокруг центрального атома.
- 19. Слайд 19
- 20. красно-фиолетовый
- 21. Слайд 21
- 22. Слайд 22
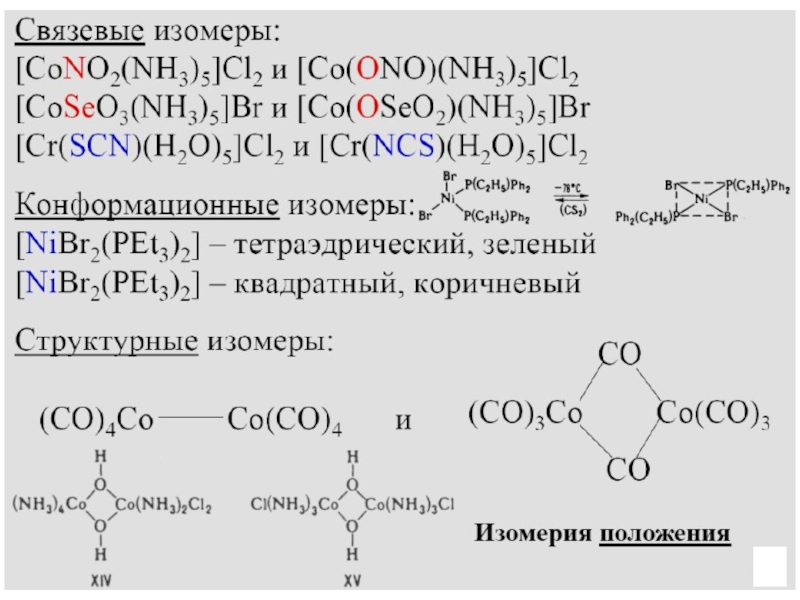
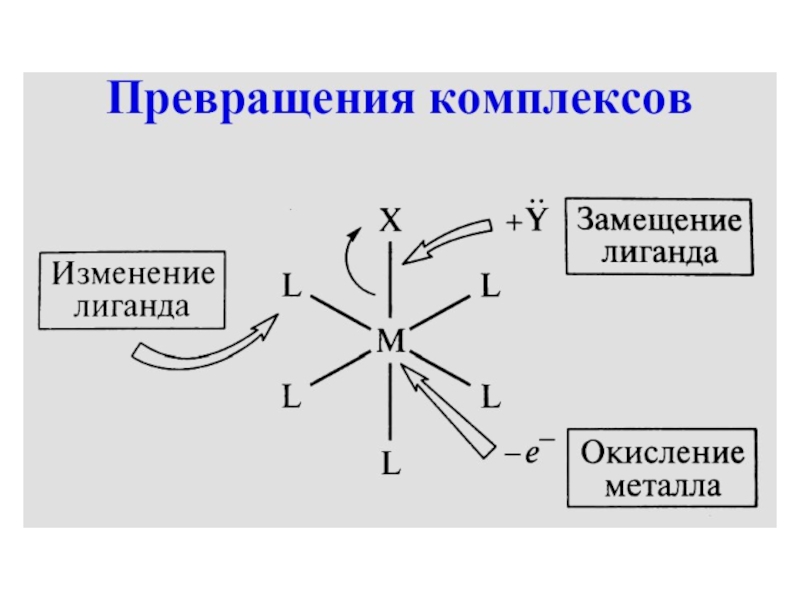
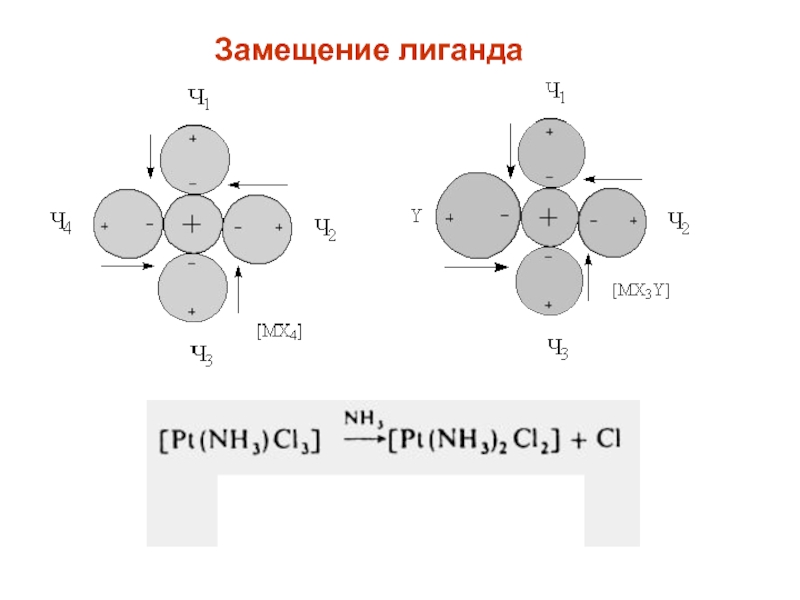
- 23. Замещение лиганда
- 24. Изменение лиганда[PdCl2(CnH2n)]2 [PdCl(CnH2n-1)]2 + HCl
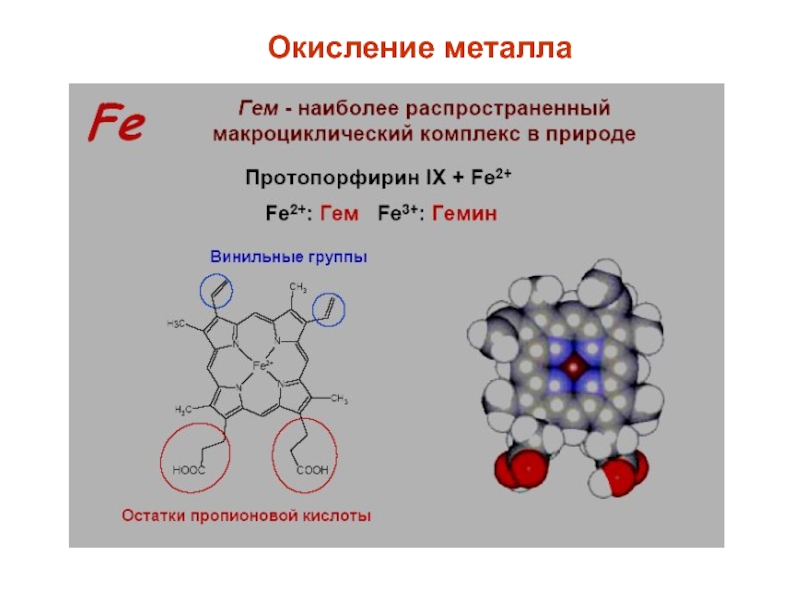
- 25. Окисление металла
- 26. Номенклатура комплексных соединений Согласно номенклатуре
- 27. Если комплексообразователь входит в
- 28. Слайд 28
- 29. Слайд 29
- 30. Слайд 30
- 31. В большинстве комплексных частиц
- 32. Пространственное строение этой частицы
- 33. Более «сильные» лиганды CN-
- 34. Слайд 34
- 35. Слайд 35
- 36. Структуры кристаллов комплексов K2[PtCl4] и K2[PtCl6]
- 37. Слайд 37
- 38. Слайд 38
- 39. Слайд 39
- 40. Благодарю за внимание
- 41. Скачать презентанцию
Лекция № 16Комплексные соединения(метод валентных связей)
Слайды и текст этой презентации
Слайд 1Курс «Общая химия»
Лектор: проф. Майстренко Валерий Николаевич
Башкирский государственный университет
Кафедра неорганической
химии
Слайд 5 Комплексные соединения (лат. complexus — сочетание, обхват) или координационные
соединения - частицы (нейтральные моле-кулы или ионы), которые образуются в
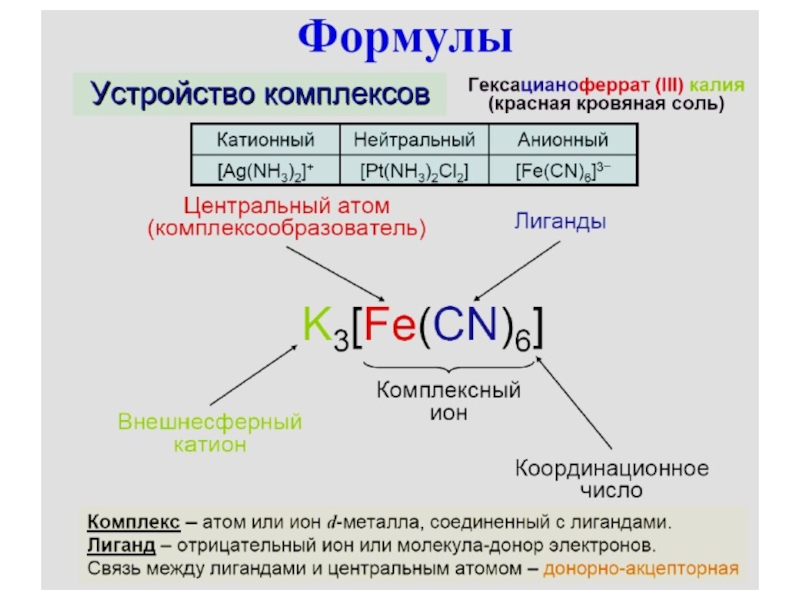
результате присоединения к данному иону (или атому), называемому комплексообразовате-лем, нейтральных молекул или других ионов, называемых лиган-дами. Комплексообразователь обычно положительно заряжен и именуется центральным атомом (ионом). Первая теория комп-лексных соединений (координационная теория) была предложена в 1893 году А. Вернером.Комплексные соединения обычно содержат комплексный малодиссоциирующий анион или катион (например, [Fe(CN)6]3−, [Ag(NH3)2]+) либо вообще не диссоциируют на ионы (например, карбонилы металлов).
Применяются в химическом анализе, в технологии при получении ряда металлов (Ag, Au, Pt и др.), для разделения сме- сей элементов, например лантаноидов. Огромная область приме-нения комплексных соединений — каталитические процессы.
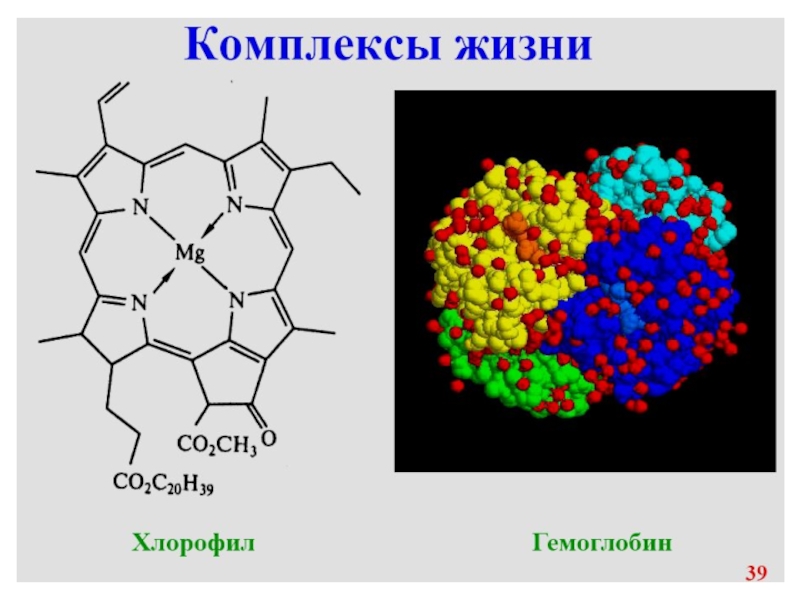
Большую роль комплексные соединения играют в жизне-деятельности организмов; например, гемоглобин и хлорофилл являются комплексными соединениями.
Слайд 7 Если в состав комплекса входят ионы, не
связанные непо-средственно с центральным атомом, то их выделяют во внешнюю
сферу комплекса. Внешнесферными могут быть и катионы, например К+ в K4[Fe(CN)6], и анионы, например SO42- в [Сu(NH3)4]SO4. При записи формулы внешнесферные ионы выно-сятся за квадратные скобки. В растворах комплексные соедине-ния с внешнесферными ионами практически нацело диссоци-ируют по схемеK2[CoCl4] = 2K+ + [CoCl4]2-
[Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42-.
Комплексные ионы тоже могут диссоциировать в растворе
[CoCl4]2- ⇆ Co2++4Cl-.
Устойчивость комплексных соединений характеризуется константой диссоциации Кд комплексных ионов, называемой константой нестойкости Кнес
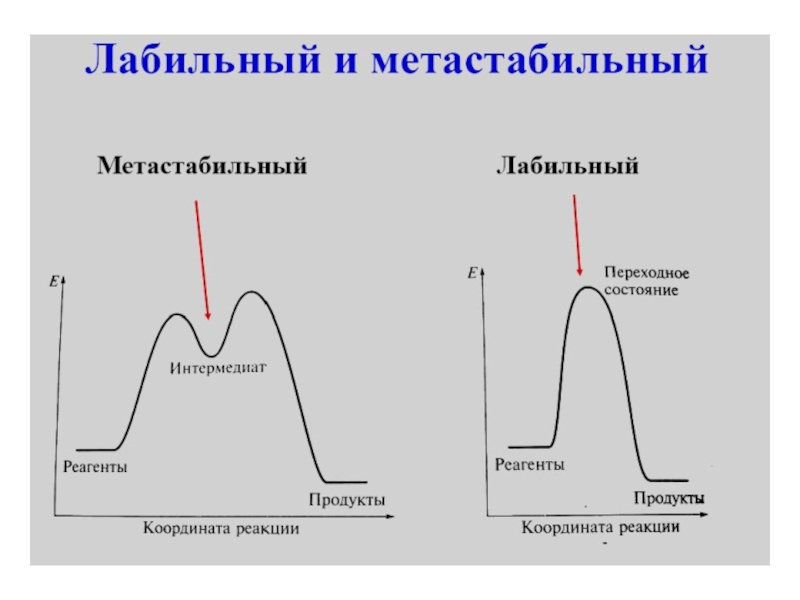
Слайд 8 Константа нестойкости характеризует термодинамическую устойчивость комплекса, зависящую от
энергии связи между центральным атомом и лигандом. Различают также кинетическую
устойчивость, или инертность, комплексной группировки – спо-собность комплексного иона обменивать внутрисферные ионы или молекулы на другие лиганды. Например, [Fe(H2O)6]3+ и [Сr(H2O)6]3+ имеют почти одинаковые энергии связи Me - H2O (116 и 122 ккал/моль), но первый комплекс обменивает лиганды быст-ро, а второй - медленно. Величина, обратная константе нестой-кости комплексного иона, называется константой устойчивостиЧисло ионов или молекул, непосредственно связанных с центральным атомом, называется координационным числом Например, в K4[Fe(CN)6], Ti(CO)7 и [Сu(NH3)4]SO4 координационные числа равны 6, 7 и 4. Значения координационных чисел меняются в зависимости от размеров и природы центральных атомов и лигандов. В настоящее время известны координационные числа от 1 до 12, чаще всего 4 и 6.
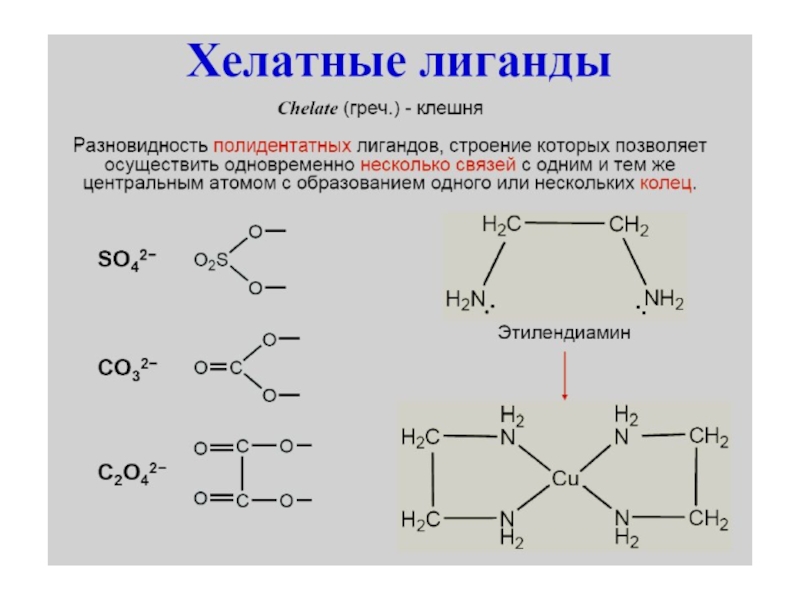
Слайд 12 Многие органические лиганды присоединяется к централь-ному атому
несколькими атомами. Такие лиганды называются полидентатными. Среди органических производных встречают-ся
лиганды, координирующиеся двумя, тремя, четырьмя, пятью, шестью и даже восемью атомами (соответственно би-, три-, тетра-, пента-, гекса- и октадентатные лиганды). Полидентатные органические лиганды могут образовывать циклические комп-лексы (внутрикомплексные соединения)Слайд 18 Геометрическая изомерия (цис-транс изомерия) - различное пространственное
расположениие лигандов вокруг центрального атома.
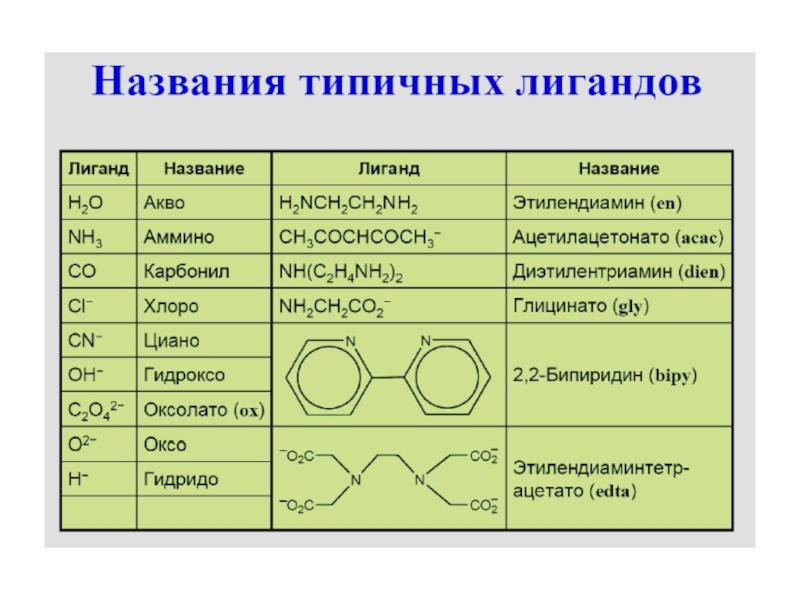
Слайд 26Номенклатура комплексных соединений
Согласно номенклатуре комплексных соединений, название
комплексного аниона начинают с указания состава внутренней координационной сферы. Прежде
всего называют анионы, при-бавляя к их названию окончание «о». Например, Cl– (хлоро), CN– (циано), OH– (гидроксо) и др. Далее называют нейтральные лиганды. Для NH3 используют название «аммино», для воды – «акво». Количество лигандов указывают греческими обозначе-ниями: ди, три, тетра, пента, гекса. Затем называют центральный атом, используя для него латинское название и окончание «ат» (в скобках римскими цифрами указывают степень окисления комплексообразователя). После названия внутренней координа-ционной сферы называют внешнесферные катионы.K[Fe(NH3)2(CN)4] – тетрацианодиамминоферрат (III) калия
K4[Сo(CN)6] – гексацианокобальтат (II) калия
Na2[PtCl6] – гексахлороплатинат (IV) калия
(NH4)2[Pt(OH)2Cl2] – дихлородигидроксоплатинат (II) аммония
Слайд 27 Если комплексообразователь входит в состав комплексного катиона,
то название внутренней координационной сферы сос-тавляют так же, как и
в случае комплексного аниона, но исполь-зуют русское название комплексообразователя и в скобках указывают степень его окисления.[Pt(NH3)4Cl2]Cl2 – хлорид дихлоротетраамминоплатины (IV)
[Ag(NH3)2]Cl – хлорид диамминосеребра (I)
Если комплексное соединение является неэлектролитом, т. е. не содержит ионов во внешней координационной сфере, то степень окисления центрального атома не указывается, т. к. она определяется из условия электронейтральности комплекса.
[RhI3(NH3)3)] – трииодотриамминородий
[Co(NO2)3(H2O)3] – тринитротриаквокобальт
[Cu(CNS)2(NH3)2] – дироданодиамминомедь.
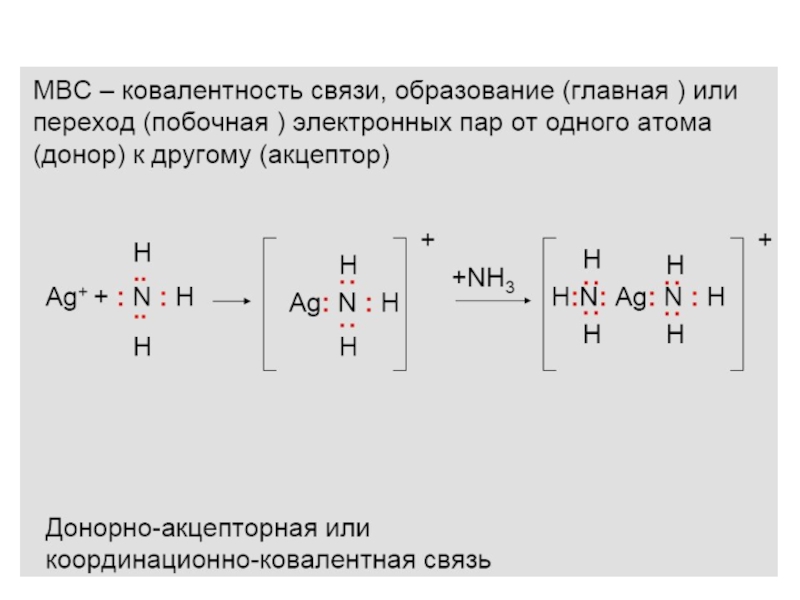
Слайд 31 В большинстве комплексных частиц связи между централь-ным
атомом и лигандами ковалентные. Все они или их часть образованы
по донорно-акцепторному механизму. В наименее прочных комплексах (например, в аквокомплексах щелочных и щелочноземельных элементов, а также аммония) лиганды удерживаются электростатически. Часто связь в комплексных частицах называют координационной связью. Рассмотрим ее образование на примере аквокатиона железа (II). Этот ион обра-зуется по реакцииFeCl2 + 6H2O = [Fe(H2O)6]2+ + 2Cl-
Электронная формула Fe – 1s22s22p63s23p64s23d6. При образо-вании двухзарядного иона атом Fe теряет два 4s-электрона
Ион Fe2+ акцептирует шесть электронных пар атомов кисло-рода шести молекул воды на вакантные электронные орбитали
Fe2+
3d
4s
4p
4d
Слайд 32 Пространственное строение этой частицы выражается одной из
структур:
Форма координационного полиэдра – октаэдр. Все связи
Fe-O одинаковые. Предполагается sp3d2-гибридизация атомных орбита-лей атома железа. Комплекс парамагнитен. Если FeCl2 растворять в растворе, содержащем цианид-ионы, то протекает реакция
FeCl2 + 6CN- = [Fe(CN)6]42- + 2Cl- .
3d
4s
4p
4d
H2O:
H2O:
H2O:
H2O:
H2O:
H2O:
Fe2+
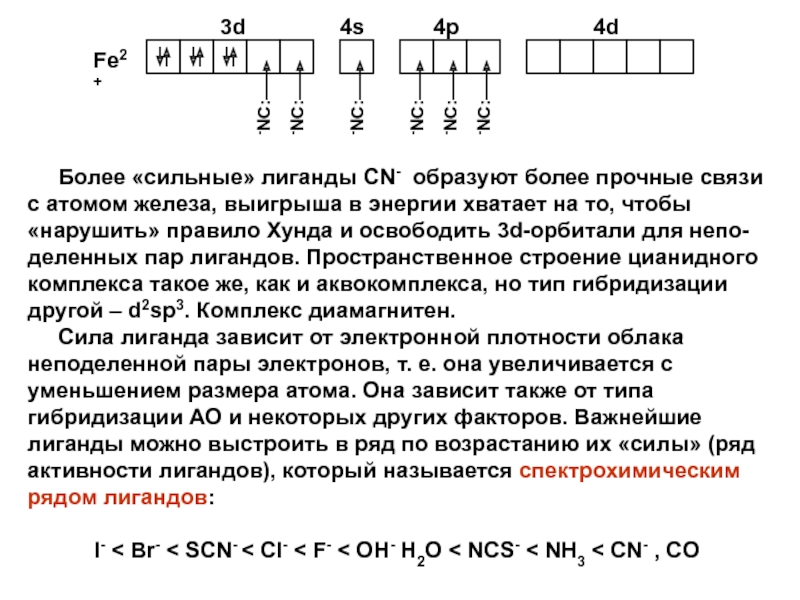
Слайд 33 Более «сильные» лиганды CN- образуют более прочные
связи с атомом железа, выигрыша в энергии хватает на то,
чтобы «нарушить» правило Хунда и освободить 3d-орбитали для непо-деленных пар лигандов. Пространственное строение цианидного комплекса такое же, как и аквокомплекса, но тип гибридизации другой – d2sp3. Комплекс диамагнитен.Сила лиганда зависит от электронной плотности облака неподеленной пары электронов, т. е. она увеличивается с уменьшением размера атома. Она зависит также от типа гибридизации АО и некоторых других факторов. Важнейшие лиганды можно выстроить в ряд по возрастанию их «силы» (ряд активности лигандов), который называется спектрохимическим рядом лигандов:
I- < Br- < SCN- < Cl- < F- < OH- H2O < NCS- < NH3 < CN- , CO
Fe2+
3d
4s
4p
4d
-NC:
-NC:
-NC:
-NC:
-NC:
-NC:













![Курс Общая химия
Лектор: проф. Майстренко Валерий Николаевич
Башкирский Изменение лиганда[PdCl2(CnH2n)]2 [PdCl(CnH2n-1)]2 + HCl Изменение лиганда[PdCl2(CnH2n)]2 [PdCl(CnH2n-1)]2 + HCl](/img/thumbs/ea0f14473b300a73afa54d282c10aad2-800x.jpg)








![Курс Общая химия
Лектор: проф. Майстренко Валерий Николаевич
Башкирский Структуры кристаллов комплексов K2[PtCl4] и K2[PtCl6] Структуры кристаллов комплексов K2[PtCl4] и K2[PtCl6]](/img/thumbs/6adb5c3288acaa25306269f68bcc756d-800x.jpg)
















![Звуки [ Г ], [ Г ' ]](/img/tmb/7/641721/126d2193ce288c820a428ffd0ebbf728-800x.jpg)


