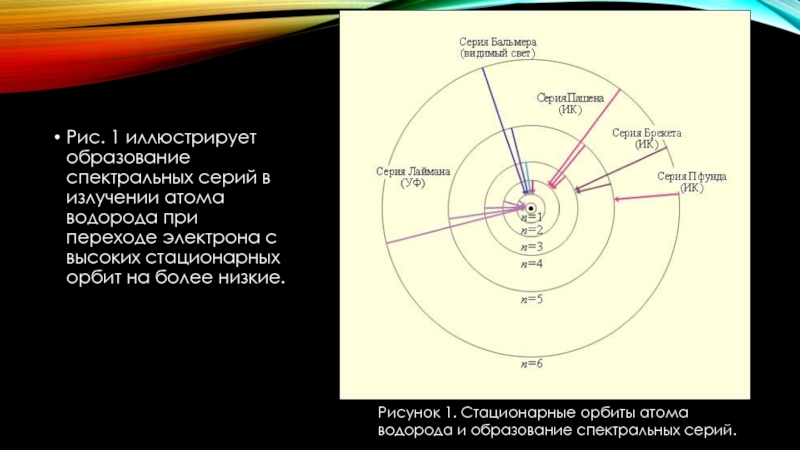
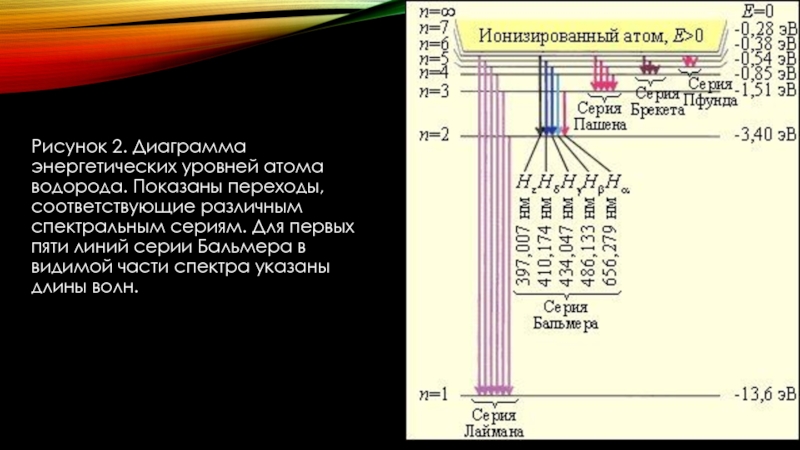
Института Химии II курса 213 группы
Бунина Наталья, Соколова Татьяна
Проверил:
доц. кафедры общей физики СГУ, канд. физ.-мат. наук Медведев Б. А.Министерство образования и науки Российской федерации федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «саратовский государственный университет имени н. г. Чернышевского»
Саратов 2015 г.