лишь задав некоторый потенциал, обусловленный распределением электронной плотности, априорно неизвестный.
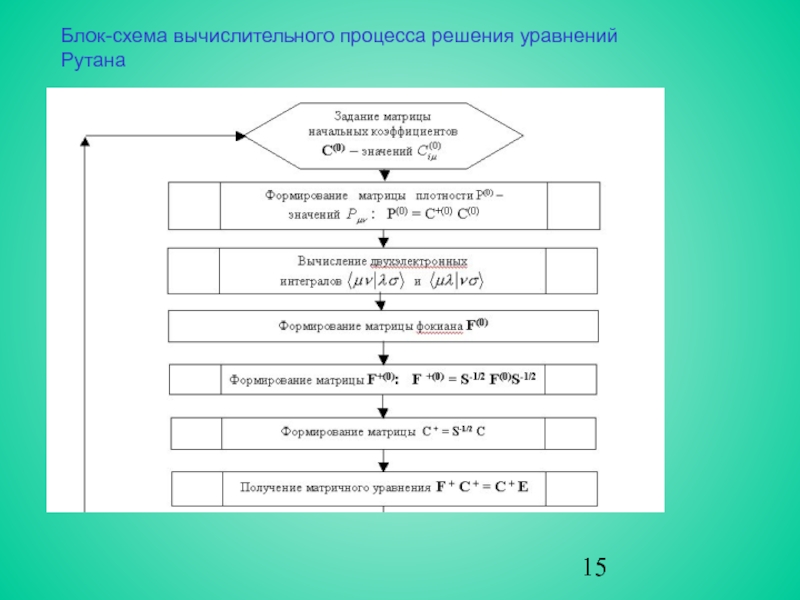
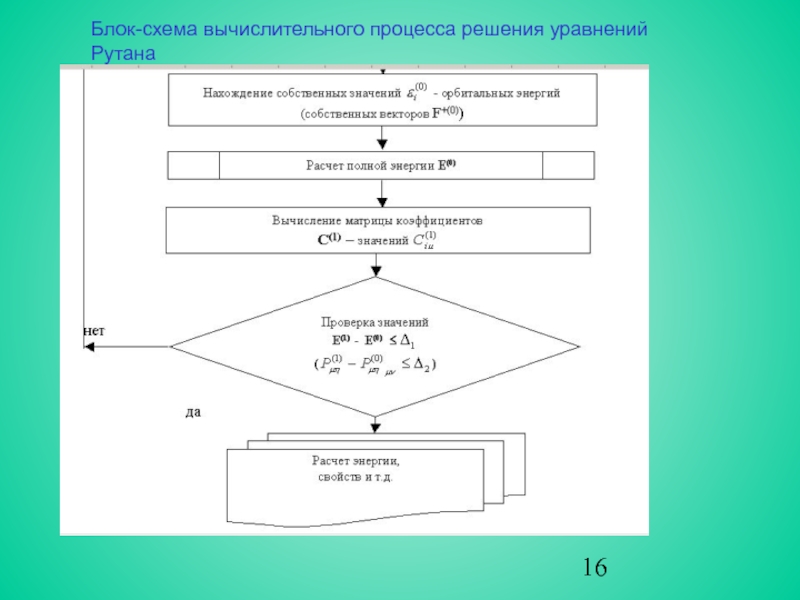
Поэтому решение уравнений Рутана осуществляется тем же итерационным методом ССП, что и в случае атома. Блок-схема вычислительного процесса представлена на рис.
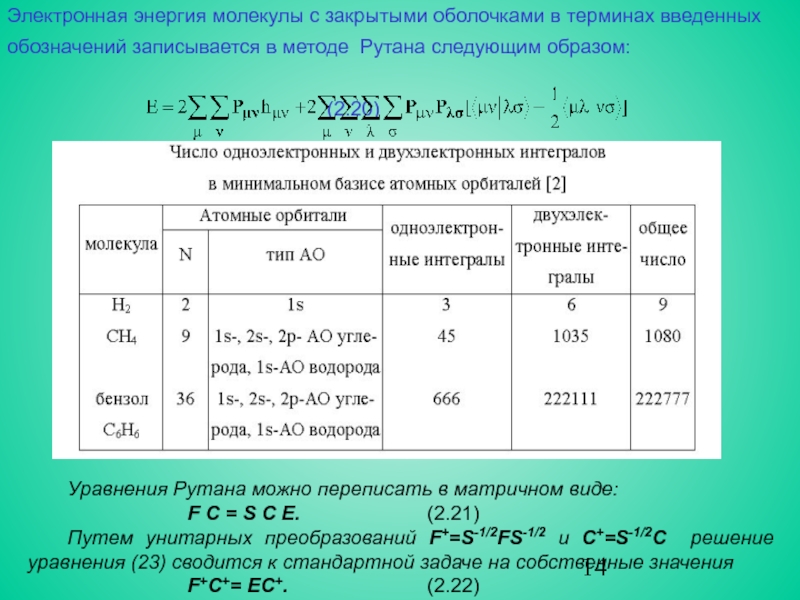
Вычисление двухэлектронных кулоновских и обменных интегралов по АО (или по базисным функциям - см. ниже), в случае, когда расчет проводился из первых принципов, в прежние годы являлось причиной большинства практических проблем. Сейчас эти проблемы сняты современными вычислительными и компьютерными технологиями. Тем не менее, без учета симметрии число этих интегралов равно ≈ N4/8, где N - число АО, т.е. очень велико, особенно, если учесть, что все четыре орбитали χμ, χν, χλ и χσ в общем случае центрированы на разных ядрах (для сравнения: число одно- электронных интегралов равно ≈ N2/2 – см. табл.).
hμν