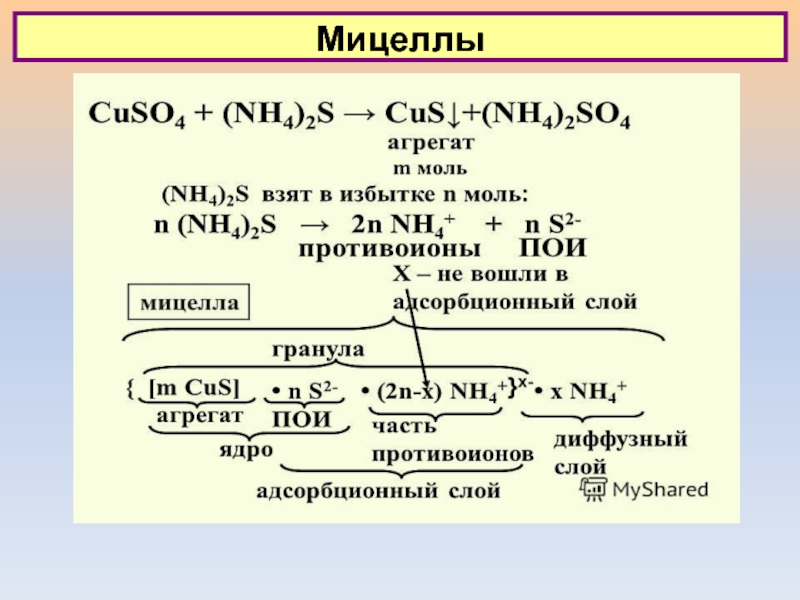
Слайд 1Л-9. Особенности дисперсных систем
Литература
1. Мушкамбаров, Н.Н. Физическая и коллоидная химия:
учебник для медицинских вузов (с задачами и решениями). – М.:
ООО "Медицинское информационное агентство", 2008. – 295 с.
2. Семиохин, И.А. Физическая химия: учебник. — М.: МГУ, 2001. — 272 с.
3. Родин, В.В. Основы физической, коллоидной и биологической химии: курс лекций / Ставропольский ГАУ. – Ставрополь: Агрус, 2009. – 124 с.
4. Евстратова, К.И. Физическая и коллоидная химия: учебник для фарм. вузов и факультетов /К.И. Евстратова, Н.А. Купина, Е.Е. Малахова. – М.: В. шк., 1990. — 487 с.
1. Факторы, определяющие ф-х свойства дисперсных систем. ДЭС
2. Методы исследования дисперсных систем
3. Природные коллоидные растворы
Слайд 21. Факторы, определяющие ф-х свойства дисперсных систем
- Размер частиц (более
10-5 м; 10-5 до 10-7 м; 10-7 до 10-9 м)
- Агрегатное состояние (гетерогенность);
–
Термодинамические параметры (кинетическая устойчивость и агрегативная неустойчивость);
- Структура дисперсной системы (коллоидный раствор, гель-студень, пена, взвесь, эмульсия-суспензия);
- Состояние межфазных границ и поверхностные явления (сорбция, когезия, адгезия, смачивание; поверхностное натяжение);
- Коллигативные свойства (опалесценция, осмос, электрофорез и электроосмос);
- Состояние дисперсионной среды (химическая природа; посторонние вещества – стабилизаторы: ВМС, ПАВ, электролиты; фазовое состояние);
- Концентрация компонентов (ККМ,
Слайд 31. Факторы, определяющие ф-х свойства дисперсных систем
Факторы и параметры устойчивости
Агрегативная
Седиментационная
Изо-электрическая
точка
Лиофильность, лиофобность
Потенциалы течения
Мембранный потенциал
Био-потенциал
Дзета-потенциал
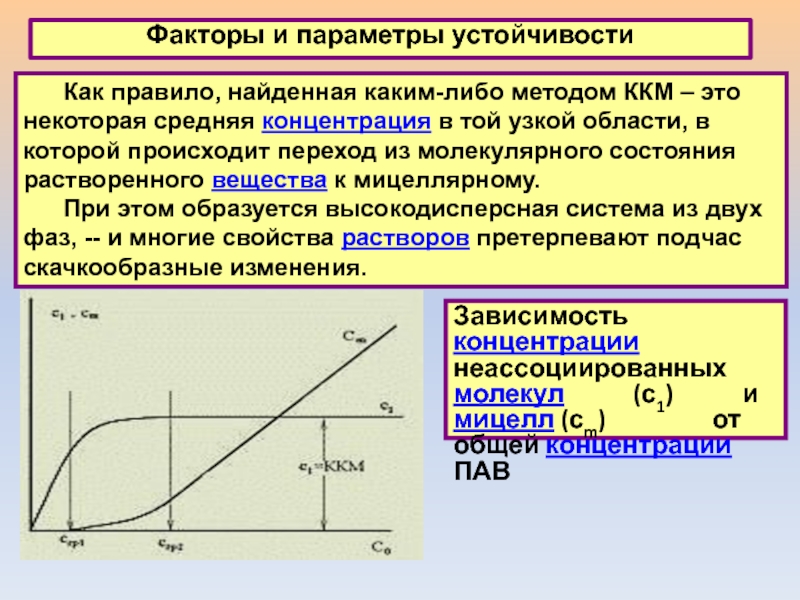
Слайд 7Факторы и параметры устойчивости
Как правило, найденная каким-либо методом ККМ –
это некоторая средняя концентрация в той узкой области, в которой происходит переход
из молекулярного состояния растворенного вещества к мицеллярному.
При этом образуется высокодисперсная система из двух фаз, -- и многие свойства растворов претерпевают подчас скачкообразные изменения.
Зависимость концентрации неассоциированных молекул (с1) и мицелл (сm) от общей концентрации ПАВ
Слайд 8 Двойной электрический слой
При контакте двух конденсированных фаз свойства поверхностного слоя
каждой фазы под воздействием второй фазы изменяются. В результате поверхностные
слои жидкостей и твёрдых тел по структуре, физическим и химическим свойствам значительно отличаются от внутреннего объёма этих фаз.
Толщина поверхностного слоя обычно составляет от долей до единиц нанометра. Совокупность двух поверхностных слоёв при контакте конденсированных фаз называют межфазным слоем.
1. Факторы, определяющие ф-х свойства дисперсных систем
Слайд 9Двойной электрический слой
При контакте твёрдого тела с раствором электролита происходит
ряд процессов, приводящих к заряжению поверхности: 1) адсорбция (достройка кристаллической
решётки) ионов на поверхности твёрдого тела; 2) диссоциация поверхностных групп; 3) переход ионов одного знака из твёрдого тела в раствор, когда а на поверхности остаётся фрагмент группы противоположного заряда; 4) поляризация поверхности (для металлов – наличие избытка/недостатка электронов на поверхности).
Вблизи заряженной поверхности изменяется концентрации ионов: к поверхности из раствора подтягиваются ионы противоположного знака и отталкиваются ионы одного знака с зарядом поверхности. В результате в системе твёрдое тело / электролит формируется двойной электрический слой.
Слайд 10Двойной электрический слой
Гельмгольц считал, что и в электролите формиру-ется тонкий
слой ионов, заряд которых противо-положен заряду поверх-ности твёрдого тела и
полностью компенсирует его. Эти два слоя формируют конденсатор с атомарным расстоянием между обкладками.
Гуи и Чепмен показали, что тепловое движение ионов "размывает" слой ионов, формирующийся в электролите, и он простирается достаточно далеко вглубь электролита.
Слайд 11Двойной электрический слой
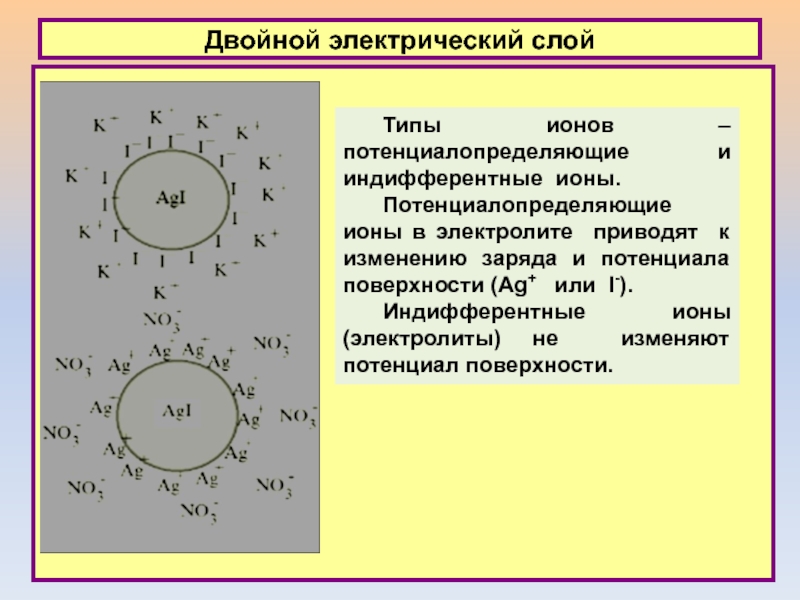
Типы ионов – потенциалопределяющие и индифферентные ионы.
Потенциалопределяющие
ионы в электролите приводят к изменению заряда и потенциала поверхности
(Ag+ или I-).
Индифферентные ионы (электролиты) не изменяют потенциал поверхности.
Слайд 12Двойной электрический слой
Условие равновесия в системе заряженных частиц.
Для них условием
равновесия является постоянство электрохимического потенциала, которое при малой концентрации ионов
ci в растворе имеет вид (eNA – число Фарадея), и уравнение Нернста – после его дифференцирования:
Для твёрдой фазы:
0 - потенциал поверхности
Слайд 13Двойной электрический слой
Изотерма адсорбции ионов (изотерма Штерна)
Адсорбция ионов определяется
не только знаком, но и природой ионов. В связи с
этим вводят понятие о специфической адсорбции, связанной с не электростатическим взаимодействием ионов с поверхностью. Менее часто используется термин неспецифическая адсорбция, величина которой определяется только знаком, но не типом ионов.
Ионы в растворе обычно окружены гидратной оболочкой, которая может разрушаться, разрушаться частично или не разрушаться при адсорбции.
При адсорбции ионов невозможной считается полислойная адсорбция. Фактически речь может идти только о заполнении первого монослоя, - и изотерма адсорбции ионов должна быть схожей с изотермой адсорбции Ленгмюра.
Слайд 14Двойной электрический слой
Изотерма адсорбции ионов (Генри - Штерн)
Изотерма адсорбции
ионов (Генри - Штерн)
где KHi - приведённая константа Генри
(нормировка хим. потенциала!), потенциал Фi определяет специфическую
адсорбцию ионов.
Изотерма адсорбции ионов (Штерн)
Для нейтральных молекул она переходит в изотерму адсорбции Ленгмюра
Слайд 15Двойной электрический слой
Лиотропные ряды
С наличием специфической адсорбции связывают существование
так называемых лиотропных рядов. Было показано, что катион оказывает тем
более сильное понижающее воздействие на отрицательный поверхностный потенциал, чем больше его истинный объём. Для ионов щелочных металлов этот ряд выглядит как
а для ионов щёлочноземельных металлов
Лиотропному ряду щелочных металлов отвечает адсорбционный ряд
Слайд 16Двойной электрический слой
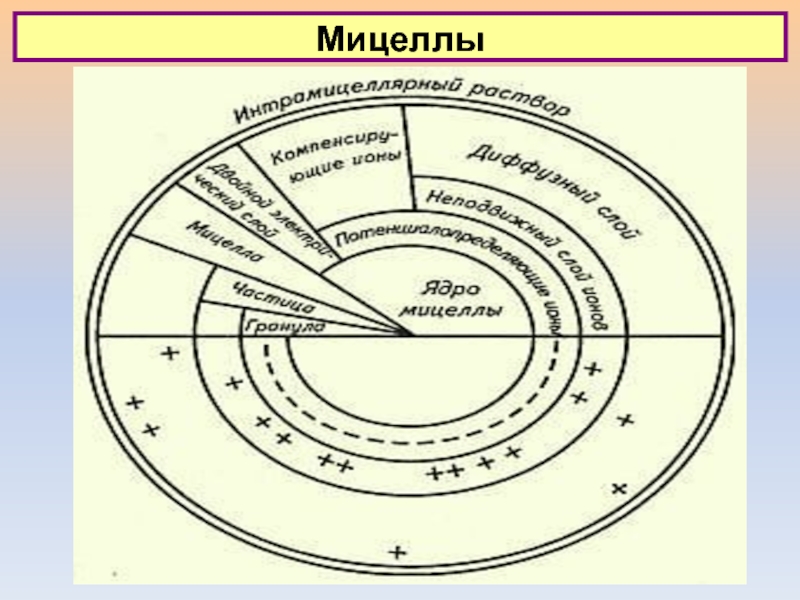
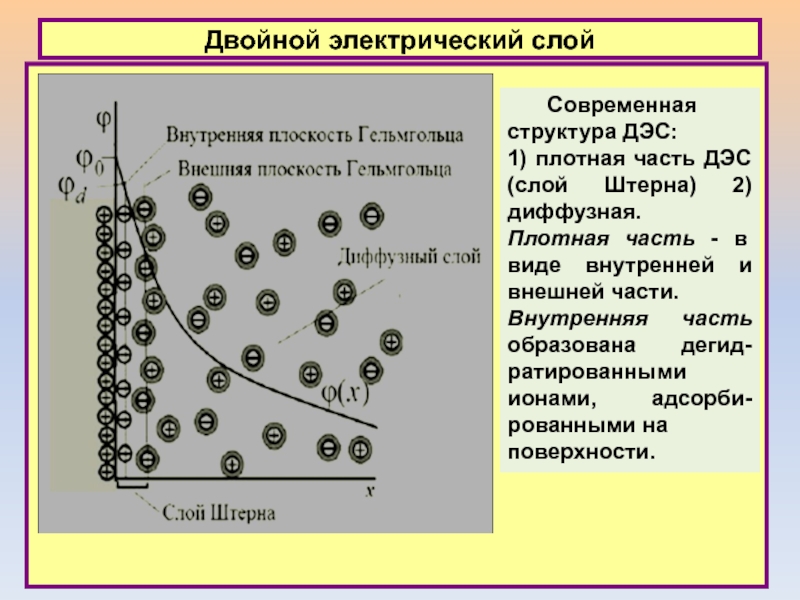
Современная структура ДЭС:
1) плотная часть ДЭС (слой
Штерна) 2) диффузная.
Плотная часть - в виде внутренней и
внешней части.
Внутренняя часть образована дегид-ратированными ионами, адсорби-рованными на
поверхности.
Слайд 17Двойной электрический слой
Ионы в плотной части ДЭС считаются неподвижными, а
ионы в диффузной части подвижны.
Имеется различие между потенциалом стенки
0 и потенциалом d в той плоскости, в которой находятся адсорбированные (внутренняя плоскость Гельмгольца) дегидратированные ионы (в слое Штерна). Потенциал d часто называют Штерновским.
Внешнюю часть плотного слоя составляют гидратированные ионы, взаимодействие которых с поверхностью практически лишено специфичности.
Специфически адсорбированные ионы во внутренней части плотного слоя могут иметь как противо-положный, так и одинаковый с потенциалопределяющими ионами заряд.
Слайд 18Двойной электрический слой
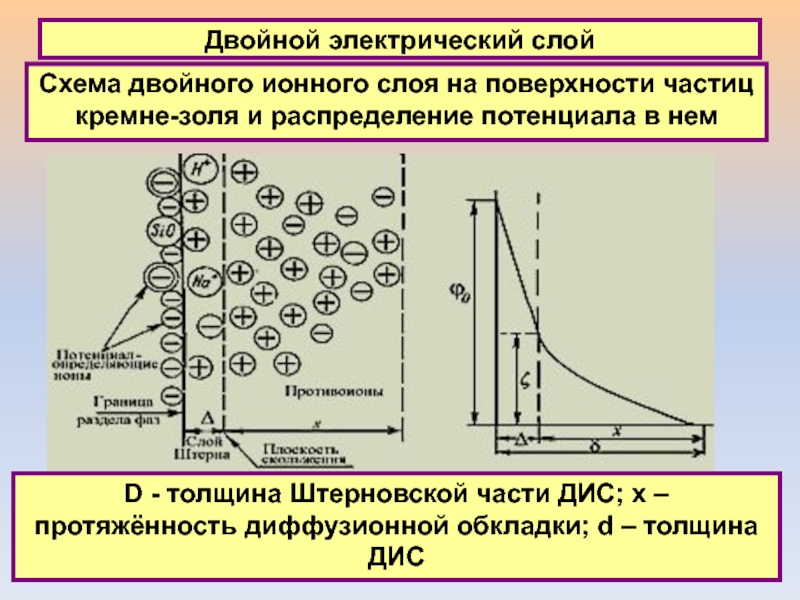
Схема двойного ионного слоя на поверхности частиц кремне-золя
и распределение потенциала в нем
D - толщина Штерновской части ДИС;
x – протяжённость диффузионной обкладки; d – толщина ДИС
Слайд 19Двойной электрический слой
Основные группы ионов двойного слоя:
1. Ионы, подчиняющиеся закону Нернста
–
где F – число Фарадея, аi – активность ионов в растворе,
R – универсальная газовая постоянная, T – абсолютная температура:
Для них характерно адсорбционное равновесие, определяемое равенством химических потенциалов в растворе и в адсорбционном слое, т. е.
Слайд 20Двойной электрический слой
Основные группы ионов двойного слоя:
2. Потенциалопределяющие ионы (ПОИ), -
при адсорбции становятся неотличимыми от твёрдой матрицы.
Электрохимические потенциалы этих ионов в адсорбированном состоянии
не зависят от концентрации.
Они не подчиняются уравнению Нернста, что характерно, например, для частиц некоторых красителей.
Слайд 21Двойной электрический слой
Основные группы ионов двойного слоя:
3. Поверхностные ионы, химически связанные
с поверхностью и вносящие вклад в поверхностный заряд rs. Сюда
относятся хемосорбированные ионы Н+ и ОН- и характеристические группы полимерных молекул.
4. Химически не связанные с поверхностью ионы, вносящие вклад в термодинамический поверхностный избыток Гi. Это, например, молекулы ПАВ, фиксированные при физической адсорбции. Сюда также можно отнести и противоионы двойного слоя.
Слайд 22Двойной электрический слой
Строение диффузной части ДЭС
Диффузная часть ДЭС играет доминирующую
роль и в электрокинетических явлениях, и в устойчивости коллоидных систем.
Для нахождения потенциала и концентрации ионов в диффузной части двойного слоя используется уравнение Пуассона и Больцмановское распределение для концентрации ионов:
Основное уравнение теории диффузной части ДЭС – уравнение Пуассона-Больцмана
Слайд 23Двойной электрический слой
Строение диффузной части ДЭС
- диэлектрическая проницаемость электролита,
которую считают постоянной,
0 - электрическая постоянная,
q(x) -
плотность заряда.
Размер ионов не учитывается, они считаются точечными частицами.
Окончательно, имеем
где
Слайд 242. Методы исследования дисперсных систем
Слайд 252. Методы исследования дисперсных систем
Методы электрофореза и электро-осмоса
При наложении
внешнего электрического поля электрически заряженные частицы (гранулы) передвигаются в дисперсионной
среде к электродам: катоду или аноду.
Движение дисперсных коллоидных частиц под влиянием внешнего электрического поля называется электрофорезом.
Одновременно происходит перемещение в противоположном направлении гидратированных противо-ионов диффузного слоя жидкости - электросмос.
Слайд 262. Методы исследования дисперсных систем
Методы электрофореза и электро-осмоса
Методом электрофореза
доказывают правильность определения заряда гранул.
Электрофоретический зонд Наумова: 1,
2 —электроды, 3, 4 — стеклянные трубки.
При погружении в коллоидный раствор зонд действует как коротко-замкнутый гальванический элемент (медь — положительно заряженный электрод, цинк — отрицательно). После погружения зонда в золь возле электрода, заряженного одинаково с гранулами, появляется тонкая светлая полоска.
Слайд 272. Методы исследования дисперсных систем
Метод капиллярного анализа
Некоторые вещества при
погружении в воду заряжаются отрицательно (целлюлоза, шёлк, стекло, песок и
др.). Вода поднимается вверх по полоске фильтровальной бумаги, опущенной одним концом в воду.
Отрицательно заряженные гранулы не притягиваются капиллярами поверхности бумаги (заряженными отрицательно), а будут двигаться вверх.
Положительно заряженные гранулы не будут подниматься, а осядут на поверхности бумаги.
Слайд 282. Методы исследования дисперсных систем
Метод капиллярного анализа
Некоторые вещества при
погружении в воду заряжаются отрицательно (целлюлоза, шёлк, стекло, песок и
др.).
Второй способ определения знака заряда коллоидных частиц капиллярным анализом
На фильтровальную бумагу наносят каплю исследуемого золя.
После всасывания капли золь с положительно заряженными частицами адсорбируется на бумаге и даёт окрашенное в центре и бесцветное по краям пятно.
Золь с отрицательно заряженными частицами не адсорбируется бумагой и образует на ней равномерно окрашенное пятно.
Слайд 292. Методы исследования дисперсных систем
Исследование условий коагуляции – укрупнения частиц
коллоидного раствора и их оседание под действием силы тяжести.
Разрушение
коллоидной системы идёт при воздействии низких и высоких температур, присутствия других веществ, при встряхивании, "старении", изменении концентрации дисперсионной фазы. Наблюдать этот процесс можно по увеличению мутности, изменению цвета раствора.
Коагуляция при добавлении электролитов. При добавлении электролитов к лиофобному золю происходит уменьшение толщины ДЭС и снижение ζ-потенциала на границе подвижного и неподвижного слоёв ионов коллоидных частиц. В результате уменьшается связь коллоидной частицы с дисперсионной средой, и наступает коагуляция.
Слайд 302. Методы исследования дисперсных систем
Исследование условий коагуляции – укрупнения частиц
коллоидного раствора и их оседание под действием силы тяжести.
Явная
коагуляция начинается при критическом значении электрокинетического потенциала до 30 мВ (правило критического потенциала). Если значение электрокинетического потенциала в пределах от 30 мВ до 70 мВ, то коллоидный раствор считается устойчивым.
Минимальная концентрация электролита-коагулятора называется порогом коагуляции
Слайд 312. Методы исследования дисперсных систем
Исследование условий коагуляции – укрупнения частиц
коллоидного раствора и их оседание под действием силы тяжести.
Минимальная
концентрация электролита-коагулятора называется порогом коагуляции:
V – объем золя, мл; VЭ – объем раствора электролита, достаточный для коагуляции, мл; С – концентрация электролита, моль/дм3.
Слайд 322. Методы исследования дисперсных систем
Исследование условий коагуляции – укрупнения частиц
коллоидного раствора и их оседание под действием силы тяжести.
Порог
коагуляции Cпор обратно пропорционален шестой степени электрического заряда (валентности) ионов-коагуляторов:
Т – температура системы, К; k – коэффициент, зависящий от физических свойств фаз системы;
Z – заряд иона-коагулятора.
Слайд 332. Методы исследования дисперсных систем
Исследование условий коагуляции – укрупнения частиц
коллоидного раствора и их оседание под действием силы тяжести.
Коагулирующая
способность электролита возрастает с увеличением валентности иона коагулятора (правило Шульца-Гарди).
В ряду Li+ > Na+ > K+ > Rb+ > Cs+ коагулирующее действие иона уменьшается. Ионы коагуляторы с высшей валентностью обладают меньшим порогом коагуляции.
Слайд 342. Методы исследования дисперсных систем
При коагуляции золя смесью двух электролитов
возможны три случая. У электролитов со сходными свойствами наблюдается аддитивное
действие, когда результат зависит от суммы протекающих независимо процессов коагуляции.
- В том случае, если действие одного иона усиливает действие другого, для коагуляции системы их требуется меньше, чем это нужно по правилу аддитивности, говорят о явлении синергизма.
- Антагонизм электролитов - если требуется больше ионов, чем по правилу аддитивности. Это происходит при конкурентной адсорбции ионов на поверхности коллоидов. При смешивании двух коллоидных растворов с частицами противоположного заряда наступает их взаимная коагуляция.
Слайд 352. Методы исследования дисперсных систем
Оптические методы исследования
(ультра-микроскопия, электронная микроскопия, нефелометрия,
турбидиметрия)
При действии светового луча на однородную прозрачную среду (чистые газы
и жидкости, истинные растворы, аморфные и кристаллические тела) наблюдаются следующие явления:
1) прохождение света через систему;
2) преломление света частицами дисперсной фазы;
3) отражение света частицами дисперсной фазы;
4) рассеяние света (опалесценция);
5) абсорбция (поглощение) света дисперсной фазой с превращением световой энергии в тепловую.
Слайд 362. Методы исследования дисперсных систем
Оптические методы исследования
(ультра-микроскопия, электронная микроскопия, нефелометрия,
турбидиметрия)
1. Явление двойного лучепреломления в потоке (эффект Максвелла) - наблюдается
в жидкостях, растворах и дисперсных системах, содержащих анизометрические или способные деформироваться молекулы и частицы.
Частица движется со скоростью движения слоя жидкости, в котором она находится, и вращается вокруг своего центра тяжести из-за того, что она расположена в слоях жидкости, обладающих различными скоростями. Чем полнее гидродинамическая ориентация преодолевает броуновское движение, тем более резко проявляется ориентация частиц в одном направлении и тем ближе это направление к направлению течения. Эти зависимости позволяют наблюдать изменение степени анизотропности системы и определять анизометрию частиц
Слайд 372. Методы исследования дисперсных систем
Оптические методы исследования
(ультра-микроскопия, электронная микроскопия, нефелометрия,
турбидиметрия)
2. Для коллоидных систем наиболее характерны рассеяние (дифракция) и абсорбция
света.
2а. Турбидиметрический метод исследования основан на измерении интенсивности света, прошедшего через дисперсную систему. Интенсивность падающего светового потока ослабляется в результате его рассеяния дисперсной системой.
2б. Нефелометрический метод исследования основан на измерении интенсивности света, рассеянного дисперсной системой. В нефелометре источник света направляет падающий световой поток под углом к потоку регистрируемого рассеянного света.
Слайд 382. Методы исследования дисперсных систем
Оптические методы исследования
(ультра-микроскопия, электронная микроскопия, нефелометрия,
турбидиметрия)
2а. Для турбидиметрии использую фото-электро-колориметры. Применение метода ограничивается золями,
отличающимися сравнительно высокой мутностью. Точность турбидиметрического метода небольшая .
2б. Более высокая чувствительность и точность нефелометрии позволяют определить не только концентрацию и размер частиц в золях, но и форму и конформацию частиц, межчастичные взаимодействия и другие свойства дисперсных систем.
Слайд 392. Методы исследования дисперсных систем
Исследование растворов ВМС
Свойства ВМС и
их растворов зависят не только от размера и формы молекул,
но и от химического строения. Размеры молекул приближаются е размерам мицелл золей (1 – 100 нм), что обуславливает их сходство с лиофобными золями:
Не способны проходить через полупроницаемые мембраны;
Малая скорость диффузии;
Имеют сходные молекулярно - кинетические, оптические и электрохимические свойства.
Слайд 402. Методы исследования дисперсных систем
Исследование растворов ВМС
1. Метод ИЭТ.
В ИЭТ частички ВМС имеют иные свойства, чем в обычном
состоянии. Так, в ИЭТ белки не обладают электрофоретической подвижностью, имеют минимальную устойчивость, растворимость, гидратацию, вязкость, осмотическое давление, электропроводность, степень набухания, удельное оптическое вращение, мембранный потенциал.
1а – по измерению вязкости системы. Построить график зависимости: рН = f(). Минимум на этом графике соответствует ИЭТ ВМС.
1б - по измерению степени помутнения раствора.
Максимальное помутнение раствора соответствует ИЭТ ВМС.
Слайд 412. Методы исследования дисперсных систем
Наличие ДЭС на границе раздела
фаз в дисперсных системах обусловливает существование ряда так называемых электрокапиллярных
явлений, - при электрической поляризации происходит изменение поверхностного натяжения (σ) на границе раздела фаз.
Для измерения σ часто применяется метод отсчёта капель с помощью сталагмометра.
Схема сталагмометра:
1 ‒ сталагмометр; 2 ‒ резиновая трубочка; 3 ‒ стаканчик с рас-
твором; 4 ‒ зажим; 5 ‒ штатив
Слайд 422. Методы исследования дисперсных систем
Строятся графики σ = f(c)
и Г = f(c)
Слайд 432. Методы исследования дисперсных систем
Седиментационный анализ - для определения
размеров частиц дисперсной системы и выяснения распределения частиц дисперсной системы
по определённым размерам.
Седиментационный анализ сводится к измерению скорости оседания (или всплытия) частиц в суспензиях или эмульсиях и характеризует кинетическую устойчивость дисперсных систем.
В основе его лежит закон Стокса
‒ скорость оседания частиц; r – радиус частиц;
d и d0 – плотность частиц и среды; η ‒ вязкость среды;
g ‒ ускорение силы тяжести.
Слайд 442. Методы исследования дисперсных систем
Седиментационный анализ
Закон Стокса. В одном
и том же растворе скорость седиментации пропорциональна квадрату радиуса частицы,
т. е. скорость падения частиц возрастает в 4 раза при увеличении ее радиуса вдвое.
Метод непрерывного взвешивания - определение увеличения веса осадка на поверхности стеклянной чашечки, подвешенной к крючку торсионных весов и опущенной в цилиндр с суспензией.
Слайд 452. Методы исследования дисперсных систем
Методы вискозиметрии
Чистые жидкости и разбавленные
коллоидные растворы, в которых частицы имеют сферическую форму, характеризуются Ньютоновской
(нормальной)
вязкостью, а растворы с палочковидными и нитевидными частицами в большинстве случаев даже в пределах ламинарного потока характеризуются неньютоновской вязкостью.
Существует около 15 разных способов определения вязкости. Совокупность методов измерения вязкости называется вискозиметрией, а приборы, предназначенные для измерения вязкости, ‒ вискозиметрами.
Слайд 462. Методы исследования дисперсных систем
Вязкость жидкостей и растворов биоорганических соединений
измеряют в пределах ламинарного (послойного) потока.
Если при изменении скорости
течения в пределах ламинарности вязкость жидкости остаётся постоянной, то такая жидкость называется Ньютоновской.
Если же вязкость при этом изменяется и скорость течения жидкости не пропорциональна приложенной силе, жидкость называется неНьютоновской.
Слайд 472. Методы исследования дисперсных систем
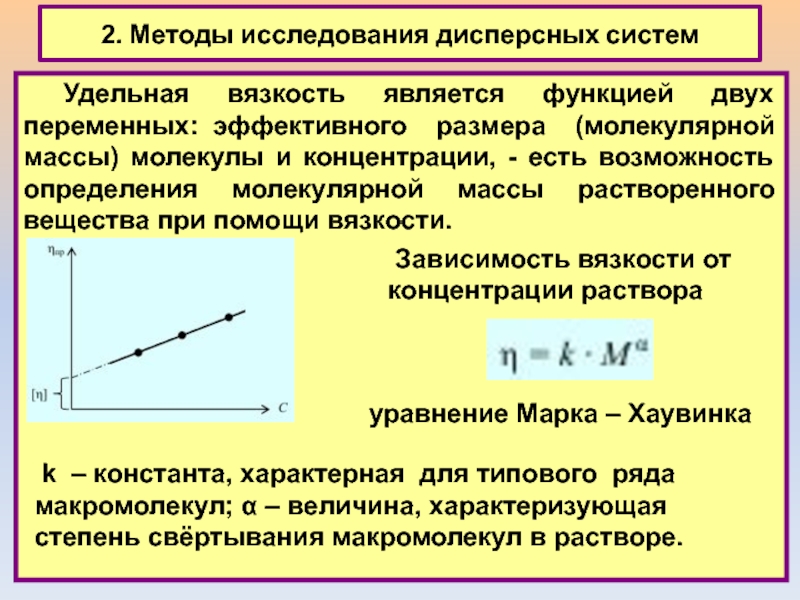
Удельная вязкость является функцией двух переменных:
эффективного размера (молекулярной массы) молекулы и концентрации, - есть возможность
определения молекулярной массы растворенного вещества при помощи вязкости.
Зависимость вязкости от концентрации раствора
уравнение Марка ‒ Хаувинка
k ‒ константа, характерная для типового ряда макромолекул; α ‒ величина, характеризующая степень свёртывания макромолекул в растворе.
Слайд 482. Методы исследования дисперсных систем
Методы вискозиметрии
Для жёстких макромолекул, имеющих форму
палочек, α = 1.
Для гибких макромолекул, имеющих форму, близкую
к сферической, α = 0,5.
Производя вискозиметрические измерения, можно по уравнению Марка ‒ Хаувинка вычислить молекулярную массу ВМС и оценить форму макромолекул.
На вязкость ВМС растворов оказывают влияние многие факторы, в том числе концентрация растворов, температура, время, способ приготовления
растворов, рН среды.