Слайд 1Лекции №2-3 Элементы ядерной физики.
Основные разделы лекции
1.
Строение ядра. Элементарные частицы. Нуклоны.
2. Масса ядра и
энергия связи.
3. Причины неустойчивости ядер.
4. Радиоактивность, единицы радиоактивности.
5. Основной закон радиоактивного распада.
6. Следствия из закона р.а. распада
7. Определение периодов полураспада
Слайд 21. Основные свойства ядер
. Размер, состав и заряд атомного ядра.
Массовое
и зарядовое число
Ядро - центральная массивная часть атома, в
которой сосредоточена почти вся масса атома (более 99,95%). Размеры ядер составляют порядка 10-15 ÷ 10-14 м.
Ядра имеют положительный заряд, кратный элементарному заряду е.
Ядро состоит из протонов и нейтронов (?)
Слайд 32. Элементарные частицы
После открытия протона (1919) и нейтрона (1932) возникла
протонно-нейтронная теория строения ядер, согласно которой атомное ядро включает только
два типа частиц — нейтроны и протоны.
В 1932 г. Гейзенберг : в связи с близостью масс протона и нейтрона ( mp = 938,3 МэВ, а mn = 939,6 МэВ) предположил, что протон и нейтрон — различные состояния одной и той же частицы, названной им нуклоном.
Слайд 4 Было показано. что ядро представляет собой на
самом деле динамичную систему разнообразных частиц, скоротечное образование которых, а
также их взаимодействие и распад играют ключевую роль в ядерных процессах.
Эти частицы получили название элементарных частиц. В первоначальном смысле элементарные частицы представлялись как частицы, которые нельзя считать состоящими из других частиц.
Слайд 5В настоящее время известно более 300 элементарных частиц, большинство их
которых являются составными системами.
Элементарные частицы делятся на две группы:
адроны (от греческого hadros - «большой») и лептоны ( от греческого leptos, что значит «маленький»).
Адроны делятся на барионы (от греческого barys — «тяжелый») и мезоны (от греческого mesos — «средний»). К числу барионов относятся гипероны и нуклоны.
Множество элементарных частиц
Слайд 6Нуклоны - общее название протонов и нейтронов, являющихся основными составляющими
атомных ядер.
К классу лептонов относятся электрон и нейтрино.
фотон
- не входит ни в одну из этих групп.
Практически каждая элементарная частица имеет свою античастицу.
Для объяснения явления радиоактивного распада достаточно рассмотреть : электрон, нейтрон, протон, нейтрино. античастицы, а также фотоны.
Слайд 7Свойства нуклонов
Масса. В ядерной физике, масса ядер и атомов измеряется
в атомных единицах массы (а.е.м.) - 1/12 часть массы атома
улерода-12.
1а.е.м.= 1.660∙10-24 г =1.660∙10-27 кг.
Электрон считается материальным носителем наименьшей массы в природе: me= 9,1∙10-28 г (в энергетических единицах 0,511 МэВ)
Энергия. I эВ = 1,6 . I0-12 эрг = 1,6 . 10 -19 Дж
I а.е.м. = 1,660 · 10-27 · (3 · 108)2 = 1,49 · 10-10Дж = 931,5 МэВ
Слайд 8
Протон (от греческого protos - первый) - одна из двух
стабильных элементарных частиц.
Протон обозначают символом "р", он имеет следующие
характеристики.
mр=1,672614*10 -27 кг =938,28МэВ=1836 me
здесь me - масса электрона.
Слайд 9Заряд протона - равен элементарному: q(p)=e=1.6021892*10-19 Кл.
Электрический заряд нейтрона равен
нулю. Масса нейтрона mn=1.6749543*10-27 кг=
1.008665 а.е.м. =939,57МэВ=
1838.6me
Так как масса нейтрона больше массы протона, то он нестабилен и распадается в свободном состоянии.
Слайд 10Протоны и нейтроны получили общее название нуклонов, т.е. ядерных частиц.
Общее
число нуклонов в ядре означается буквой А и называется массовым
числом ядра.
Число нейтронов в ядре обозначают буквой N.
Число протонов в ядре -буквой Z,
Число нейтронов : N= A-Z
Слайд 11 Совокупность атомов, имеющих одинаковый заряд ядра, называется химическим
элементом.
Совокупность атомов, ядра которых имеют данное число
протонов и нейтронов называют нуклидом.
Для однозначной характеристики нуклидов необходимо указывать заряд ядра Z и массовое число А (например: , и т.д.).
Слайд 12Различают следующие группы нуклидов:
нуклиды, имеющие одинаковое число протонов, т.е.
нуклиды одного и того же элемента называют изотопами (например:Ra-226, Ra-222);
нуклиды,
имеющие одинаковое число нуклонов - изобары ( Sr-90 и Y-90 );
нуклиды, имеющие одинаковое число протонов и нуклонов и отличающиеся только энергией связи ядра называют изомерами.
Слайд 13Масса ядра и энергия связи
Масса ядра отличается от суммы масс
свободных нейтронов и протонов, входящих в состав ядра.
Дефект масс
- Δm= [Z∙mP + (A-Z)mn – mя ]
Энергия соответствующая этой разности масс, называется энергией связи ядра:
ΔЕ= Δm∙C2=[Z∙mP + (A-Z)mn – mя ]∙C2
ΔЕсв= [Z∙mP + (A-Z)mn – mя ]∙931 (МэВ)
931-энергия в МэВ, эквивалентная 1 а.е.м.
Слайд 14Энергия связи - это та энергия, которую необходимо затратить, чтобы
разделить ядро на составляющие его нуклоны и удалить нуклоны друг
от друга на такое расстояние, где они не взаимодействуют друг с другом.
Для характеристики устойчивости ядра удобно использовать энергию связи ядра приходящуюся на один нуклон: εсв= ΔЕсв/А – удельная энергия связи
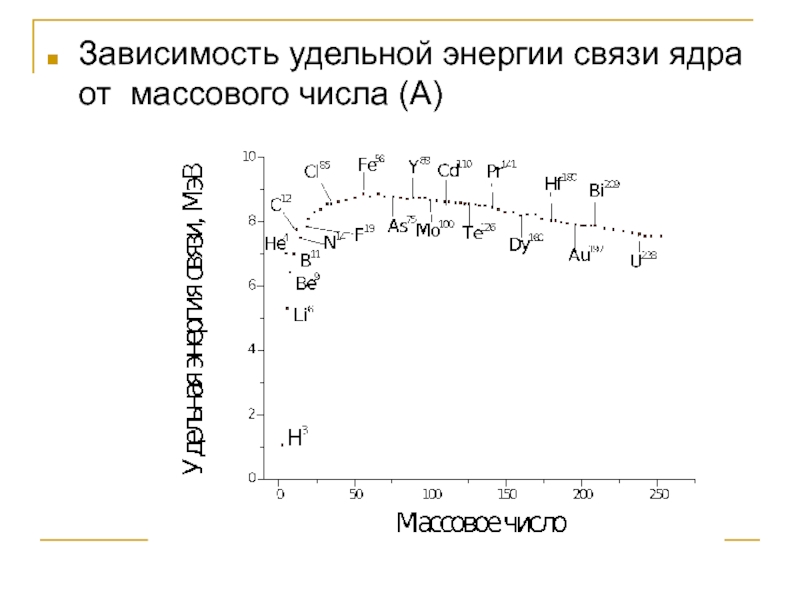
Слайд 15Зависимость удельной энергии связи ядра от массового числа (А)
Слайд 16Величина удельной энергии связи для большинства ядер лежит в пределах
6-8 МэВ.
Так почему же ядра распадаются?
Простой
подход к объяснению устойчивости.
Устойчивость ядер зависит от соотношения чисел протонов и нейтронов Сравнение εсв с np/nn :
1. Неустойчивость ядер связана с неравновесным значением np/nn в этих ядрах.
2. Наибольшую энергию связи имеют ядра середины периодической таблицы.
Четно-нечетные ядра более устойчивы.
Из нечетно-нечетных ядер стабильны только:
H-2, Li-6, B-10, N-14.
Слайд 17Наряду с рассмотренным выше подходом к рассмотрению устойчивости ядер, существует
и другой (упрощенный) подход к объяснению их устойчивости и неустойчивости.
При этом кроме энергии связи ядра относительно всех его нуклонов ввели в рассмотрение энергию связи ядра относительно каких-либо других составных частей. Оказалось, что в некоторых случаях энергия связи ядра, рассчитанная по отношению к каким-либо составным частям, становится малой, а нередко и отрицательной.
Слайд 18Так, например, энергия связи 9Be относительно всех 9 нуклонов приблизительно
равна 58 МэВ, тогда как энергия связи данного ядра по отношению
к его распаду на 2 ядра гелия и нейтрон равна всего 2 МэВ.
А энергия связи ядра урана-238 рассчитанная по отношению к торию-234 и альфа-частице –отрицательная величина;
ΔЕсв = [m(Th-234)+ m(He-4) – m(U-238)]∙931= - 4.25 МэВ.
Ядро урана - система неустойчивая, кроме того при распаде должна выделяться энергия.
Слайд 19Общие сведения о радиоактивности.
Радиоактивность есть свойство ядер атомов к
самопроизвольному распаду, получившему название радиоактивный распад.
Единицы измерения количества радиоактивного
вещества:
1. Мг-эквивалент радия- количество радия в радиевых препаратах.
Слайд 202. Для измерения количества радона, образующегося при распаде радия, была
установлена единица Кюри - количество радона, находящегося в радиоактивном равновесии
с одним граммом радия.
Позже: 1Кюри- количество любого элемента, находящегося в равновесии с 1 г. радия.
Еще позже: Кюри - количество любого радиоактивного нуклида, в котором происходит 3,7.1010 актов распада за секунду.
Слайд 21 В1962 году Кюри определили как единицу активности радионуклида, а
не его количества.
Активность (А) радионуклида определяется как отношение числа
спонтанных ядерных превращений нуклида dN, происходящих в данном источнике за интервал времени dt, к этому интервалу:
А = dN / dt.
Единицей измерения активности в международной системе единиц (СИ) является одно ядерное превращение в секунду, называемая Беккерель, Бк.
Слайд 222. Основной закон радиоактивного распада.
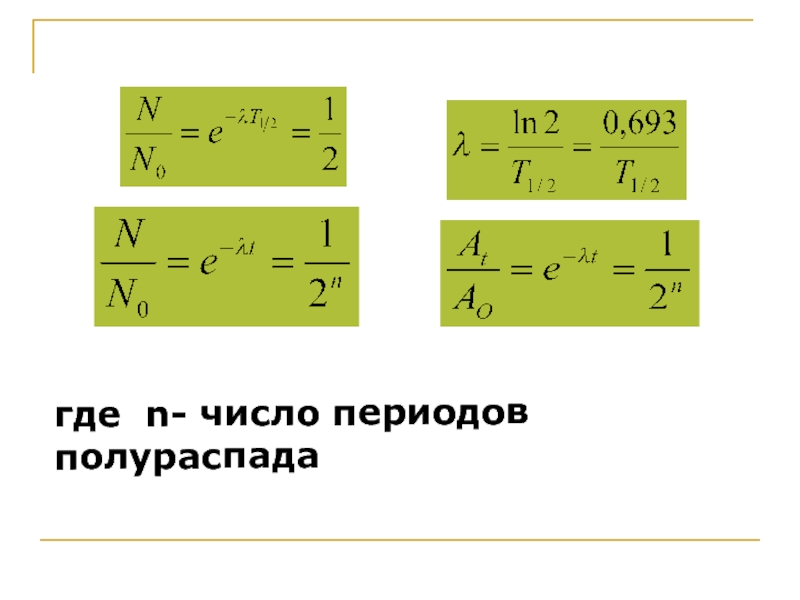
Экспериментально было установлено, что число
радиоактивных атомов данного радионуклида уменьшается со временем по экспоненциальному закону
в интегральной форме:
Слайд 23Или в дифференциальной форме:
где N(o) -
количество радиоактивных атомов в начальный момент времени ( t=0 ),
N(t)- число ядер в момент времени t;
а - постоянная распада, характеризующая скорость уменьшения числа радиоактивных ядер, с-1. Знак “ – “указывает на то, что в ходе распада количество радиоактивного вещества убывает.
Слайд 24 Постоянная распада является паспортной характеристикой радионуклида; на ее
величину не влияют внешние условия и химическая форма состояния вещества
практически для всех типов распада. Исключение составляет электронный захват.
Второй важной характеристикой любого радионуклида является период полураспада- время, в течение которого распадается половина атомов радиоактивного препарата, Связь между периодом полураспада и постоянной распада выражается:
Слайд 25 Третья характеристика радиоактивных ядер:
Среднее время жизни радиоактивного
ядра равно величине, обратной от постоянной распада , т.е.
за это время начальное число ядер уменьшается в e раз.
Слайд 26 Ранее было показано, что А = dN /
dt. Тогда, активность A образца - это среднее количество ядер
образца, распадающихся в единицу времени, тогда
Уменьшение абсолютной активности также подчиняется экспоненциальному закону:
Слайд 273. Следствия из закона р.а. распада
1. Можно показать, что
при n=10T1/2
A(t)= 0,001A(0), т.е.0.1%.Отсюда следует так называемое правило
десяти периодов полураспада, т.е. промежутка времени, за который распадается практически все вещество. Однако остаточное количество радиоактивных ядер, равно как и остаточная активность по истечении 10T1/2 зависит от их начальных значений.
Слайд 28
где n- число периодов полураспада
Слайд 292 Следствие. Из уравнения A=λN можно получить уравнение, связывающее массу
радионуклида с его активностью и периодом полураспада.
Слайд 304. Определение периода полураспада
4.1. Определение периода полураспада долгоживущего нуклида.
Если период полураспада радиоактивного нуклида настолько велик, что за время
исследования активность препарата практически не меняется, то для нахождения периода полураспада используют приведенное выше уравнение.
Слайд 31Определение периодов полураспада короткоживущих нуклидов
Методы определения периодов полураспада, лежащих
в интервале от нескольких минут до нескольких месяцев или даже
лет основаны на использовании интегральной формы основного закона радиоактивного распада: N=No∙e-λt
Слайд 32В строго постоянных условиях через некоторые промежутки времени определяют регистрируемую
активность препарата (скорость счета).
Измерения продолжают до тех пор, пока
активность не уменьшится, по крайней мере, в 2 раза.
По результатам измерений строят график в полулогарифмических координатах, откладывая по оси абсцисс время t, прошедшее с момента начала измерений, а по оси ординат — логарифм регистрируемой активности lgIt (целесообразно применять полулогарифмическую бумагу).
Слайд 33 Если в исследуемом препарате присутствует только один радиоактивный
изотоп, то график зависимости lgIt от t будет представлять собой
прямую линию. Действительно, логарифмируя уравнение It= I0∙exp(-λt), получим:
lgIt=lgI0-0.4343λt
Для того, чтобы по графику определить период полураспада, надо отложить по оси ординат отрезок, численно равный lg2, и найти на оси абсцисс отрезок, соответствующий Т1/2.