Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 14. СИНТЕЗ НАНОМАТЕРИАЛОВ НА ГРАНИЦАХ РАЗДЕЛА ЖИДКОСТЬ – ЖИДКОСТЬ И
Содержание
- 1. Лекция 14. СИНТЕЗ НАНОМАТЕРИАЛОВ НА ГРАНИЦАХ РАЗДЕЛА ЖИДКОСТЬ – ЖИДКОСТЬ И
- 2. Схема строения границ раздела двух жидкостейγ –
- 3. Ujjal K. Gautam, Moumita Ghosh и др.
- 4. Ujjal K. Gautam, Moumita Ghosh и др.,
- 5. Одной из проблем получения нанослоев на границе
- 6. Фазовое состояние локализованного на границе раздела монослоязависит
- 7. НЕРАСТВОРИМОЕ ПАВ НА ПОВЕРХНОСТИ ВОДЫ.
- 8. Строение молекулыПАВ имеют несимметричное строение молекулы, которая
- 9. ИЗМЕНЕНИЕ ДАВЛЕНИЯ В СЛОЕ В ЗАВИСИМОСТИ ОТ
- 10. БЛОК-СХЕМА УСТАНОВКИ ДЛЯ СИНТЕЗА СЛОЕВ МЕТОДОМ Л.-Б.
- 11. Особенности установки для синтезаТермостабилизация осуществляется циркуляцией воды
- 12. АBСПОСОБЫ ПЕРЕНЕСЕНИЯ СЛОЯ ПАВ С ГРАНИЦЫ РАЗДЕЛА
- 13. ТРИ РАЗЛИЧНЫХ ТИПА ПЛЕНОК Л.-Б.
- 14. СИНТЕЗ НАНОЧАСТИЦ СУЛЬФИДОВ МЕТАЛЛОВ МЕТОДОМ Л.-Б.Соль металла
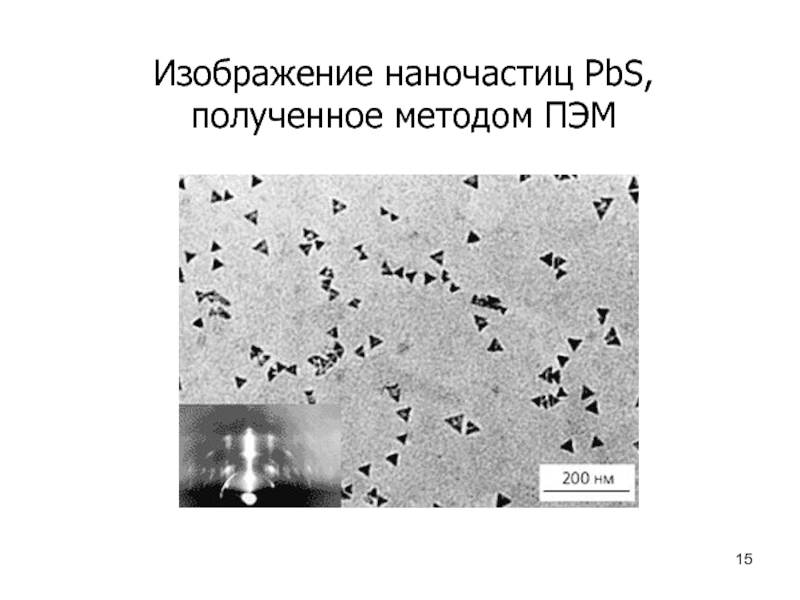
- 15. Изображение наночастиц PbS, полученное методом ПЭМ
- 16. ИЗОБРАЖЕНИЕ ВАННЫ Л.-Б. С НАНЕСЕННЫМ НА ПОВЕРХНОСТЬ
- 17. НАНОКОМПОЗИТ, ПОЛУЧЕННЫЙ МЕТОДОМ Л.-Б. ИЗ ПАВ (DODAB) И КОЛЛОИДНОГО РАСТВОРА НАНОПЛОСКОСТЕЙ HxTiOy.nH2O
- 18. СХЕМА СИНТЕЗА МЕТОДОМ Л.-Б. СЛОЯ, СОДЕРЖАЩЕГО ЛИГАНД
- 19. СХЕМА, ПОКАЗЫВАЮЩАЯ ПЕРЕХОД КОЛЛОИДНЫХ ЧАСТИЦ РАСТВОРА НА
- 20. СТАДИИ НАНЕСЕНИЯ НА ПОДЛОЖКУ МЕТОДОМ Л.-Б. СЛОЕВ,
- 21. Синтез монослоев серебра методом Л.-Б.Количество монослоевИзменение массы мг/см2Изображение монослоя нанопроволок Ag
- 22. МОРФОЛОГИЯ СЛОЕВ, СОДЕРЖАЩИХ НАНОЧАСТИЦЫ, ЗАВИСИТ ОТ УГЛА
- 23. ИЗОБРАЖЕНИЯ СЛОЕВ КОЛЛОИДНЫХ ЧАСТИЦ WO3 НА ПОВЕРХНОСТИ
- 24. ПРИМЕР СИНТЕЗА МУЛЬТИСЛОЯ, СОДЕРЖАЩЕГО СТЕАРИЛ АМИН, АРАХИДАТ
- 25. СЛОЙ КОЛЛОИДНЫХ ЧАСТИЦ SiO2, ПОЛУЧЕННЫЙ МЕТОДОМ Л.-Б.
- 26. C12- додекантиолСИНТЕЗ СЛОЯ CdS C ФУНКЦИОНАЛЬНЫМИ ГРУППАМИ
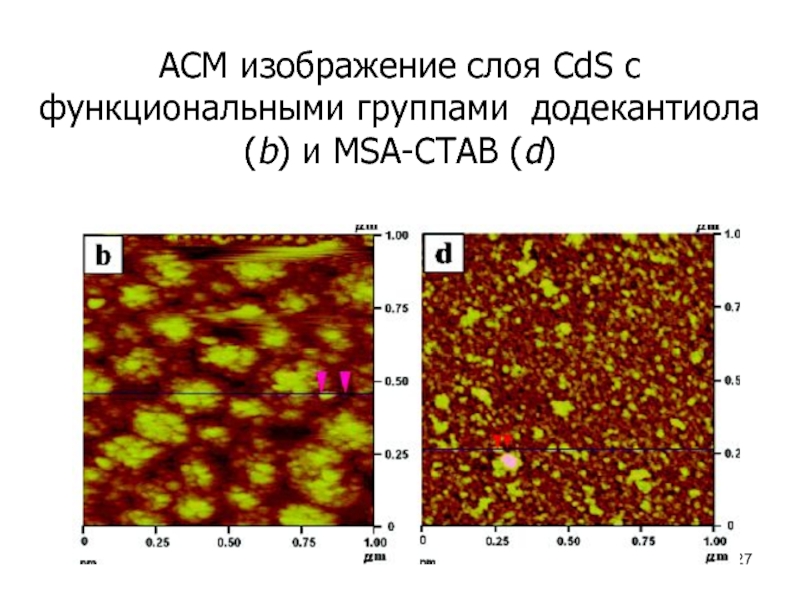
- 27. АСМ изображение слоя CdS c функциональными группами додекантиола (b) и MSA-CTAB (d)
- 28. СИНТЕЗ 3D КОЛЛОИДНЫХ КРИСТАЛЛОВ SiO2Коллоидные частицы SiO2
- 29. Применение пленок Л.-Б. для получения наностержней SiСтадии
- 30. ИЗОБРАЖЕНИЕ ЭЛЕКТРОФИЗИЧЕСКОГО УСТРОЙСТВА, СОДЕРЖАЩЕГО СЛОЙ Ленгмюра -
- 31. Скачать презентанцию
Слайды и текст этой презентации
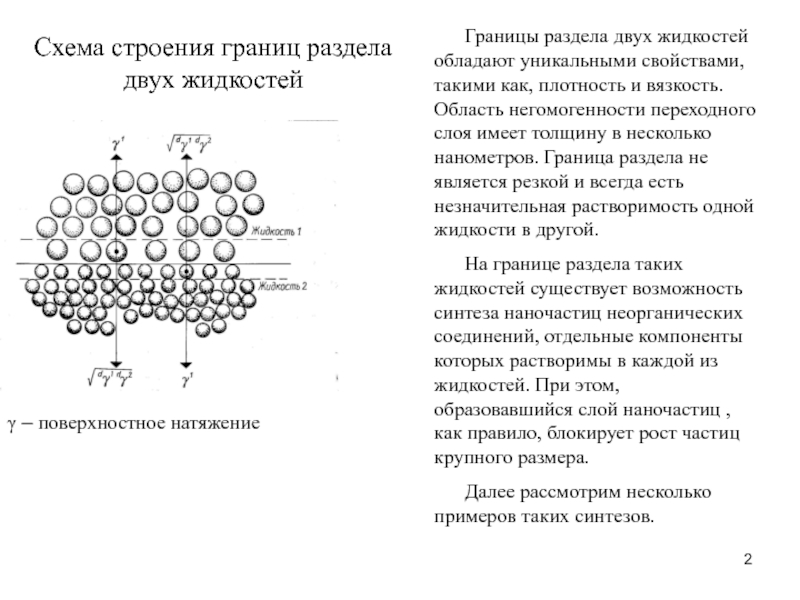
Слайд 2Схема строения границ раздела двух жидкостей
γ – поверхностное натяжение
Границы раздела
двух жидкостей обладают уникальными свойствами, такими как, плотность и вязкость.
Область негомогенности переходного слоя имеет толщину в несколько нанометров. Граница раздела не является резкой и всегда есть незначительная растворимость одной жидкости в другой.На границе раздела таких жидкостей существует возможность синтеза наночастиц неорганических соединений, отдельные компоненты которых растворимы в каждой из жидкостей. При этом, образовавшийся слой наночастиц , как правило, блокирует рост частиц крупного размера.
Далее рассмотрим несколько примеров таких синтезов.
Слайд 3Ujjal K. Gautam, Moumita Ghosh и др. Chemical Physics Letters
381 (2003) 1–6
Как показывают эксперименты, размер наночастиц, сформированных на границе,
контролируется концентрацией и составом реагентов, температурой, вязкостью растворов и временем реакции. Слои CdS (a) и гамма-Fe2O3 (б), сформированные на границе раздела толуол-вода
ТЕМ изображения слоев CdS, полученных в результате реакции в течение 12 часов 1 mM раствора Cd(cup)2 и 2 mM р-ра Na2S (a) и 2,5 mM р-ра Cd стеарата и 5 mM р-ра Na2S (б).
ТЕМ изображение слоя гамма-Fe2O3, полученного при комнатной температуре с использование 0,17 mM раствора Fe(cup)3 в толуоле и 4 N раствора NaOH. Шкала - 10 нм.
Сd(cup)2 в толуоле + Na2S (или NaOH) в воде CdS (Fe2O3)
Cd(cup)2 = Cd(C6H5N2O2)2
Слайд 4Ujjal K. Gautam, Moumita Ghosh и др., Langmuir, Vol. 20,
No. 25, 2004, 10778
СИНТЕЗ СЛОЕВ МОНОКРИСТАЛЛОВ CuO и CuS
НА ГРАНИЦЕ РАЗДЕЛА ЖИДКОСТЬ-ЖИДКОСТЬCu(cup)2 в толуоле + Na2S (или NaOH) в воде CuS (CuO)
ТЕМ изображение слоя CuS, полученного на границе 0,12 mM раствора Cu(cup)2 и 0,5 mM раствора Na2S, t = 25oC.
ТЕМ изображение слоя CuO, полученного на границе 0,18 mM раствора Cu(cup)2 и 0,75 N раствора NaOH, t = 70oC.
После 1 часа реакции на границе раздела слои были аморфные, а после 12 часов - кристаллические. Степень “кристалличности” увеличивается также с возрастанием концентрации реагентов.
Толщина пленки на границе раздела составляла 40 - 60 нм.
Слайд 5Одной из проблем получения нанослоев на границе раздела двух сред
является их перемещение после реакции на границе на поверхность подложки.
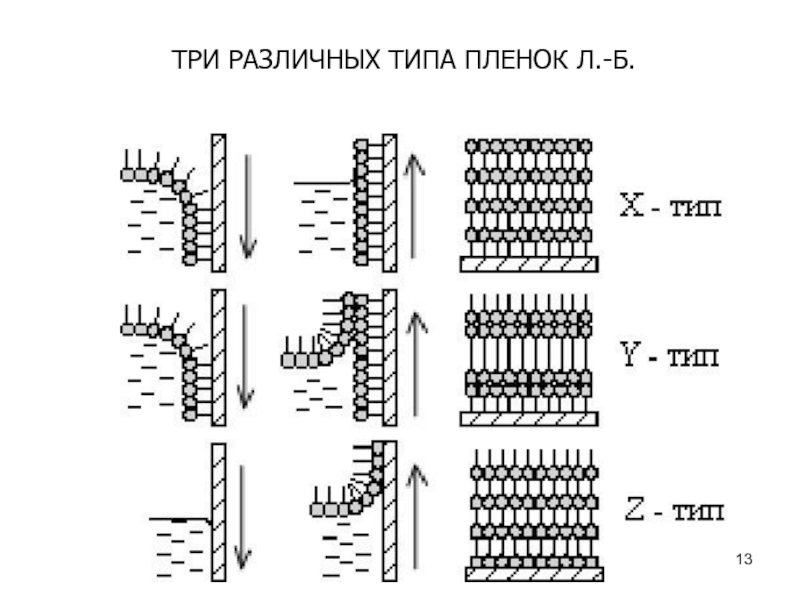
Один из вариантов такого перемещения основан на методе Ленгмюра - Блоджетт.В начале 30-х годов К. Блоджетт осуществила перенос мономолекулярных пленок нерастворимых жирных кислот на поверхность твердой подложки, получив таким образом мультислойные пленки.
Подход Блоджетт, основанный на методике Ленгмюра, получил название технологии Ленгмюра-Блоджетт, а полученные таким способом пленки – пленки Ленгмюра-Блоджетт.
Особенностью метода Ленгмюра-Блоджетт является то, что сплошной упорядоченный мономолекулярный слой предварительно формируется на поверхности жидкости и впоследствии переносится на поверхность подложки
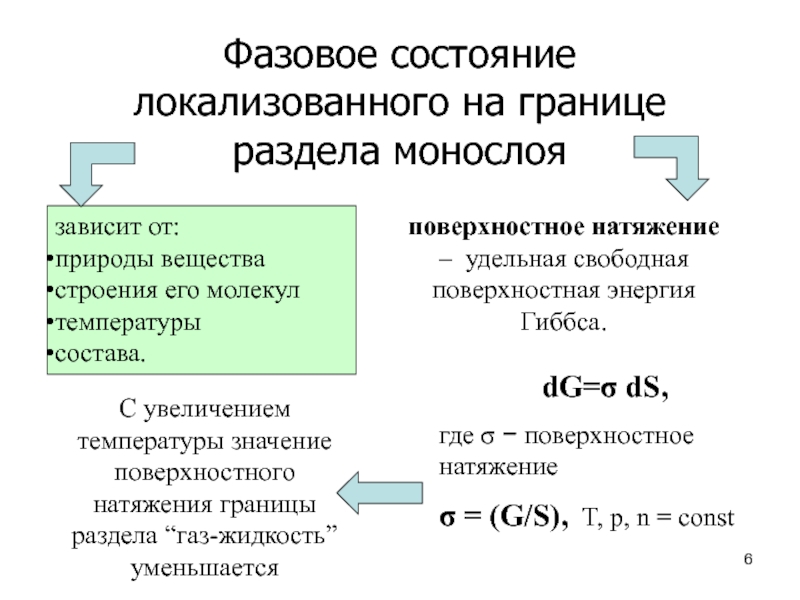
Слайд 6Фазовое состояние локализованного на границе раздела монослоя
зависит от:
природы вещества
строения
его молекул
температуры
состава.
поверхностное натяжение – удельная свободная поверхностная энергия
Гиббса. dG=s dS,
где s - поверхностное натяжение
s = (G/S), T, p, n = const
С увеличением температуры значение поверхностного натяжения границы раздела “газ-жидкость” уменьшается
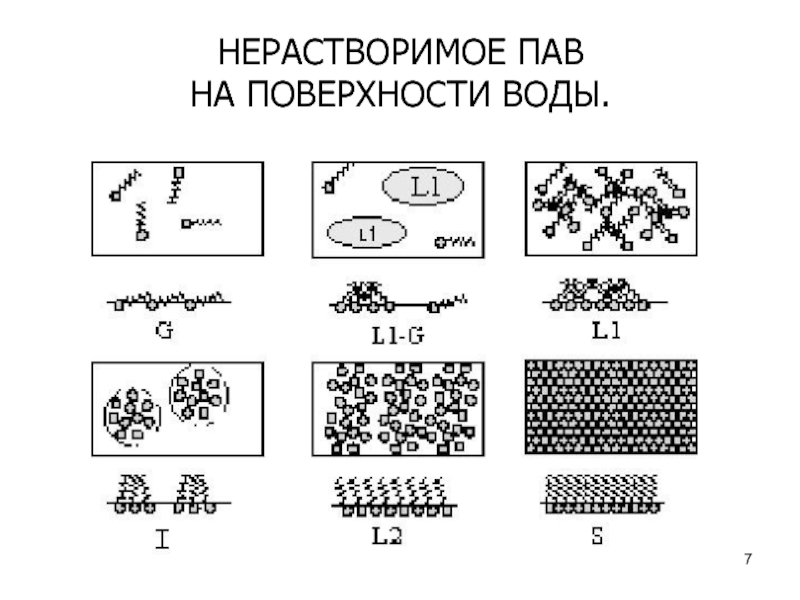
Слайд 8Строение молекулы
ПАВ имеют несимметричное строение молекулы, которая состоит из полярных
и неполярных групп.
Полярная группа обладает дипольным моментом и имеет
сродство к полярной фазе. Полярными свойствами обладают группы –COOH, –OH,–NH2, –CHO и др.
Неполярная часть молекулы ПАВ представляет собой гидрофобную углеводородную цепь (радикал).
ПАВ – вещества, присутствие которых на границе раздела приводит к уменьшению поверхностного натяжения
Молекулы ПАВ самопроизвольно образуют ориентированный монослой на поверхности раздела фаз в соответствии с условием уменьшения энергии Гиббса системы: полярные группы располагаются в водной (полярной) фазе, а гидрофобные радикалы вытесняются из водной среды и переходят в менее полярную фазу – воздух.
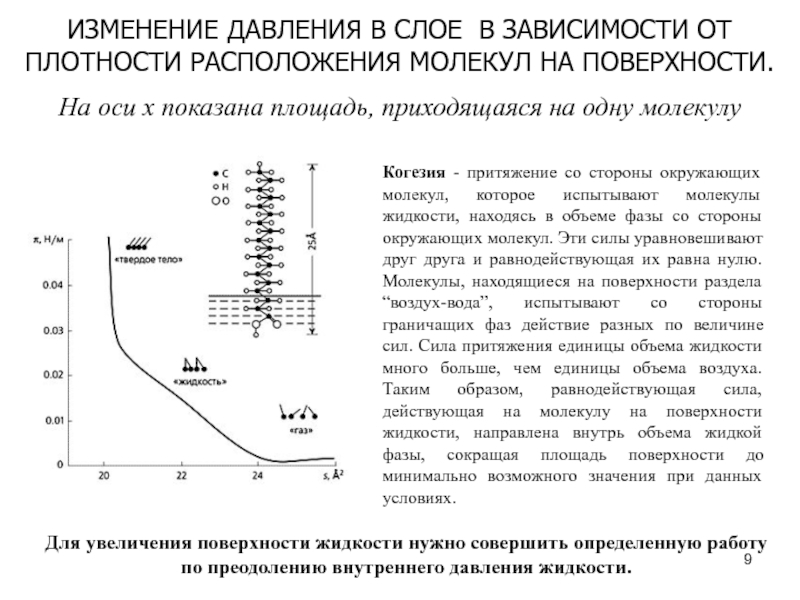
Слайд 9ИЗМЕНЕНИЕ ДАВЛЕНИЯ В СЛОЕ В ЗАВИСИМОСТИ ОТ ПЛОТНОСТИ РАСПОЛОЖЕНИЯ МОЛЕКУЛ
НА ПОВЕРХНОСТИ.
На оси x показана площадь, приходящаяся на одну молекулу
Когезия - притяжение со стороны окружающих молекул, которое испытывают молекулы жидкости, находясь в объеме фазы со стороны окружающих молекул. Эти силы уравновешивают друг друга и равнодействующая их равна нулю. Молекулы, находящиеся на поверхности раздела “воздух-вода”, испытывают со стороны граничащих фаз действие разных по величине сил. Сила притяжения единицы объема жидкости много больше, чем единицы объема воздуха. Таким образом, равнодействующая сила, действующая на молекулу на поверхности жидкости, направлена внутрь объема жидкой фазы, сокращая площадь поверхности до минимально возможного значения при данных условиях.
Для увеличения поверхности жидкости нужно совершить определенную работу по преодолению внутреннего давления жидкости.
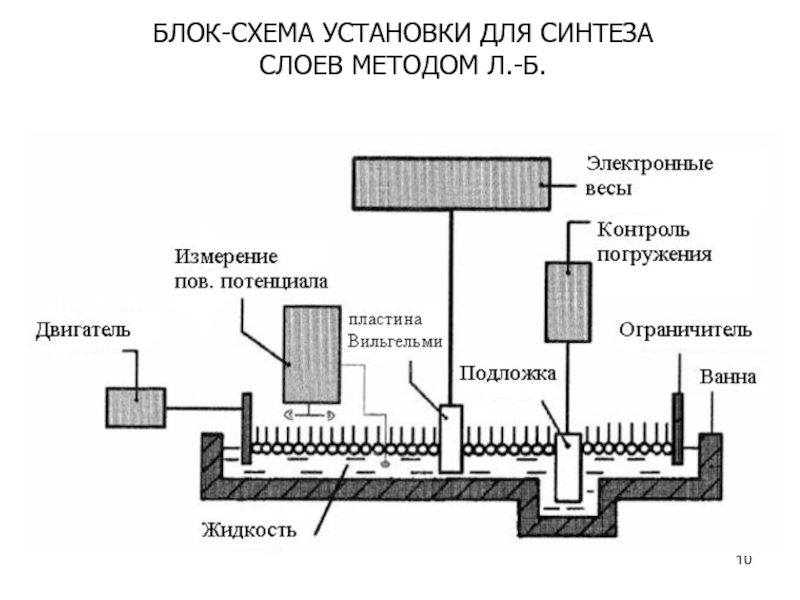
Слайд 11Особенности установки для синтеза
Термостабилизация осуществляется циркуляцией воды по системе каналов
находящихся под дном ванны.
Установка располагается на виброзащитном основании в
специализированном помещенииДля измерения поверхностного давления в монослое в современных установках Ленгмюра-Блоджетт используется датчик поверхностного давления – электронные весы Вильгельми.
Действие датчика основано на принципе измерения усилия необходимого для компенсации воздействия на пластинку Вильгельми силы поверхностного давления в монослое на границе раздела “субфаза-газ”
Основные блоки установки:
емкость - ванна,
поверхностные барьеры, движущиеся встречно согласованно по краям ванны,
электронные весы Вильгельми для измерения величины поверхностного давления в монослое,
устройство перемещения подложки.
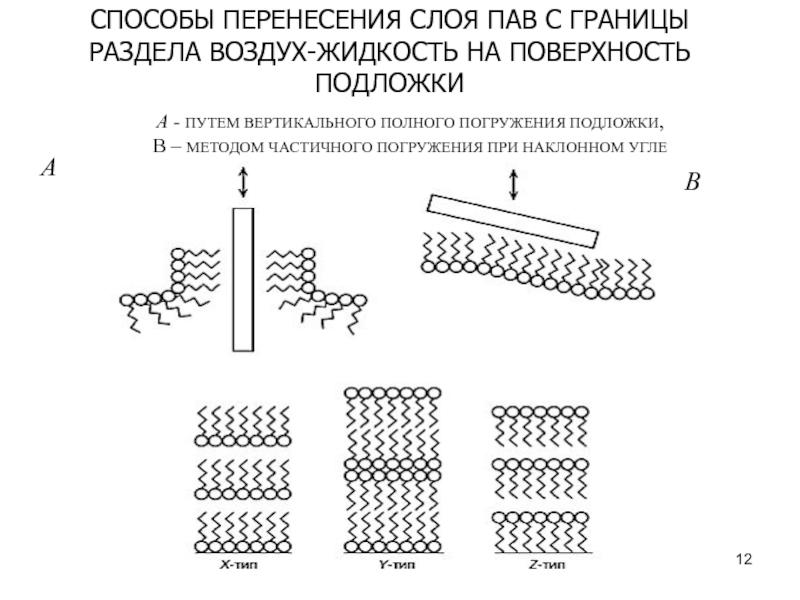
Слайд 12А
B
СПОСОБЫ ПЕРЕНЕСЕНИЯ СЛОЯ ПАВ С ГРАНИЦЫ РАЗДЕЛА ВОЗДУХ-ЖИДКОСТЬ НА ПОВЕРХНОСТЬ
ПОДЛОЖКИ
А - ПУТЕМ ВЕРТИКАЛЬНОГО ПОЛНОГО ПОГРУЖЕНИЯ ПОДЛОЖКИ,
B – МЕТОДОМ
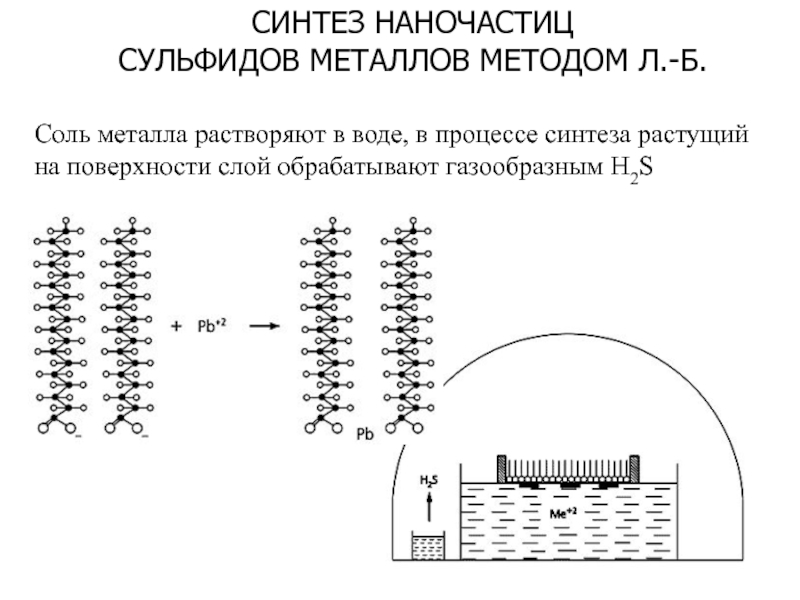
ЧАСТИЧНОГО ПОГРУЖЕНИЯ ПРИ НАКЛОННОМ УГЛЕСлайд 14СИНТЕЗ НАНОЧАСТИЦ
СУЛЬФИДОВ МЕТАЛЛОВ МЕТОДОМ Л.-Б.
Соль металла растворяют в воде,
в процессе синтеза растущий на поверхности слой обрабатывают газообразным H2S
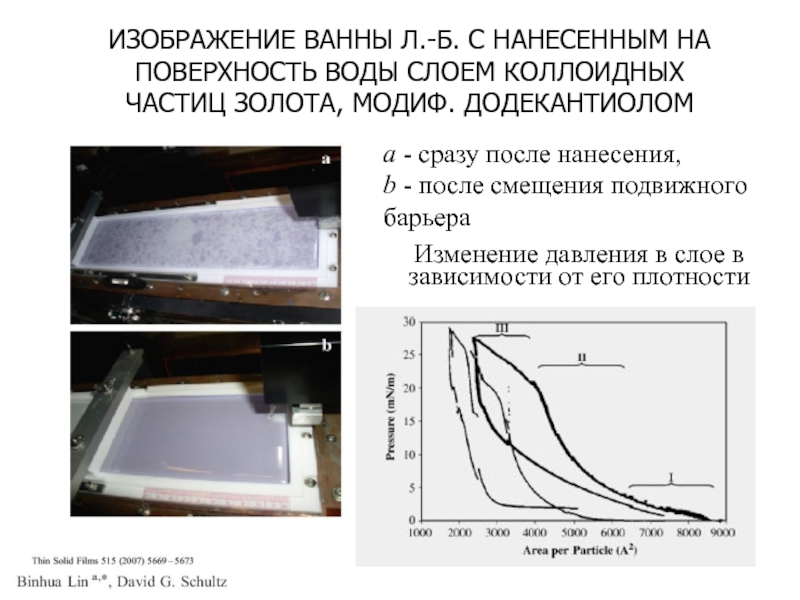
Слайд 16ИЗОБРАЖЕНИЕ ВАННЫ Л.-Б. С НАНЕСЕННЫМ НА ПОВЕРХНОСТЬ ВОДЫ СЛОЕМ КОЛЛОИДНЫХ
ЧАСТИЦ ЗОЛОТА, МОДИФ. ДОДЕКАНТИОЛОМ
a - сразу после нанесения,
b -
после смещения подвижного барьера Изменение давления в слое в зависимости от его плотности
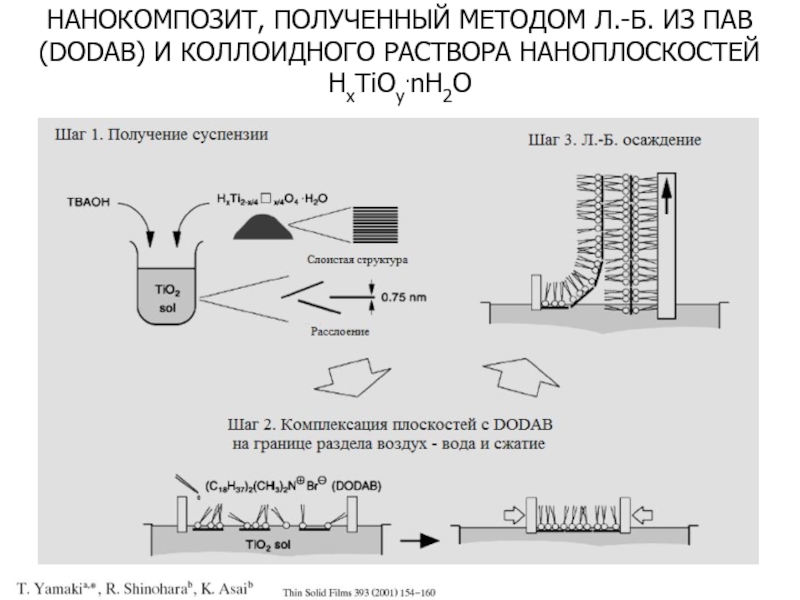
Слайд 17НАНОКОМПОЗИТ, ПОЛУЧЕННЫЙ МЕТОДОМ Л.-Б. ИЗ ПАВ (DODAB) И КОЛЛОИДНОГО РАСТВОРА
НАНОПЛОСКОСТЕЙ HxTiOy.nH2O
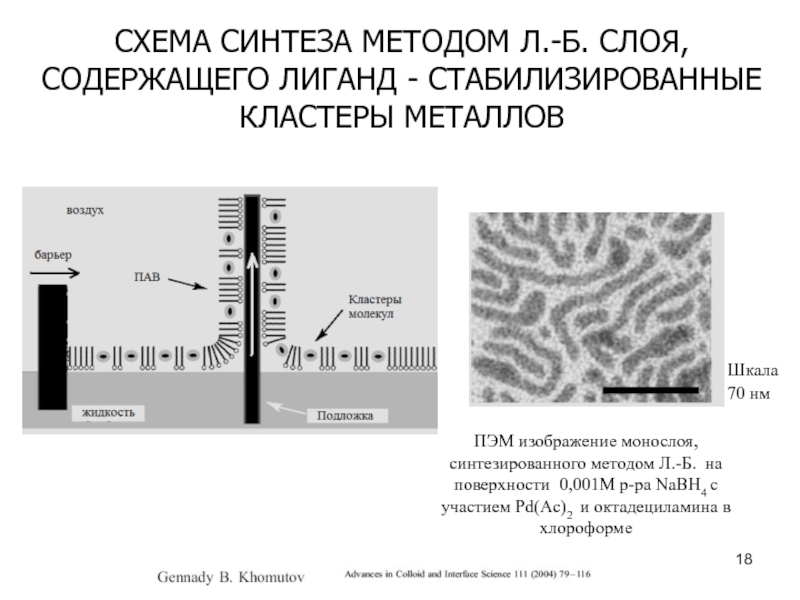
Слайд 18СХЕМА СИНТЕЗА МЕТОДОМ Л.-Б. СЛОЯ, СОДЕРЖАЩЕГО ЛИГАНД - СТАБИЛИЗИРОВАННЫЕ КЛАСТЕРЫ
МЕТАЛЛОВ
ПЭМ изображение монослоя, синтезированного методом Л.-Б. на поверхности 0,001М р-ра
NaBH4 c участием Pd(Ac)2 и октадециламина в хлороформе Шкала
70 нм
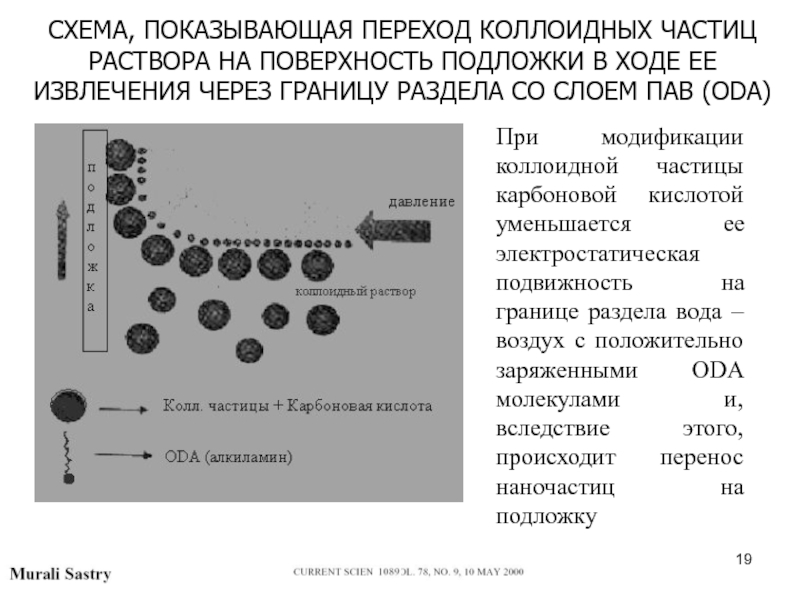
Слайд 19СХЕМА, ПОКАЗЫВАЮЩАЯ ПЕРЕХОД КОЛЛОИДНЫХ ЧАСТИЦ РАСТВОРА НА ПОВЕРХНОСТЬ ПОДЛОЖКИ В
ХОДЕ ЕЕ ИЗВЛЕЧЕНИЯ ЧЕРЕЗ ГРАНИЦУ РАЗДЕЛА СО СЛОЕМ ПАВ (ODA)
При
модификации коллоидной частицы карбоновой кислотой уменьшается ее электростатическая подвижность на границе раздела вода – воздух с положительно заряженными ODA молекулами и, вследствие этого, происходит перенос наночастиц на подложкуСлайд 20СТАДИИ НАНЕСЕНИЯ НА ПОДЛОЖКУ МЕТОДОМ Л.-Б. СЛОЕВ, СОСТОЯЩИХ ИЗ НАНОПРОВОЛОК
СЕРЕБРА
A – На поверхность нанесена суспензия нанопроволок серебра в CCl4,
B
– При смещении барьера на поверхности воды образован плотный слой,С – Монослой переносится на подложку
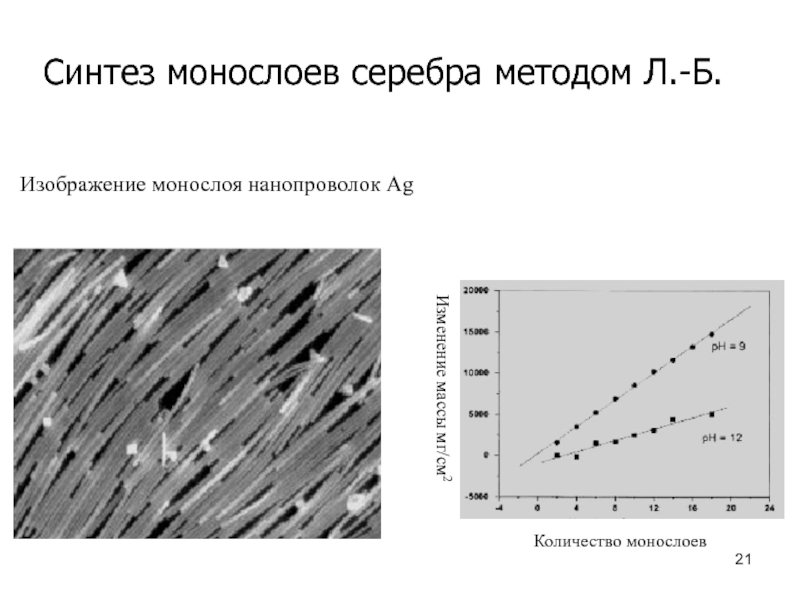
Слайд 21Синтез монослоев серебра методом Л.-Б.
Количество монослоев
Изменение массы мг/см2
Изображение монослоя нанопроволок
Слайд 22МОРФОЛОГИЯ СЛОЕВ, СОДЕРЖАЩИХ НАНОЧАСТИЦЫ, ЗАВИСИТ ОТ УГЛА ИЗВЛЕЧЕНИЯ ПОДЛОЖКИ ИЗ
ВОДЫ
Монослой Co-Pt наночастиц, полученных на поверхности монокристаллического Si при
различных углах наклона подложкиОт угла наклона подложки
От температуры раствора и среды
От давления
От состава и рН растворов
Морфология слоев, полученных методом Л.-Б. зависит от условий синтеза:
Слайд 23ИЗОБРАЖЕНИЯ СЛОЕВ КОЛЛОИДНЫХ ЧАСТИЦ WO3 НА ПОВЕРХНОСТИ СТЕКЛА, ПОЛУЧЕННЫХ ПРИ
РАЗЛИЧНЫХ ДАВЛЕНИЯХ СЖАТИЯ СЛОЕВ
a- π = 14,0 mN/m, b -
16,5, c - 18,7, d - 27,3 mN/mСлайд 24ПРИМЕР СИНТЕЗА МУЛЬТИСЛОЯ, СОДЕРЖАЩЕГО СТЕАРИЛ АМИН, АРАХИДАТ СВИНЦА И НАНОЧАСТИЦЫ
СЕРЕБРА
Синтез гибридного мультислоя методом Ленгмюра - Блоджетт
Слайд 25СЛОЙ КОЛЛОИДНЫХ ЧАСТИЦ SiO2, ПОЛУЧЕННЫЙ МЕТОДОМ Л.-Б. НА ПОВЕРХНОСТИ ПОДЛОЖКИ
ИЗ МОНОКРИСТАЛЛИЧЕСКОГО КРЕМНИЯ
Одно из важнейших преимуществ метода Ленгмюра – Блоджетт
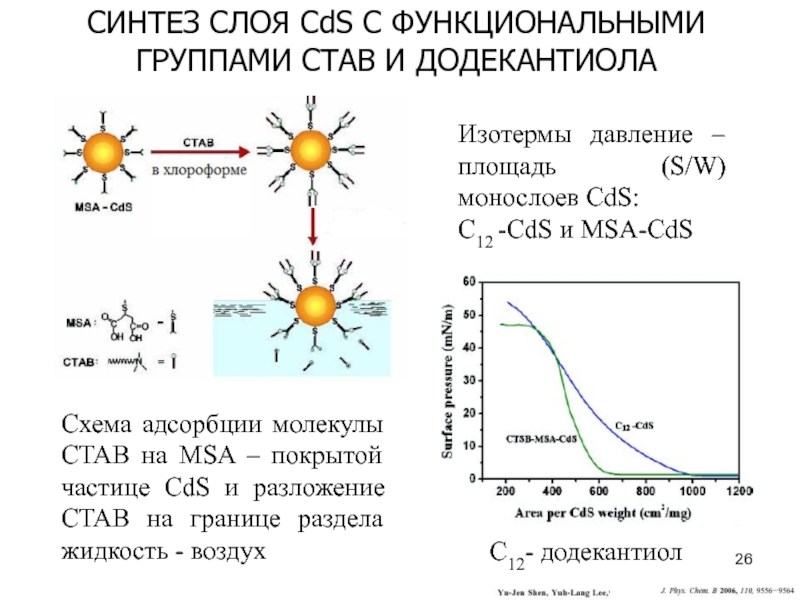
– возможность получения однородных пленокСлайд 26C12- додекантиол
СИНТЕЗ СЛОЯ CdS C ФУНКЦИОНАЛЬНЫМИ ГРУППАМИ CTAB И ДОДЕКАНТИОЛА
Схема
адсорбции молекулы CTAB на MSA – покрытой частице CdS и
разложение CTAB на границе раздела жидкость - воздухИзотермы давление – площадь (S/W) монослоев CdS:
C12 -CdS и MSA-CdS
Слайд 28СИНТЕЗ 3D КОЛЛОИДНЫХ КРИСТАЛЛОВ SiO2
Коллоидные частицы SiO2 были функционализированы аллилтриметоксисиланом
или аминопропилтриэтоксисиланом
Изображения слоев, полученных после 3 и 5 циклов
обработкиСлайд 29Применение пленок Л.-Б. для получения наностержней Si
Стадии процесса:
Осаждение наночастиц Si
методом Л.-Б.
Окисление – получение маски
Анизотропное травление
Удаление маскирующего слоя
Слайд 30ИЗОБРАЖЕНИЕ ЭЛЕКТРОФИЗИЧЕСКОГО УСТРОЙСТВА, СОДЕРЖАЩЕГО СЛОЙ Ленгмюра - Блоджетт
Особенности формирования
пленок Л.-Б.
высокая степень упорядоченности на молекулярном и надмолекулярном уровне
возможность
контролирования состава, структуры, кристалличности синтезируемых слоевпростота технологии получения
возможность встраивания в плёнку разнообразных биологических молекул, или неорганических нанокомпонентов
возможность создавать органо-неорганические нанокомпозитные молекулярные упорядоченные ансамбли, включающие в себя биологически-активные компоненты