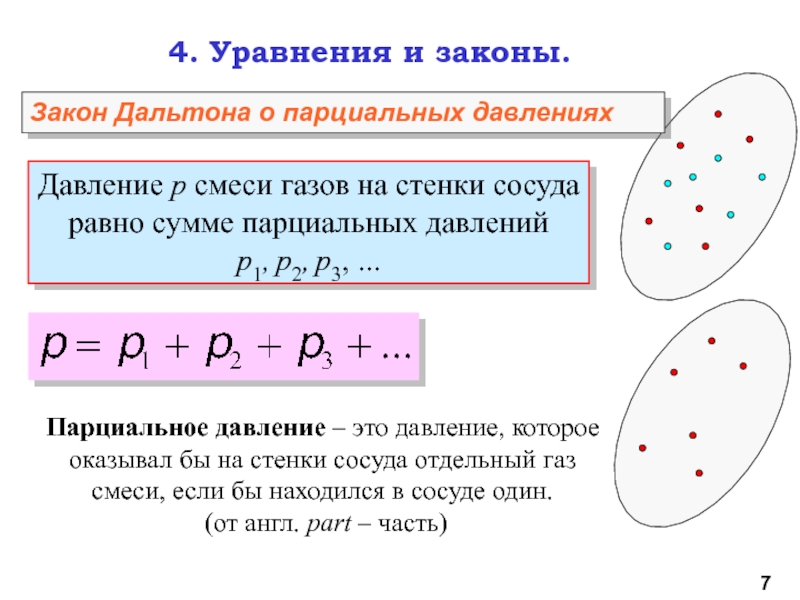
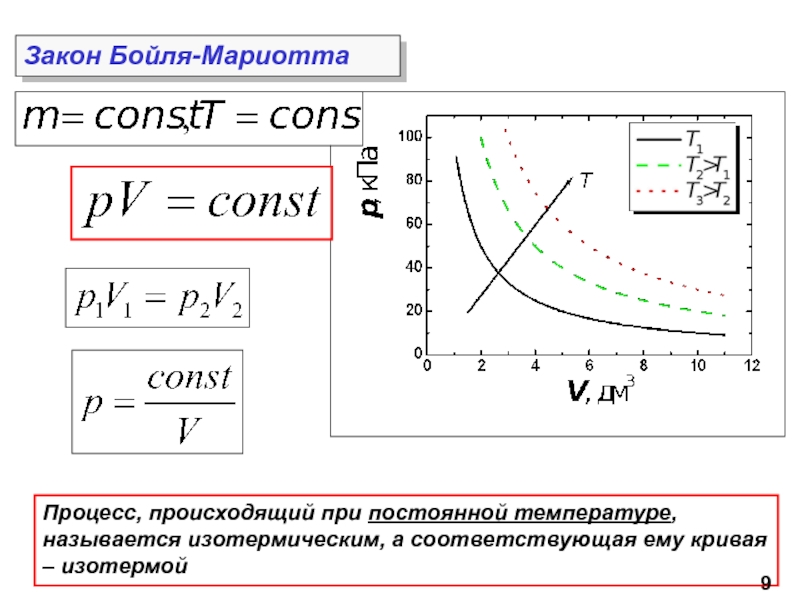
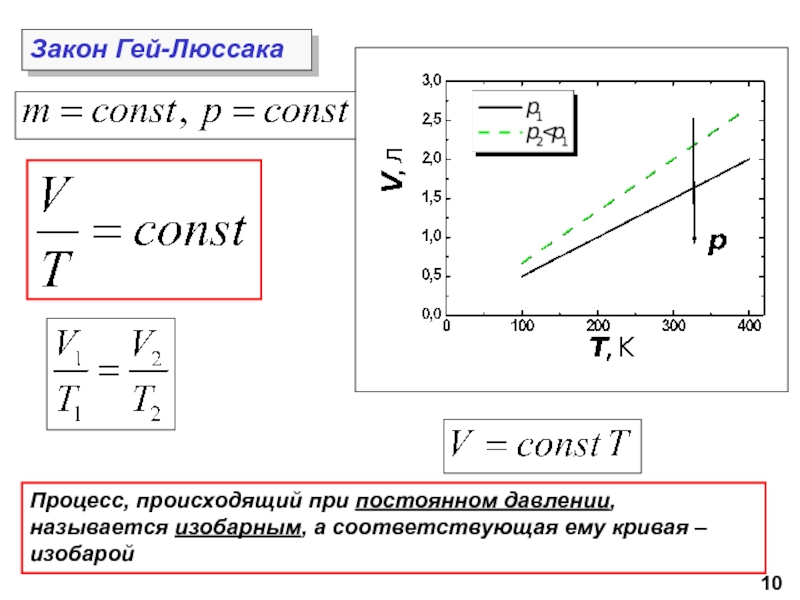
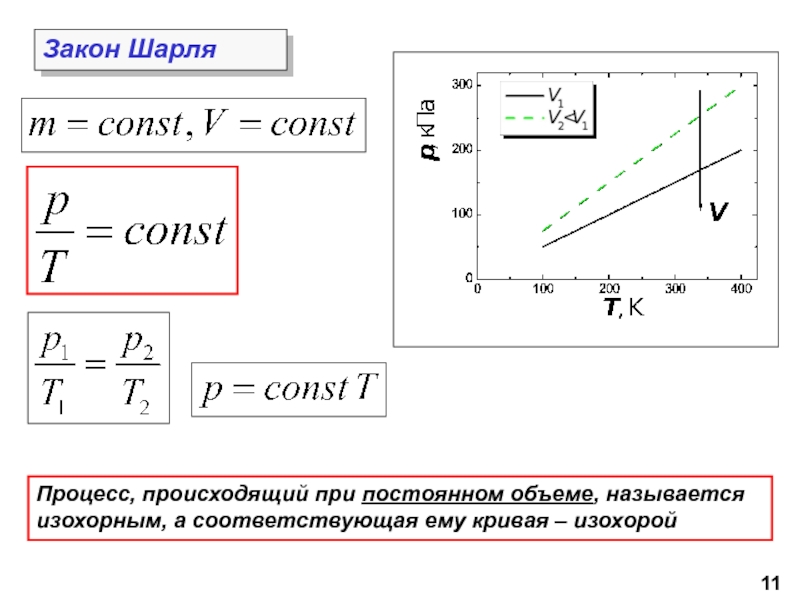
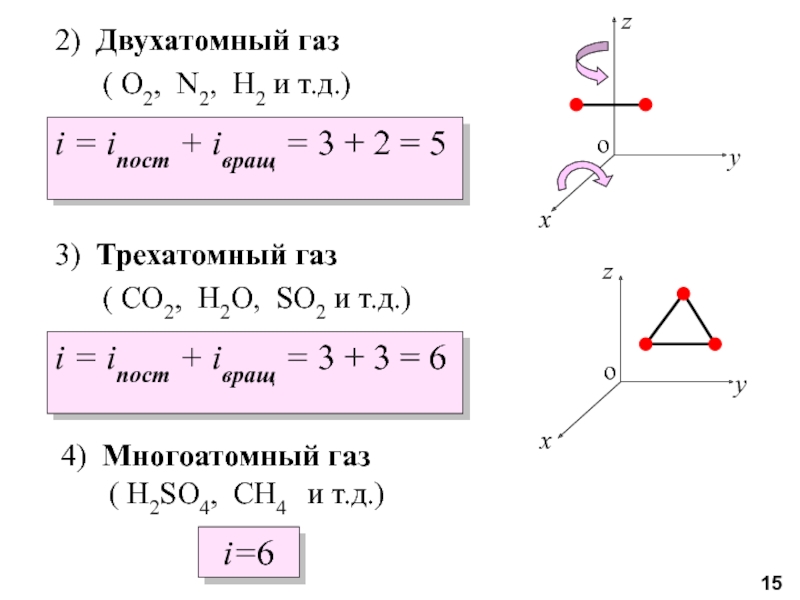
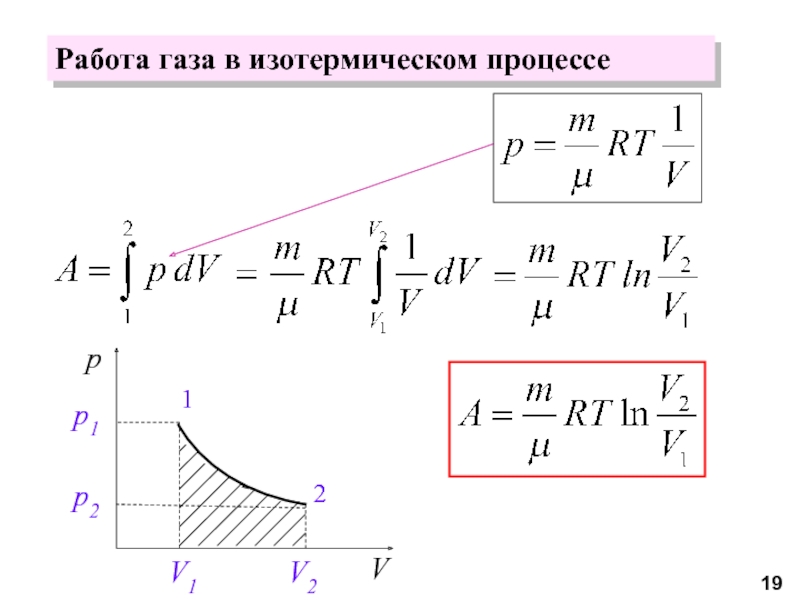
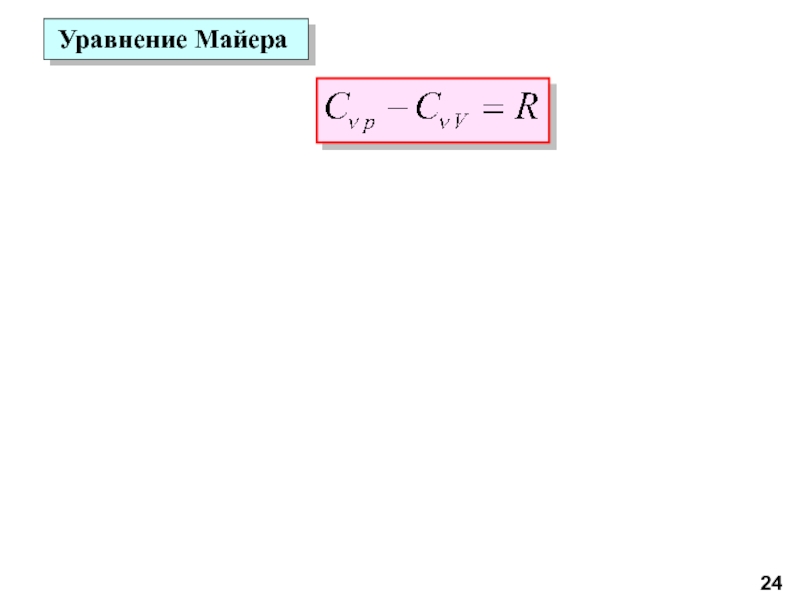
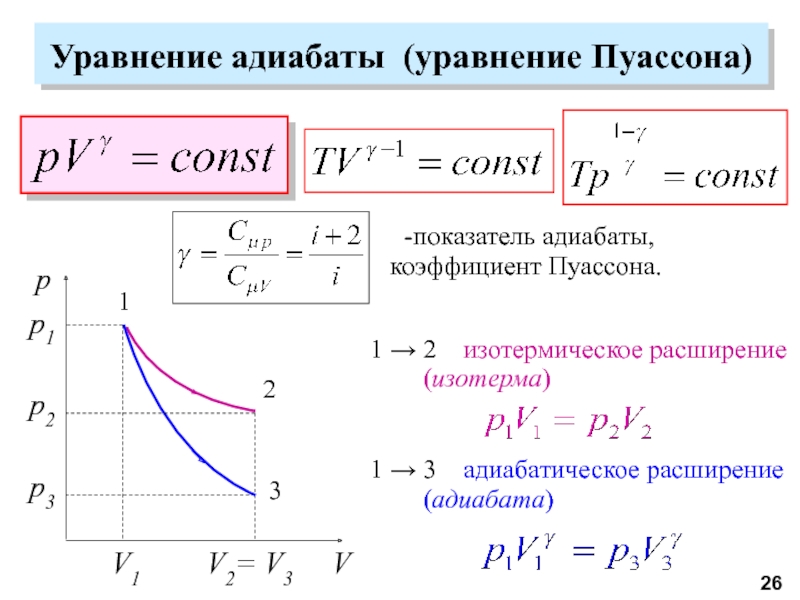
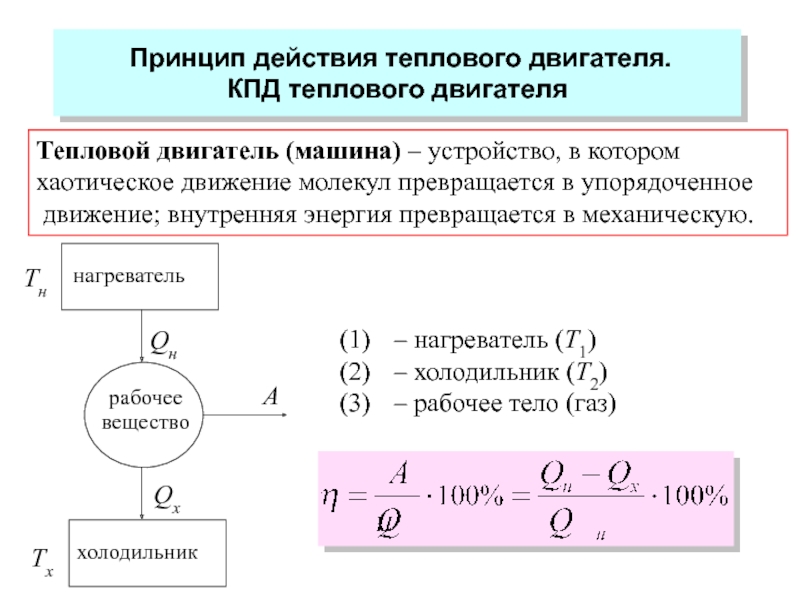
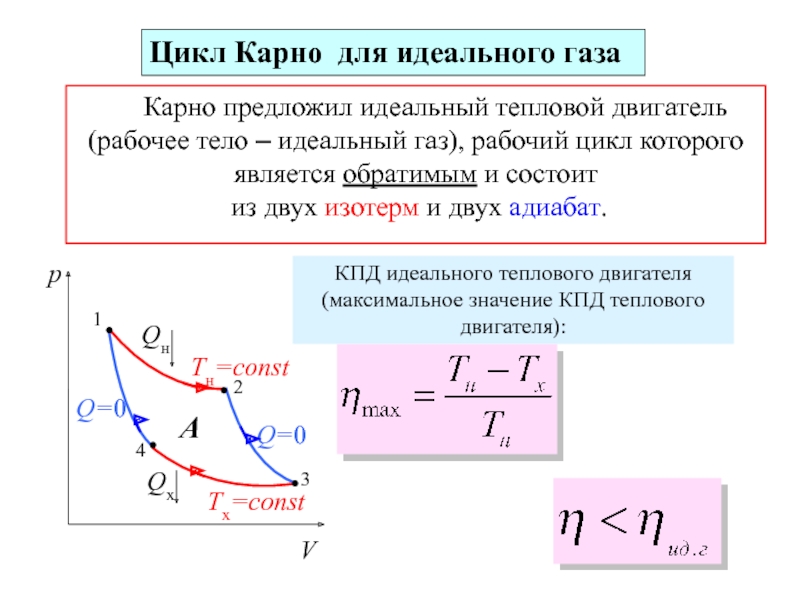
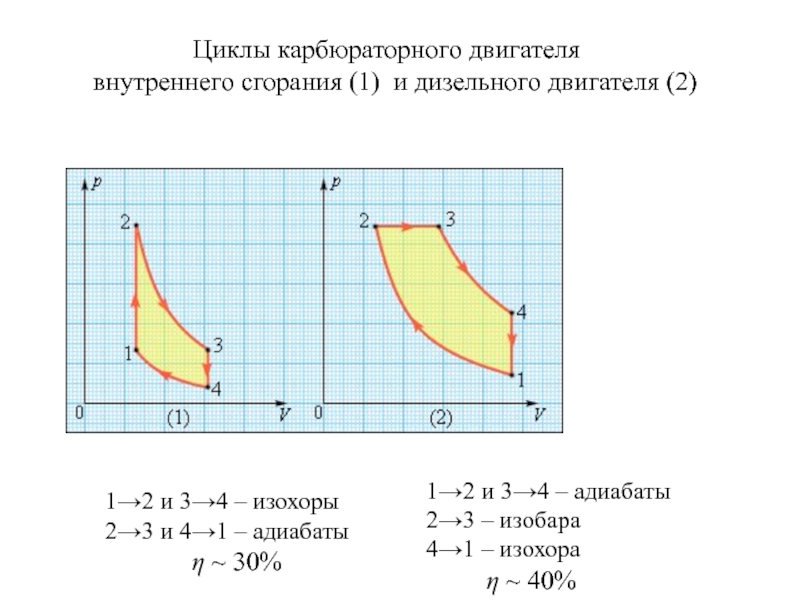
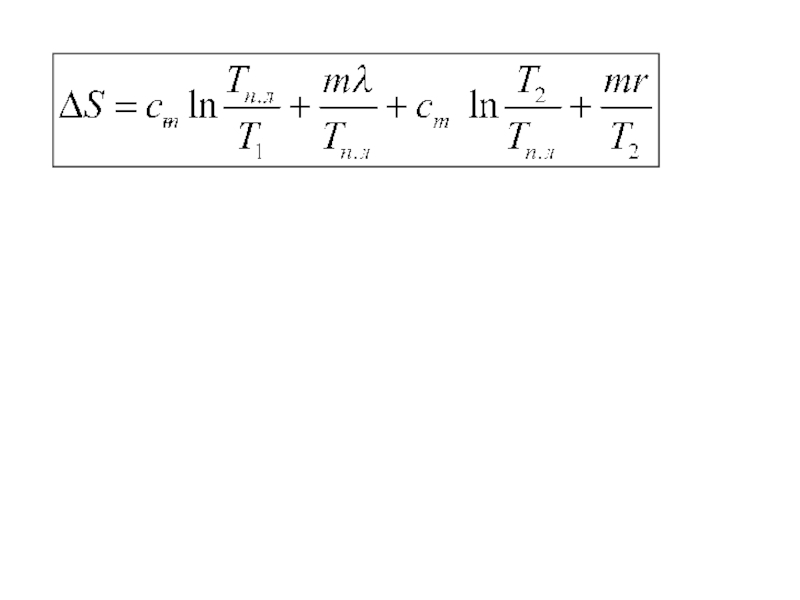молекул.
2. Атомы и молекулы находятся в
непрерывном хаотическом движении.
3. Молекулы взаимодействуют с друг другом.
На больших расстояниях они притягиваются, на малых – отталкиваются.




![Лекция 3 Три закона термодинамики 3. Термодинамические параметры.Объем - область пространства, занимаемая данной системой частиц.Объём V 3. Термодинамические параметры.Объем - область пространства, занимаемая данной системой частиц.Объём V [V ] = м3Давление p1 атм](/img/thumbs/6f715cbdc7d8a9fbfaff3c23be2e1c12-800x.jpg)