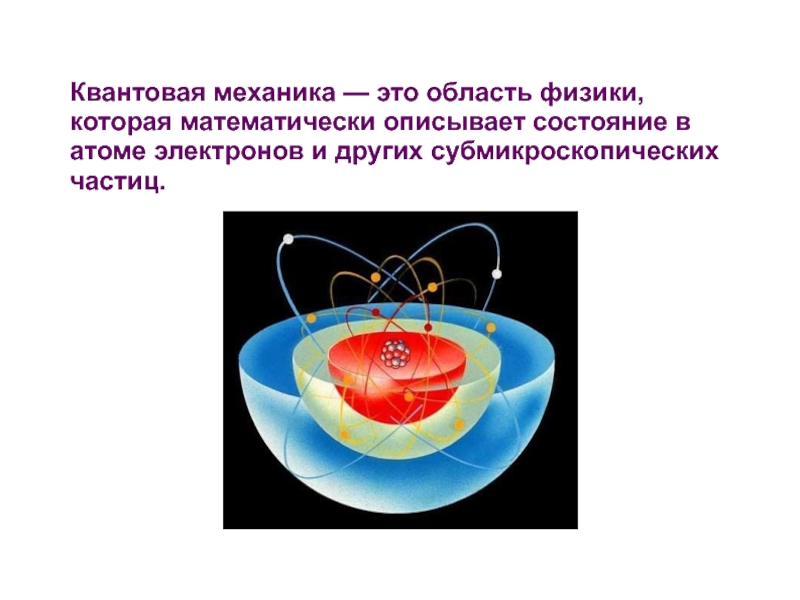
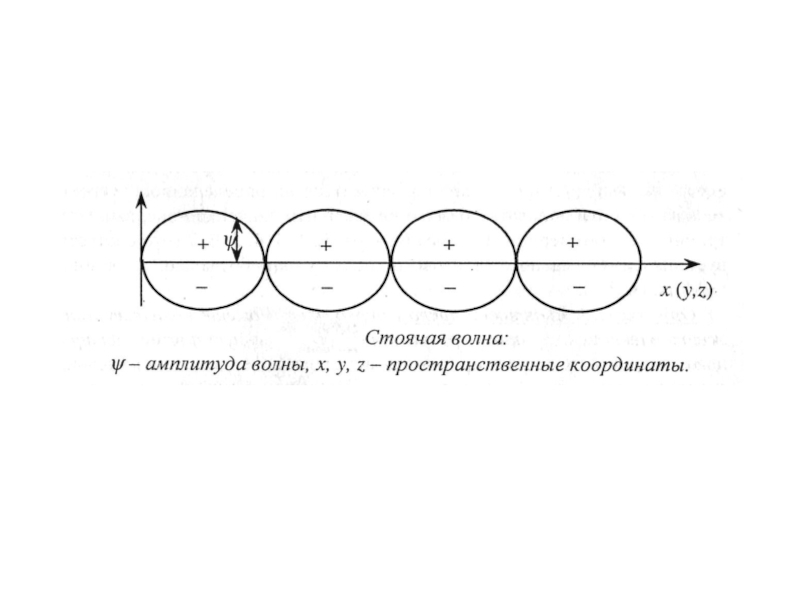
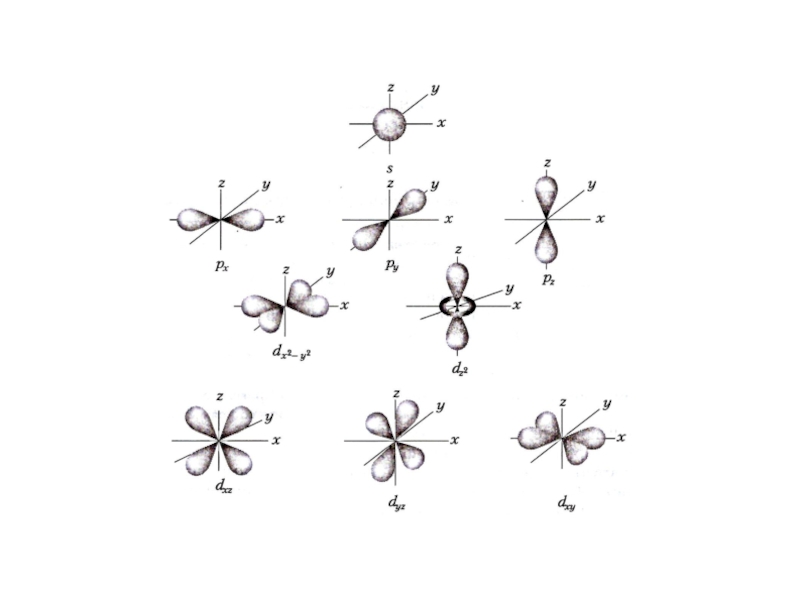
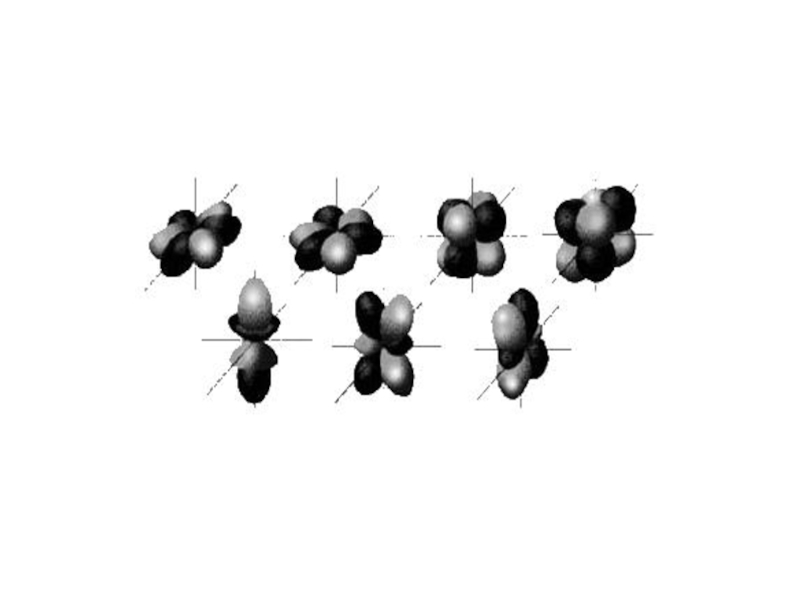
неопределенности Гейзенберга.
3. Понятие об атомной орбитали.
4. Уравнение Шредингера — основное
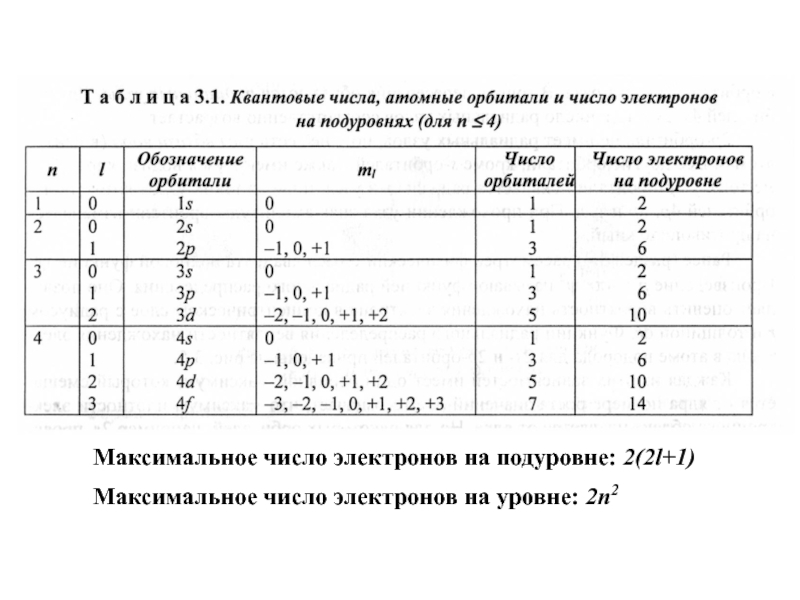
уравнение квантовой механики.5. Квантовые числа электрона.
6. Правила заполнения электронных орбиталей.
7. Составление электронных конфигураций атомов и ионов.
8.Свойства атомов.