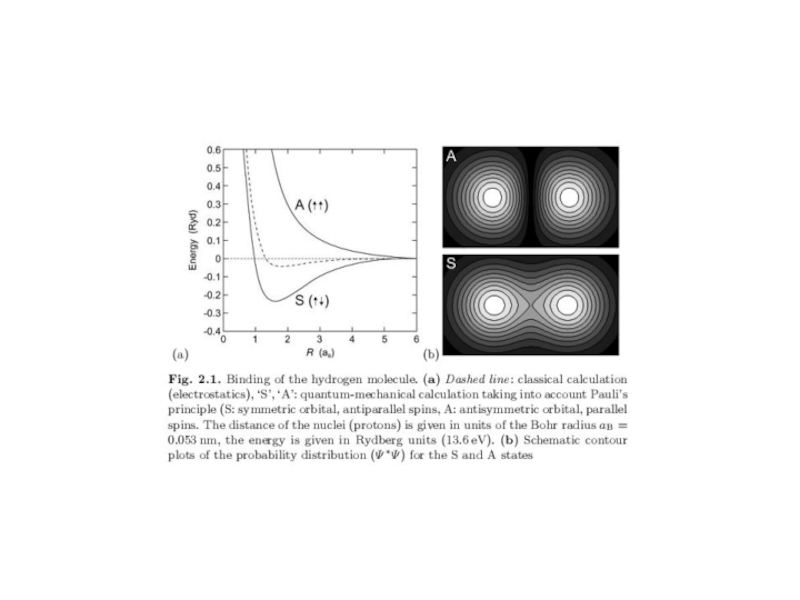
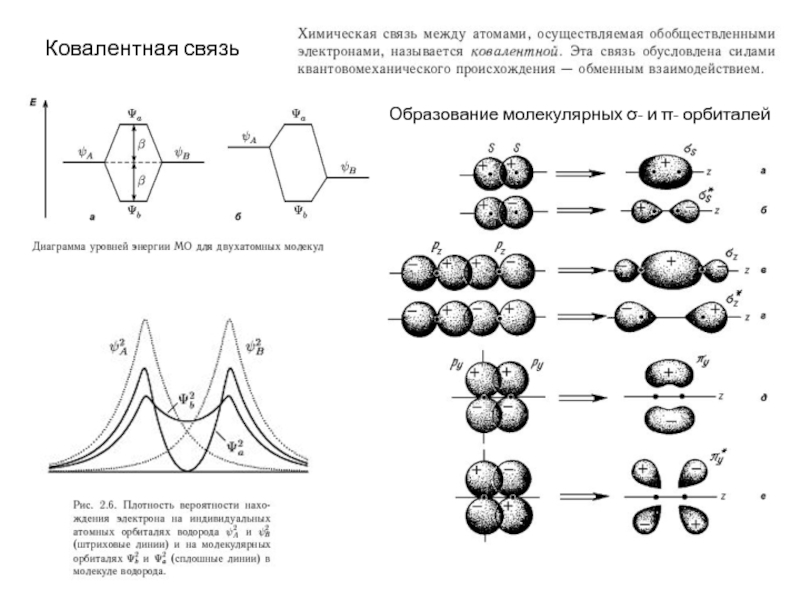
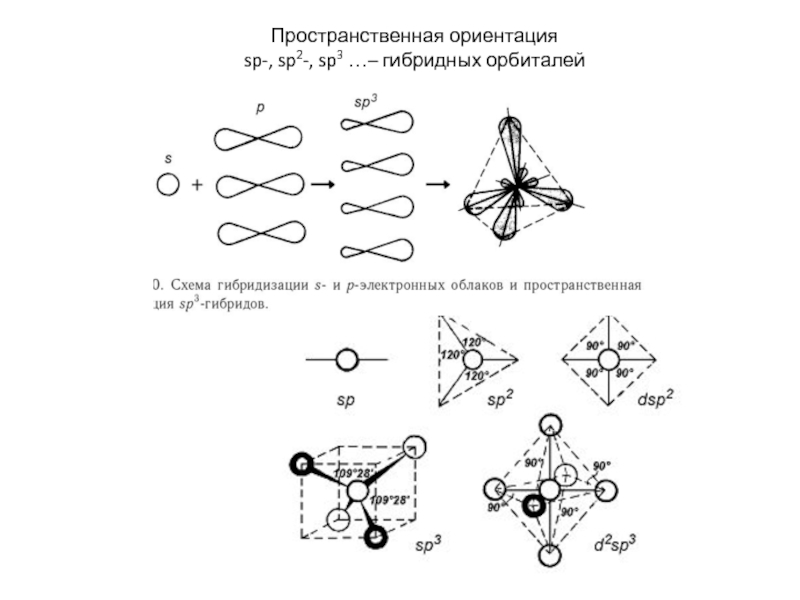
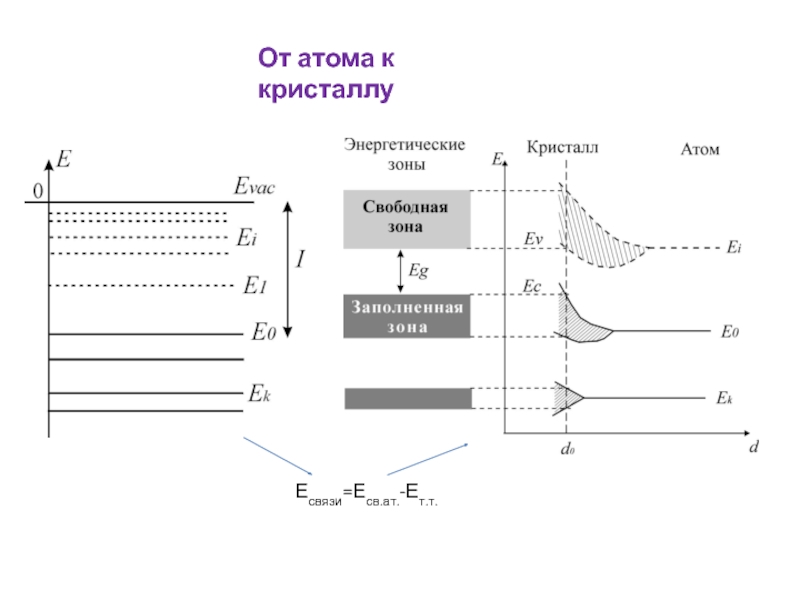
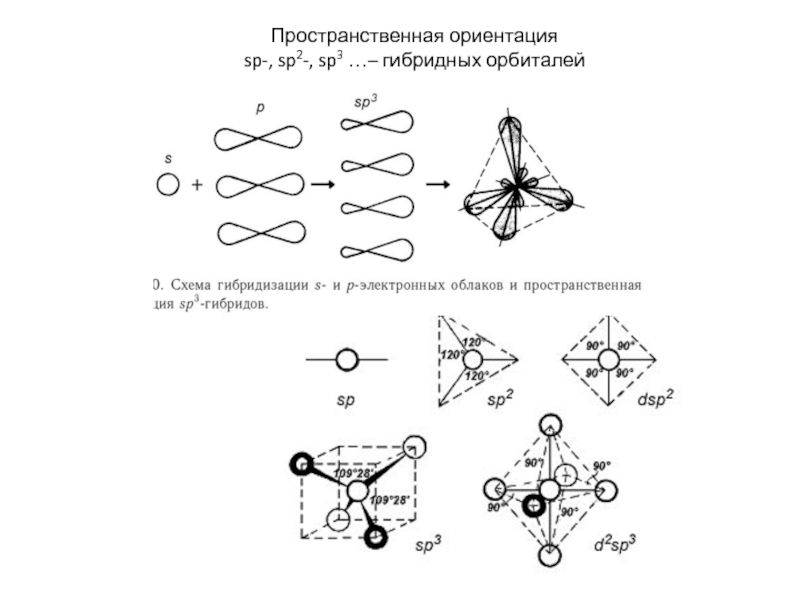
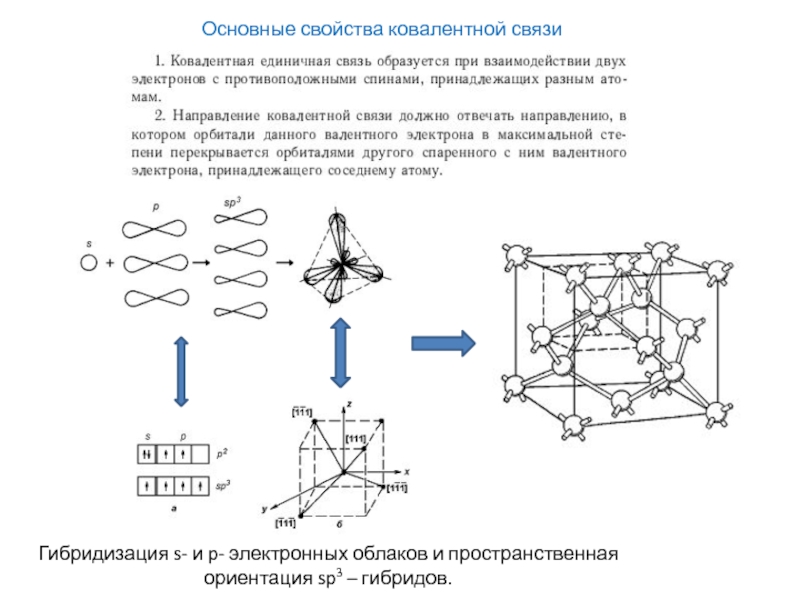
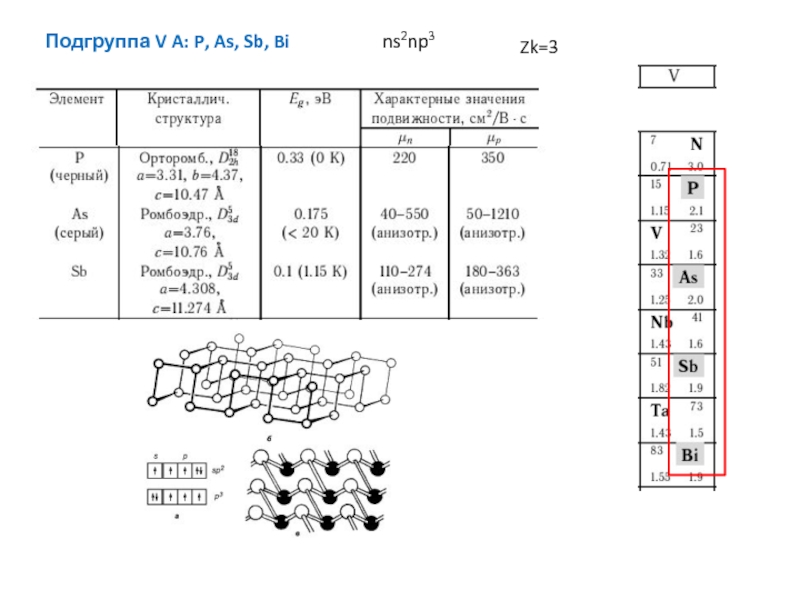
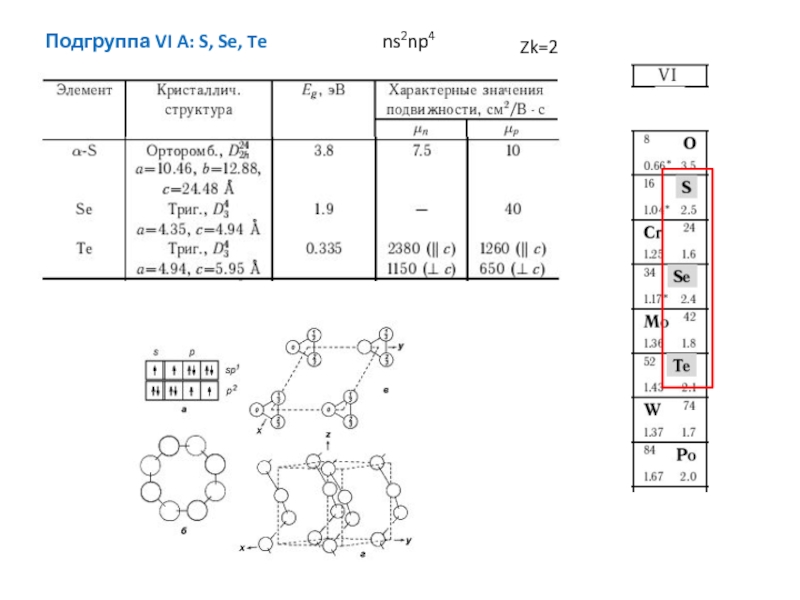
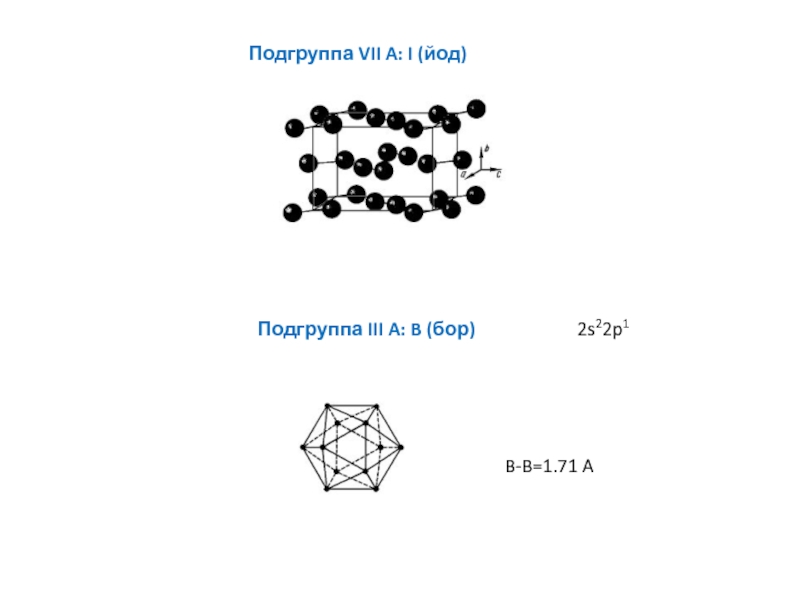
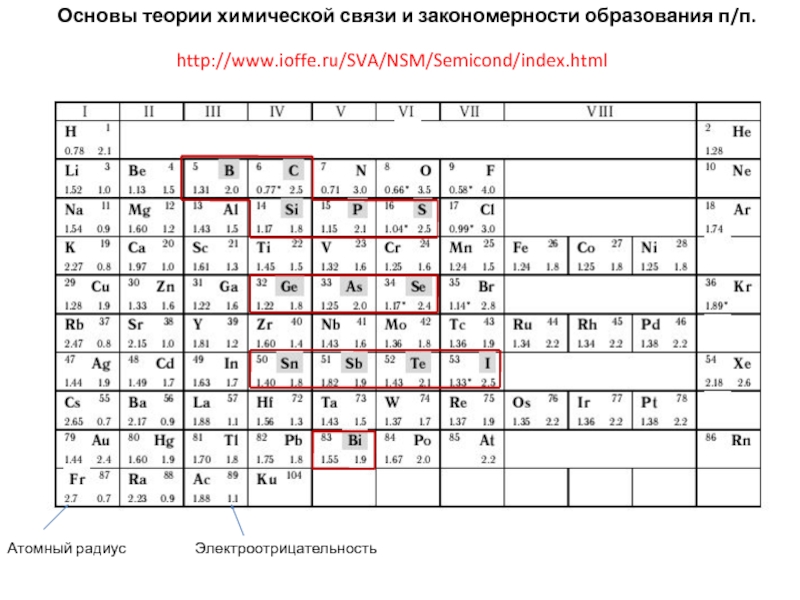
энергия связи
Ненаправленная,
ненасыщенная;
эн.св. 5-7 эВ на пару ионов.
Направленная,
насыщенная;
эн.св. 5-7 эВ на
атом.Ненаправленная,
ненасыщенная;
эн.св. около 4 эВ на атом.
Ненаправленная,
ненасыщенная;
эн.св. около 0.1 эВ на атом.
Зонная структура
Имеется эн. щель между Еv и Ес (Eg>2-3 эВ)
Имеется эн. щель между Еv и Ес (Eg<2-3 эВ)
Зона проводимости частично заполнена (Eg=0 эВ)
Эн. щель между Еv и Ес очень широкая
Структурные свойства
Крупные анионы образуют ст-ры с плотной упаковкой, в пустотах - катионы (Zk=8,6,4 и3)
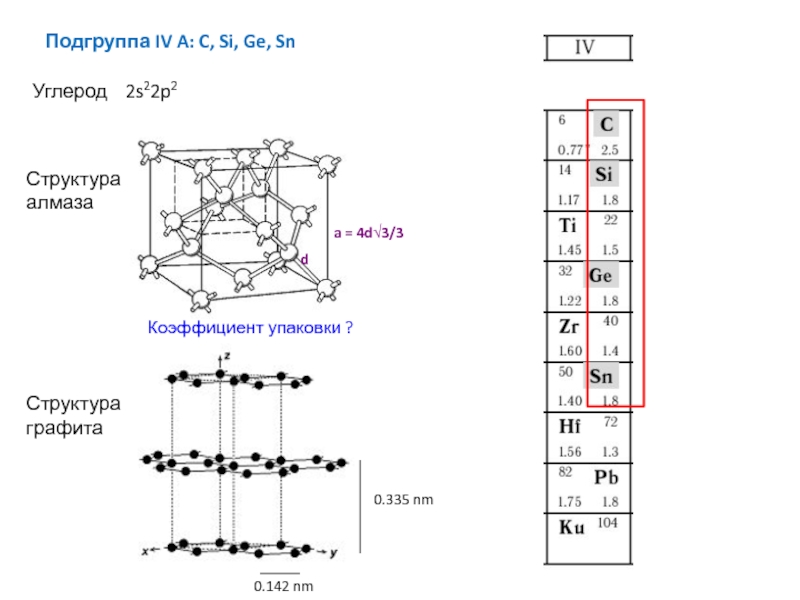
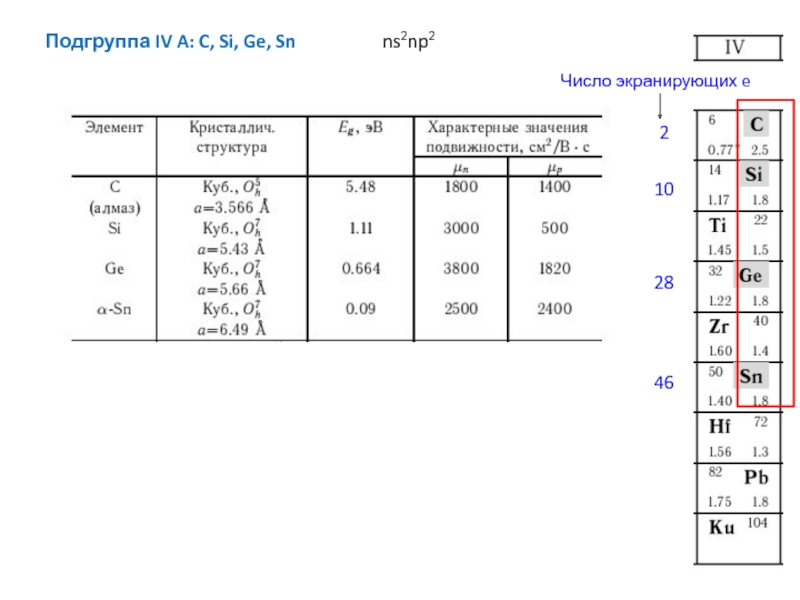
Структуры с неплотной упаковкой решетки (например Zk=4) и низкой плотностью
Компактные кристаллические структуры с плотнейшей упаковкой (Zk=12, 8)
Компактные кристаллические структуры с плотнейшей упаковкой (Zk=12 )