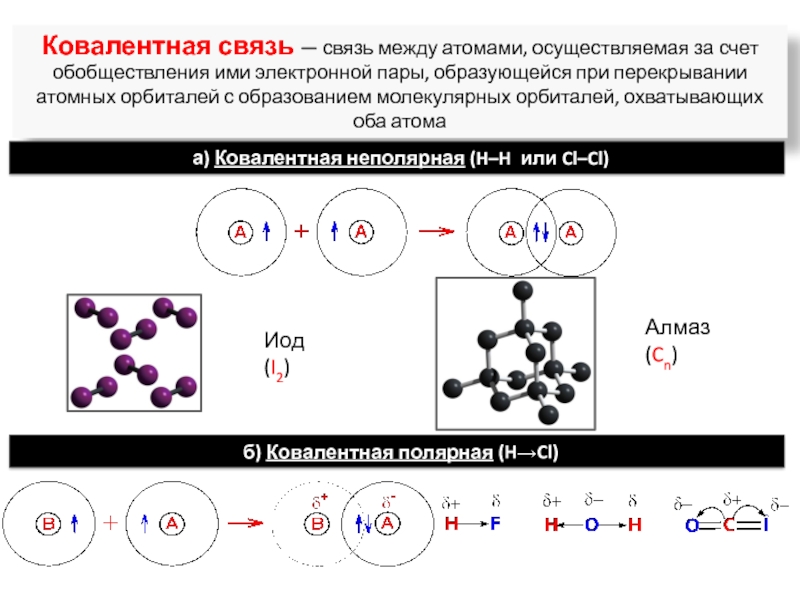
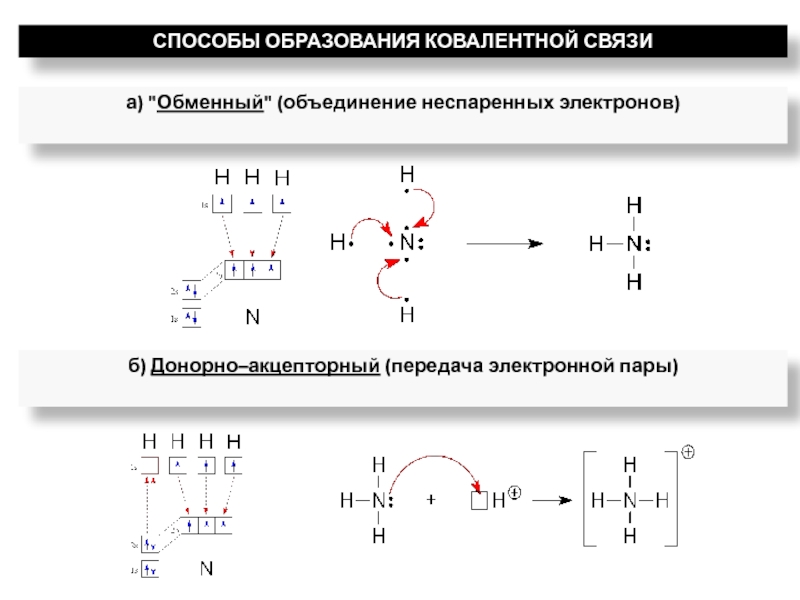
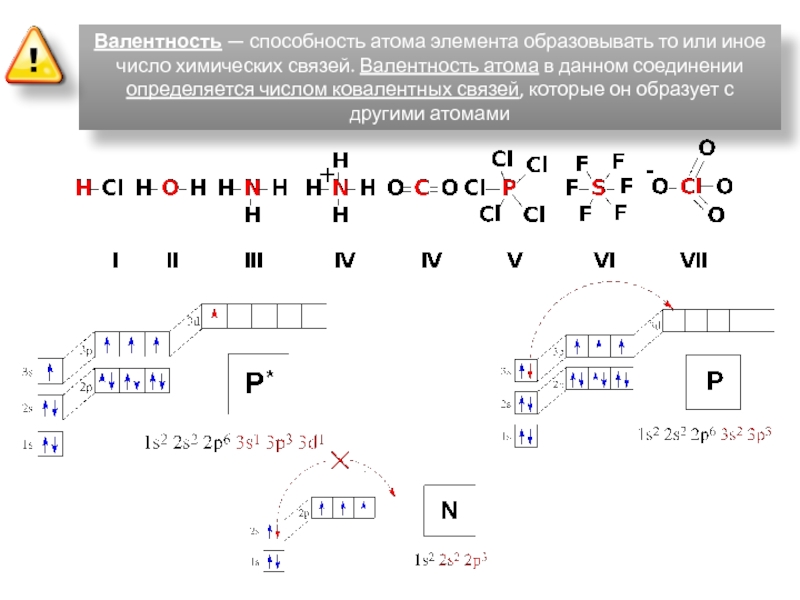
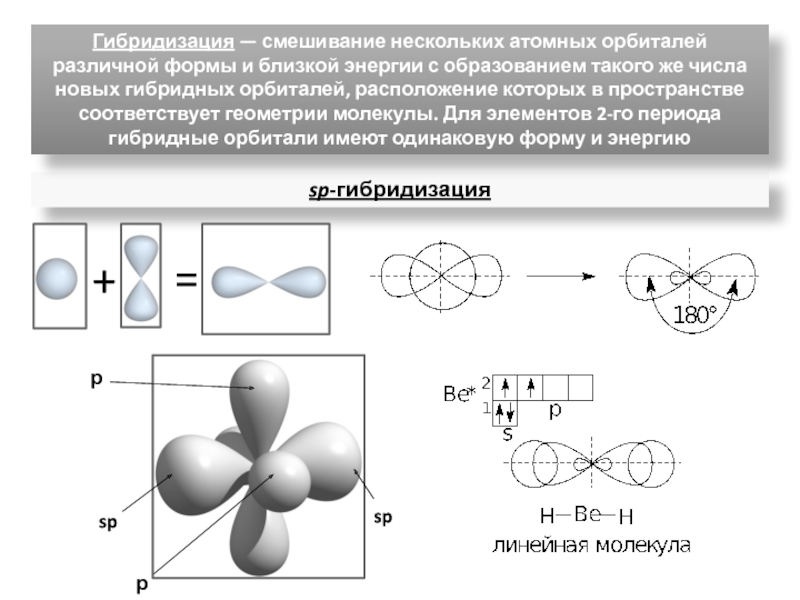
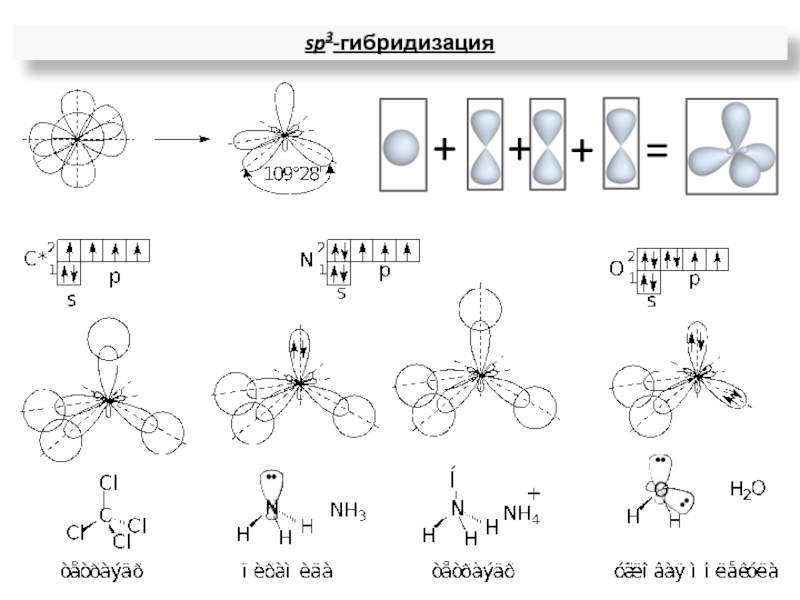
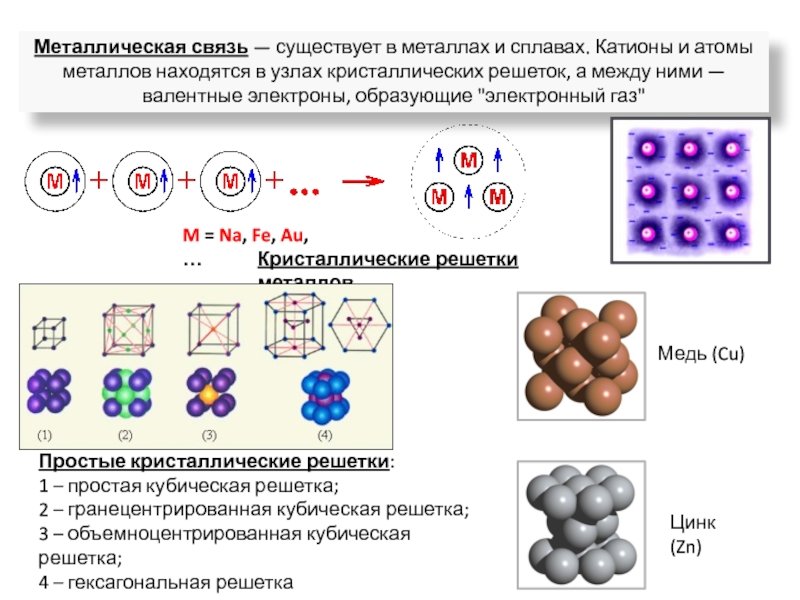
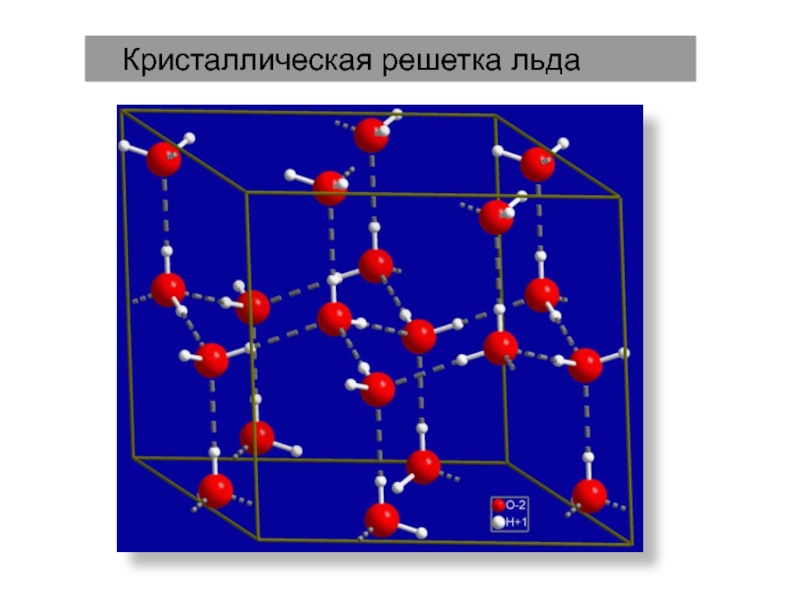
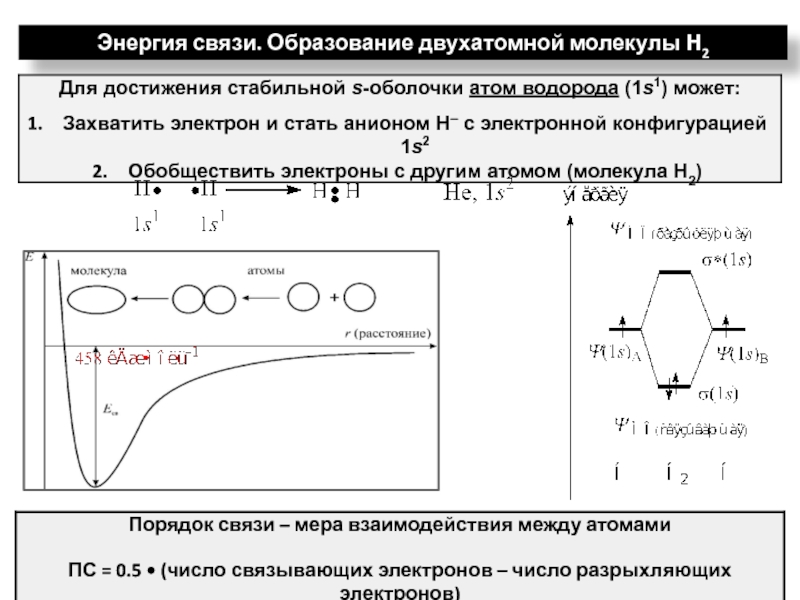
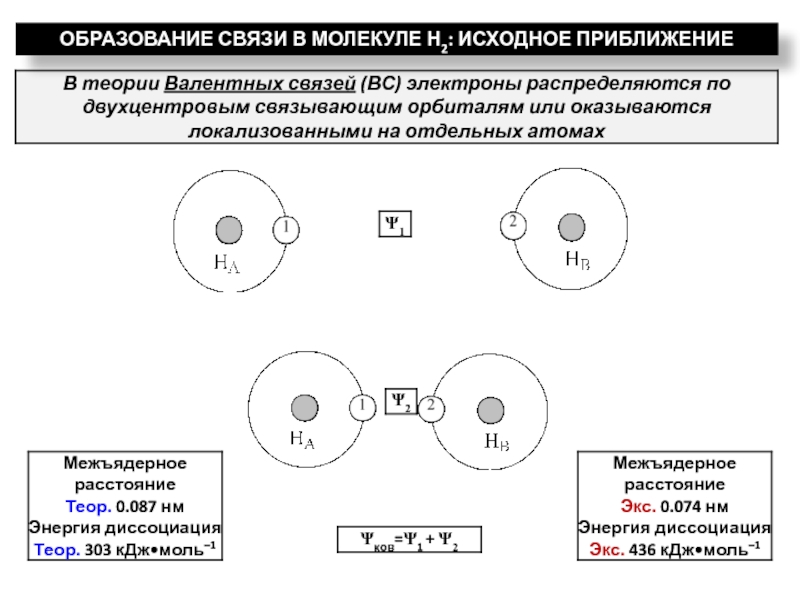
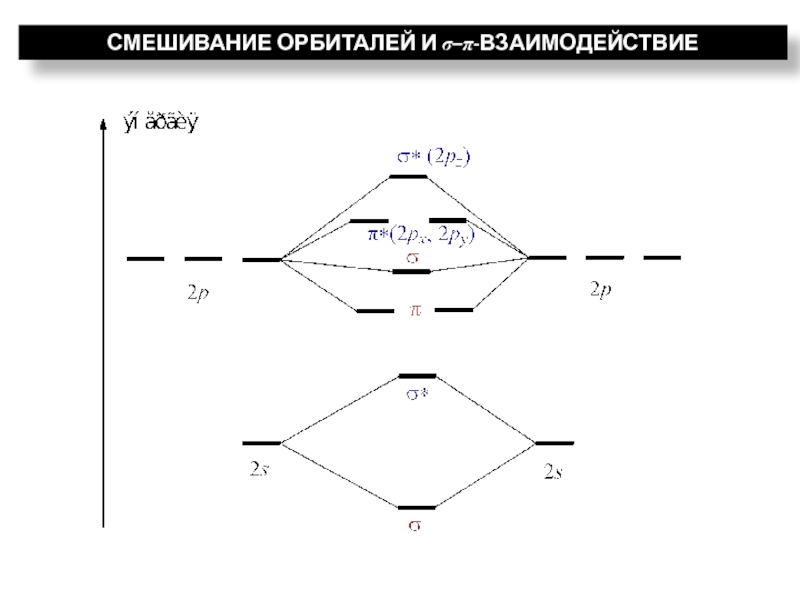
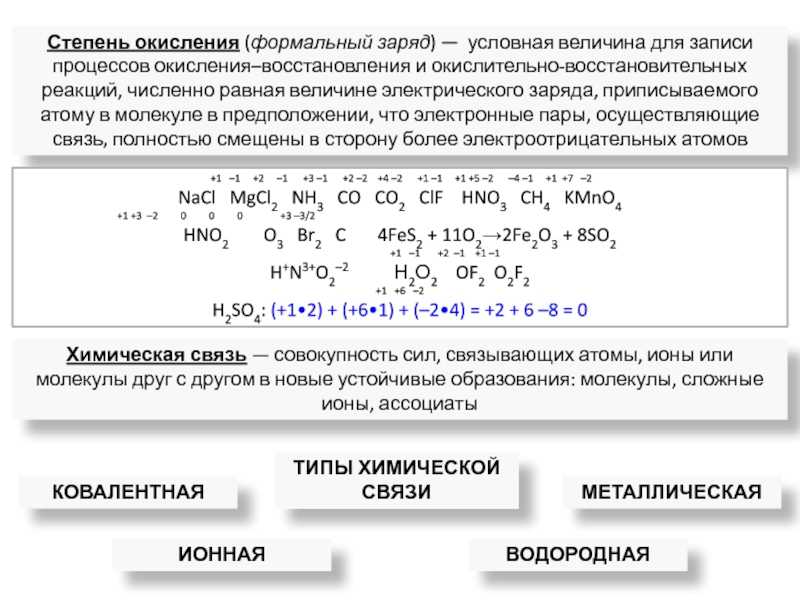
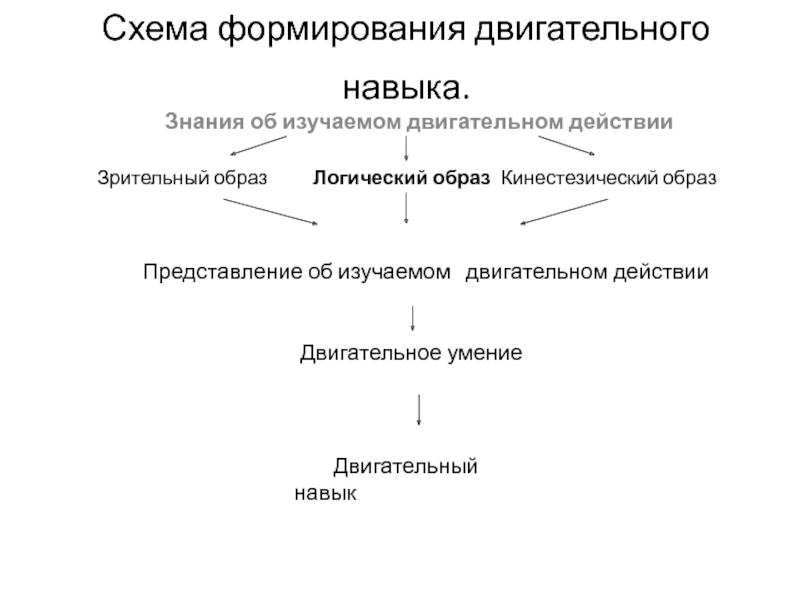
ядрами, приводящих к соединению атомов в молекулу.
2. В образовании химической
связи между атомами главную роль играют валентные электроны.3. При образовании связи атомы стремятся к более устойчивому энергетическому состоянию, которому соответствует завершенный восьми- (или двух-), электронный внешний уровень как у инертных элементов.