Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция № 3. Общая характеристика реакций органических соединений. Кислотные и
Содержание
- 1. Лекция № 3. Общая характеристика реакций органических соединений. Кислотные и
- 2. Слайд 2
- 3. Слайд 3
- 4. 1.
- 5. 2. Электрофильные реагенты (электрофилы) ,
- 6. 3. Кислотные реагенты (кислоты)- нейтральные
- 7. 4. Нуклеофильные реагенты(нуклеофилы) , Nu- или Nu-
- 8. 5. Основные реагенты (основания),
- 9. 6. Окислители, [O] - нейтральные молекулы или
- 10. 7. Восстановители , [H]- нейтральные
- 11. В соответствии с характером разрывасвязи в субстрате
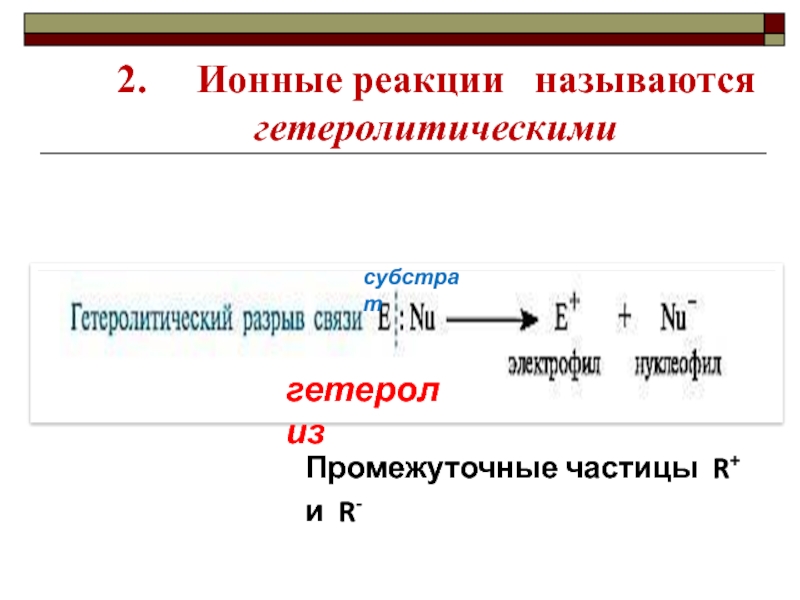
- 12. 2. Ионные реакции называются гетеролитическими гетеролизсубстратПромежуточные частицы R+ и R-
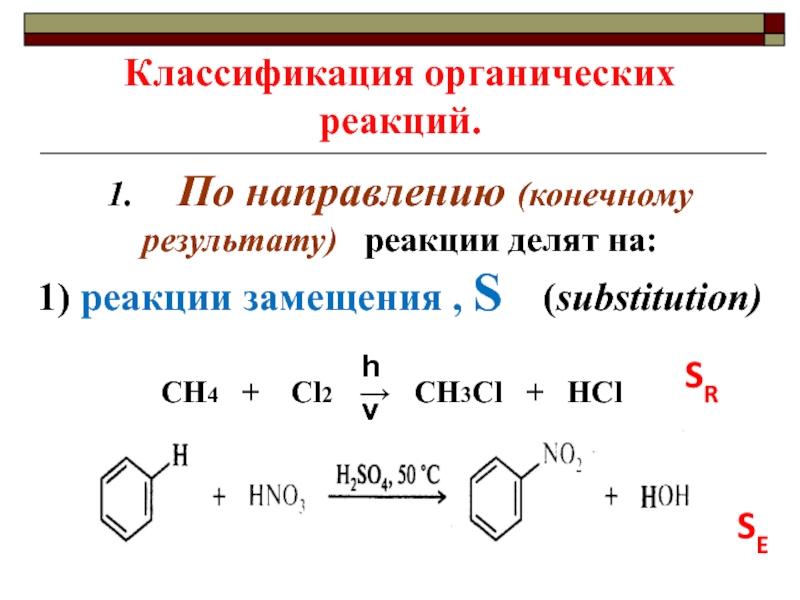
- 13. Классификация органических реакций.1.
- 14. 2. Реакции
- 15. 3. Реакции отщепления или элиминирования, E (El) (еlimination):КОН / спиртαβ
- 16. 4. Реакции окисления-восстановленияПроцесс окисления – переход электронов
- 17. По молекулярности реакции делятся на
- 18. Мономолекулярная реакция:Бимолекулярная реакция:SN2SN1
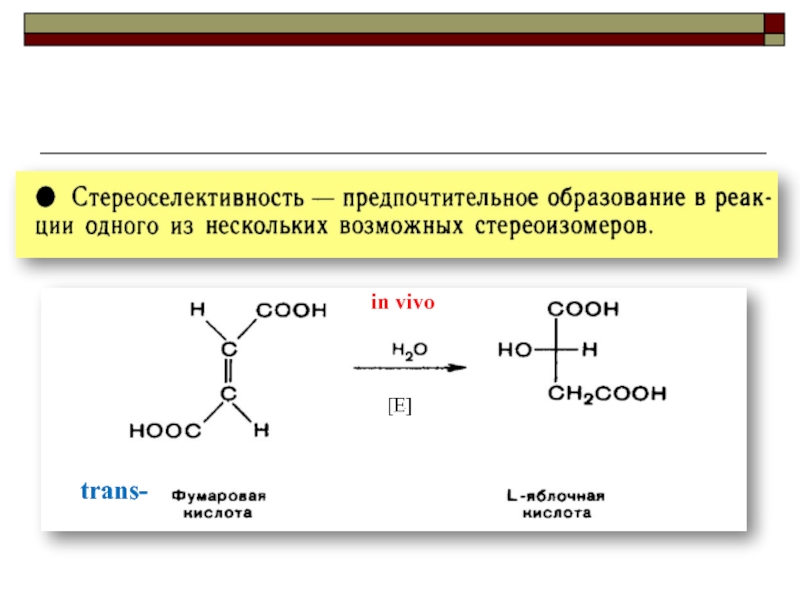
- 19. Селективность ( избирательность) химических превращений.
- 20. Слайд 20
- 21. in vivotrans-
- 22. плоское строение Карб(o)катионы - замещенные атомы углерода, имеющие вакантную (незаполненную) орбиталь. CH3+Факторы, определяющие реакционную способность
- 23. Алифатические катионы.Для устойчивости катионов нужны ЭД заместители
- 24. Аллильный катион
- 25. Бензильный катион
- 26. CH2=CH+ Винильный катионC6H5+ Фенильный катионC spC sp
- 27. Ряд устойчивости катионов:Бензильный, аллильный > третичный
- 28. 1,2- метильный сдвигСН3-Н-1,2- гидридный сдвигПерегруппировки катионов
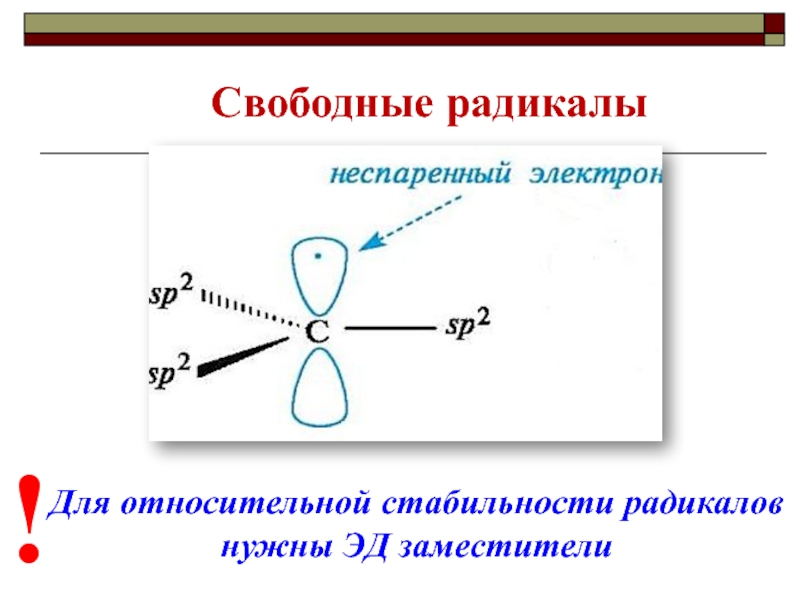
- 29. Свободные радикалы Для относительной стабильности радикалов нужны ЭД заместители !
- 30. Алифатические радикалы 3 +I 2 +I
- 31. Слайд 31
- 32. Слайд 32
- 33. C6H5• < CH2=CH• < CH3• < RCH2•
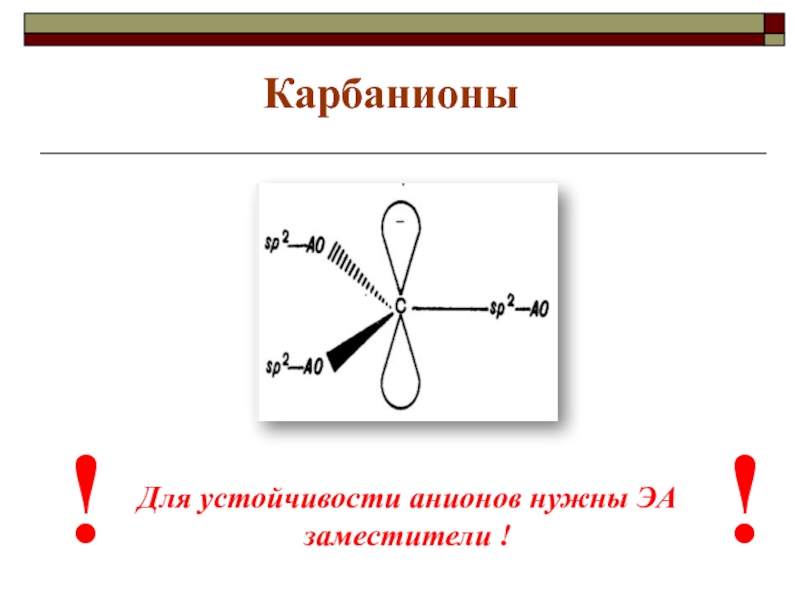
- 34. Карбанионы Для устойчивости анионов нужны ЭА заместители ! ! !
- 35. Рассредоточение отрицательного заряда:→Н+ +
- 36. Алифатические анионы ----увеличение стабильности R-+I2 +I3 +I
- 37. Ряд устойчивости анионов:Бензильный, аллильный >
- 38. КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- 39. Теория Брёнстеда-Лоури.(1923) Датский физико-химик Йоханнес Николаус Брёнстед, 1879-1947 Английский химик Томас Мартин Лоури, 1874-1936
- 40. Кислоты Брёнстеда (протонные кислоты)- это нейтральные молекулы
- 41. Органические кислоты классифицируют по природе кислотного центра:
- 42. Константа
- 43. электроотрицательностьПрогнозирование кислотностиСтабильность аниона определяется степенью делокализации отрицательного заряда.1. Природа атома в кислотном центре
- 44. С – Н кислоты
- 45. Увеличение кислотностиПри одинаковых радикалах кислотность увеличивается в
- 46. 2. Спирт Фенол Карбоновая кислота
- 47. +I -I увеличение кислотности3. Влияние органического радикала, связанного с кислотным центромЭАЭДα β
- 48. В ароматическом ряду:-I , -M+I
- 49. Относительная кислотность H2O
- 50. Основания Брёнстеда -
- 51. -основания
- 52. Аммониевые основания (центр основности азот) n-основания
- 53. 2. Оксониевые основания
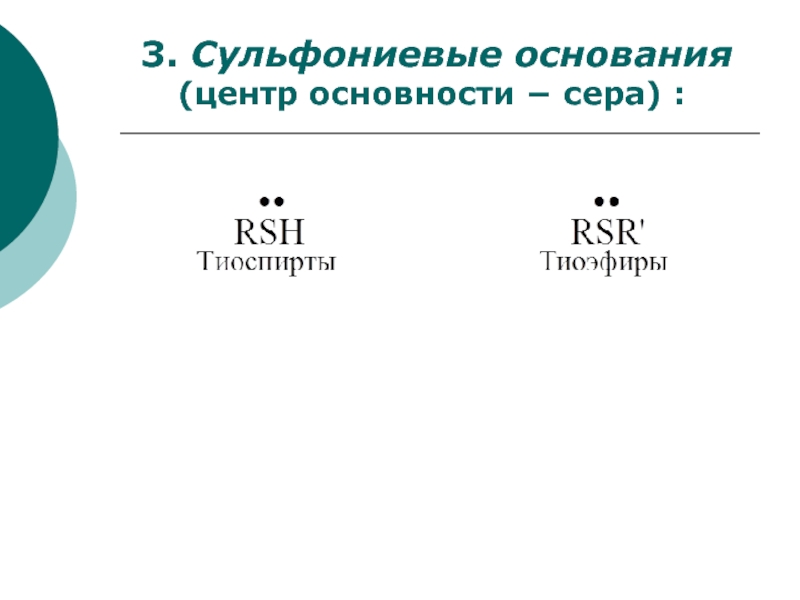
- 54. 3. Сульфониевые основания (центр основности сера) :
- 55. Основность тем выше, чем выше концентрация отрицательного
- 56. Алифатические амины Основность аминов в растворе:NH3
- 57. Основные свойства–I +M > –I Ароматические амины менее основны, чем алифатические амины.>
- 58. Ароматические аминыЭД заместители повышают основные свойства, а ЭА заместители понижают выраженность основных свойств. +I
- 59. НовокаинНовокаин (плохо растворим в воде)2-(диэтиламино)этил-4-аминобензоат
- 60. Слайд 60
- 61. МазьИнъекционный раствор
- 62. Кислотно-основные свойства аминокислот.
- 63. ПирролГетероциклические соединения
- 64. Кислотно – основные свойства 1. Пиррол практически лишен основных свойств 2. КислотностьpKa=16,5
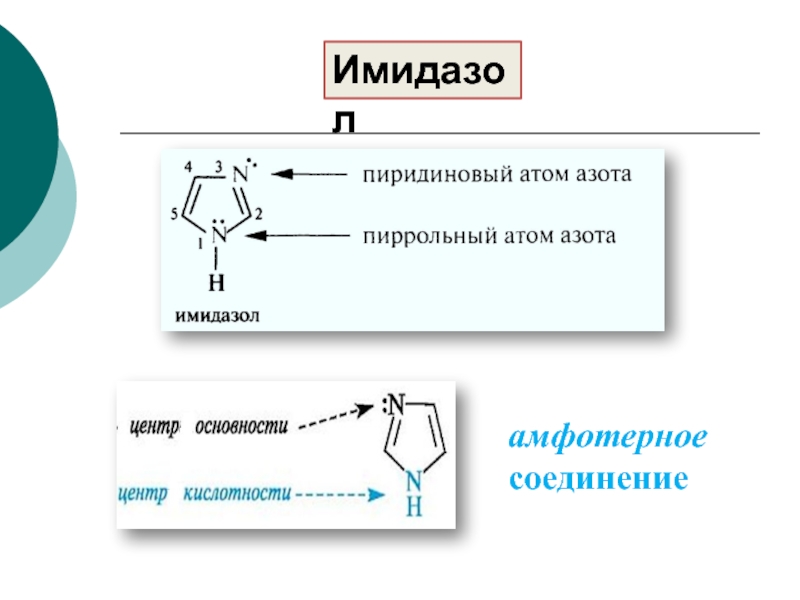
- 65. амфотерное соединениеИмидазол
- 66. +Основные свойства имидазола: pKa 14.2 pKa 7.03 -7.25
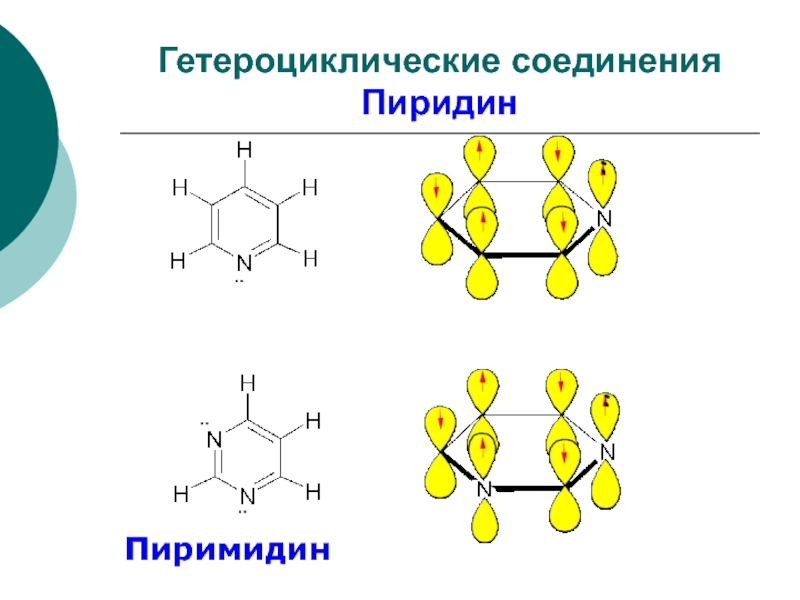
- 67. Гетероциклические соединения ПиридинПиримидин
- 68. Основные свойства пиридина: pKb 8.70pKb 2.8
- 69.
- 70. Слайд 70
- 71. Слайд 71
- 72. Слайд 72
- 73. Новокаинамид
- 74. Слайд 74
- 75. Слайд 75
- 76. кислота это акцептор пары электронов, основание это донор электронной пары.Теория Льюиса (1923) Кислотно-основный комплекс
- 77. ЛЬЮИС (Lewis), Джилберт НьютонАмериканский физикохимик23 октября 1875 г. – 23 марта 1946 г.
- 78. Кислоты Льюиса – это любые соединения со свободной орбиталью
- 79. Теория Льюиса
- 80. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Лекция № 3. Общая характеристика реакций органических соединений. Кислотные и основные
свойства органических соединений.
Слайд 4
1. Радикальные реагенты
- свободные
атомы или частицы с неспаренным электроном.
Типы реагентов и характер изменения связей в субстрате.Слайд 52. Электрофильные реагенты (электрофилы) , Е+ или Е
- частицы, образующие новую ковалентную связь за счет электронной пары
реакционного партнера. ( акцепторы
электронов)
, SO3
Слайд 63. Кислотные реагенты (кислоты)
- нейтральные молекулы (CH3COOH, HCl)
либо положительно заряженные частицы (NH4+, H3O+), способные быть донором протона
для реакционного партнера.Слайд 74. Нуклеофильные реагенты
(нуклеофилы) , Nu- или Nu
- частицы, образующие новую
ковалентную связь с реакционным партнером, предоставляя для этого свою электронную
пару.Термин «нуклеофил» применяется к частице, реагирующей с любым электрофильным
реакционным партнером за исключением протона Н+.
!
, CH2=CH2, C6H6
Слайд 85. Основные реагенты (основания), B- или B:
(base)
- отрицательно заряженные частицы (НО- , RO-) или
нейтральные молекулы (:NH3, H2O:), способные оторвать протон от кислотного реакционного центра. Слайд 96. Окислители, [O]
- нейтральные молекулы или ионы
(O2, Fe3+,
органические окислители), принимающие электроны или атомы Н от органического
субстрата.Слайд 107. Восстановители , [H]
- нейтральные молекулы или ионы
(H2, Fe2+, H-, органические восстановители), отдающие электроны или атомы водорода
органическому субстрату.Слайд 11В соответствии с характером разрыва
связи в субстрате и природой реагента:
1. Радикальные (гомолитические)
реакции ( R)
һν
гомолиз
субстрат
промежуточные частицы
Слайд 122. Ионные реакции называются
гетеролитическими
гетеролиз
субстрат
Промежуточные частицы
R+ и R-
Слайд 13Классификация органических реакций.
1. По направлению (конечному
результату) реакции делят на:
1) реакции замещения , S (substitution)CH4 + Cl2 CH3Cl + HCl
һν
SR
SE
Слайд 14 2. Реакции присоединения, Ad (А)
(аddition присоединение):
CH2=CH2 + Br2
CH2BrCH2BrОН-
H2C=O + HCN H2C(CN)OH
AE
AN
Слайд 164. Реакции окисления-восстановления
Процесс окисления – переход электронов от органического субстрата
к реагенту - окислителю, процесс восстановления – передача электронов от
реагента к органическому субстратуСлайд 17 По молекулярности реакции делятся на мономолекулярные и
бимолекулярные.
A + B AB Мономолекулярная реакция
v = k [A] v = k [B]
скорость реакции
Бимолекулярная реакция
v = k [A] [B]
скорость реакции
Слайд 22плоское строение
Карб(o)катионы - замещенные атомы углерода, имеющие вакантную (незаполненную)
орбиталь.
CH3+
Факторы, определяющие реакционную способность
Слайд 23Алифатические катионы.
Для устойчивости катионов
нужны ЭД заместители
!
!
+I
2 +I
3
+I
Возможность делокализации + заряда является основным фактором, обусловливающим стабильность карбкатиона.
Слайд 27Ряд устойчивости катионов:
Бензильный, аллильный > третичный >
вторичный > первичный
> метильный >
винильный > фенильный
увеличение стабильности R+
Слайд 33C6H5• < CH2=CH• < CH3• < RCH2• < R2CH•
R3C• <
< CH2=CHCH2• , C6H5CH2•
Ряд увеличения стабильности свободных
радикалов:увеличение стабильности R
Слайд 37Ряд устойчивости анионов:
Бензильный, аллильный > ацетиленовый >
метильный
> первичный> вторичный >
третичный
Для относительной
стабильности анионовнужны ЭА заместители
увеличение стабильности R-
!
Слайд 39Теория Брёнстеда-Лоури.
(1923)
Датский физико-химик Йоханнес Николаус Брёнстед, 1879-1947
Английский
химик Томас Мартин Лоури, 1874-1936
Слайд 40Кислоты Брёнстеда
(протонные кислоты)
- это нейтральные молекулы или ионы, способные
отдавать протон (доноры протонов).
Кислотность
в 1012 раз
в 1021 раз
сопряженные
Слайд 42 Константа кислотности (Ка)
pKa =
- lg Ka.
Чем меньше рКа, тем больше кислотность !
дополняющее
кислота
основание
Ka 1,7510-5
pKa 4,75
* сопряженная
*сопряженное
Слайд 43электроотрицательность
Прогнозирование кислотности
Стабильность аниона определяется степенью делокализации отрицательного заряда.
1. Природа
атома в кислотном центре
Слайд 45Увеличение кислотности
При одинаковых радикалах кислотность увеличивается в ряду:
- SH >-OH > -NH > -CH
(возрастание стабильности аниона
за счет увеличения размера соответствующего атома)Слайд 47+I
-I
увеличение кислотности
3. Влияние органического радикала, связанного с кислотным
центром
ЭА
ЭД
α
β
Слайд 49 Относительная кислотность
H2O
СН3 -SH
15.7
10.33 pKa
(CH3)3CCOOH
5.05
HC=CH
36
NH3
35
CH3- CH3
44
CH3 – CH2 – OH
18.0
Слайд 50Основания Брёнстеда
- это нейтральные молекулы
или ионы, способные присоединять протон (акцепторы протонов).
катион
сопряженные
n-основания
Слайд 55Основность тем выше,
чем выше концентрация
отрицательного заряда на атоме
Сила
n-оснований с одинаковыми радикалами
увеличивается в ряду:
N
> O > S
ЭО
Слайд 56Алифатические амины
Основность аминов в растворе:
NH3 первичный третичный
< вторичный амин
в
газовой фазе+I
2 +I
3 +I








![Лекция № 3. Общая характеристика реакций органических соединений. Кислотные и 6. Окислители, [O] - нейтральные молекулы или ионы (O2, Fe3+, органические 6. Окислители, [O] - нейтральные молекулы или ионы (O2, Fe3+, органические окислители), принимающие электроны или атомы](/img/thumbs/3f8013929d4bd7a28960138f5f3c21f4-800x.jpg)
![Лекция № 3. Общая характеристика реакций органических соединений. Кислотные и 7. Восстановители , [H]- нейтральные молекулы или ионы (H2, Fe2+, 7. Восстановители , [H]- нейтральные молекулы или ионы (H2, Fe2+, H-, органические восстановители), отдающие электроны](/img/thumbs/47aff8e0e671700a3314986172887a7d-800x.jpg)