Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция № 9 Аминокислоты, белки
Содержание
- 1. Лекция № 9 Аминокислоты, белки
- 2. Аминокислоты — бифункциональные соединения, в молекуле которых одновременно содержатся карбоксильные и амино- группы.
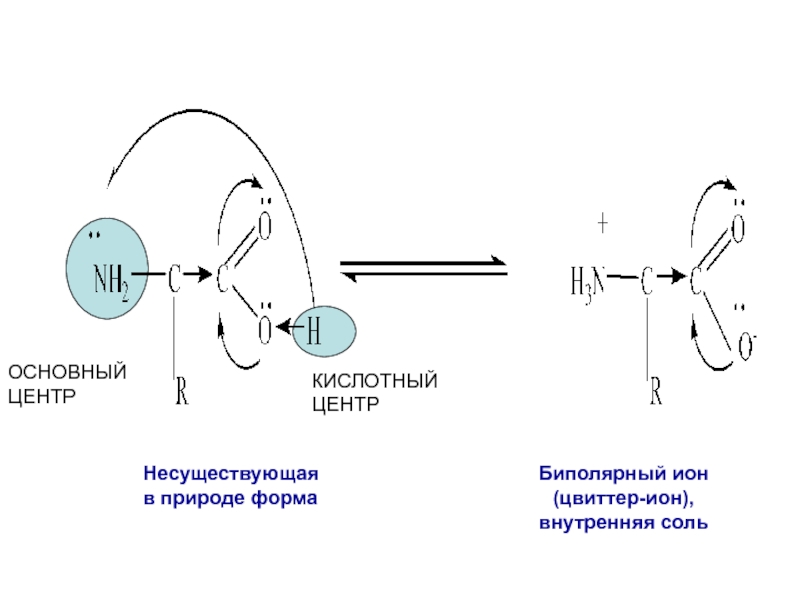
- 3. Несуществующая в природе формаБиполярный ион (цвиттер-ион), внутренняя сольОСНОВНЫЙ ЦЕНТРКИСЛОТНЫЙЦЕНТР
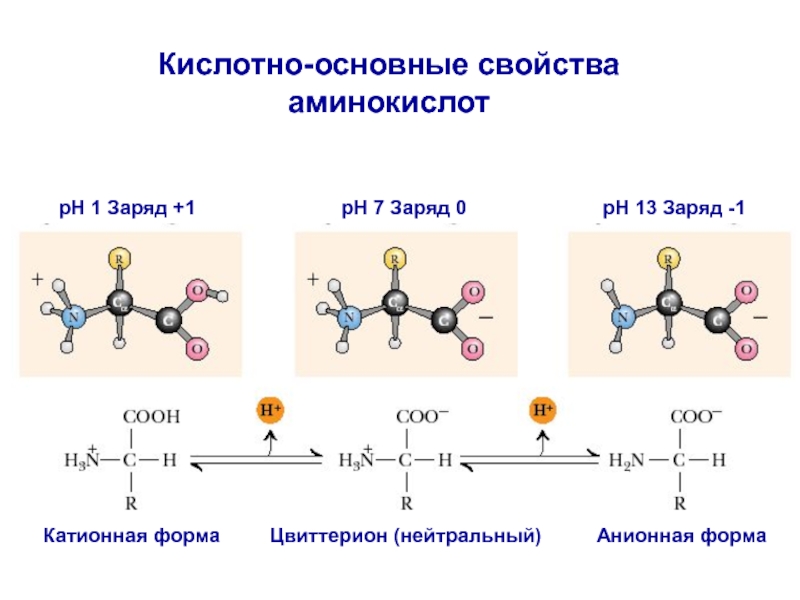
- 4. pH 1 Заряд +1pH 7 Заряд 0pH 13 Заряд -1Цвиттерион (нейтральный)Анионная формаКатионная формаКислотно-основные свойства аминокислот
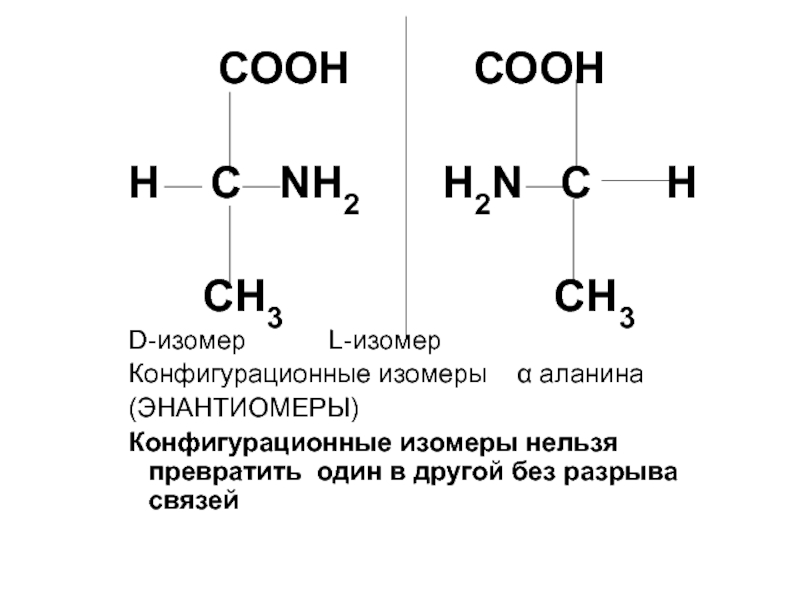
- 5. СООН СООНН С
- 6. Зеркало Венеры (1898), Edward Burne-Jones
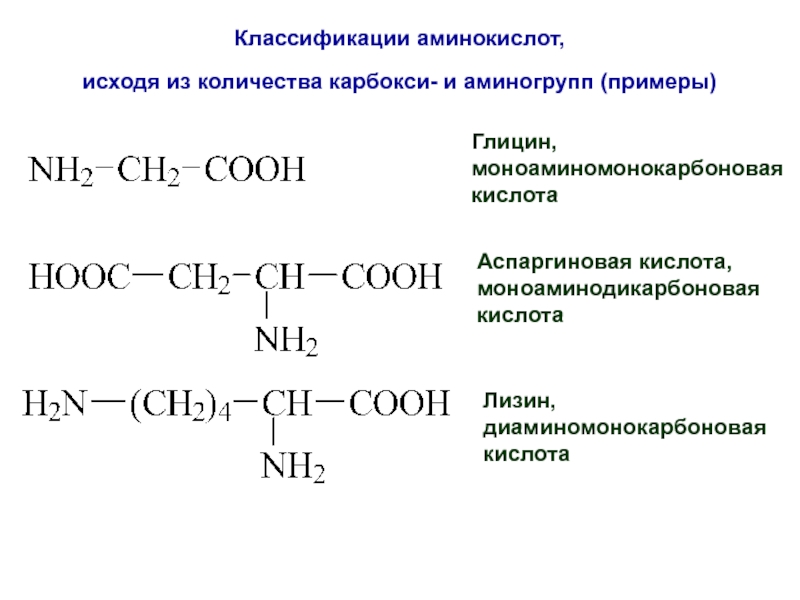
- 7. Классификации аминокислот, исходя из количества карбокси-
- 8. Классификация аминокислот по степени полярности боковых цепейНЕПОЛЯРНЫЕ
- 9. Неполярные ароматические, гидрокси- и серосодержащие аминокислоты фенилаланин
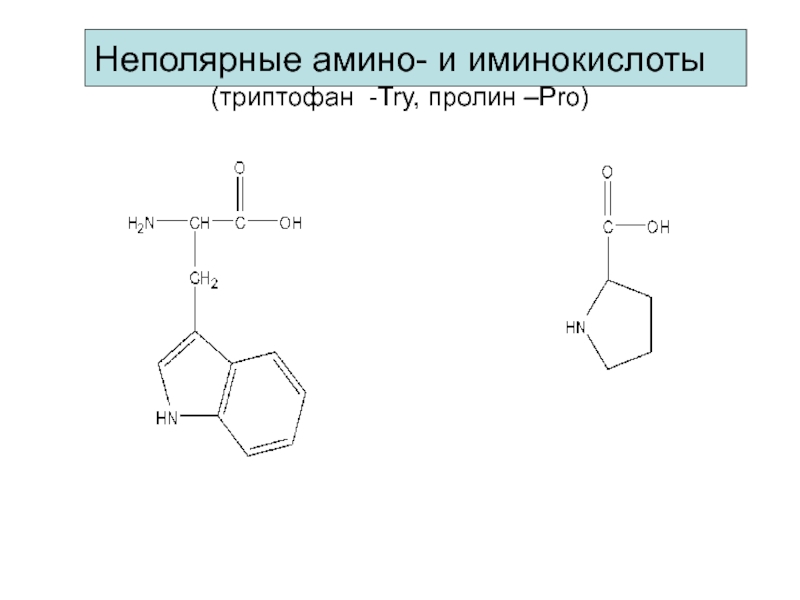
- 10. Неполярные амино- и иминокислоты (триптофан -Try, пролин –Pro)
- 11. полярные заряженные аминокислоты: Аминокислоты, содержащие вторую
- 12. Основные аминокислоты, имеющие дополнительные амино-группы, которые несут
- 13. Нейтральные аминокислоты – представляют собой амидные производные
- 14. Образование дипептидов (по принципу голова-хвост)Аминокислота 1 (С-конец)Аминокислота 2 (N-конец)Дипептид
- 15. СИНТЕЗ ПЕПТИДОВ И БЕЛКОВ
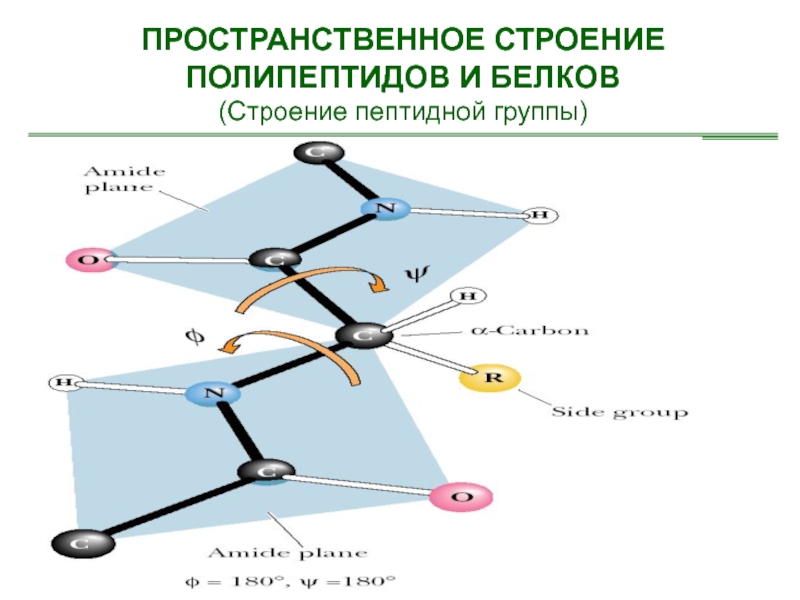
- 16. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ(Строение пептидной группы)
- 17. Классификация пептидов в зависимости от количества
- 18. Дипептиды, полипептиды Биологическая роль1. Эндогенные биорегуляторы (органоспецифичны) 2. Гормоны (более 100 гормонов)3. Токсические пептиды
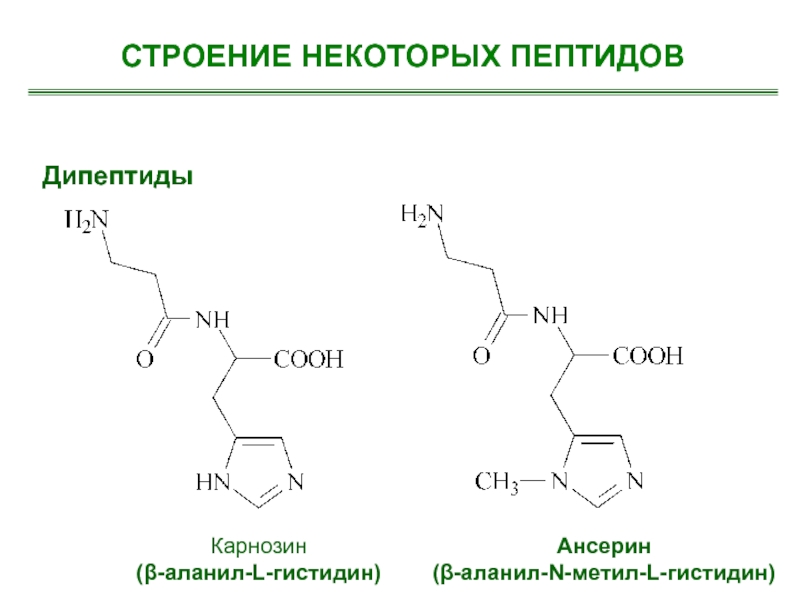
- 19. Дипептиды Карнозин (-аланил-L-гистидин) Ансерин(-аланил-N-метил-L-гистидин) СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВ
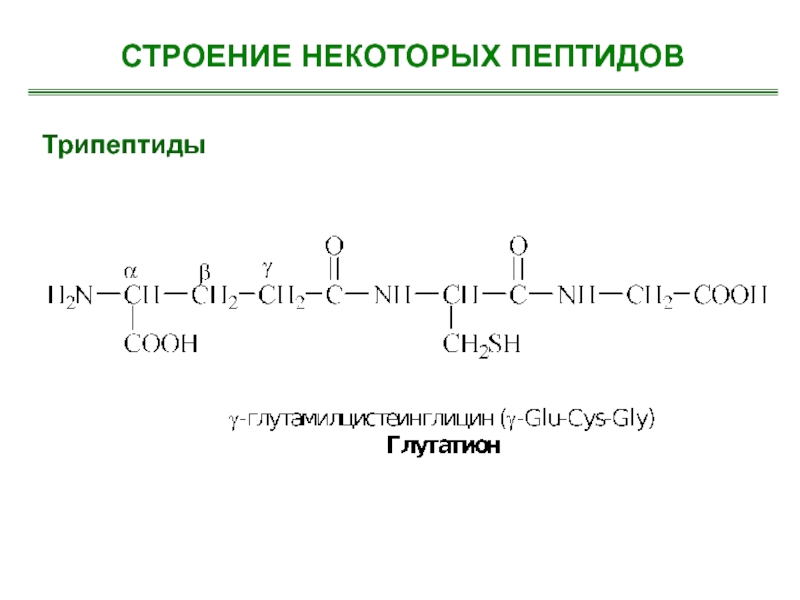
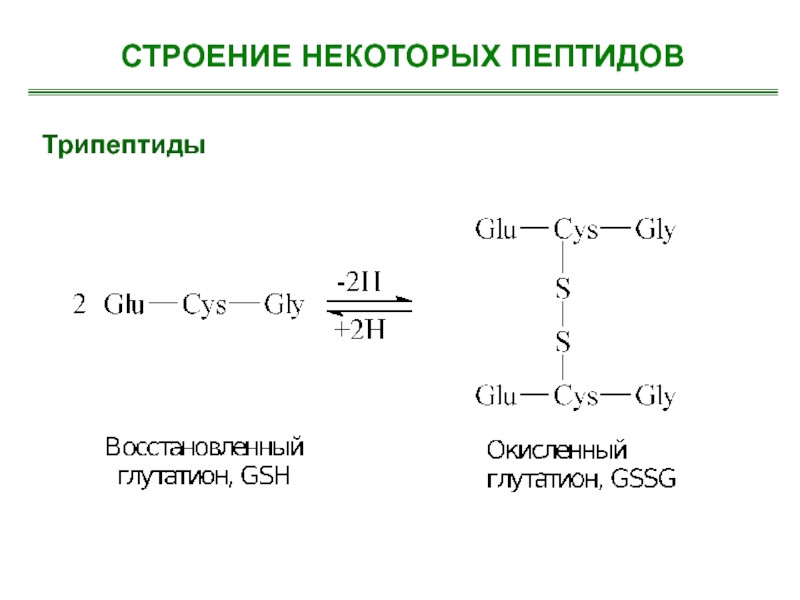
- 20. Трипептиды СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВ
- 21. Трипептиды СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВ
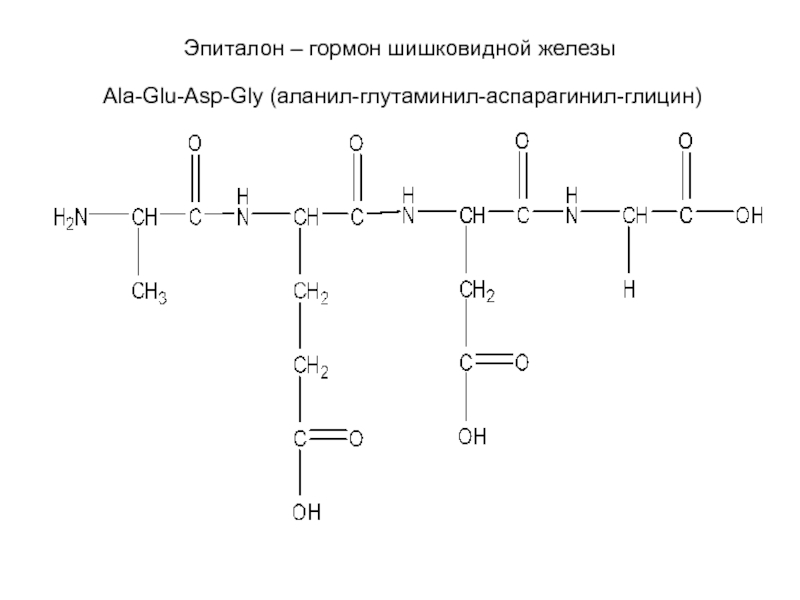
- 22. Эпиталон – гормон шишковидной железы Ala-Glu-Asp-Gly (аланил-глутаминил-аспарагинил-глицин)
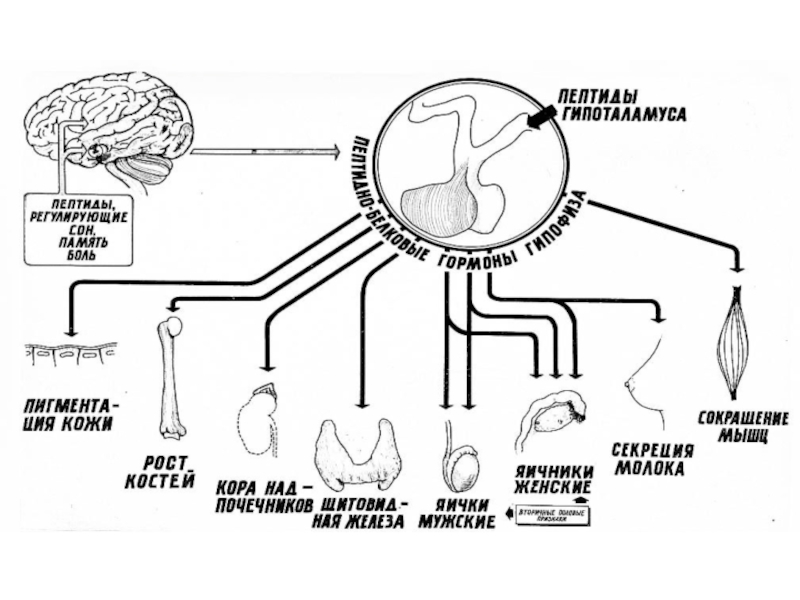
- 23. Слайд 23
- 24. Гормоны гипофизаКортикотропин (адренокортикотропный гормон (АКТГ )– 39
- 25. Слайд 25
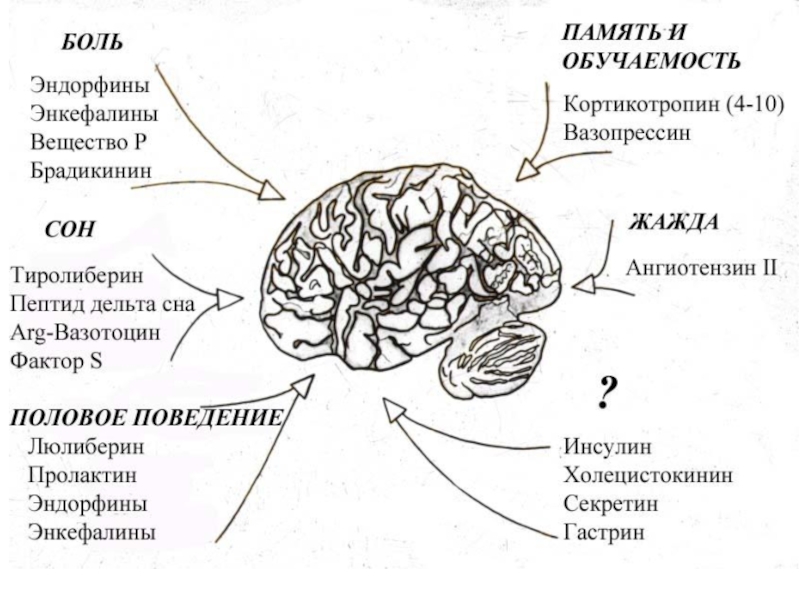
- 26. Нейропептиды Эндорфины мозга – это
- 27. Нейропептиды СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВСуществует также группа поведенческих
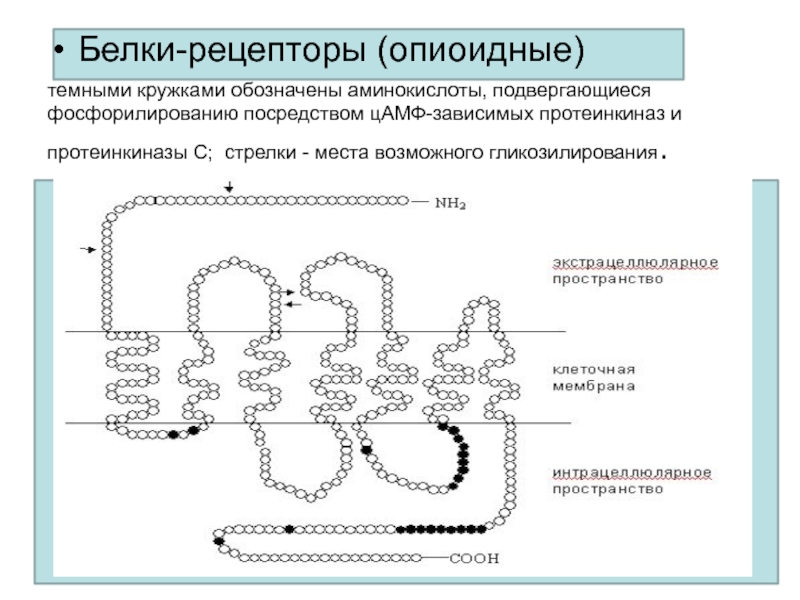
- 28. Белки-рецепторы (опиоидные)темными кружками обозначены аминокислоты, подвергающиеся фосфорилированию
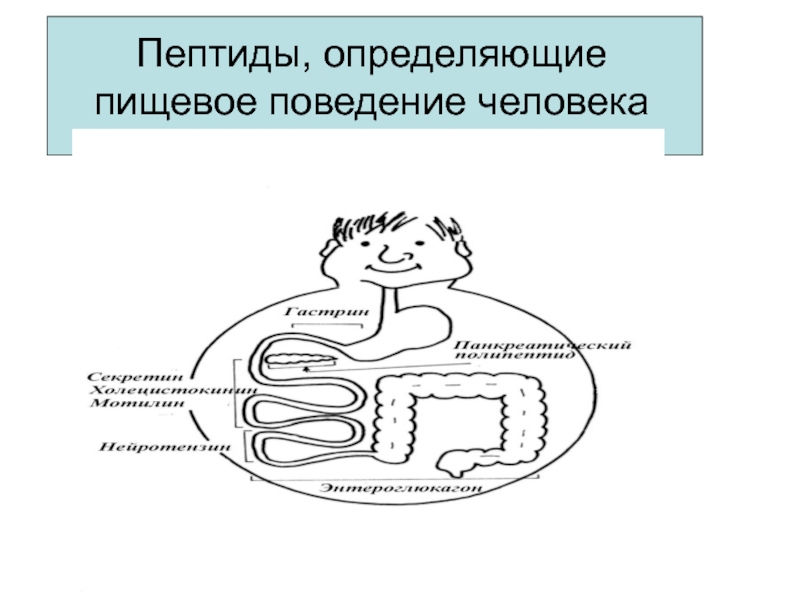
- 29. Пептиды, определяющие пищевое поведение человека
- 30. ЛептиныЛептин — гормон, регулирующий энергетический обмен.Секретируется клетками
- 31. Ангиотензин I декапептид - синтезируется в печени.
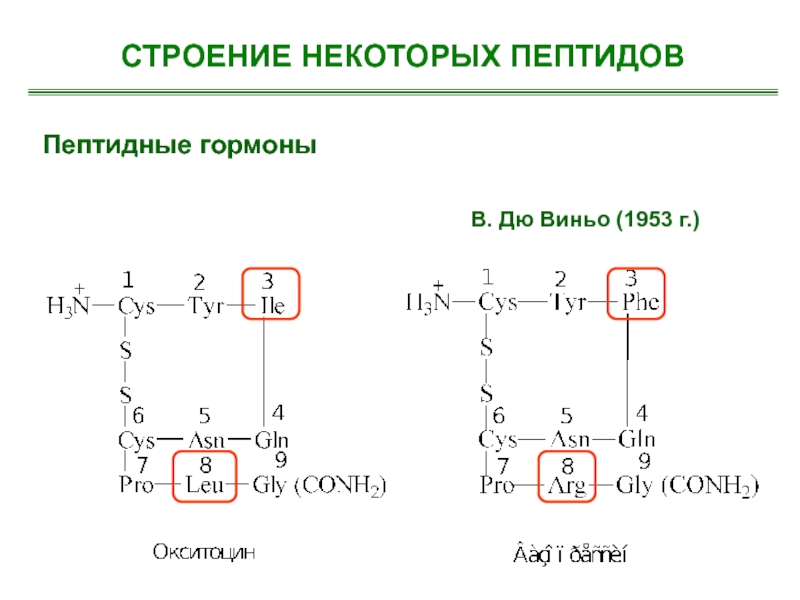
- 32. Пептидные гормоны В. Дю Виньо (1953 г.)СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВ
- 33. Токсические пептидыПептиды пчелиного яда - продукта ядовитых
- 34. Токсические пептидыТоксины моллюсков (коннотоксины) - группа пептидов,
- 35. Сывороточный фактор тимуса - нанопептид
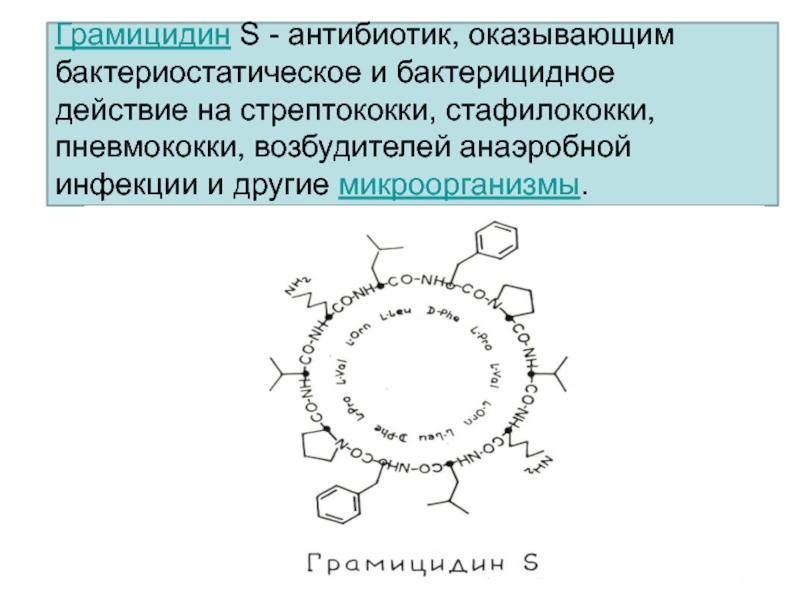
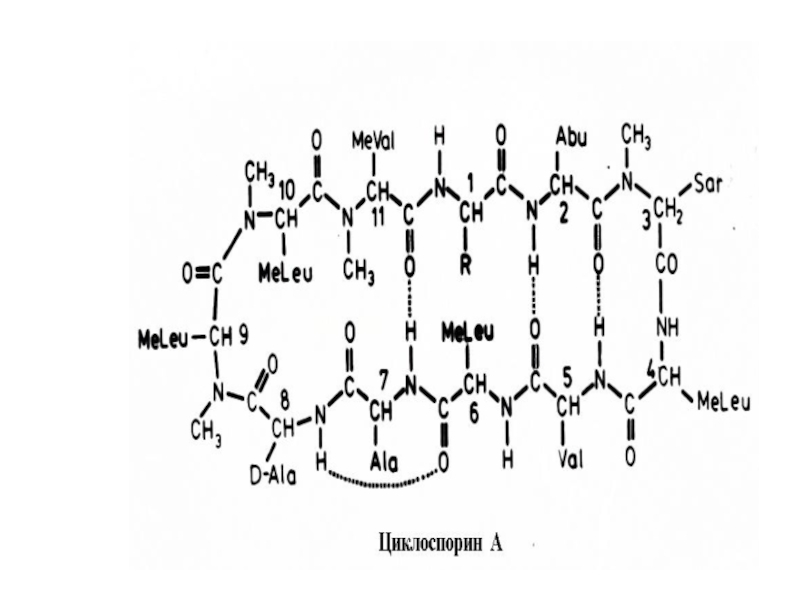
- 36. Грамицидин S - антибиотик, оказывающим бактериостатическое и
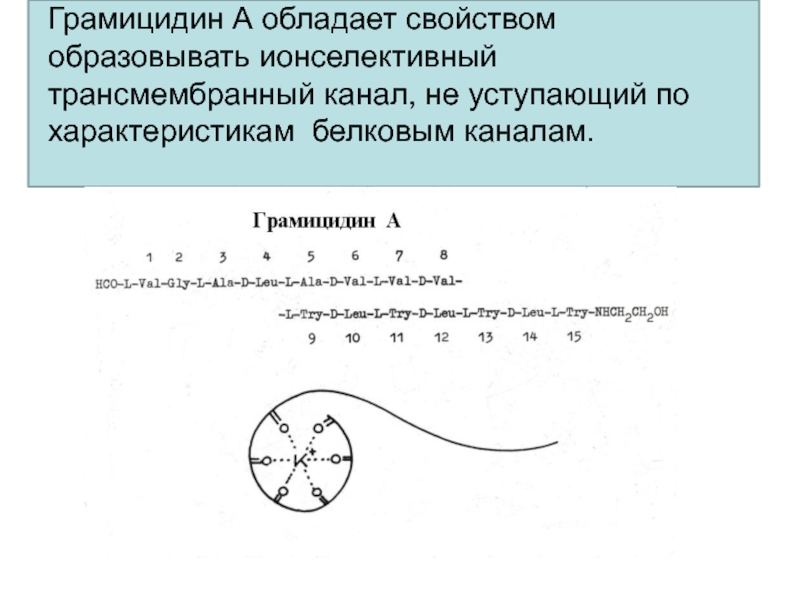
- 37. Грамицидин А обладает свойством образовывать ионселективный трансмембранный канал, не уступающий по характеристикам белковым каналам.
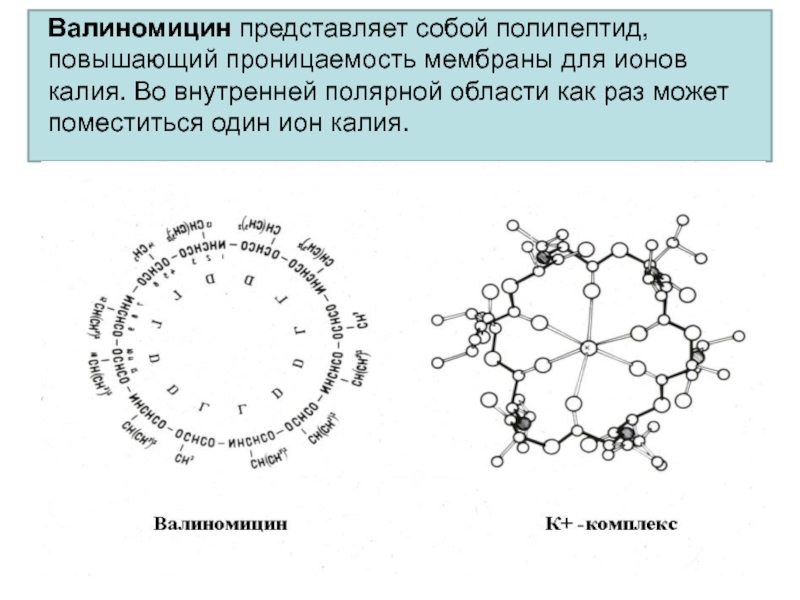
- 38. Валиномицин представляет собой полипептид, повышающий проницаемость мембраны
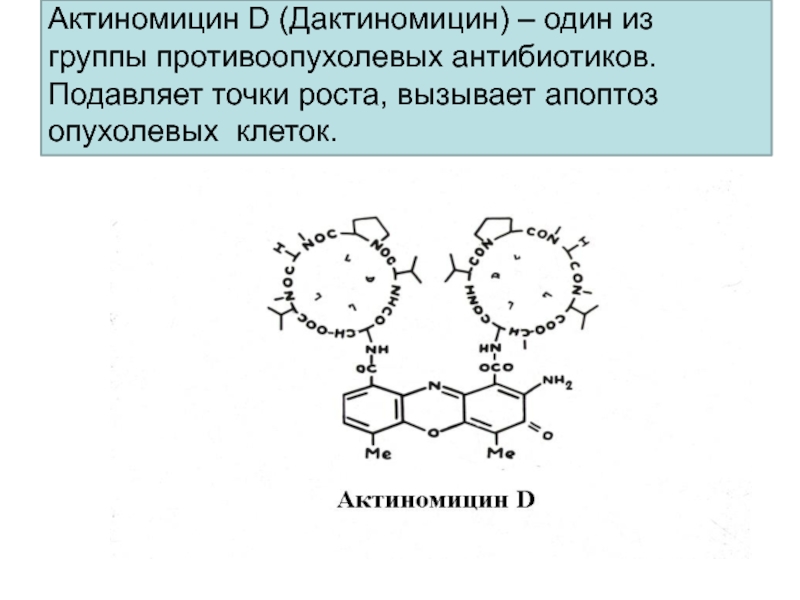
- 39. Актиномицин D (Дактиномицин) – один из группы противоопухолевых антибиотиков. Подавляет точки роста, вызывает апоптоз опухолевых клеток.
- 40. Антимикробные пептиды – возможная альтернатива традиционным антибиотикикамАнтимикробные
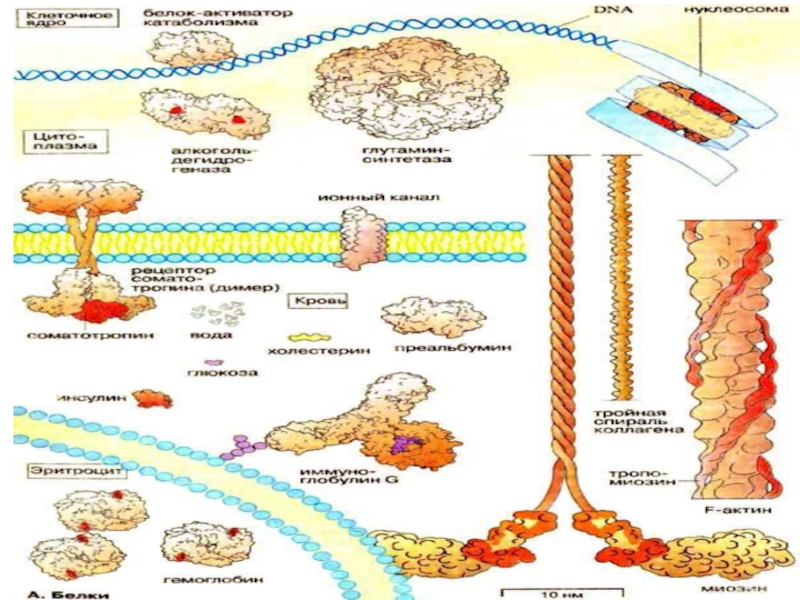
- 41. Белки- наиболее распространенные биополимерыПоследовательность аминокислот, связанных в
- 42. ПротеомикаПротеомика –наука, исследующая протеом — совокупность всех
- 43. Функции белков1. Структурообразующие функции. Отвечают за поддержание
- 44. Модель строения спирали коллагена Структурообразующие функции. Структурные
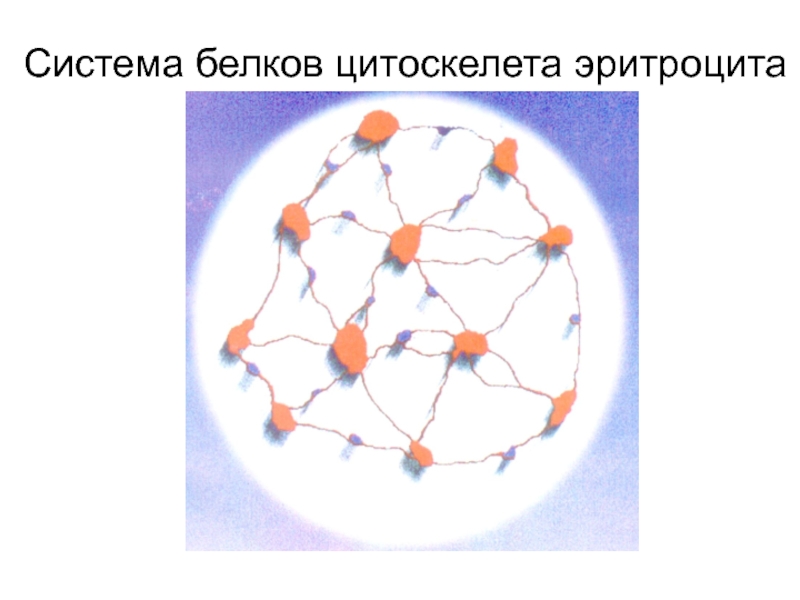
- 45. Система белков цитоскелета эритроцита
- 46. Слайд 46
- 47. Первичная структура белка - это последователь-ность расположения амино-кислотных остатков в полипептидной цепи, определяется структурой ДНК.
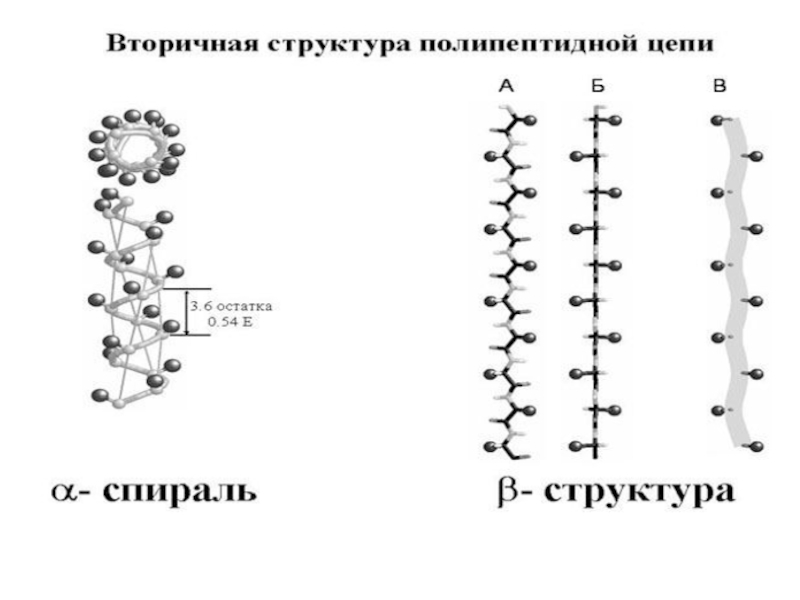
- 48. Вторичная структура белка - это упорядоченное строение
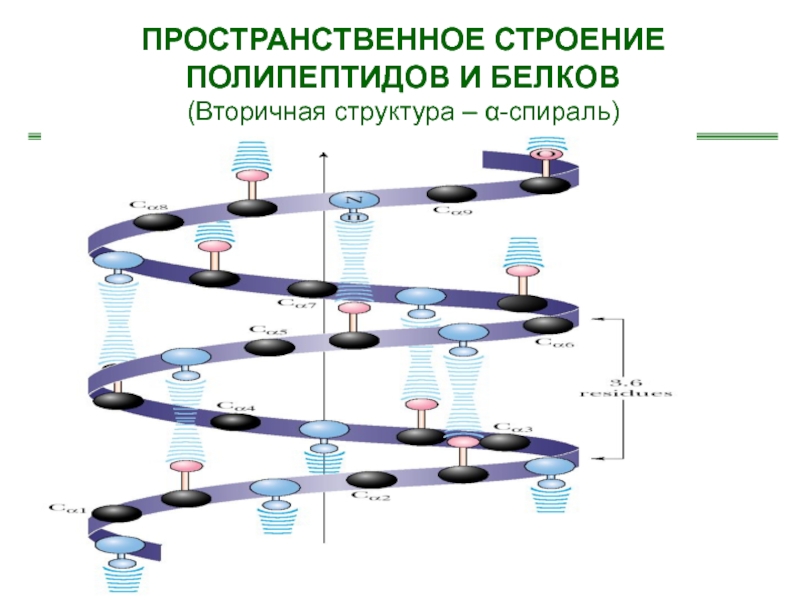
- 49. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ(Вторичная структура – α-спираль)
- 50. Слайд 50
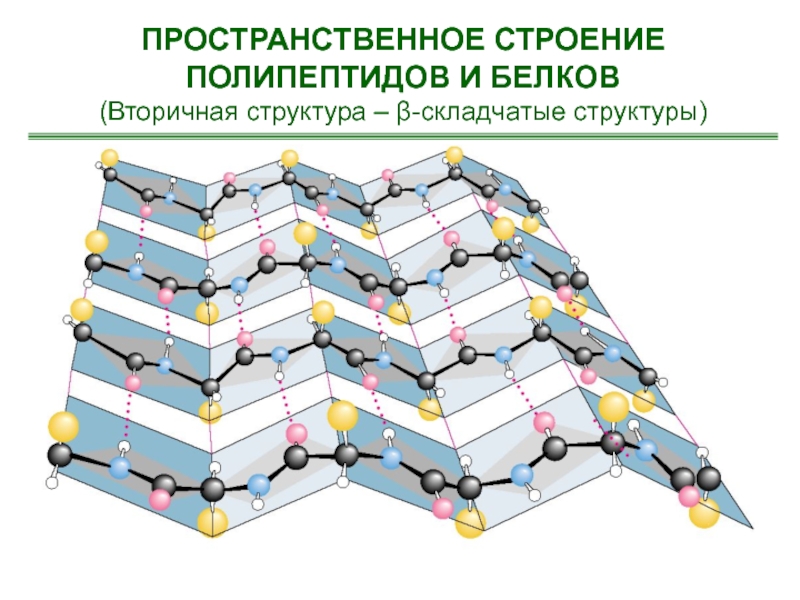
- 51. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ(Вторичная структура – β-складчатые структуры)
- 52. Третичная структура белка - расположение элементов вторичной
- 53. Что же заставляет белки сворачиваться? Гидрофобные взаимодействия.
- 54. Третичная структура полностью задается первичной структурой белкаОпределяющими
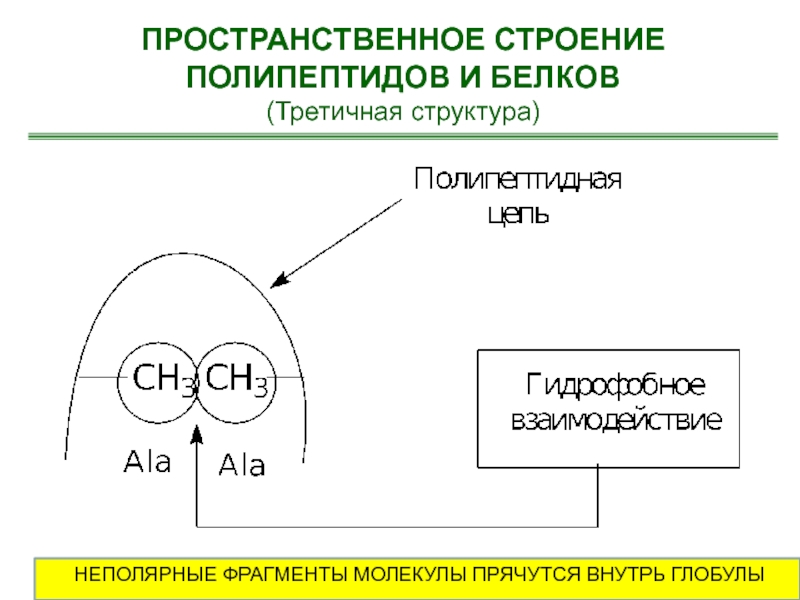
- 55. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ(Третичная структура)НЕПОЛЯРНЫЕ ФРАГМЕНТЫ МОЛЕКУЛЫ ПРЯЧУТСЯ ВНУТРЬ ГЛОБУЛЫ
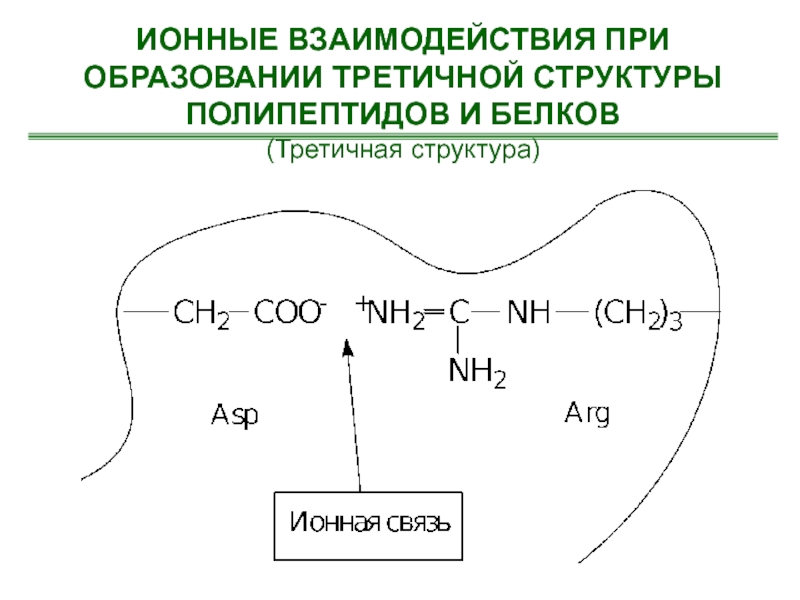
- 56. ИОННЫЕ ВЗАИМОДЕЙСТВИЯ ПРИ ОБРАЗОВАНИИ ТРЕТИЧНОЙ СТРУКТУРЫ ПОЛИПЕПТИДОВ И БЕЛКОВ(Третичная структура)
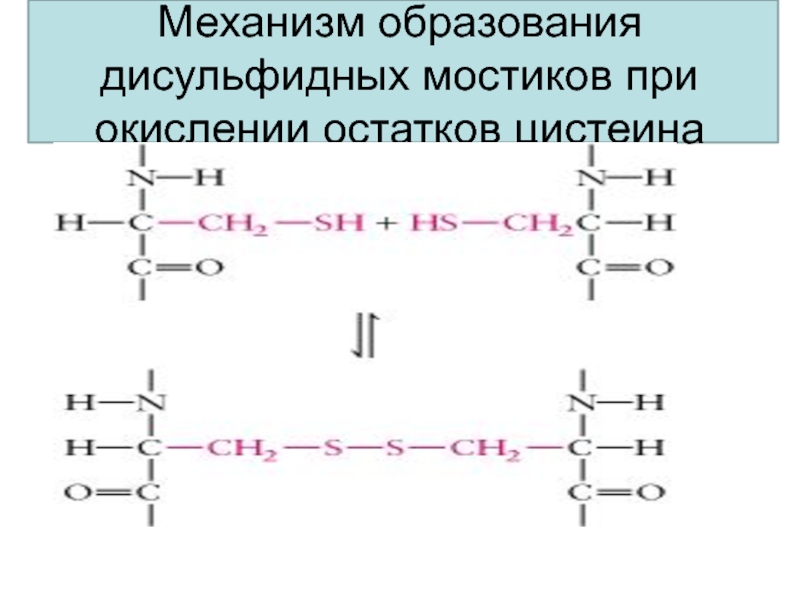
- 57. Механизм образования дисульфидных мостиков при окислении остатков цистеина
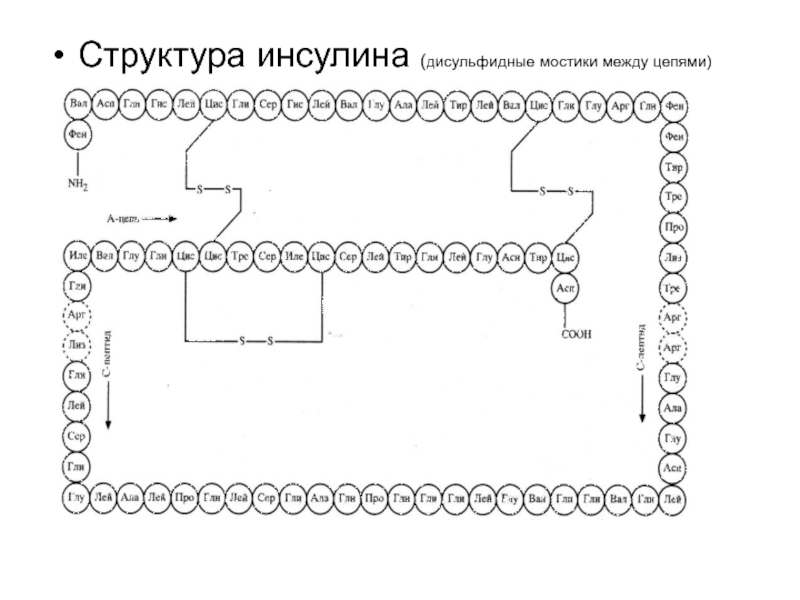
- 58. Структура инсулина (дисульфидные мостики между цепями)
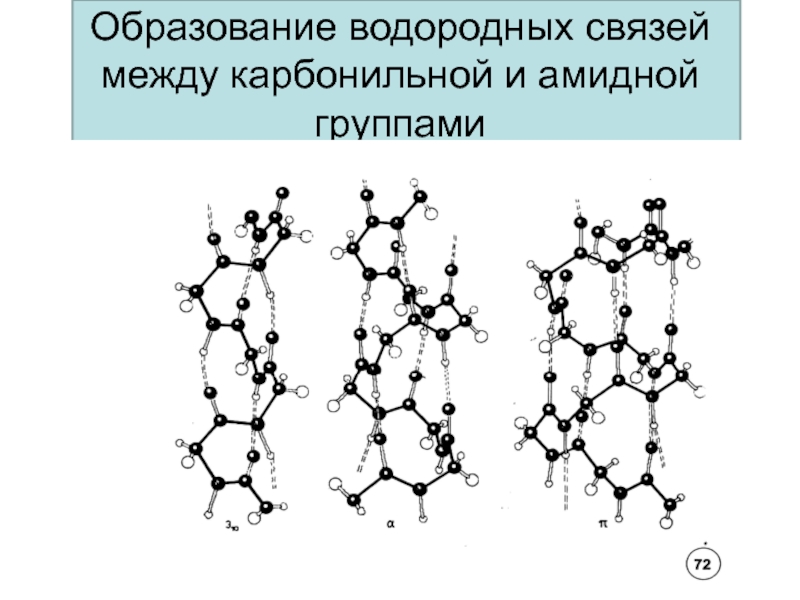
- 59. Образование водородных связей между карбонильной и амидной группами
- 60. Слайд 60
- 61. Белок при попадании в водный раствор
- 62. ПРИОННЫЕ БЕЛКИ(Болезнь -коровье бешенство - губчатая энцефалопатия)
- 63. У людей есть аналог болезни коровьего бешенства.
- 64. Серповидно-клеточная анемия как пример влияния первичной структуры
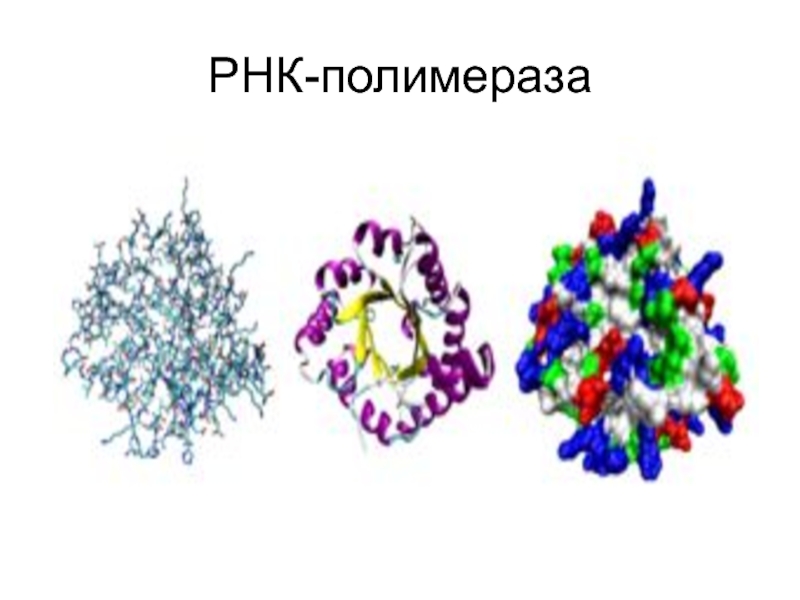
- 65. РНК-полимераза
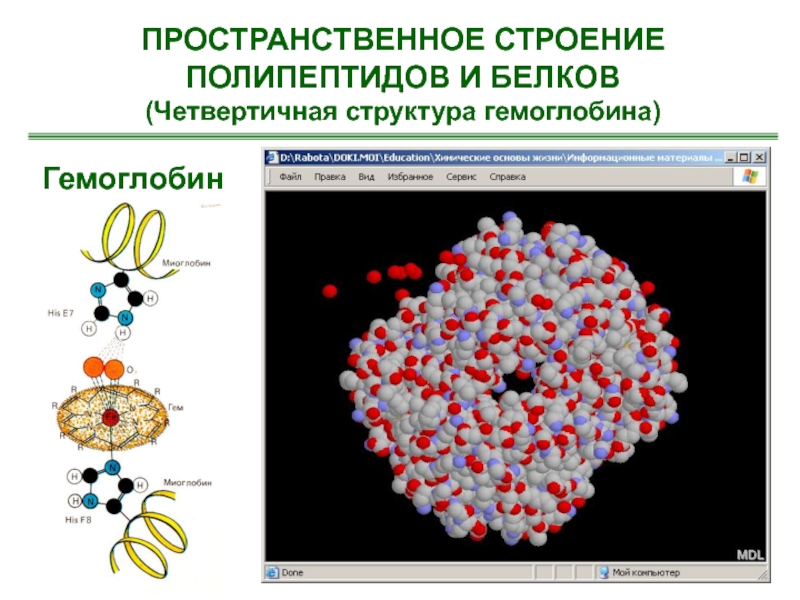
- 66. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ(Четвертичная структура гемоглобина)Гемоглобин
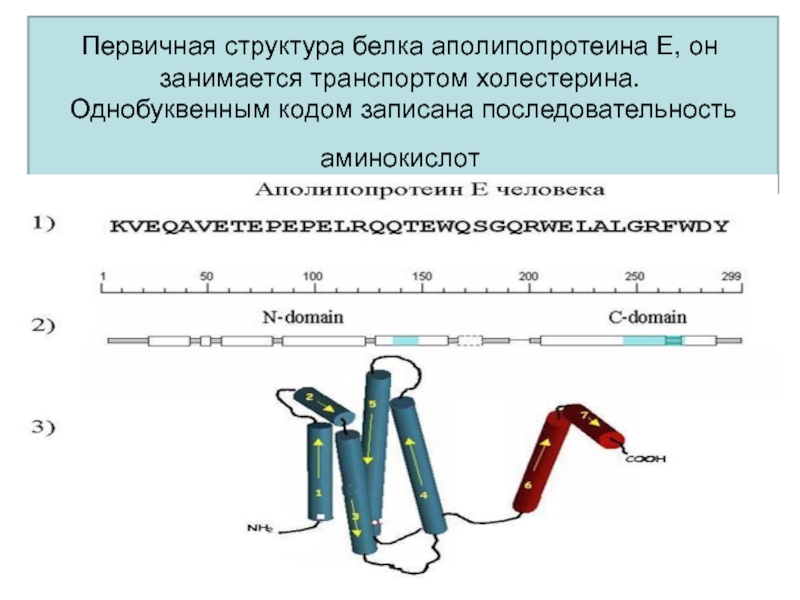
- 67. Первичная структура белка аполипопротеина Е, он занимается
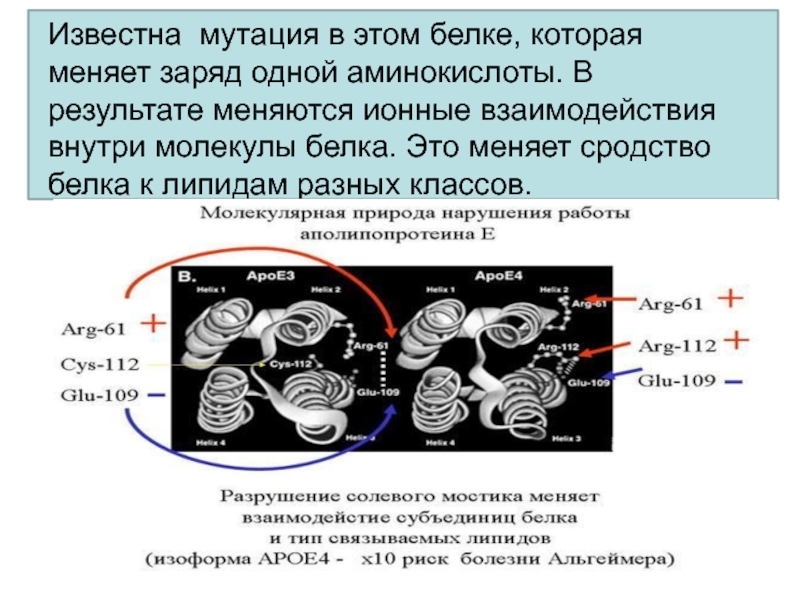
- 68. Известна мутация в этом белке, которая меняет
- 69. Функция аполипопротеида заключается в переносе липидов и
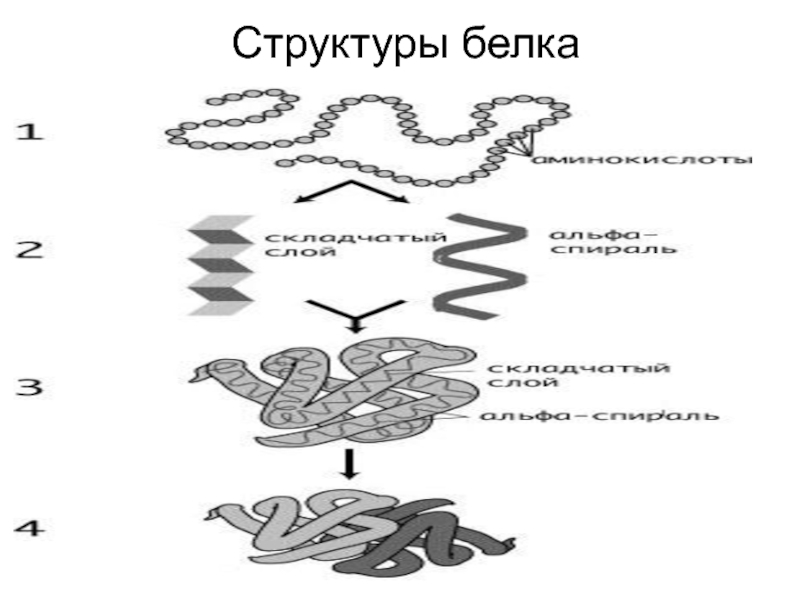
- 70. Структуры белка
- 71. Кристаллы различных белков, выращенные на космической станции
- 72. Расшифровка белка- крайне трудоемкий процесс. На расшифровку
- 73. Скачать презентанцию
Аминокислоты — бифункциональные соединения, в молекуле которых одновременно содержатся карбоксильные и амино- группы.
Слайды и текст этой презентации
Слайд 2Аминокислоты — бифункциональные соединения, в молекуле которых одновременно содержатся карбоксильные
и амино- группы.
Слайд 3Несуществующая
в природе форма
Биполярный ион
(цвиттер-ион),
внутренняя соль
ОСНОВНЫЙ
ЦЕНТР
КИСЛОТНЫЙ
ЦЕНТР
Слайд 4pH 1 Заряд +1
pH 7 Заряд 0
pH 13 Заряд -1
Цвиттерион
(нейтральный)
Анионная форма
Катионная форма
Кислотно-основные свойства аминокислот
Слайд 5 СООН СООН
Н С NH2
H2N C H
CH3 CH3 D-изомер L-изомер
Конфигурационные изомеры α аланина
(ЭНАНТИОМЕРЫ)
Конфигурационные изомеры нельзя превратить один в другой без разрыва связей
Слайд 7Классификации аминокислот,
исходя из количества карбокси- и аминогрупп (примеры)
Глицин,
моноаминомонокарбоновая
кислота
Аспаргиновая кислота,
моноаминодикарбоновая
кислота
Лизин,
диаминомонокарбоновая
кислота
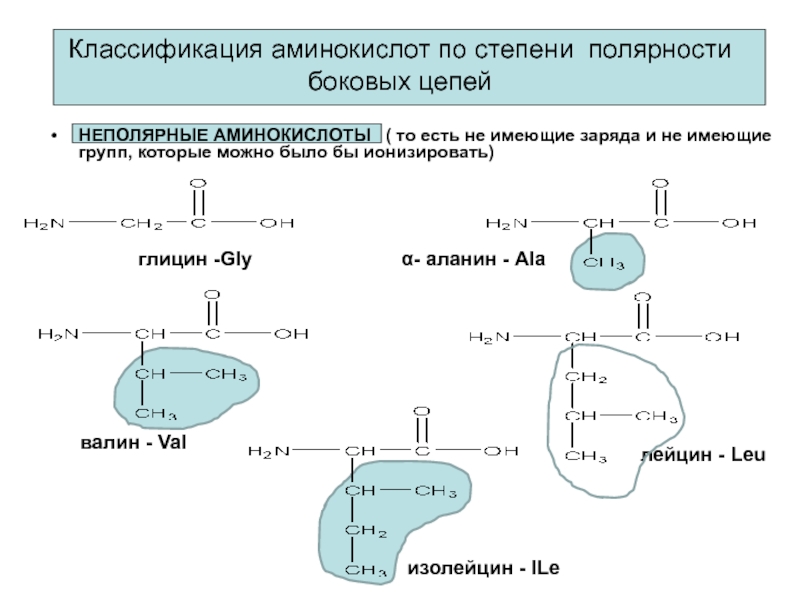
Слайд 8Классификация аминокислот по степени полярности боковых цепей
НЕПОЛЯРНЫЕ АМИНОКИСЛОТЫ (
то есть не имеющие заряда и не имеющие групп, которые
можно было бы ионизировать)глицин -Gly
α- аланин - Ala
валин - Val
лейцин - Leu
изолейцин - ILe
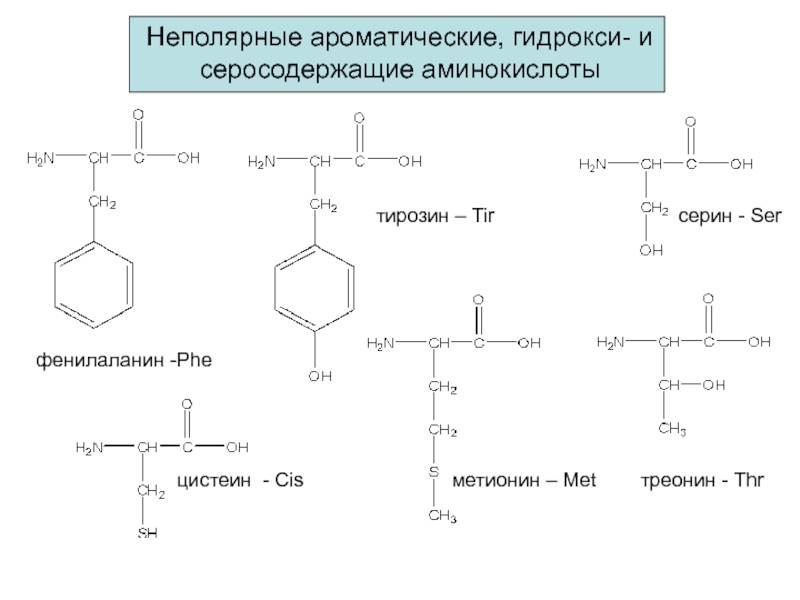
Слайд 9Неполярные ароматические, гидрокси- и серосодержащие аминокислоты
фенилаланин -Phe
метионин – Met
цистеин -
Cis
тирозин – Tir
серин - Ser
треонин - Thr
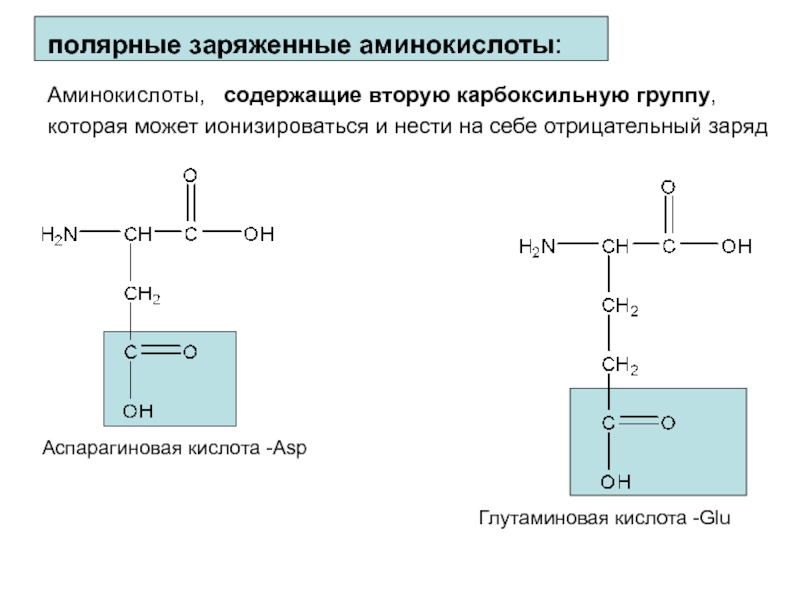
Слайд 11полярные заряженные аминокислоты: Аминокислоты, содержащие вторую карбоксильную группу, которая может
ионизироваться и нести на себе отрицательный заряд
Аспарагиновая кислота -Asp
Глутаминовая
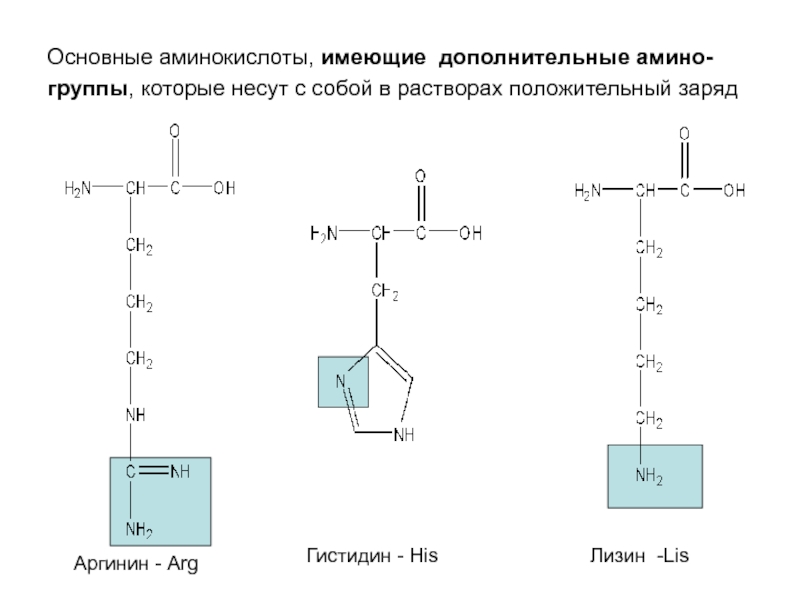
кислота -GluСлайд 12Основные аминокислоты, имеющие дополнительные амино-группы, которые несут с собой в
растворах положительный заряд
Аргинин - Arg
Гистидин - His
Лизин -Lis
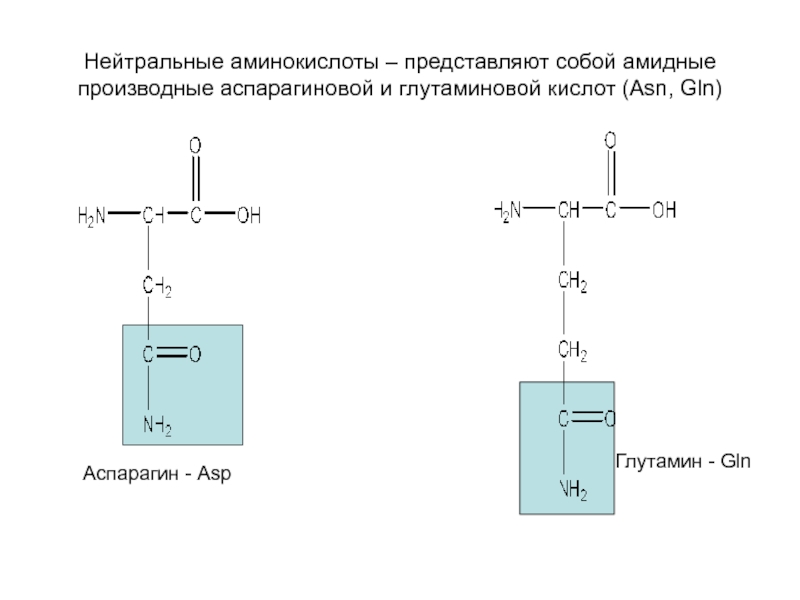
Слайд 13Нейтральные аминокислоты – представляют собой амидные производные аспарагиновой и глутаминовой
кислот (Asn, Gln)
Аспарагин - Asp
Глутамин - Gln
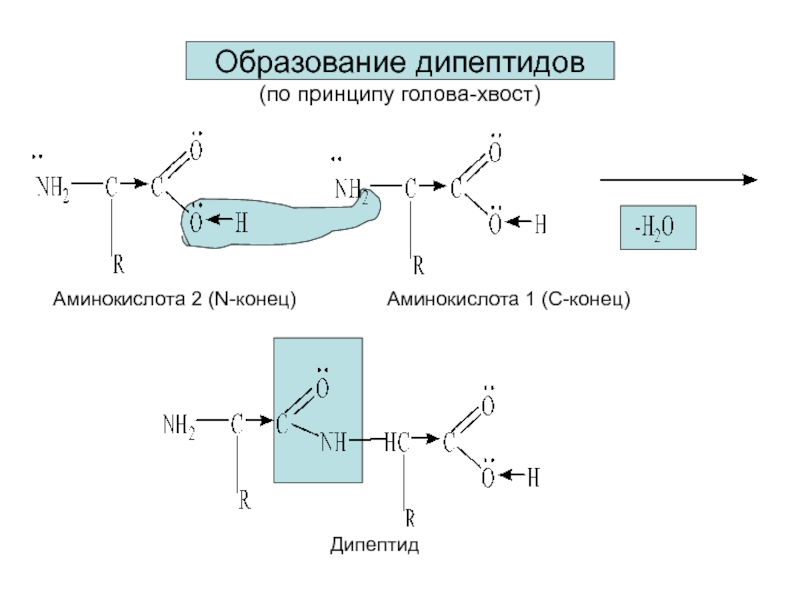
Слайд 14Образование дипептидов
(по принципу голова-хвост)
Аминокислота 1 (С-конец)
Аминокислота 2 (N-конец)
Дипептид
Слайд 17Классификация пептидов
в зависимости от количества остатков аминокислот
1. Дипептиды (2 аминокислоты)
2.
Олигопептиды (до 10 аминокислот)
3. Полипептиды (от 11 до 100 аминокислот)
4.
Белки (свыше 100 аминокислот)Слайд 18Дипептиды, полипептиды
Биологическая роль
1. Эндогенные биорегуляторы (органоспецифичны)
2. Гормоны
(более 100
гормонов)
3. Токсические пептиды
Слайд 19Дипептиды
Карнозин
(-аланил-L-гистидин)
Ансерин
(-аланил-N-метил-L-гистидин)
СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВ
Слайд 24Гормоны гипофиза
Кортикотропин (адренокортикотропный гормон (АКТГ )– 39 аминокислот
ά- Меланотропин (
-меланостиму-лирующий гормон) – 18 аминокислот
Окситоцин – 9 аминокислот
Вазопрессин – 9
аминокислотСлайд 26Нейропептиды Эндорфины мозга – это гормоны, обладающие морфиноподобным, анальгизирующим действием.
Эндорфины - собственный опий организма. Их действие связано с пептидом
(энкефалином), расположенным с N-конца молекулы эфдорфина.СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВ
Слайд 27Нейропептиды
СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВ
Существует также группа поведенческих пептидов.
Скотофобин –
особый пептид (из 15 аминокислот), вызывающий светобоязнь.
Слайд 28Белки-рецепторы (опиоидные)
темными кружками обозначены аминокислоты, подвергающиеся фосфорилированию посредством цАМФ-зависимых протеинкиназ
и протеинкиназы С; стрелки - места возможного гликозилирования.
Слайд 30Лептины
Лептин — гормон, регулирующий энергетический обмен.
Секретируется клетками жировой ткани. Этот
гормон участвует в регуляции энергетического обмена организма и массы тела.
Лептин часто называют гормоном насыщения.Существует обратная связь между количеством лептина и заболеваниями сердечно-сосудистой системы.
Кроме того, высокий уровень лептина создает высокую вероятность тромбоза.
Лептин рассматривается также в качестве одного из факторов патогенеза инсулиннезависимого сахарного диабета (диабета II типа): избыток лептина приводит к подавлению секреции инсулина, вызывает резистентность ткани к его воздействию, подавляет действие инсулина на клетки печени.
Концентрация лептина играет роль физиологического сигнала о достаточности энергетических ресурсов организма для выполнения репродуктивной функции и влияет на выработку стероидных гормонов в яичниках. В период полового созревания происходит повышение концентрации лептина в крови.
Слайд 31Ангиотензин I декапептид - синтезируется в печени. В мембране кровеносных
сосудов, особенно в легких под действием ферментов он превращается в
ангиотензин II. Этот октапептид является гормоном и одновременно нейромедиатором. Ангиотензин II благодаря выраженному суживающему действию на сосуды повышает кровяное давление, в почках способствует уменьшению выведения ионов Na+ и воды.Эритропоэтин — полипептидный гормон, образуется в основном в почках и печени. Гормон контролирует дифференцировку стволовых клеток костного мозга и обеспечивает превращение их в эритроциты. Секреция эритропоэтина стимулируется при гипоксии (pO2↓).
Слайд 33Токсические пептиды
Пептиды пчелиного яда - продукта ядовитых желез пчелы (апамин,
мелитин, пептид 401 (МСД-пептид), адолапин, протеазные ингибиторы, секапин, терциапин и
др.)Пептиды- токсины ядовитых грибов
Аматоксины (35 видов) определяют токсическое действие грибов. Смертельно опасная доза составляет 0,1 мг/кг массы тела человека
Фаллотоксины - токсины бледной поганки и близких к ней видов ядовитых грибов Фаллотоксины оказывают специфическое гепатотоксическое действие.
Слайд 34Токсические пептиды
Токсины моллюсков (коннотоксины) - группа пептидов, выделенных из яда
хищных морских моллюсков рода Conus. Токсины используются моллюсками для защиты,
жертва лишается чувствительности. На основе коннотоксинов получен новый класс обезболивающих средств.Токсины змеиного яда – нейротоксины - парализуют нервную систему жертвы.
геморрагины - разрушают эндотелий сосудов, вызывают кровоточивость, нарушающие свертывание крови, некроз тканей и дисфункцию многих органов, снижение сердечного выброса; Многие змеиные яды вызывают полиорганную недостаточность
Бактериальные токсины –например, дифтерийный токсин.
Слайд 36Грамицидин S - антибиотик, оказывающим бактериостатическое и бактерицидное действие на
стрептококки, стафилококки, пневмококки, возбудителей анаэробной инфекции и другие микроорганизмы.
Слайд 37Грамицидин А обладает свойством образовывать ионселективный трансмембранный канал, не уступающий
по характеристикам белковым каналам.
Слайд 38Валиномицин представляет собой полипептид, повышающий проницаемость мембраны для ионов калия.
Во внутренней полярной области как раз может поместиться один ион
калия.Слайд 39Актиномицин D (Дактиномицин) – один из группы противоопухолевых антибиотиков. Подавляет
точки роста, вызывает апоптоз опухолевых клеток.
Слайд 40Антимикробные пептиды – возможная альтернатива традиционным антибиотикикам
Антимикробные пептиды – это
относительно короткие молекулы (в среднем 30-40 аминокислот), способные убивать клетки
микроорганизмов.Являются первичным эшелоном защиты от патогенов и задействованы в системе врожденного иммунитета. Открыто 800 таких пептидов.
Ряд пептидов производится собственно микроорганизмами. Например, Lactococus casea, молочнокислые бактерии – продуцирует высокоактивный пептид низин (популярная добавка ко всем «иммунизирующим» иогуртам типа Актимель)
Слайд 41Белки- наиболее распространенные биополимеры
Последовательность аминокислот, связанных в белке пептидными связями,
составляет его первичную структуру.
При записи первичной структуры аминокислоты обозначают обычно
трехбуквенным кодом, по первым трем буквам названия, либо используют однобуквенный код. Слайд 42Протеомика
Протеомика –наука, исследующая протеом — совокупность всех протеиновых (белковых, пептидных)
молекул, которые имеются в клетке. Рrotos означает «первый, первенствующий». В
мифологии известен бог Протей способный превращаться в любое существо и владеющий даром прорицания.Слайд 43Функции белков
1. Структурообразующие функции. Отвечают за поддержание формы клеток и
тканей ( коллаген).
Транспортные функции
(гемоглобин, трансферрин, церуллоплазмин, преальбумин, ионные
каналы, интегральные белки). Защитные функции.
Белки имунной системы ( иммуноглобулины).
Регуляторные функции.
Гормоны (соматотропин, инсулина и др. ).
Каталитические функции. 2100 белков – ферментов (супероксиддисмутаза, каталаза, алкогольдегидрогеназа) .
Двигательные функции. Белки – отвечающие за мышечное сокращение (актин, миозин, тропомиозин).
Запасные функции. Запасные белки, которые мобилизуются при крайней необходимости (казеин).
Слайд 44Модель строения спирали коллагена
Структурообразующие функции. Структурные белки отвечают за
поддержание формы и стабильности клеток и тканей. Например, коллаген.
Слайд 47Первичная структура белка - это последователь-ность расположения амино-кислотных остатков в
полипептидной цепи,
определяется структурой ДНК.
Слайд 48Вторичная структура белка - это упорядоченное строение полипептидных цепей, обусловленное
образованием водородных связей между группами С=О и N-H разных аминокислот.
Вторичная структура может быть – α- или β-спиралью и складчатой структурой.На один виток -спирали с диаметром 10.1Å приходится 3,6 аминокислотных остатков.
Слайд 51ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ
(Вторичная структура – β-складчатые структуры)
Слайд 52Третичная структура белка - расположение элементов вторичной структуры (альфа-спиралей) в
пространстве относительно друг друга (пространственная конформация полипептида) (формирование глобулы)
Слайд 53Что же заставляет белки сворачиваться?
Гидрофобные взаимодействия. Существуют полярные и
неполярные аминокислоты. В водном окружении гидрофобные (неполярные) аминокислоты прячутся внутрь
спирали, образуя структуру с минимальной потенциальной энергией.Ионные взаимодействия. Заряженные разноименные остатки аминокислотные остатки притягиваются друг к другу, а разноименные – отталкиваюися. Наличие гидрофобных или заряженных участков в полипептидной цепи, определяет то, как белок свернется.
Ковалентные связи между остатками двух цистеинов (дисульфидные мостики), образующиеся а счет окисления аминокислоты цистеина.
Водородные связи. Участвуют все аминокислоты, имеющие гидроксильные, амидные или карбоксильные группы.
Слайд 54Третичная структура полностью задается первичной структурой белка
Определяющими являются гидрофобные взаимодействия
аминокислот в силу их многочисленности. Гидрофобное ядро существует у большинства
белков.На поверхности третичной структуры белка находятся, как правило –SH –группы цистеина.
Слайд 55ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ
(Третичная структура)
НЕПОЛЯРНЫЕ ФРАГМЕНТЫ МОЛЕКУЛЫ ПРЯЧУТСЯ ВНУТРЬ
ГЛОБУЛЫ
Слайд 56ИОННЫЕ ВЗАИМОДЕЙСТВИЯ ПРИ ОБРАЗОВАНИИ ТРЕТИЧНОЙ СТРУКТУРЫ ПОЛИПЕПТИДОВ И БЕЛКОВ
(Третичная структура)
Слайд 61 Белок при попадании в водный раствор принимает ту конформацию, в
которой он должен работать. Если в первичной структуре белков имеются
нарушения, то белки сворачиваются неправильно, то это может иметь катастро-фические последствия.Слайд 62ПРИОННЫЕ БЕЛКИ
(Болезнь -коровье бешенство - губчатая энцефалопатия)
Только в Англии
в 2005 г. было уничтожено 12 млн., в 2008 –
4 млн. коров.Коровье бешенство вызывается не вирусом и не бактерией, а особым клеточным агентом – неправильно свернутым белком.
Это происходит потому, что белки, которые в норме в клетке взаимодействовали бы с этим белком, не могут этого сделать, так как он свернут неправильно, и поэтому клетка начинает неправильно функционировать.
Слайд 63У людей есть аналог болезни коровьего бешенства. Это заболевание куру.
Болезнь описана у народов, имеющих привычку съедать мозги умерших предков
(из уважения к последним). В них как раз и находились инфек-ционные белки.В связи с этим опытом чело-век всегда хоронит умерших (родственников, друзей и даже врагов).
Слайд 64Серповидно-клеточная анемия как пример влияния первичной структуры на третичную и
четвертичную.
Известны наследственные заболевания, обусловленные мутацией по 1 или 2
аминокислотам.В эритроцитах содержится гемоглобин - комплекс белка глобина с небелковой железосодержащей частью - гемом.
Глобин состоит из двух альфа- и двух бета- полипептидных цепей. В белковой части глобина 574 аминокислоты, в результате мутации заменяется 2 аминокислоты.
Такой гемоглобин теряет растворимость, образуется волокнистый осадок, деформирующий эритроцит.
Дети - рецессивные гомозиготы по такому аллелю не доживают до двух лет (в популяции – 25%). У гетерозигот 85% нормальных и 15% дефектных эритроцитов.
Слайд 66ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ
(Четвертичная структура гемоглобина)
Гемоглобин
Слайд 67Первичная структура белка аполипопротеина Е, он занимается транспортом холестерина.
Однобуквенным кодом записана последовательность аминокислот
Слайд 68Известна мутация в этом белке, которая меняет заряд одной аминокислоты.
В результате меняются ионные взаимодействия внутри молекулы белка. Это меняет
сродство белка к липидам разных классов.Слайд 69Функция аполипопротеида заключается в переносе липидов и холестерина.
У
людей с такой мутацией более высокий уровень холестерина и выше
уровень риска развития старческого слабоумия.Примерно у 15% европейцев и американцев отмечается такая мутация, у бушменов же это число достигает 40%, но старческого слабоумия у них не бывает, так как у них низко холестериновая диета и много физических нагрузок. У людей же с западной «диетой» - проявляются последствия мутации - возникает гиперхолестеринемия.
Слайд 71Кристаллы различных белков, выращенные на космической станции «Мир» и во
время полётов шаттлов НАСА. Высокоочищенные белки при низкой температуре образуют
кристаллы, которые используют для получения модели данного белка.Слайд 72
Расшифровка белка- крайне трудоемкий процесс. На расшифровку гемоглобина потребовалось 26
лет.
В настоящее время ежегодно расшифровывают 60-70 белков, на это
тратится 80-90 млд. долларов и усилия многих химиков, биохимиков и молекулярных биологов. Изучая первичную структуру белков можно определить участок ДНК, кодирующий определенный белок.