Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция N Взаимодействие металлов с водой, растворами солей, щелочей и кислот
Содержание
- 1. Лекция N Взаимодействие металлов с водой, растворами солей, щелочей и кислот
- 2. Характер взаимодействия металлов с водой.При обычной температуре
- 3. Примеры взаимодействия металлов с водой.2Na + 2H2O
- 4. В раскаленном состоянии железо реагирует с перегретым
- 5. С растворами щелочей реагируют металлы, оксиды и
- 6. Характер взаимодействия металлов с растворами солейКаждый более
- 7. Характер взаимодействия металлов с кислотами.По отношению к
- 8. По отношению к кислотам все металлы можно
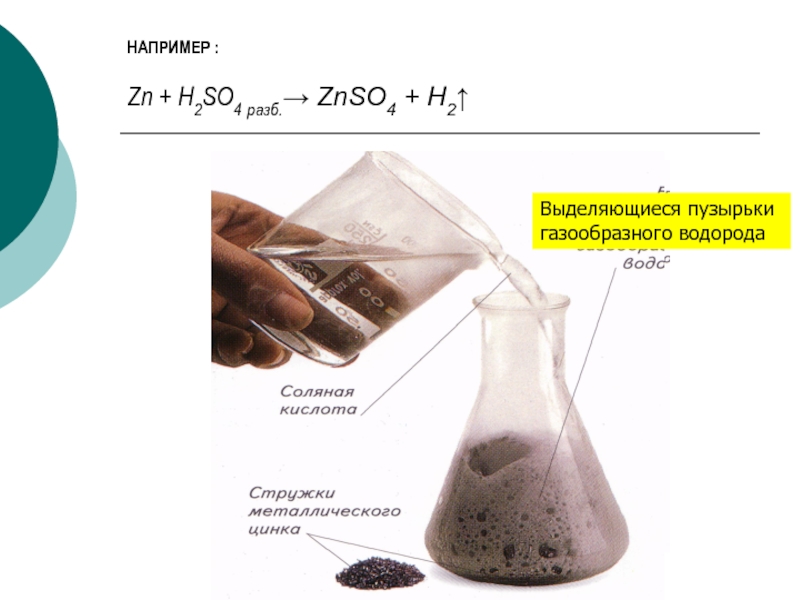
- 9. Взаимодействие металлов с обычными кислотамиС обычными кислотами
- 10. НАПРИМЕР : Zn
- 11. Характер взаимодействия концентрированной H2SO4 с металлами. не
- 12. Характер взаимодействия HNO3 с
- 13. Примеры реакций.4HNO3 (конц.)+ Cu = Cu(NO3)2 + 2NO2
- 14. Скачать презентанцию
Характер взаимодействия металлов с водой.При обычной температуре с водой взаимодействуют только наиболее активные металлы, стоящие в ряду активностей до магния.РЯД АКТИВНОСТЕЙ МЕТАЛЛОВ:Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn,
Слайды и текст этой презентации
Слайд 1Лекция N
Взаимодействие металлов с водой, растворами солей, щелочей и кислот.
Профессор
Рыбальченко В.С.
Слайд 2Характер взаимодействия металлов с водой.
При обычной температуре с водой взаимодействуют
только наиболее активные металлы, стоящие в ряду активностей до магния.
РЯД
АКТИВНОСТЕЙ МЕТАЛЛОВ:Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd,Co, Ni, Sn, Pb, H , Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
Реакция протекает по схеме:
Мe0 + H2O → Me+n(OH)n + H2↑
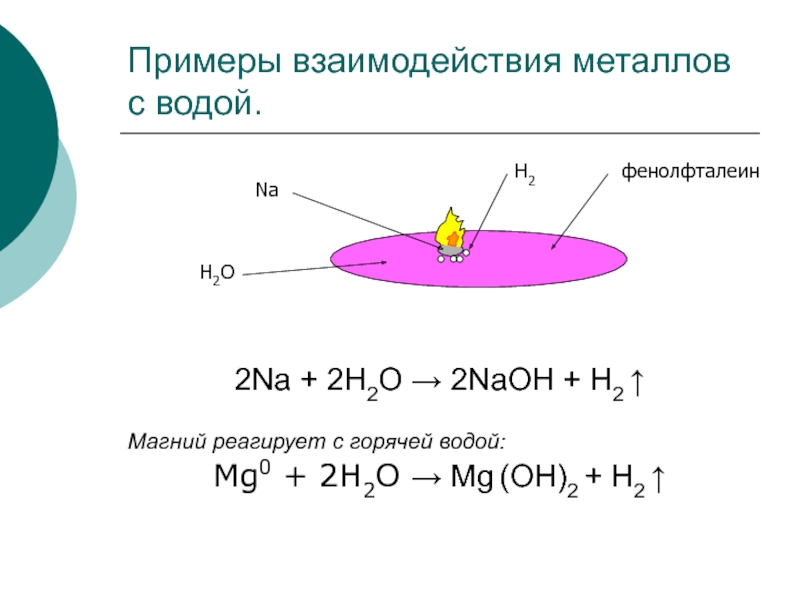
Слайд 3Примеры взаимодействия металлов с водой.
2Na + 2H2O → 2NaOH +
H2 ↑
Магний реагирует с горячей водой:
Мg0 + 2H2O → Mg
(OH)2 + H2 ↑фенолфталеин
Na
H2O
H2
Слайд 4В раскаленном состоянии железо реагирует с перегретым водяным паром.
Железо-паровой способ
получения водорода:
2Fe + 3H2O = Fe2O3 + 3H2
Раскаленное
Нагретый парСлайд 5С растворами щелочей реагируют металлы, оксиды и гидроксиды которых обладают
амфотерными свойствами.
В щелочных средах неустойчивы Al, Zn и их сплавы.
2Al
+ 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2↑
Слайд 6Характер взаимодействия металлов с растворами солей
Каждый более активный металл (не
взаимодейству-ющий с водой) способен вытеснить стоящий за ним металл из
растворов его солей.Например:
Cu + AgNO3 = Cu(NO3)2 + Ag
Cu + Hg(NO3)2 = Cu(NO3)2 + Hg
AgNO3
Ag
Cu
Cu(NO3)2
Слайд 7Характер взаимодействия металлов с кислотами.
По отношению к металлам все кислоты
можно подразделить на:
Все кислоты, кроме H2SO4 конц.
и HNO3 любой
концентрацииH2SO4 конц.
и HNO3 любой концентрации
Слайд 8По отношению к кислотам все металлы можно подразделить на:
Fe, Cr,
Al
Au, Pt, Ir, Os
Активными металлами считают металлы, расположенные в ряду
активностей до водорода.Слайд 9Взаимодействие металлов с обычными кислотами
С обычными кислотами взаимодействуют только активные
металлы.
Реакция протекает по схеме:
Me 0+ H+1An → Me+nAn + H20
металл + кислота → соль + водород
Слайд 11Характер взаимодействия концентрированной H2SO4 с металлами.
не взаимодействует с благородными
металлами;
в концентрированном состоянии без нагревания пассивирует Fe, Cr и
Al;с остальными металлами реакция протекает по схеме:
SO2
Me + H2SO4 = MeSO4 + S0 + H2O
H2S-2
Глубина восстановления S+6 определяется активностью металла: чем активнее металл, тем больше меняется степень окисления.
+6
+n
0
+4
Слайд 12
Характер взаимодействия HNO3 с металлами.
не взаимодействует с благородными металлами;
в концентрированном состоянии без нагревания пассивирует Fe, Cr и
Al;с остальными металлами реакция протекает по схеме:
N+4O2
Me0 + HN+5O3 = Me+nNO3 + N+2O + H2O
N2+1O
N-3H4NO3
Глубина восстановления N+5 зависит :
I) от активности металла: чем активнее металл, тем глубже происходит
изменение степени окисления.
II) от концентрации кислоты: чем более разбавлена кислота, тем глубже
происходит изменение степени окисления.
I
II
Слайд 13Примеры реакций.
4HNO3 (конц.)+ Cu =
Cu(NO3)2 + 2NO2 + 2H2O
8HNO3 (разб.)
+ 3Cu =
3Cu(NO3)2 + 2NO +4H2O
10HNO3 (с.разб.) +
4Са =4Ca(NO3)2 + NН4 NO3 + 3H2O