Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция №1 Атомно-молекулярное учение. Основные законы химии. Понятие об
Содержание
- 1. Лекция №1 Атомно-молекулярное учение. Основные законы химии. Понятие об
- 2. ИСТОРИЯ РАЗВИТИЯ АТОМНО-МОЛЕКУЛЯРНОГО УЧЕНИЯЛевкип(500—440 до н. э.)
- 3. Слайд 3
- 4. Закон эквивалентов4. Закон эквивалентов В.Рихтер, 1792—1794 гг.
- 5. Пример: Молярная масса эквивалента некоторого металла равна
- 6. Пример 2: В оксиде некоторого элемента
- 7. Эквивалент – это реальная или условная
- 8. Между H3PO4 и КОН также могут происходить
- 9. 5. Закон Авогадро - в равных объемах различных
- 10. Из Уравнения Менделеева-Клапейрона выводятся еще 3 закона:Закон
- 11. Основные положения атомно-молекулярного ученияСуществуют вещества с молекулярным
- 12. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2ИСТОРИЯ РАЗВИТИЯ АТОМНО-МОЛЕКУЛЯРНОГО УЧЕНИЯ
Левкип(500—440 до н. э.) - материальный мир
дискретен, он состоит из мельчайших частиц и пустоты;
Демокрит (460—370 до
н. э.) - назвал мельчайшие частицы “неделимые”, что по-гречески значит “атом. Демокрит, развил новое учение — “атомистику”, приписал атомам такие “современные” свойства, как размер и форму, способность к движению;Эпикур (342—270 до н. э.) - предположил, что у атомов существует внутренний источник движения и они сами способнывзаимодействовать друг с другом.
Прошло 20 веков……
французский философ Пьера Гассенди (1592—1655 гг.) восстановил и собрал воедино забытые концепции древнегреческих философов, которые он подробно изложил в своих трудах ;
Р. Бойлем (1627—1691 гг.) установил фундаментальную закономерность, описывающую изменения объема газа от его давления.
Слайд 4Закон эквивалентов
4. Закон эквивалентов В.Рихтер, 1792—1794 гг. Все вещества реагируют
и образуются в эквивалентных соотношениях. Эквивалентное соотношение означает одинаковое число
моль эквивалентов. Рассмотрим реакцию, записанную в общем виде:aA + bB = cC + dD,
где A, B – реагенты, C, D – продуты, а,b,c,d – стехиометрические коэффициенты;
справедливо равенство: n(1/z А) = n(1/z B) = n(1/z С) = n(1/z D.
Это выражение является математической записью закона эквивалентов. Число моль эквивалентов вещества можно рассчитать через массу т(В) вещества В: n(1/z B) = m(B)/M(1/zB) или объем V(B) газообразного вещества В: n(1/z B) =V(B)/V(1/z B)
Закон эквивалентов дает возможность производить расчеты без уравнения реакции.
Слайд 5Пример: Молярная масса эквивалента некоторого металла равна 12 г/моль. Какая
масса этого металла прореагировала с кислотой, если при этом выделилось
1150 мл водорода (н.у.)?По закону эквивалентов число моль эквивалентов прореагировавшего металла и водорода одинаково: n(1/z Ме) = n(1/z Н2).
Выразим число моль эквивалентов металла через отношение масс,
а для водорода – через отношение объемов: =
Молярный объем эквивалента водорода известен V(1/2 Н2) = 11.2 л/моль. Таким образом, в реакции с кислотой прореагировало металла
m(Me) = 1.23 г.
Ответ: 1.23 г.
Слайд 6 Пример 2: В оксиде некоторого элемента массовая доля кислорода составляет
20 %. Рассчитайте молярную массу эквивалента элемента и его оксида.
Закон
эквивалентов для такой реакции окисления можно записать как:n(1/z элемента) = n(1/z О2) = n(1/z оксида);
Удобно принять массу оксида за 100 г (100%).Тогда, в 100 г оксида содержится 20 г кислорода и 80 г элемента:
=
Молярная масса эквивалента элемента равна М(1/z элемента) = 32 г/моль. Отсюда молярная масса эквивалента оксида составляет:
М(1/zоксида) = М(1/z элемента) + 8 = 32 + 8 = 40 г/моль.
Ответ: 32 г/моль; 40 г/моль.
Слайд 7 Эквивалент – это реальная или условная частица, которая в кислотно-основных
реакциях присоединяет (или отдает) один ион Н+ или ОН–, в
окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества.Например, рассмотрим следующую реакцию:
H3PO4 + 2KOH = K2HPO4 + 2H2O.
В ходе этой реакции только два атома водорода замещаются на атомы калия, иначе, в реакцию вступают два иона Н+ (кислота проявляет основность 2). Тогда по определению эквивалентом H3PO4 будет являться условная частица 1/2H3PO4, т.к. если одна молекула H3PO4 предоставляет два иона Н+, то один ион Н+ дает половина молекулы H3PO4.
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности (fЭ). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1.
В примере, рассмотренном выше, фактор эквивалентности для кислоты, соответственно, равен 1/2, а для щелочи КОН равен 1.
Слайд 8Между H3PO4 и КОН также могут происходить и другие реакции.
При этом кислота будет иметь разные значения фактора эквивалентности: H3PO4 +
3KOH = K3PO4 + 3H2O fЭ(H3PO4) = 1/3 H3PO4 + KOH = KН2PO4 + H2O fЭ(H3PO4) = 1. Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
На основе законов эквивалентов можно вывести следующие формулы для вычисления эквивалентных масс сложных веществ – оксидов, кислот, оснований и солей:
Мэ (кислоты)=М(кислоты) / основность;
Мэ (основания)=М(основания) / кислотность;
Мэ(соли)=М(соли) / Валентность(Ме) · кол-во атомов (Ме);
Мэ(оксида)=М(оксида)/ Валентность(Ме) · кол-во атомов (Ме).
Слайд 95. Закон Авогадро - в равных объемах различных газов при постоянных
температуре и давлении содержится одинаковое число молекул. Из Закона Авогадро
выводится 2 следствия:Следствие 1: Один моль любого газа при одинаковых условиях занимает одинаковый объем . В частности, при нормальных условиях (T=0 °C (273К) и p=101,3 кПа) объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью
6. уравнения Менделеева-Клайперона:
, где Р – давление; Vm – молярный объем; m – масса; R = 8,31 - универсальная газовая постоянная; Т – абсолютная температура.
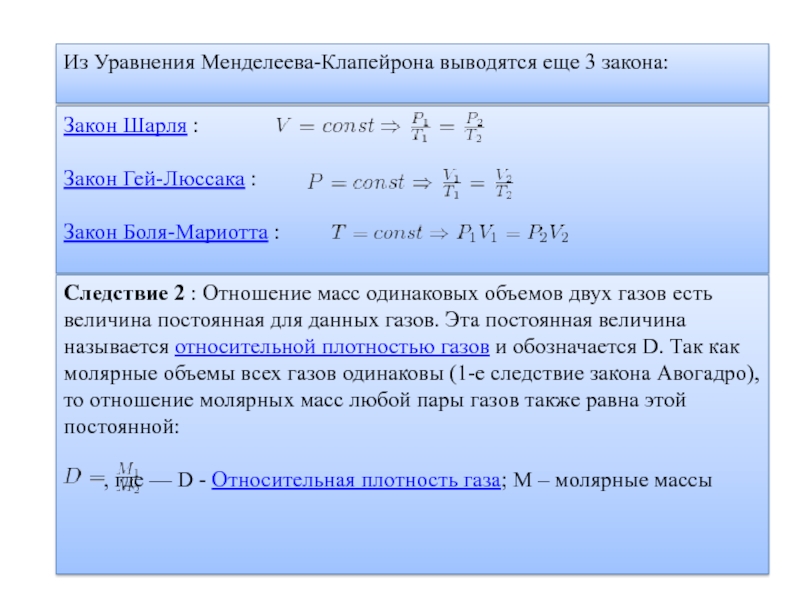
Слайд 10Из Уравнения Менделеева-Клапейрона выводятся еще 3 закона:
Закон Шарля :
Закон
Гей-Люссака :
Закон Боля-Мариотта :
Следствие 2 : Отношение масс одинаковых
объемов двух газов есть величина постоянная для данных газов. Эта постоянная величина называется относительной плотностью газов и обозначается D. Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной: , где — D - Относительная плотность газа; М – молярные массы