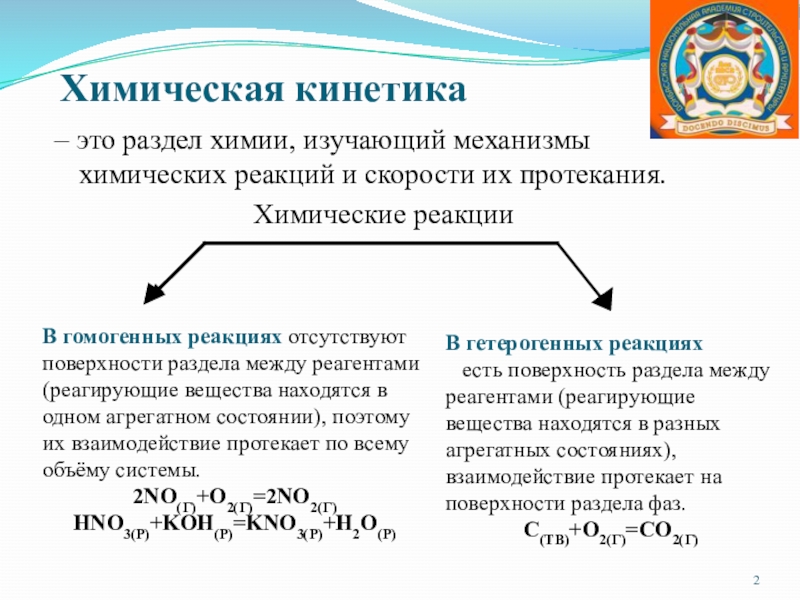
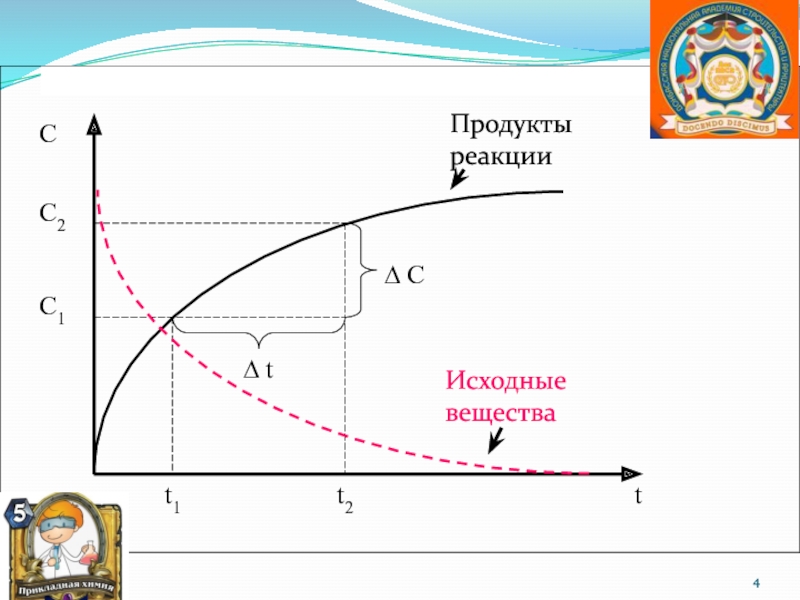
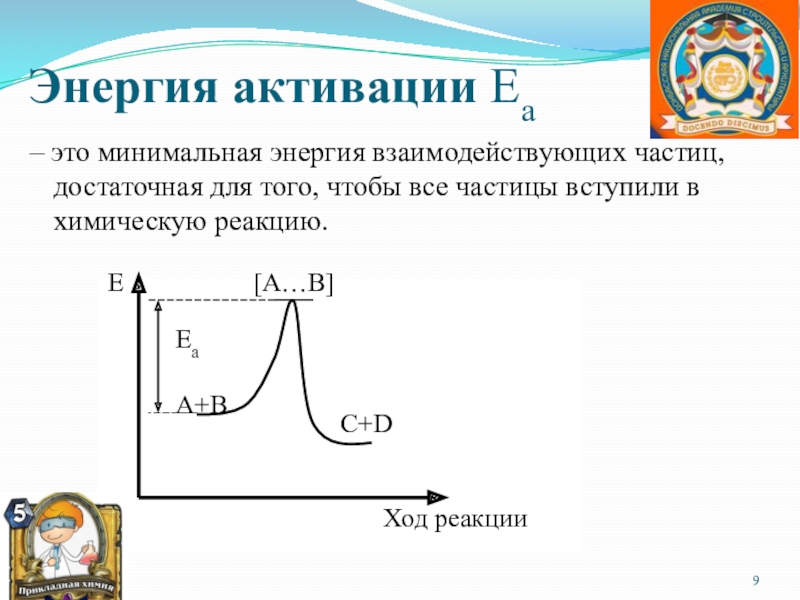
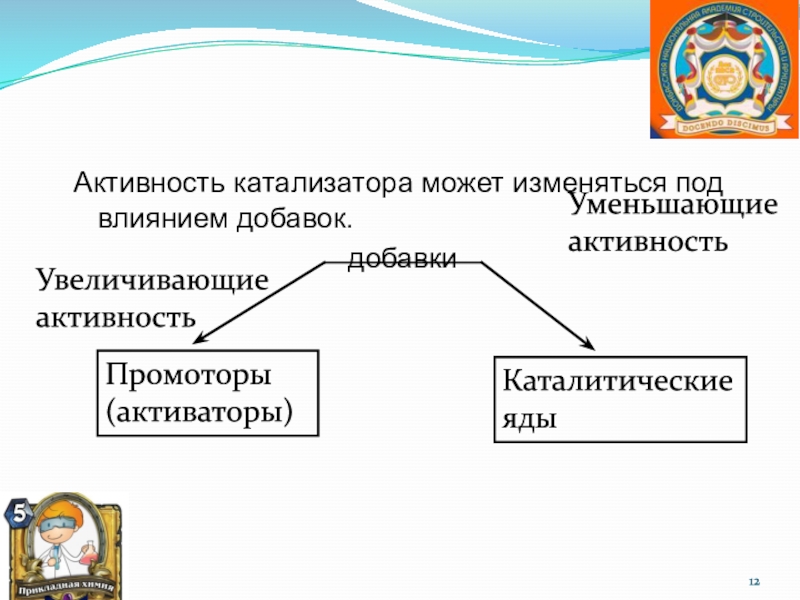
систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое либо
из условий, определяющих положение равновесия, то в системе усилится то из направлений процесса, которое ослабляет влияние воздействия, и положение равновесия сместится в том же направлении.
1. Увеличение концентрации исходных веществ смещает равновесие в сторону увеличения концентрации продуктов реакции. И наоборот.
2. Увеличение давления смещает равновесие в сторону уменьшения объема системы.
3. Влияние температуры: увеличение температуры смещает равновесие в сторону того процесса, который сопровождается поглощением тепла.
ПРИНЦИП ЛЕ ШАТЕЛЬЕ