Слайд 1Мария Дмитриевна Смирнова
Smirnova@sch2101.ru
Vk.com/masha2101
ХИМИЯ
9 класс
Углерод и 4 группа
Слайд 2Немного о планах
Нам нужно пройти:
Группу углерода ( 2 недели)
Группу 3
(1.5 недели)
Группу щелочно-земельных металлов (1.5)
Группу щелочных металлов (2 недели)
Введение в
органику (2 недели)
На это у нас 9 недель, поэтому большие КР сменятся небольшими тестиками, ну или не тестиками.
За то на каждую тему и у всех будет возможность получить оценки.
Слайд 3Немного о планах на 4ю группу
Сегодня посмотрим химию углерода –
основные оксиды и вещества.
Завтра кремния и в меньшей степени германия,
олова и свинца.
На следующей неделе во вторник – поговорим о метеоритах и первичном веществе вселенной (белые включения) – тут нам потребуются знания о кремнии и углероде. И если успеем поговорим об определении возраста Земли и других космических объектов.
В среду попробуем сделать лабораторную по углероду поэтому берём халаты!
Слайд 4Немного о планах на 4ю группу
Зачем вам всё это?
Плюсов очень
много:
Развитие абстрактного мышления
Увеличение словарного запаса
Ознакомление с современными принципами наук о
Земле
Знакомство с разнообразием веществ
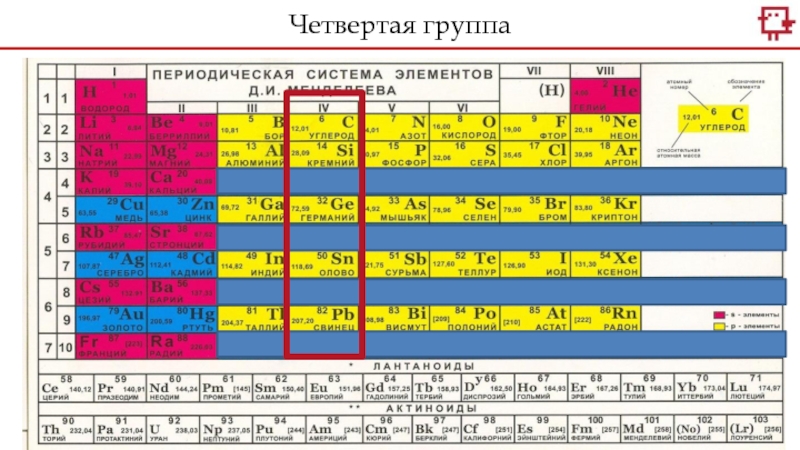
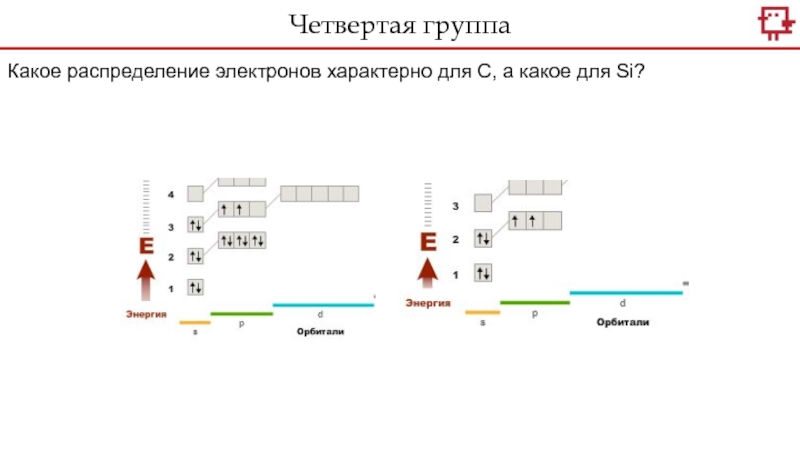
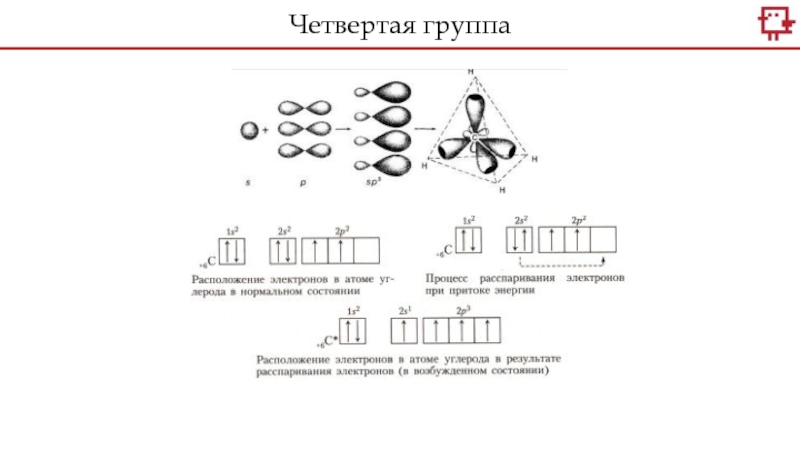
Слайд 6Какое распределение электронов характерно для С, а какое для Si?
Четвертая
группа
Слайд 8Четвертая группа
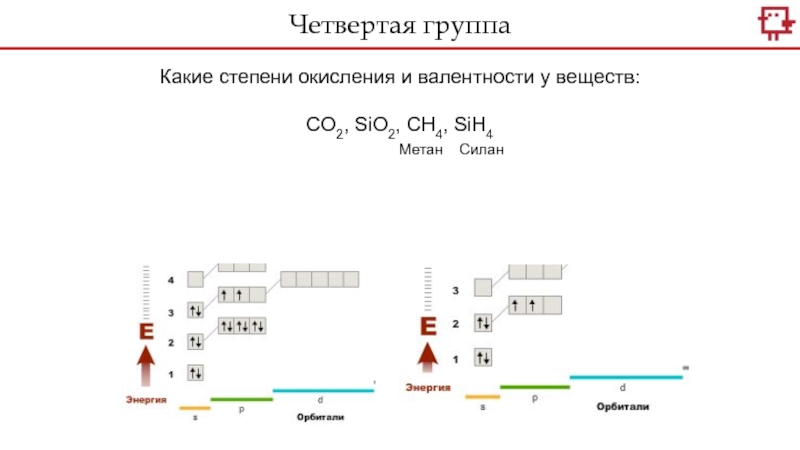
Какие степени окисления и валентности у веществ:
CO2, SiO2, CH4,
SiH4
Метан Силан
Слайд 9Четвертая группа
Какие степени окисления и валентности у веществ:
CO2, SiO2, CH4,
SiH4
Метан Силан
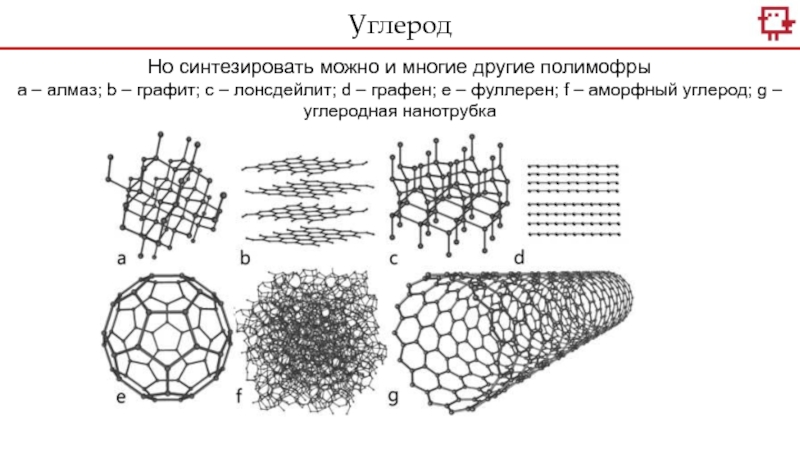
Слайд 11Углерод
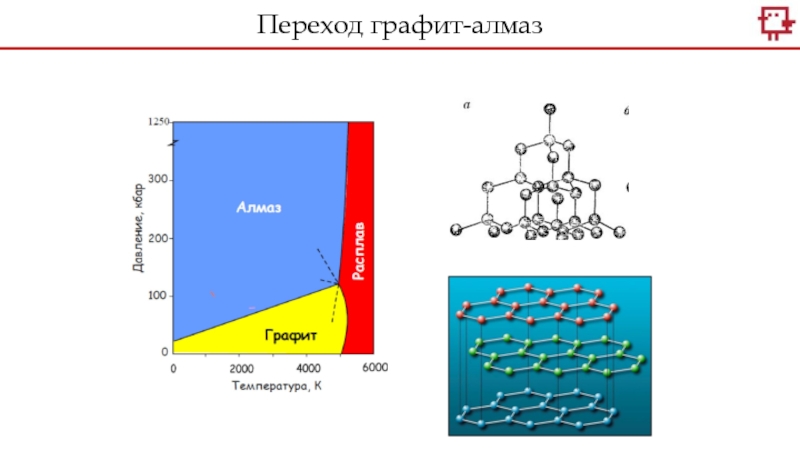
Углерод встречается в природе в виде графита и алмаза.
Слайд 15Углерод
Но синтезировать можно и многие другие полимофры
а – алмаз; b
– графит; c – лонсдейлит; d – графен; e –
фуллерен; f – аморфный углерод; g – углеродная нанотрубка
Слайд 16Углерод
«За новаторские эксперименты по исследованию двумерного материала графена»
Андрей Гейм, Константин
Новосёлов
Слайд 17Углерод
Адсорбция – поглощение вещества из газообразной среды или раствора поверхностным
слоем жидкости или твердого тела или процесс концентрирования вещества из
объёма фаз на границе их раздела.
Содержит огромное количество пор, и поэтому имеет очень большую удельную поверхность на единицу массы, вследствие чего обладает высокой адсорбционной способностью. В зависимости от технологии изготовления, 1 грамм активированного угля может иметь поверхность от 500 до 1500 м².
Слайд 18Углерод. Химические свойства
Графит – типичный восстановитель.
При нагревании С +
О2 = СО2
При недостатке кислорода 2С + О2 = 2СО
или СО2 + С = 2СО
При обычной температуре: С + 2F2 = CF4
При нагревании: C + 2Cl2 = CCl4; 4C + S8 = 4CS2
Слайд 19Углерод. Химические свойства
Карборунд – вещество, схожее по твёрдости с алмазом:
Si
+ C = SiC
Слайд 20Углерод. Химические свойства
Углерод не реагирует с кислотами, кроме концентрированных азотной
и серной, которые его окисляют:
C + 2H2SO4 = CO2 +
2SO2 + 2H2O
3C + 4HNO3 = 3CO2 + 4NO + 2H2O
Слайд 21Углерод. Химические свойства
Графит часто используют для восстановления малоактивных металлов из
их оксидов:
CuO + C = Cu + CO
При нагревании с
оксидами активных металлов углерод диспропорционирует, образую карбиды:
СaO + 3C = CaC2 + CO
2Al2O3 + 9C = Al4C3 + 6CO
Но активные металлы - более сильные восстановители:
Ca + 2C = CaC2
Слайд 22Оксид углерода (II)
Оксид углерода (II) – ядовитый газ бес цвета
и запаха, горит голубоватым пламенем, легче воздуха, плохо растворим в
воде.
Несолеобразующий, но может образовать при высоком давлении при пропускании через расплав щёлочи муравьиную кислоту:
СО + КОН = НСООК
Слайд 23Оксид углерода (II)
При обычных температурах СО не вступает в реакции
с водой, щелочами, кислотами.
При нагревании:
2СO + O2 = 2CO2
FeO +
CO = Fe + CO2
CO + Cl2 = COCl2
Со многими металлами СО образует летучие карбонилы:
Ni + 4CO = Ni(CO)4
Слайд 24Оксид углерода (II)
При обычных температурах СО не вступает в реакции
с водой, щелочами, кислотами.
При нагревании:
2СO + O2 = 2CO2
FeO +
CO = Fe + CO2
CO + Cl2 = COCl2
Со многими металлами СО образует летучие карбонилы:
Ni + 4CO = Ni(CO)4
Слайд 25Оксид углерода (IV)
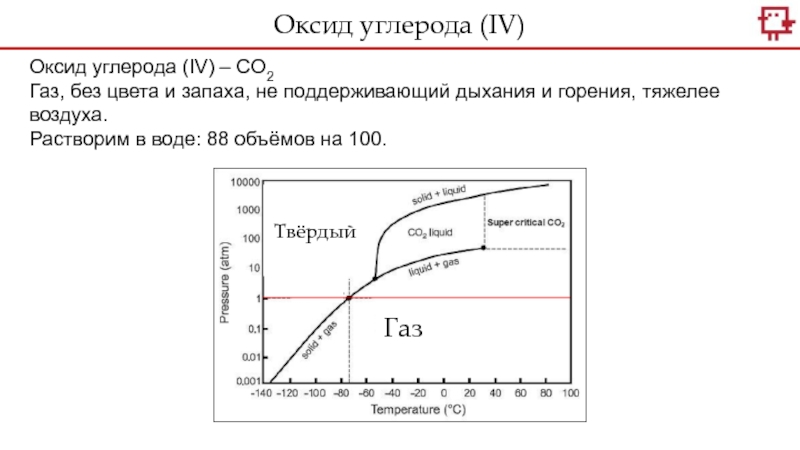
Оксид углерода (IV) – CO2
Газ, без цвета и
запаха, не поддерживающий дыхания и горения, тяжелее воздуха.
Растворим в
воде: 88 объёмов на 100.
Газ
Твёрдый
Слайд 26Оксид углерода (IV)
При больших концентрациях оксид углерода (IV) – яд!
При
концентрациях около 3% в воздухе – у человека наблюдаются учащенное
дыхание.
Более 10% - потеря сознания и даже смерть.
Слайд 27Оксид углерода (IV)
СО2 – ангидрид угольной кислоты Н2СО3.
При растворении СО2
в воде частично образуется угольная кислота:
Равновесие наблюдается, поскольку угольная
кислота очень слабая и в свободном виде неизвестна.
Слайд 28Оксид углерода (IV)
Соли угольно кислоты – карбонаты и гидрокарбонаты.
Качественная реакция
на соли действие сильных кислот:
CaCO3 + 2HCl = CaCl2 +
H2O + CO2
Растворимость карбонатов:
Ca(OH)2 + CO2 = CaCO3 + H2O
Избыток СО2:
СaCO3 + H2O + CO2 = Ca(HCO3)2
Нагревание:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
Слайд 29Оксид углерода (IV)
Наибольшее значение из карбонатов имеет – сода:
Na2CO3*10H2O; Na2CO3*7H2O;
Na2CO3*H2O.
Cоду получают методом Сольвэ:
Насыщение концентрированного раствора поваренной соли (точнее, насыщенного
раствора NaCl) аммиаком при охлаждении и последующем пропускании через этот раствор СО2 под давлением.
NH3 + CO2 + H2O = NH4HCO3
NH4HCO3 + NaCl = NaHCO3 + NH4Cl
Прокаливают получившуюся питьевую соду
2NaHCO3 = Na2CO3 + CO2 + H2O
Выделяют обратно аммиак
2NH4Cl + Ca(OH)2 = 2NH3 + CaCl2 + 2H2O
Слайд 30Кремний
Кремний – типичный восстановитель.
Si + O2 = SiO2
SiO2 + Si
= 2SiO
2Si + O2 = 2SiO
При обычной температуре:
Si + 2F2
= SiF4
При нагревании:
Si + 2Cl2 = SiCl4
4Si + S8 = 4SiS2
Si + C = SiC