Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Матричные синтезы
Содержание
- 1. Матричные синтезы
- 2. Основной постулат молекулярной биологии ТРАНСКРИПЦИЯРЕПЛИКАЦИЯДНКРНКБЕЛОКрепликацияТРАНСЛЯЦИЯОбратная транскрипция
- 3. РЕПЛИКАЦИЯ Д. Уотсон
- 4. РЕПЛИКАЦИЯ полуконсервативный способД. Уотсон
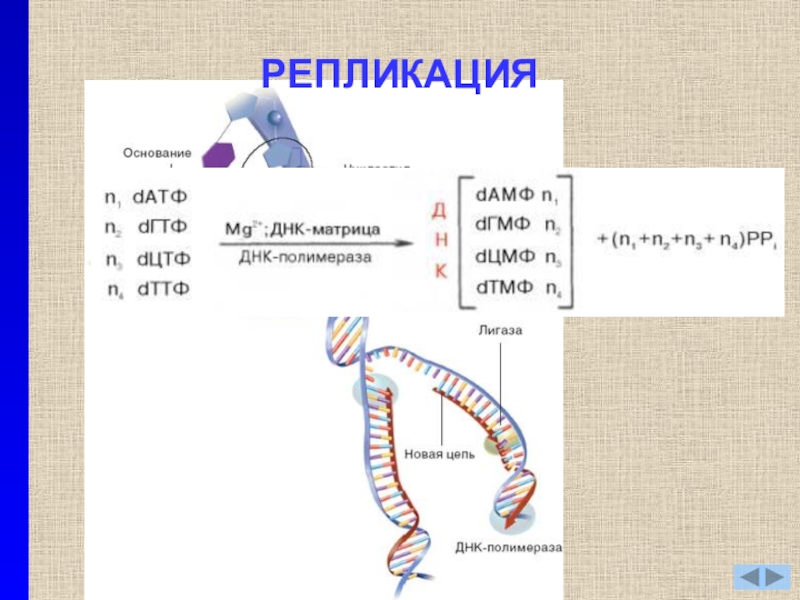
- 5. РЕПЛИКАЦИЯ
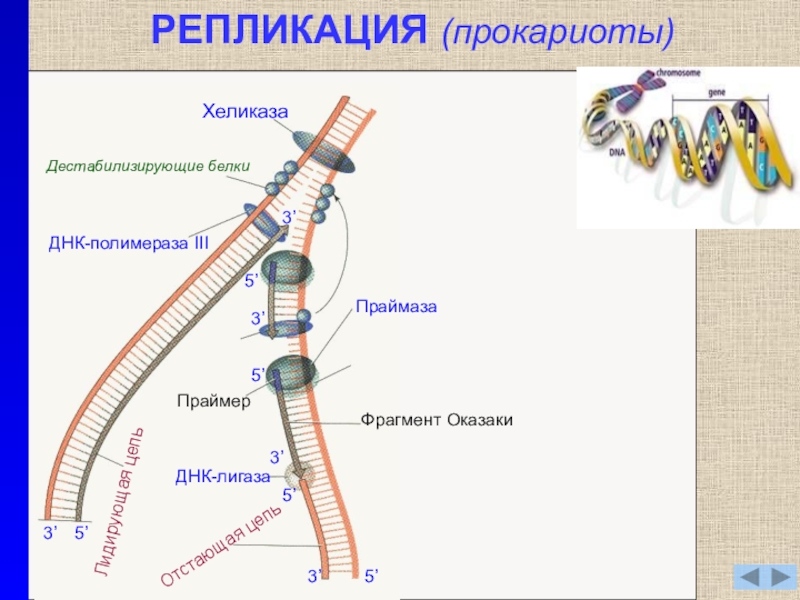
- 6. РЕПЛИКАЦИЯ (прокариоты)
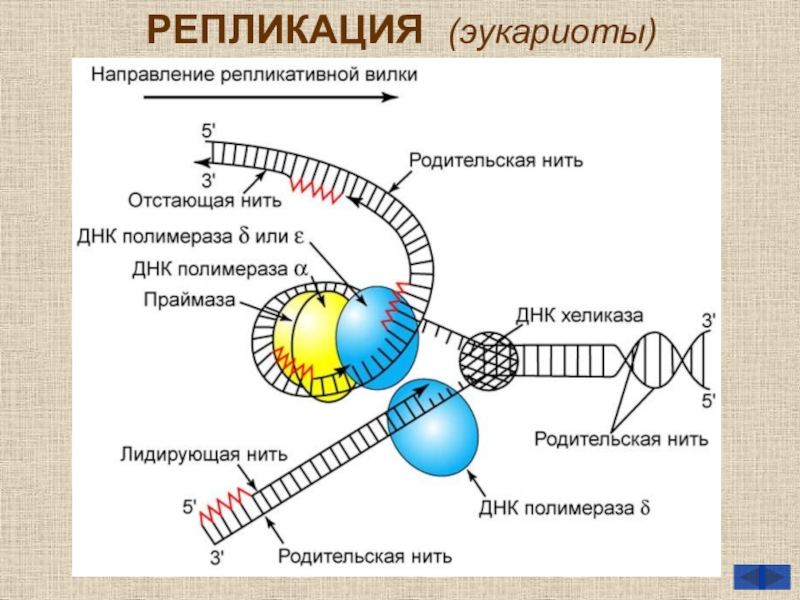
- 7. РЕПЛИКАЦИЯ (эукариоты)
- 8. РНК
- 9. ТРАНСКРИПЦИЯ
- 10. ТРАНСКРИПЦИЯ
- 11. ПРОЦЕССИНГ мРНК
- 12. ПРОЦЕССИНГ мРНК
- 13. СПЛАЙСИНГ
- 14. 3’5’м-РНК ААААА…..А поли-ААУГУАА Инициирующий кодон Терминирующий кодон
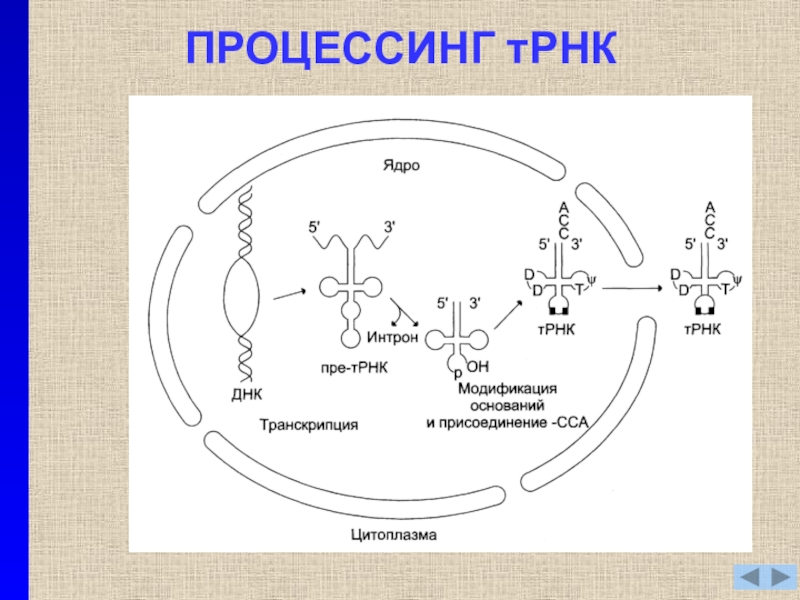
- 15. ПРОЦЕССИНГ тРНК
- 16. ПРОЦЕССИНГ рРНК и образование рибосом
- 17. Генетический код* - терминирующий кодонСпособ шифровки информации об аминокислотной последовательности белка с помощью последовательности нуклеотидов.
- 18. Свойства генетического кода Триплетность Специфичность Вырожденность Непрерывность Универсальность
- 19. РибосоматРНКНеобходимые компоненты для синтеза белкамРНКтРНКРибосомыАминокислотыФерментыБелковые факторы АТФ и ГТФMg2+мРНК
- 20. Основные этапы биосинтеза белка (трансляции)Активация аминокислот –
- 21. Этот процесс протекает в две стадии, катализируемые
- 22. р-РНК в составе рибосомы
- 23. Инициация+eIF-1+ ГТФ 40S+ eIF-3eIF-4F +
- 24. Элонгация5’ Ц А У Г Г
- 25. В процессе синтеза белка рибосома присоединяется к
- 26. ТерминацияТерминация - заключительный этап синтеза белка, наступает
- 27. Процессинг белка Фолдинг - формирование уникальной третичной
- 28. Процессинг белка
- 29. Шапероны – специфические белки, способные стабилизировать конформацию
- 30. УЧАСТИЕ ШАПЕРОНОВ В ФОЛДИНГЕ БЕЛКОВ РибосомаШапероны-70Шапероны-60ПолипептидСинтезирующийся полипептидмРНКНативный белок
- 31. У прокариотов процессы репликации, транскрипции и
- 32. Ингибиторы матричных биосинтезовВзаимодействие с ДНК, нарушение репликации и транскрипцииИнгибирование ферментов транскрипции Ингибирование трансляции
- 33. Ингибиторы биосинтеза белкаЛевомицетин (хлорамфеникол) – соединяется с
- 34. Активаторы биосинтеза белка
- 35. Процессинг белка
- 36. ПЦР ПЦР - полимеразная цепная реакция —
- 37. Анализ методом ПЦР основан на обнаружении в
- 38. Метод ПЦР основан на принципе естественной
- 39. Механизмы реакции Метод основан на многократном
- 40. Компоненты реакции ДНК-матрица, содержащая тот участок ДНК,
- 41. Праймеры Праймеры - это короткие, длиной 20-30
- 42. ПЦР проводят в амплификаторе — приборе,
- 43. Ход реакцииОбычно при проведении ПЦР выполняется 20—35
- 44. Проведение ПЦРДенатурацияДвухцепочечную ДНК-матрицу нагревают до 94—96 °C (или
- 45. Слайд 45
- 46. Проведение ПЦРОтжигКогда цепи разошлись, температуру понижают, чтобы
- 47. Слайд 47
- 48. Проведение ПЦРЭлонгацияДНК-полимераза реплицирует матричную цепь, используя праймер
- 49. Слайд 49
- 50. Проведение ПЦРСхематическое изображение первого цикла ПЦР. (1)
- 51. Преимущества метода Полимеразная цепная реакция является диагностическим
- 52. Тест-системы на основе
- 53. Перечень достоинств ПЦР - генодиагностики инфекций Метод
- 54. 6. Исследуемый материал может быть дезинфицирован
- 55. Возможность получения ложноположительного результата. ПЦР-анализ
- 56. Предупреждение ложно - положительных результатов ПЦР Перекрестная
- 57. Ошибки при проведении ПЦР исследований Ложноположительный
- 58. Применение ПЦР Криминалистика
- 59. Установление отцовства Результаты электрофореза ДНК-фрагментов, амплифицированных с
- 60. Медицинская диагностика ПЦР дает возможность
- 61. Персонализированная медицина Иногда лекарства оказываются токсичными или
- 62. Клонирование гена с использованием плазмиды. (1) Хромосомная
- 63. Спасибо за внимание
- 64. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Основной постулат молекулярной биологии
ТРАНСКРИПЦИЯ
РЕПЛИКАЦИЯ
ДНК
РНК
БЕЛОК
репликация
ТРАНСЛЯЦИЯ
Обратная транскрипция
Слайд 17 Генетический код
* - терминирующий кодон
Способ шифровки информации
об аминокислотной
последовательности белка
Слайд 18 Свойства генетического кода
Триплетность
Специфичность
Вырожденность
Непрерывность
Универсальность
Слайд 19Рибосома
тРНК
Необходимые компоненты
для синтеза белка
мРНК
тРНК
Рибосомы
Аминокислоты
Ферменты
Белковые факторы
АТФ и ГТФ
Mg2+
мРНК
Слайд 20Основные этапы биосинтеза белка
(трансляции)
Активация аминокислот – предварительный этап:
активация аминокислот
– присоединение их к специфическим тРНК.
Основные этапы:
Инициация;
Элонгация;
Терминация.
Процессинг
белка – посттрансляционная модификация: формирование специфической конформации (фолдинг);
модификация аминокислот; частичный протеолиз.
Слайд 21Этот процесс протекает в две стадии, катализируемые одним и тем
же ферментом – аминоацил-тРНК синтетаза:
I стадия – аминокислота вступает в
реакцию с АТФ, при этом освобождается пирофосфат и образуется промежуточный продукт – аминоациладенилатII стадия – аминоациладенилат взаимодействует с тРНК, при этом образуется соединение – аминоацил-тРНК.
+
О-АМФ
I стадия
II стадия
Активация аминокислот
Н
Слайд 25В процессе синтеза белка рибосома присоединяется к 5’-концу мРНК и
перемещается в направлении 3’-конца. При этом 5’-конец мРНК освобождается, и
к нему может присоединиться новая рибосома, на которой начинается рост ещё одной полипептидной цепи. Как правило, много рибосом одновременно участвуют в синтезе белка на одной и той же мРНК, образуя комплекс, который называют полирибосомой или полисомой .Слайд 26Терминация
Терминация - заключительный этап синтеза белка, наступает в том случае
если в А-центр рибосомы попадает один из стоп кодонов: УАГ,
УАА, УГА.Стоп кодоны не кодируют никаких аминокислот и для них нет соответствующих тРНК. Вместо этого к рибосоме присоединяются 2 белковых фактора терминации (RF).
В результате происходит отщепление синтезированной полипептидной цепи, отсоединение транспортной и матричной РНК и диссоциация субъединиц рибосомы. Эти процессы требуют затраты энергии ГТФ.
Слайд 27Процессинг белка
Фолдинг - формирование уникальной третичной или четвертичной структуры
белка
Присоединение простетической группы
(у сложных белков)
Частичный протеолиз Ковалентные модификации аминокислот
Слайд 28Процессинг белка
1) Частичный протеолиз – удаление части полипептидной цепи специфическими эндопротеазами.
2) Ковалентные модификации аминокислот- присоединение различных химических групп: фосфатных, ацильных, метильных, олигосахаридных и др.3) Формирование дисульфидных связей необходимых для поддержания нативной конформации белка
Слайд 29Шапероны – специфические белки, способные стабилизировать конформацию белков, находящихся в
неустойчивом состоянии.
Вид сверху
СТРОЕНИЕ ШАПЕРОНОВОГО
КОМПЛЕКСА
ТРЕТИЧНАЯ СТРУКТУРА
ШАПЕРОНА-70
ШАПЕРОНЫ
СТРОЕНИЕ ШАПЕРОНОВОГО
КОМПЛЕКСА
Вид сверху
СТРОЕНИЕ ШАПЕРОНОВОГО
КОМПЛЕКСА
ТРЕТИЧНАЯ СТРУКТУРА
ШАПЕРОНА-70
Вид сверху
СТРОЕНИЕ ШАПЕРОНОВОГО
КОМПЛЕКСА
Слайд 30УЧАСТИЕ ШАПЕРОНОВ В ФОЛДИНГЕ БЕЛКОВ
Рибосома
Шапероны-70
Шапероны-60
Полипептид
Синтезирующийся полипептид
мРНК
Нативный
белок
Слайд 31 У прокариотов процессы репликации, транскрипции и траснсляции сопряжены в
пространстве и во времени
У эукариотов трансляция осуществляется в цитоплазме,
куда поступает из ядра мРНК после завершения транскрипции процессинга;Про- и эукариоты имеют различные рибосомы
(80S у прокариот и 70S у эукариот);
Факторы инициации, элонгации и терминации различны
Различия биосинтеза белка
в про- и эукариотических клетках
Слайд 32Ингибиторы матричных биосинтезов
Взаимодействие с ДНК, нарушение репликации и транскрипции
Ингибирование ферментов
транскрипции
Ингибирование трансляции
Слайд 33Ингибиторы биосинтеза белка
Левомицетин (хлорамфеникол) – соединяется с большой субъединицей рибомом.
Оказывает ингибирующее влияние на пептидилтрансферазную реакцию (на стадии элонгации), ингибирует
транслокацию.Рубомицин - соединяется с большой субъединицей рибосом. Ингибирует пептидилтрансферазную активность.
Стрептомицин и неомицин – соединяется с большой субъединицей рибосом, вызывая ошибки в трансляции мРНК, приводящие к нарушению соответствия между кодонами и включаемыми аминокислотами, что приводит к синтезу аномальных белков и гибели бактерий.
Тетрациклины – ингибируют элонгацию: тормозят связывание аминоацил-тРНК с аминоацильным центром в малой субъединице рибосом.
Эритромицин – соединяется с малой субъединицей
рибосом, нарушая ее функцию.
Слайд 34Активаторы биосинтеза белка
АТФ,
некоторые гормоны и витаминыАТФ служит одним из источников энергии.
Гормоны взаимодействуют с гормончувствительным участком ДНК и запускают транскрипцию и трансляцию, либо изменяют активность белков и ферментов, участвующих в данных процессах (соматотропный гормон, инсулин, половые гормоны гормоны щитовидной железы (тироксин, трийодтиронин)
Витамины: А (ретинол), D (холекальциферол). Активные формы этих витаминов (ретиноевая кислота и кальцитриол) действуют подобно гормонам.
Витамины К, С, В9, В12 влияют на посттранслционную модификацию белков.
Слайд 35Процессинг белка
Синтезируемые полипептидные
цепи могут подвергаться структурным модификациям, либо будучи еще связанными с
рибосомами, либо после завершения синтеза. Эти конформационные изменения получили название посттрансляционные изменения, включающие удаление части полипептидной цепи, ковалентное присоединение одного или нескольких низкомолекулярных лигандов, приобретение белком нативной конформации.Многие модификации осуществляются в эндоплазматическом ретикулуме. Здесь происходит фолдинг полипептидных цепей - формирование уникальной третичной или четвертичной структуры белка.
Слайд 36ПЦР
ПЦР - полимеразная цепная реакция — это метод молекулярной биологии,
позволяющий добиться значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты
(ДНК) в биологическом материале (пробе).ПЦР диагностика — это метод лабораторной диагностики инфекционных заболеваний, в частности, этот метод широко применяется и для диагностики ЗППП
Слайд 37Анализ методом ПЦР основан на обнаружении в материале исследования небольшого
фрагмента ДНК возбудителя той инфекции, которую подозревает врач.
Сама полимеразная цепная реакция используется для того, чтобы найденный фрагмент размножить, клонировать.
Необходимое условие для проведения ПЦР – знание нуклеотидной последовательности амплифицируемой области.Слайд 38Метод ПЦР основан на принципе естественной репликации ДНК, включающим расплетение
двойной спирали ДНК, расхождение нитей ДНК и комплементарное дополнение обеих.
Репликация ДНК может начаться не в любой точке, а только в определенных стартовых блоках - коротких двунитевых участках. Суть метода заключается в том, что маркировав такими блоками специфический только для данного вида (но не для других видов) участок ДНК, можно многократно воспроизвести (амплифицировать) именно этот участок.Слайд 39Механизмы реакции
Метод основан на многократном избирательном копировании определённого участка
ДНК при помощи ферментов в искусственных условиях (in vitro). При
этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце. В отличие от амплификации ДНК в живых организмах, (репликации), с помощью ПЦР амплифицируютсяотносительно короткие
участки ДНК.
Слайд 40Компоненты реакции
ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать.
Два праймера,
комплементарные противоположным концам разных цепей требуемого фрагмента ДНК.
Термостабильная ДНК-полимераза —
фермент, который катализирует реакцию полимеризации ДНК. Полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов — Thermus aquaticus (Taq-полимераза), Pyrococcus furiosus (Pfu-полимераза), Pyrococcus woesei (Pwo-полимераза) и другие.Дезоксирибонуклеозидтрифосфаты (dATP, dGTP, dCTP, dTTP).
Ионы Mg2+, необходимые для работы полимеразы.
VI.Буферный раствор, обеспечивающий необходимые условия реакции
Слайд 41Праймеры
Праймеры - это короткие, длиной 20-30 оснований, одноцепочечные ДНК комплиментарные
3-концам цепей копируемой ДНК-матрицы.
Каждый из праймеров комплементарен одной из цепей
двуцепочечной матрицы и ограничивает начало и конец амплифицируемого участка. Слайд 42ПЦР проводят в амплификаторе — приборе, обеспечивающем периодическое охлаждение и
нагревание пробирок, обычно с точностью не менее 0,1 °C. Современные
амплификаторы позволяют задавать сложные программы, в том числе с возможностью «горячего старта», Touchdown ПЦР и последующего хранения амплифицированных молекул при 4 °C. Для ПЦР в реальном времени выпускают приборы, оборудованные флуоресцентным детектором. Существуют также приборы с автоматической крышкой и отделением для микропланшет, что позволяет встраивать их в автоматизированные системы.Слайд 43Ход реакции
Обычно при проведении ПЦР выполняется 20—35 циклов, каждый из
которых состоит из трех стадий. Фотография геля, содержащего маркерную
ДНК (1) и продукты ПЦР-реакции (2,3). Цифрами показана длина фрагментов ДНК в парах нуклеотидов.Слайд 44Проведение ПЦР
Денатурация
Двухцепочечную ДНК-матрицу нагревают до 94—96 °C (или до 98 °C, если
используется особенно термостабильная полимераза) на 0,5—2 мин, чтобы цепи ДНК
разошлись. Эта стадия называется плавлением (денатурацией), так как разрушаются водородные связи между двумя цепями ДНК. Обычно, перед первым циклом проводят длительный прогрев реакционной смеси в течение 2—5 мин для полной денатурации матрицы и праймеров.Слайд 46Проведение ПЦР
Отжиг
Когда цепи разошлись, температуру понижают, чтобы праймеры могли связаться
с одноцепочечной матрицей. Эта стадия называется отжигом. Температура отжига зависит
от состава праймеров и обычно выбирается равной температуре плавления праймеров. Неправильный выбор температуры отжига приводит либо к плохому связыванию праймеров с матрицей (при завышенной температуре), либо к связыванию в неверном месте и появлению неспецифических продуктов (при заниженной температуре). Время стадии отжига — 30 сек, одновременно, за это время полимераза уже успевает синтезировать несколько сотен нуклеотидов. Поэтому рекомендуется подбирать праймеры с температурой плавления выше 60 °C и проводить отжиг и элонгацию одновременно, при 60-72 °C.Слайд 48Проведение ПЦР
Элонгация
ДНК-полимераза реплицирует матричную цепь, используя праймер в качестве затравки.
Полимераза начинает синтез второй цепи от 3'-конца праймера, который связался
с матрицей, и движется вдоль матрицы, синтезируя новую цепь в направлении от 5' к 3' концу. Температура элонгации зависит от полимеразы. Время элонгации зависит как от типа ДНК-полимеразы, так и от длины амплифицируемого фрагмента. Обычно время элонгации принимают равным одной минуте на каждую тысячу пар оснований. После окончания всех циклов часто проводят дополнительную стадию финальной элонгации, чтобы достроить все одноцепочечные фрагменты. Эта стадия длится 7—10 мин.Слайд 50Проведение ПЦР
Схематическое изображение первого цикла ПЦР. (1) Денатурация при 94—96 °C.
(2) Отжиг при 68 °C (например). (3) Элонгация при 72 °C (P=полимераза).
(4) Закончен первый цикл. Две получившиеся ДНК-цепи служат матрицей для следующего цикла, поэтому количество матричной ДНК в ходе каждого цикла удваиваетсяСлайд 51Преимущества метода
Полимеразная цепная реакция является диагностическим
методом, позволяющим выявлять единичные
клетки возбудители многих инфекционных заболеваний
за счет многократного увеличения количества
копийтестируемых специфических последовательностей ДНК.
Тест-системы, основаны на принципе амплификации
ДНК, позволяет обнаруживать патогенные для человека
бактерии и вирусы даже в тех случаях, когда другими
способами (иммунологическим, бактериологическим, микроскопическим) их выявление невозможно.
Это преимущество достигается за счет высокой чувствительности ПЦР - системы, которая составляет около 10 бактериальных клеток, в то время как чувствительность и монологических и микроскопических тестов колеблется в пределах 103-106 клеток.
Слайд 52 Тест-системы на основе ПЦР эффективны при диагностике трудно культивируемых, не
культивируемых и персистирующих форм патогенных бактерий. Определение можно проводить непосредственно в
клиническом материале (кровь, сыворотка, лаважные массы, мокрота, слюна, желудочный сок, биопсийный материал, мазки, смывы) и в материале, получаемом из объектов внешней среды (вода, почва).Слайд 53Перечень достоинств ПЦР - генодиагностики инфекций
Метод прямой и позволяет достичь
предельно возможной чувствительности: от нескольких копий до одного возбудителя в
пробе.Специфичность метода равна 100%.
Для ПЦР - анализа пригоден любой материал, в том числе и гистологические препараты.
Количество исследуемого материала, как правило, составляет несколько десятков микролитров но при низкой концентрации возбудителя может быть увеличена в сотни и тысячи раз за счет экстракции ДНК и РНК.
Метод позволяет определять число копий возбудителя в пробе и тем самым контролировать виремию или бактеремию в процессе лечения.
Слайд 546. Исследуемый материал может быть дезинфицирован химической или термической обработкой
в момент его забора, и, следовательно, исключается возможность инфицирования персонала
в процессе проведения ПЦР. 7. Простота исполнения и возможность полной автоматизации. 8. Результаты получают через несколько часов, то есть в течение одного рабочего дня.Слайд 55Возможность получения ложноположительного результата. ПЦР-анализ может показать положительный результат даже
в том случае, если инфекция уже мертва, «убита» антибиотиками, но
ее мертвые клетки все еще содержатся в тканях пациента. Неспособность ПЦР «отличить» ДНК мертвой клетки от живой налагает определенные требования при использовании ПЦР и для контроля эффективности лечения. Основное правило, выдерживать необходимый период после лечения до проведения контрольного ПЦР исследования.Слайд 56Предупреждение ложно - положительных результатов ПЦР
Перекрестная контаминация от пробы к
пробе (в процессе обработки клинических образцов или при раскапывании реакционной
смеси), приводящей к появлению спорадических ложно - положительных результатов;Контаминация рекомбинантными плазмидами, содержащими клонированные последовательности детектируемого гена;
Контаминация продуктами амплификации (амплификонами) являются наиболее частой причиной ложно - положительных результатов, поскольку в процессе ПЦР - диагностики амплификоны накапливаются в больших количествах и очень легко переносятся с аэрозолями и через приборы. Поэтому детекция продуктов ПЦР должна проводиться в изолированной комнате сотрудником, не производящим обработку клинических образцов и не готовящим реактивы для ПЦР. Приготовление основных растворов также должно производиться в отдельной чистой комнате. Все растворы должны храниться и использоваться в небольших порциях.
Слайд 57Ошибки при проведении ПЦР исследований
Ложноположительный результат анализа может получиться
вследствие неправильного забора материала - не попадания в материал эпителиальных
клеток, а содержания большого количества совершенно неинформативной слизи.На получение ложных результатов ДНК-анализа оказывает влияние неправильная транспортировка и хранение полученных проб. ДНК инфекции в этом случае может разрушаться и как следствие — ложноотрицательный результат.
Нарушение стерильности при заборе материала для ПЦР - диагностики — еще одна причина ложноположительной ПЦР. В результате обнаружится «несуществующая» инфекция.
Непригодность реагентов. Неоснащенная и несовременная лаборатория, где на непригодность реагентов врачи «закрывают глаза» - это еще одна и серьезных причин недостоверной диагностики. Конечно, это сильно удешевляет лабораторную диагностику, но не может не сказаться на ее результатах.
Слайд 58Применение ПЦР
Криминалистика
ПЦР используют для сравнения
так называемых «генетических отпечатков пальцев». Необходим образец генетического материала с
места преступления — кровь,слюна, сперма, волосы и т. п.
Его сравнивают с генетическим
материалом подозреваемого.
Достаточно совсем малого
количества ДНК, теоретически —
одной копии. ДНК расщепляют на
фрагменты, затем амплифицируют
с помощью ПЦР. Фрагменты
разделяют с помощью электрофореза
ДНК. Полученную картину расположения полос ДНК и называют генетическим отпечатком пальцев (англ. genetic fingerprint).
Слайд 59Установление отцовства
Результаты электрофореза ДНК-фрагментов, амплифицированных с помощью ПЦР. (1) Отец.
(2) Ребенок. (3) Мать. Ребенок унаследовал некоторые особенности генетического отпечатка
обоих родителей, что дало новый, уникальный отпечаток.Слайд 60Медицинская диагностика ПЦР дает возможность существенно ускорить и облегчить диагностику наследственных
и вирусных заболеваний. Нужный ген амплифицируют с помощью ПЦР с
использованием соответствующих праймеров, а затем секвенируют для определения мутаций. Вирусные инфекции можно обнаруживать сразу после заражения, за недели или месяцы до того, как проявятся симптомы заболевания.Слайд 61Персонализированная медицина
Иногда лекарства оказываются токсичными или аллергенными для некоторых пациентов.
Причины этого — отчасти в индивидуальных различиях в восприимчивости и
метаболизме лекарств и их производных. Эти различия детерминируются на генетическом уровне. Например, у одного пациента определенный цитохром (белок печени, отвечающий за метаболизм чужеродных веществ) может быть более активен, у другого — менее. Для того чтобы определить, какой разновидностью цитохрома обладает данный пациент, предложено проводить ПЦР-анализ перед применением лекарства. Такой анализ называют предварительным генотипированием.Слайд 62Клонирование гена с использованием плазмиды. (1) Хромосомная ДНК организма A. (2)
ПЦР. (3) Множество копий гена организма А. (4) Вставка гена
в плазмиду. (5) Плазмида с геном организма А. (6) Введение плазмиды в организм В. (7) Умножение количества копий гена организма А в организме В.Клонирование генов — это процесс выделения генов и, в результате генноинженерных манипуляций, получения большого количества продукта данного гена.