Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
МЕХАНИЗМ КАТАЛИТИЧЕСКИХ РЕАКЦИЙ
Содержание
- 1. МЕХАНИЗМ КАТАЛИТИЧЕСКИХ РЕАКЦИЙ
- 2. Механизм действия ферментов – это последовательность превращений
- 3. Механизм действия карбоксипептидазы А Карбоксипептидаза А –
- 4. Специфичность: катализирует гидролитическое отщепление С-концевых остатков Тир,
- 5. Карбоксипептидаза А – металлофермент, содержащий 1 атом
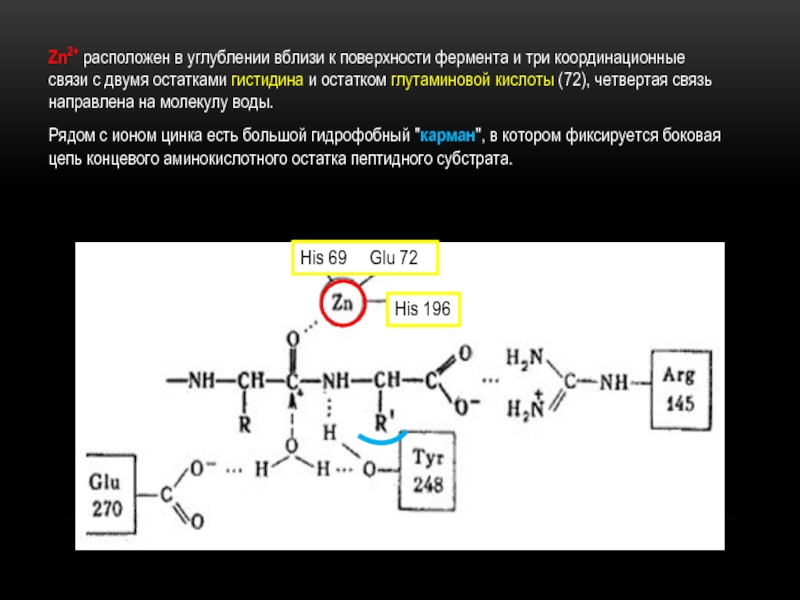
- 6. Zn2+ расположен в углублении вблизи к поверхности
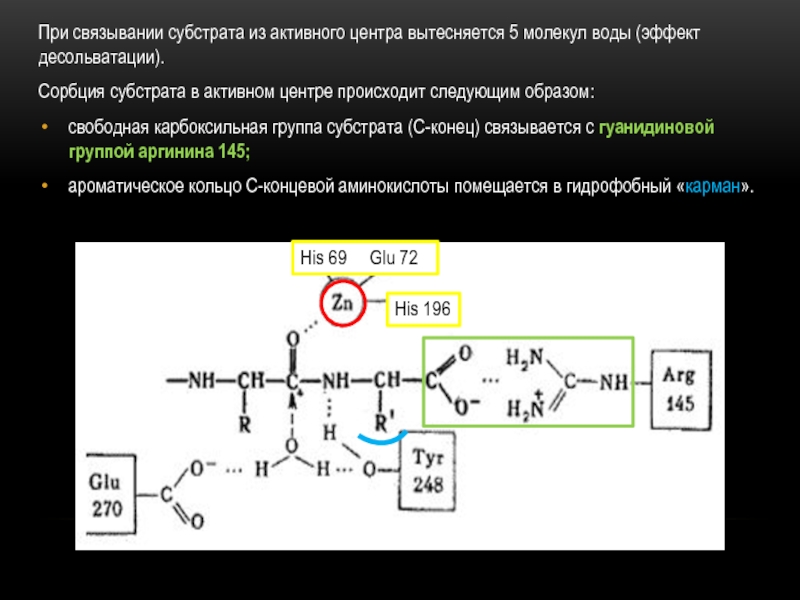
- 7. При связывании субстрата из активного центра вытесняется
- 8. При связывании субстрата происходит ряд структурных изменений:Арг-145
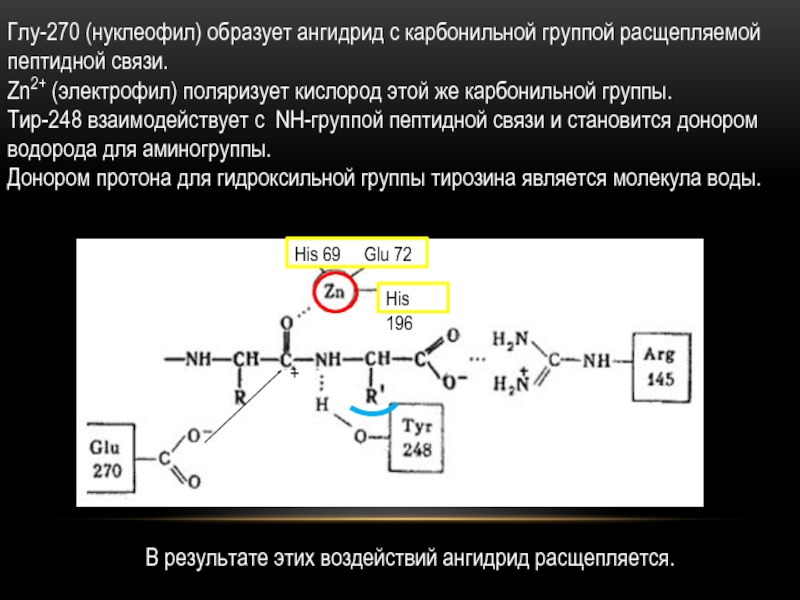
- 9. Глу-270 (нуклеофил) образует ангидрид с карбонильной группой
- 10. В процессе ферментативного гидролитического расщепления пептидной связи
- 11. МЕХАНИЗМ ДЕЙСТВИЯ СЕРИНОВЫХ ПРОТЕИНАЗСериновые протеазы катализируют специфическое
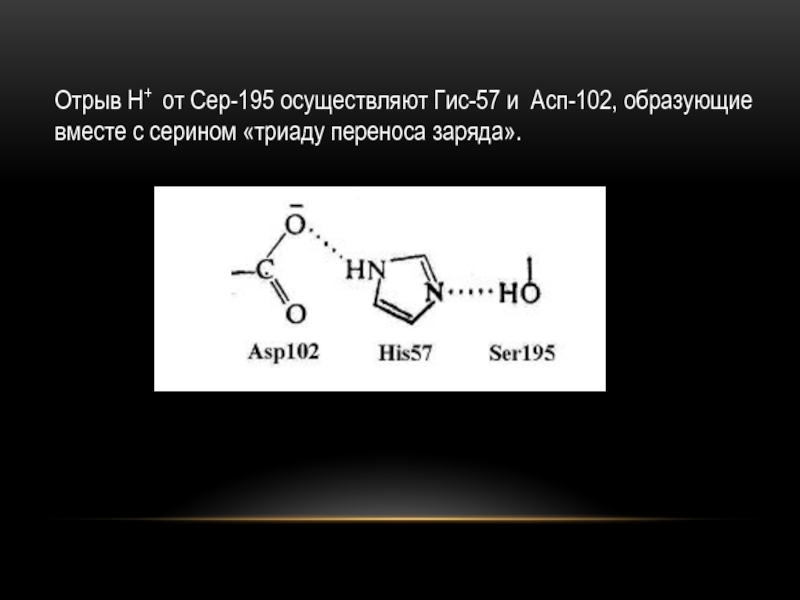
- 12. Отрыв Н+ от Сер-195 осуществляют Гис-57 и Асп-102, образующие вместе с серином «триаду переноса заряда».
- 13. Субстрат-связывающий центр сериновых протеиназ состоит из:оксианионовой дыры
- 14. Каталитический центр: "триада переноса заряда" — Ser195
- 15. Образование фермент-субстратного комплексаКарбонильная группа расщепляемого пептида атакуется кислородом гидроксигруппы серина.
- 16. Образование С-концевого продуктаАцильная группа субстрата переносится на ОН-серина и образуется Р1 (С-концевой продукт).Гидролиз сложноэфирной связи.
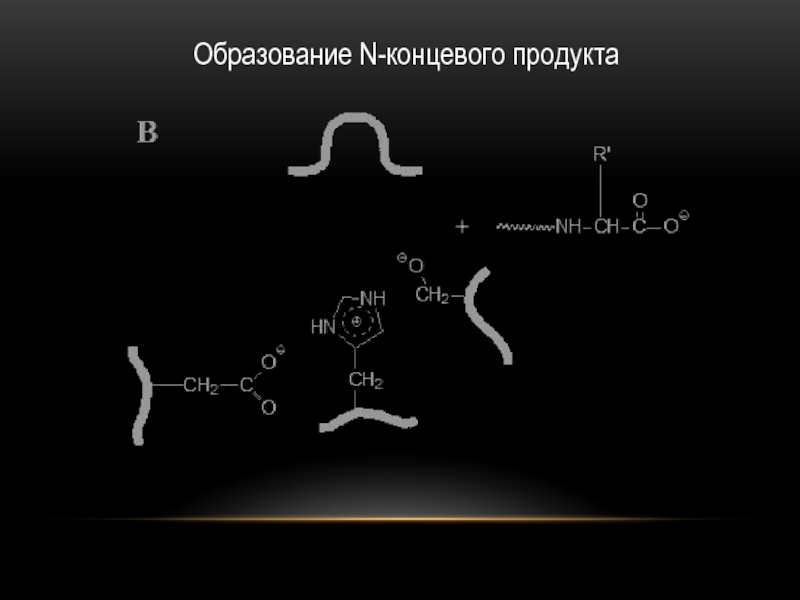
- 17. Образование N-концевого продукта
- 18. Ацилферментный активированный комплекс очень не стабилен –
- 19. Специфичность сериновых протеиназ:Химотрипсин – гидролизует связи после
- 20. МЕЗАНИЗМ ДЕЙСТВИЯ РИБОНУКЛЕАЗЫРибонуклеаза А гидролизует 3’,5”-фосфодиэфирные связи
- 21. Многоточечное связывание субстрата происходит за счет образования:шести
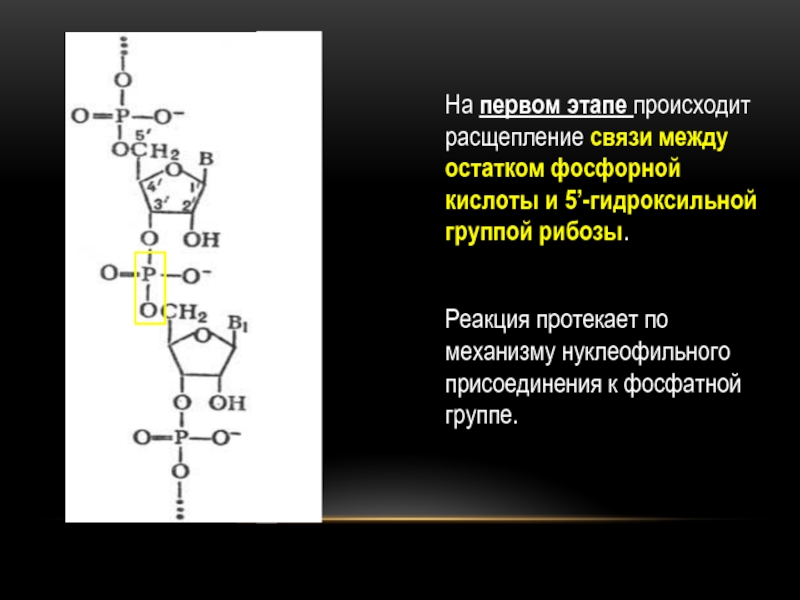
- 22. На первом этапе происходит расщепление связи между
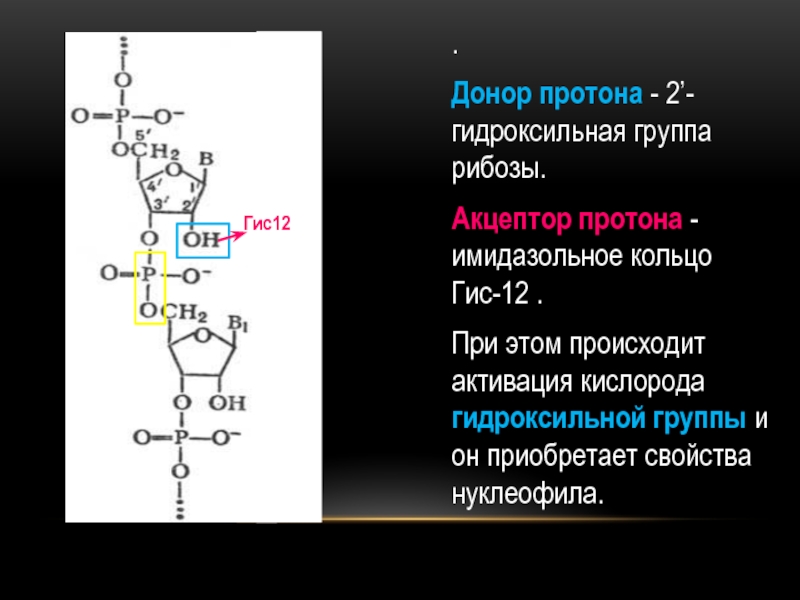
- 23. . Донор протона - 2’-гидроксильная группа рибозы.
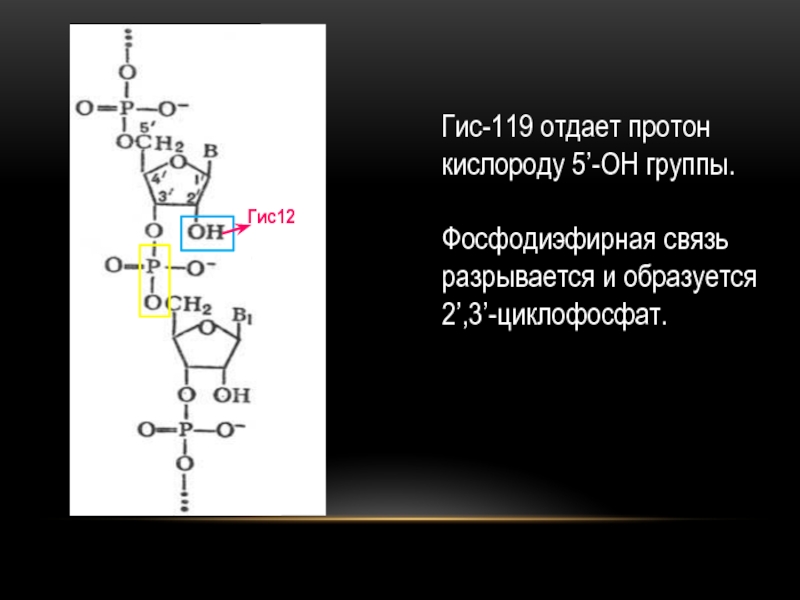
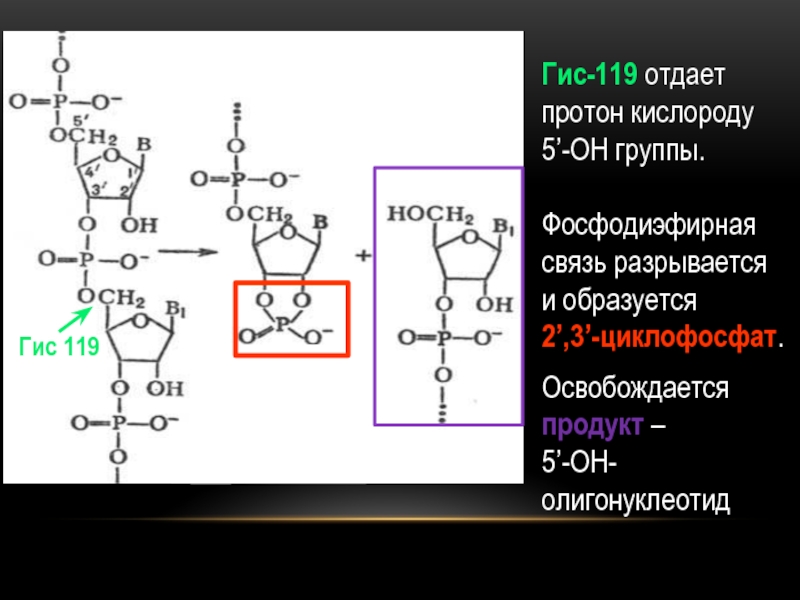
- 24. Гис-119 отдает протон кислороду 5’-ОН группы. Фосфодиэфирная связь разрывается и образуется 2’,3’-циклофосфат.
- 25. Гис-119 отдает протон кислороду 5’-ОН группы.
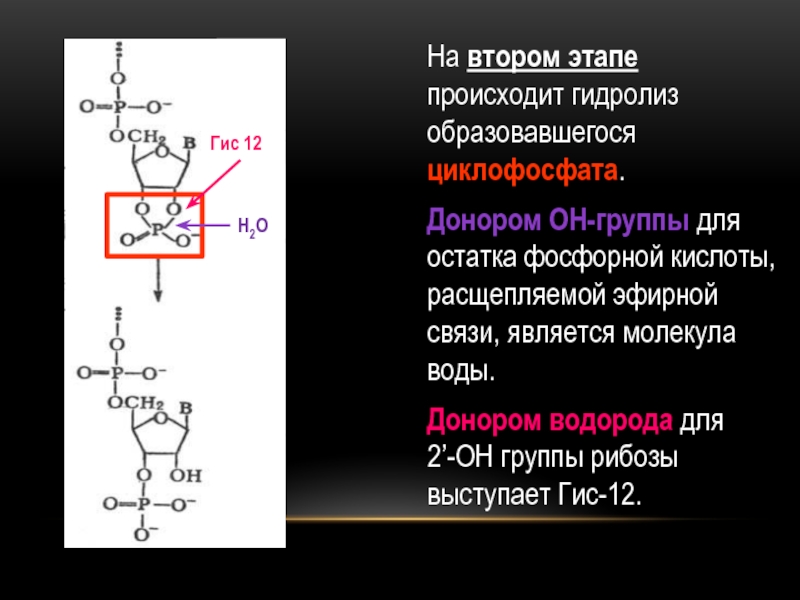
- 26. На втором этапе происходит гидролиз образовавшегося циклофосфата.
- 27. В результате гидролиза нуклеотидной связи рибонуклеазой А
- 28. В процессе катализа происходит:многоточечное сорбционное связывание субстрата
- 29. Скачать презентанцию
Механизм действия ферментов – это последовательность превращений молекул в активном центре фермента, т.е. последовательность стадий катализа:Такая организация катализа отличает ферментативные реакции от не катализируемых превращений.
Слайды и текст этой презентации
Слайд 2Механизм действия ферментов – это последовательность превращений молекул в активном
центре фермента, т.е. последовательность стадий катализа:
реакции от не катализируемых превращений. Слайд 3Механизм действия карбоксипептидазы А
Карбоксипептидаза А – протеолитический пищеварительный фермент, катализирующий
специфический гидролиз С-концевого аминокислотного остатка.
Карбоксипептидаза А синтезируется поджелудочной железой в
неактивной форме прокарбоксипептидазы.Активация фермента происходит под действием трипсина.
Слайд 4Специфичность:
катализирует гидролитическое отщепление С-концевых остатков Тир, Трп и Фен
(при рН > 7
в 12-перстной кишке),
не активна в
отношении Арг, Лиз и Про.Сывороточная карбоксипептидаза В катализирует специфический гидролиз С-концевых остатков Арг и Лиз.
Слайд 5Карбоксипептидаза А – металлофермент, содержащий 1 атом цинка, входящий в
состав активного центра.
Активный центр карбоксипептидазы А локализован во впадине
на поверхности апофермента вблизи атома цинка и образован:Zn2+
Глу-270, Глу-72,
Тир -248,
Арг-145,
Гис-69, Гис-196.
Слайд 6Zn2+ расположен в углублении вблизи к поверхности фермента и три
координационные связи с двумя остатками гистидина и остатком глутаминовой кислоты
(72), четвертая связь направлена на молекулу воды.Рядом с ионом цинка есть большой гидрофобный "карман", в котором фиксируется боковая цепь концевого аминокислотного остатка пептидного субстрата.
Слайд 7При связывании субстрата из активного центра вытесняется 5 молекул воды
(эффект десольватации).
Сорбция субстрата в активном центре происходит следующим образом:
свободная карбоксильная
группа субстрата (С-конец) связывается с гуанидиновой группой аргинина 145;ароматическое кольцо С-концевой аминокислоты помещается в гидрофобный «карман».
Слайд 8При связывании субстрата происходит ряд структурных изменений:
Арг-145 сдвигается на 2
Å и взаимодействует с α-СОО--группой расщепляемой пептидной связи;
СОО--группа Глу-270 сдвигается
на 2 Å к субстрату;связывание субстрата приводит к нарушению водородных связей в апоферменте и Тир-248 сдвигается на 12 Å к гидролизуемой пептидной связи.
В результате этого гидроксильная группа тирозина оказывается возле NH-группы атакуемой связи.
Тир-248, перемещаясь, закрывает зону активного центра.
Слайд 9Глу-270 (нуклеофил) образует ангидрид с карбонильной группой расщепляемой пептидной связи.
Zn2+ (электрофил) поляризует кислород этой же карбонильной группы.
Тир-248 взаимодействует
с NH-группой пептидной связи и становится донором водорода для аминогруппы. Донором протона для гидроксильной группы тирозина является молекула воды.
В результате этих воздействий ангидрид расщепляется.
Слайд 10В процессе ферментативного гидролитического расщепления пептидной связи карбоксипептидазой А происходит:
сближение
и ориентация субстрата по отношению к функциональным группам активного центра
фермента,специфическое многоточечное связывание субстрата в активном центре;
индукция конформационных изменений в молекуле фермента;
десольватация зоны активного центра при образовании фермент-субстратного комплекса:
общий кислотно-основный катализ.
Слайд 11МЕХАНИЗМ ДЕЙСТВИЯ СЕРИНОВЫХ ПРОТЕИНАЗ
Сериновые протеазы катализируют специфическое гидролитическое расщепление полипептидных
цепей.
Катализ в сериновых протеазах осуществляется ОН-группой серина.
Кислород в форме
-ОН группы не активен.Активация кислорода происходит в результате потери Н+ и перехода в форму -О-.
Слайд 12Отрыв Н+ от Сер-195 осуществляют Гис-57 и Асп-102, образующие вместе
с серином «триаду переноса заряда».
Слайд 13Субстрат-связывающий центр сериновых протеиназ состоит из:
оксианионовой дыры (образованной функциональными группами
аминокислотных остатков, расположенными в гидрофобном участке), связывающей кислород расщепляемой пептидной
группы,неспецифической пептид-связывающей площадки, отвечающей (вместе с оксианионовой дырой) за то, чтобы расщепляемая пептидная группа заняла правильное положение относительно активированного атома кислорода Ser195,
специфического субстрат-связывающего кармана, отвечающего за распознавание той аминокислоты, по карбоксилу которой производится расщепление пептида. Этот тип катализа является нуклеофильным.
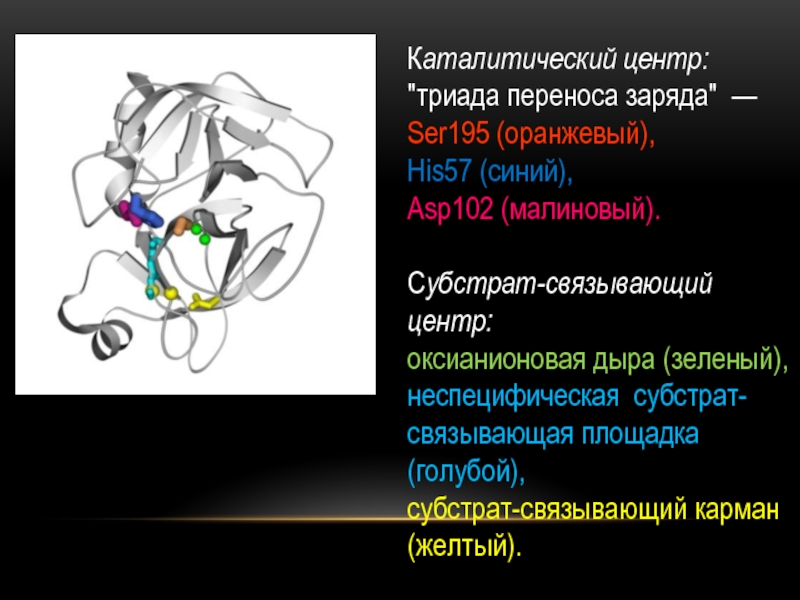
Слайд 14Каталитический центр:
"триада переноса заряда" —
Ser195 (оранжевый),
His57 (синий),
Asp102 (малиновый).
Субстрат-связывающий центр:
оксианионовая дыра (зеленый),
неспецифическая субстрат-связывающая площадка (голубой),
субстрат-связывающий
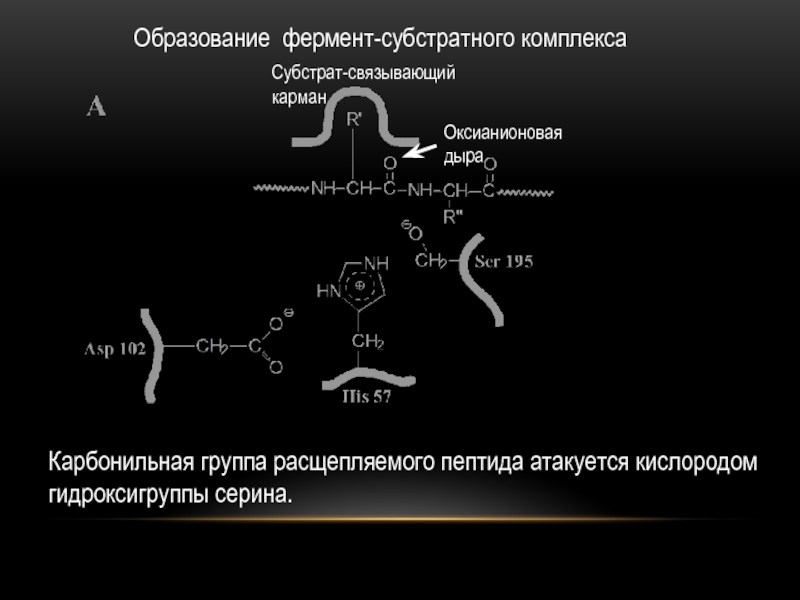
карман (желтый).Слайд 15Образование фермент-субстратного комплекса
Карбонильная группа расщепляемого пептида атакуется кислородом гидроксигруппы серина.
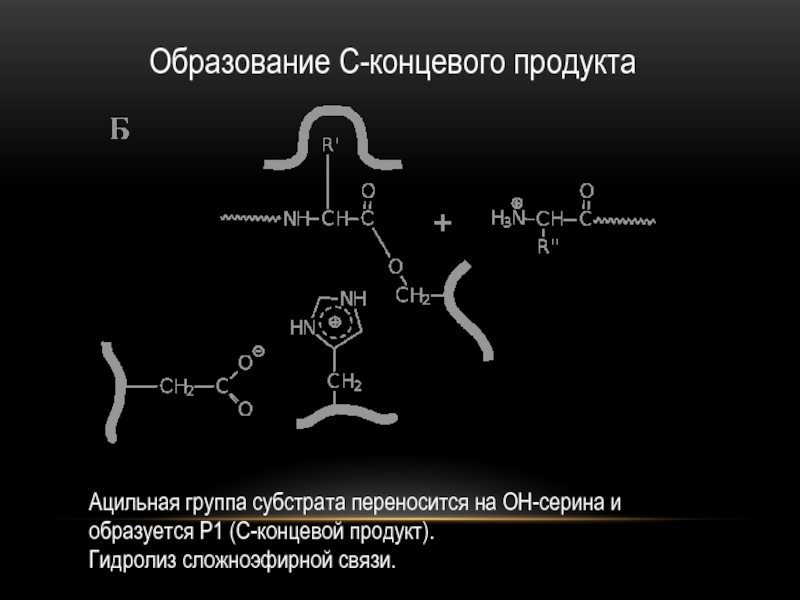
Слайд 16Образование С-концевого продукта
Ацильная группа субстрата переносится на ОН-серина и образуется
Р1 (С-концевой продукт).
Гидролиз сложноэфирной связи.
Слайд 18Ацилферментный активированный комплекс очень не стабилен – это определяется скорость
катализа (гидролиза).
Связывание =СО расщепляемой связи в оксианионовой дыре снижает энергию
переходного состояния.Слайд 19Специфичность сериновых протеиназ:
Химотрипсин – гидролизует связи после ароматических аминокислот.
Эластаза –
гидролизует после нейтральных алифатических аминокислот.
Трипсин – гидролизует после положительно заряженных
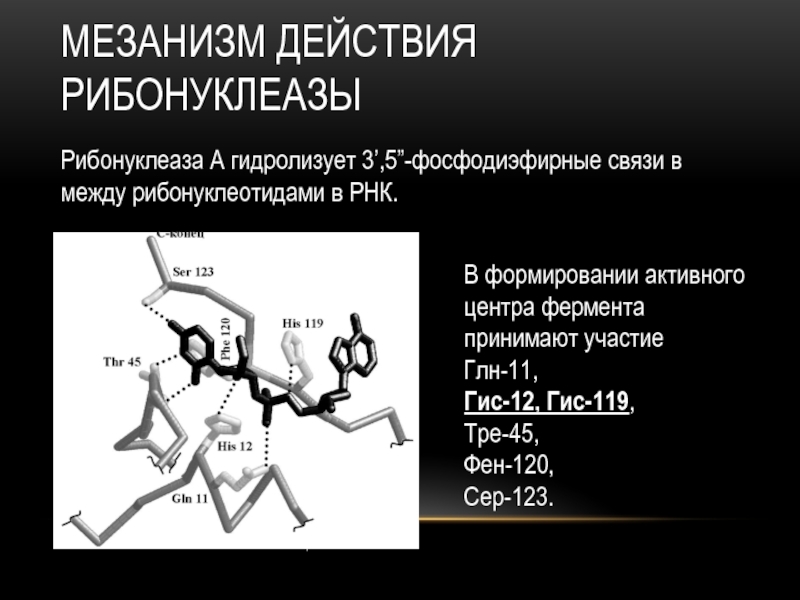
аминокислотных остатков.Слайд 20МЕЗАНИЗМ ДЕЙСТВИЯ РИБОНУКЛЕАЗЫ
Рибонуклеаза А гидролизует 3’,5”-фосфодиэфирные связи в между рибонуклеотидами
в РНК.
В формировании активного центра фермента принимают участие
Глн-11,
Гис-12, Гис-119,
Тре-45,
Фен-120,
Сер-123.