Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Механизм реакции - последовательность элементарных стадий процесса, в
Содержание
- 1. Механизм реакции - последовательность элементарных стадий процесса, в
- 2. Зачем знать механизм?5
- 3. Механизмы разрыва ковалентной связиГомолитическийГетеролитический (h)SRARAEANSESNSAX+ - электрофилY- - нуклеофилA – англ. addition – присоединение10
- 4. Радикальное замещение SR11
- 5. SR Механизм реакции замещенияН.Н. Семенов(1896-1986)1956 г.
- 6. Ингибиторы радикальных реакций13(от лат. inhibeo - удерживаю)
- 7. радикал аллильного типаSR(реакция Львова) Радикальное замещение в алкенахЛьвов Михаил Дмитриевич (1848–1899)Ученик А.М.Бутлерова.14
- 8. SEРадикальное замещение в аренах15SR
- 9. радикал бензильного типа16
- 10. Электрофильное присоединение (AE)
- 11. Механизм реакции электрофильного присоединенияH2C=CH2 + Br2 BrCH2-CH2Br18δ+δ-
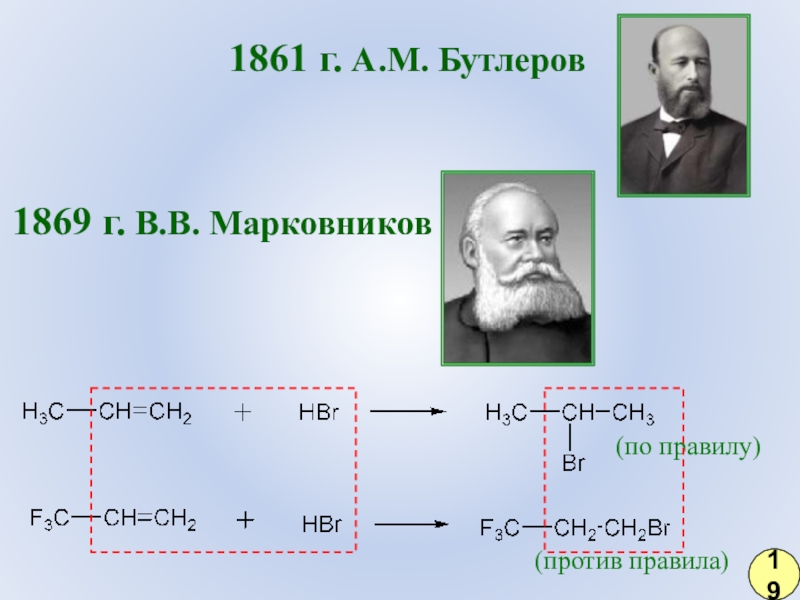
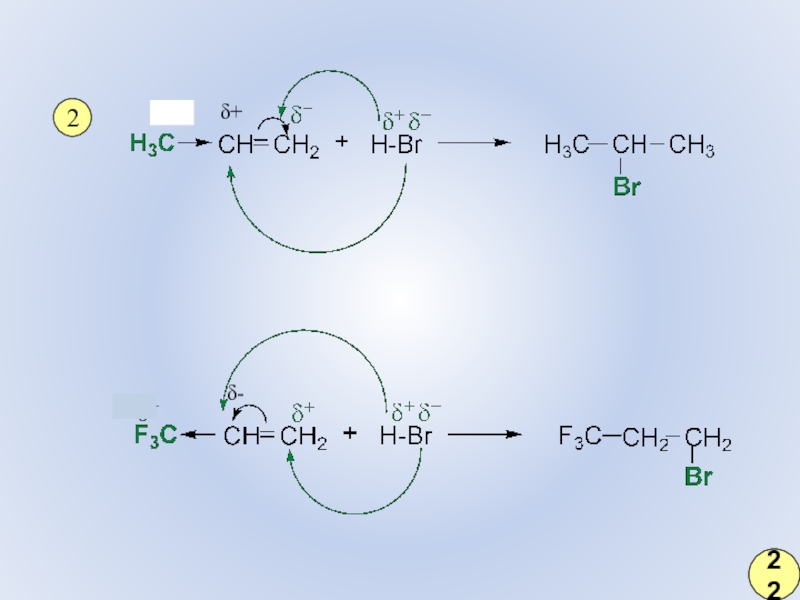
- 12. 1861 г. А.М. Бутлеров1869 г. В.В. Марковников(по правилу)(против правила)19
- 13. 19ИЗМЕНЕНИЕ ЭЛЕКТРОННОЙ ПЛОТНОСТИ В МОЛЕКУЛЕРЕАКЦИОННАЯ СПОСОБНОСТЬ
- 14. 1а)б)а)б)AE?Электронная интерпретация правила Марковникова 21
- 15. 2δ+δ-22
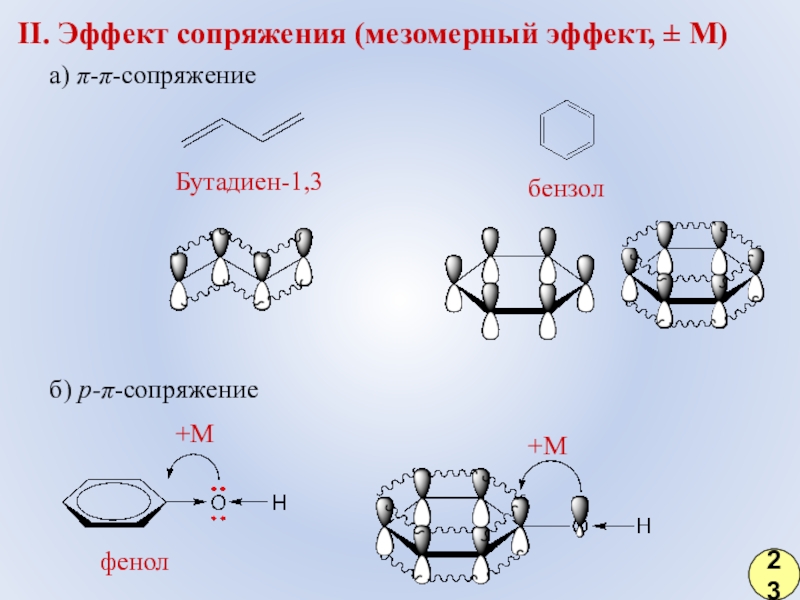
- 16. II. Эффект сопряжения (мезомерный эффект, ± М)а) π-π-сопряжениеб) р-π-сопряжениеБутадиен-1,3бензол+М+Мфенол23
- 17. Электрофильное замещение SE
- 18. ΔH = - 28,6 ккал/моль (А) ΔH = - 49,8 ккал/моль (В) 3А ≠ В36 ккал/моль21
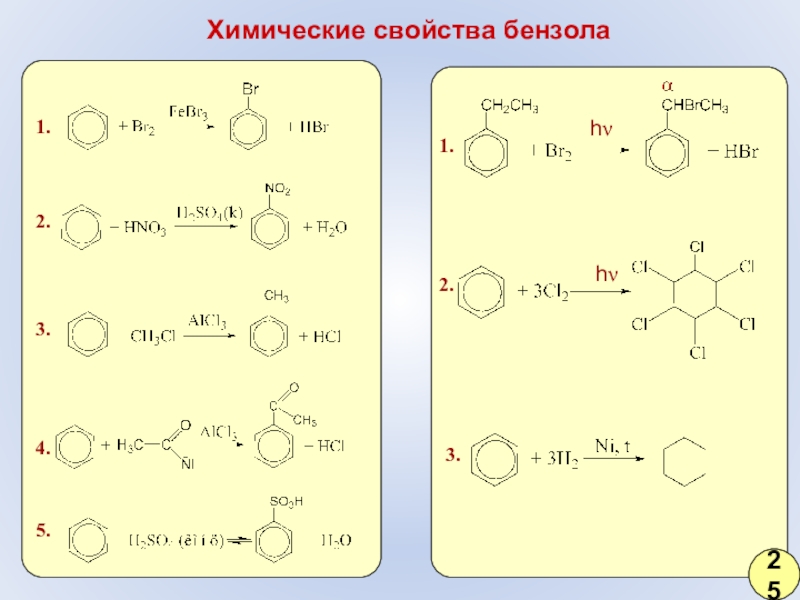
- 19. Химические свойства бензола1.2.3.4.5.1.2.3.hνhν25
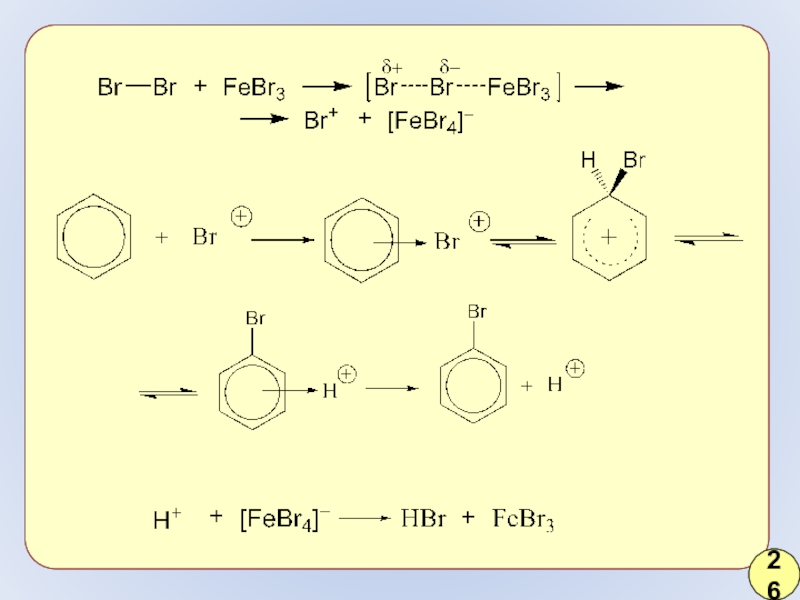
- 20. 26
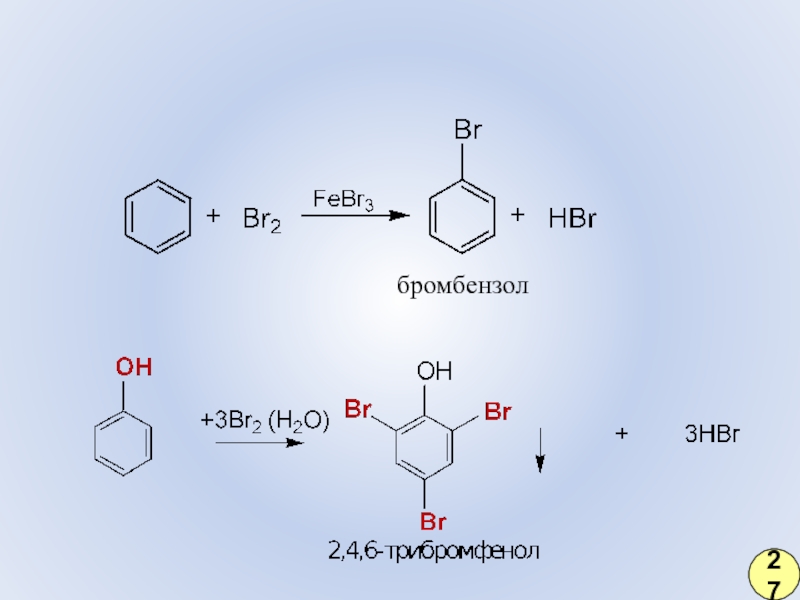
- 21. бромбензол27
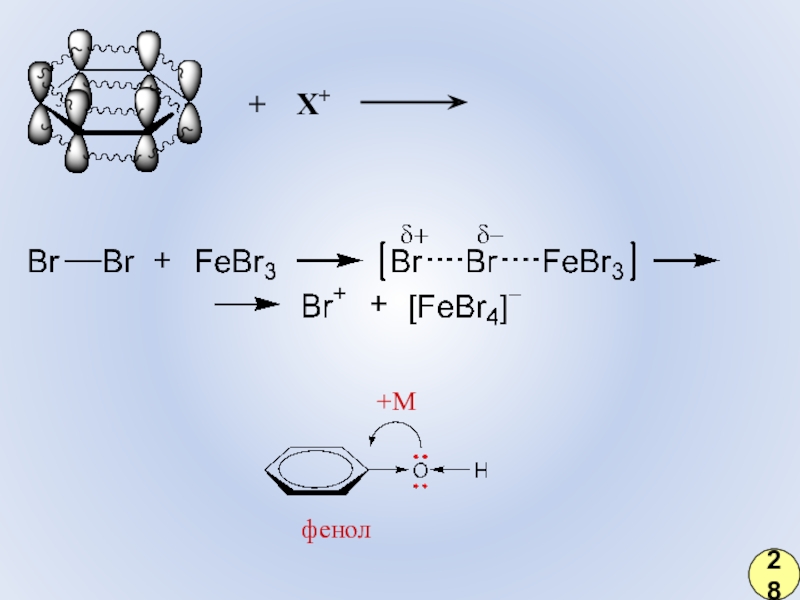
- 22. +Мфенол+ Х+28
- 23. (Реакция Фриделя — Крафтса) Шарль Фридель (1832-1899)Джеймс Мейсон Крафтс (1839-1917)Реакция алкилирования29
- 24. орто- ,пара- ориентантымета- ориентантыX:Y:R-, -OH, -NH2, -NHR,
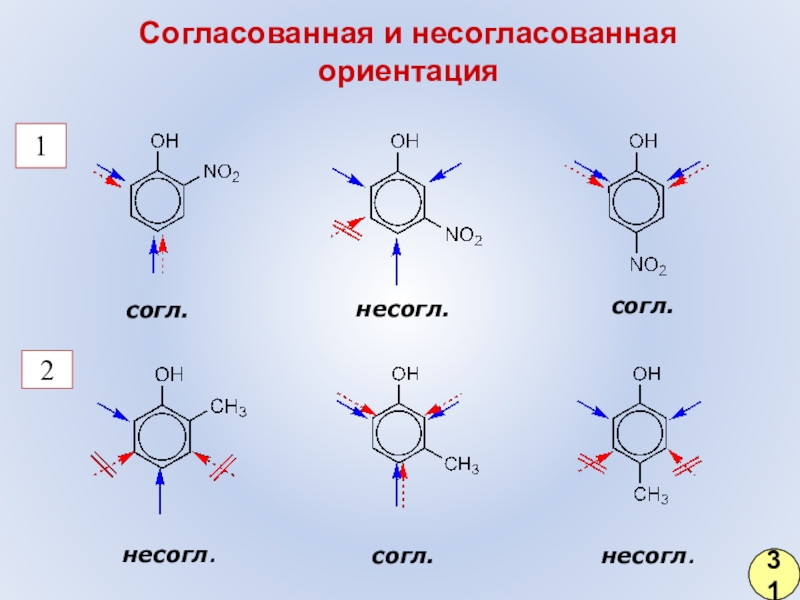
- 25. Согласованная и несогласованная ориентация12согл. несогл. согл. несогл. согл. несогл. 31
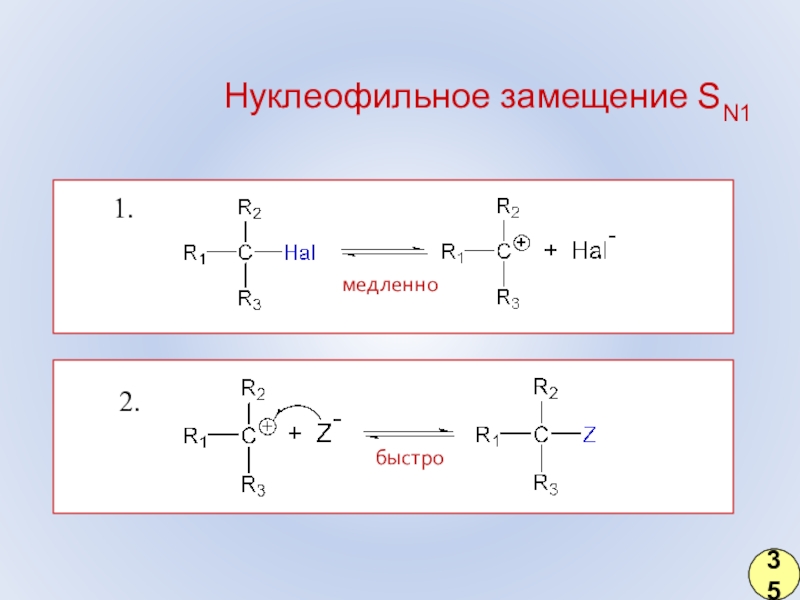
- 26. Нуклеофильное замещение SN1медленно1.2.быстро35
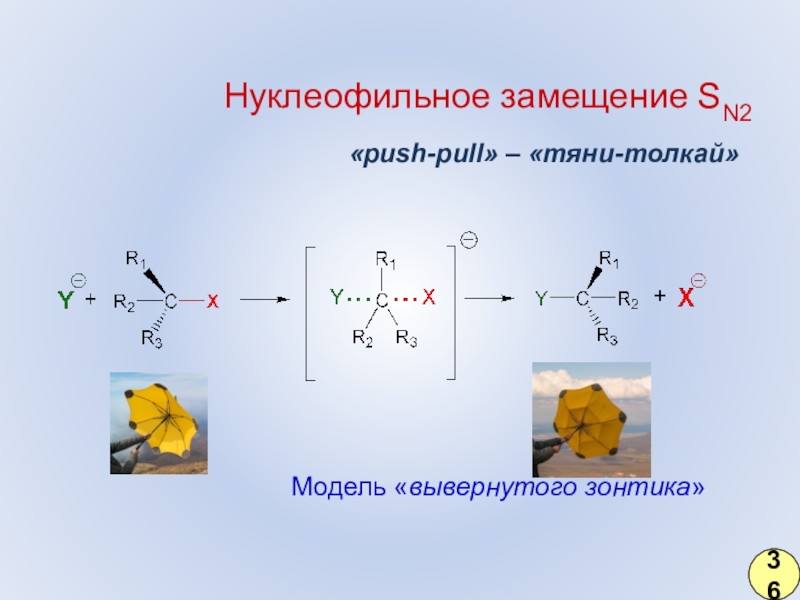
- 27. Нуклеофильное замещение SN2«push-pull» – «тяни-толкай»Модель «вывернутого зонтика»36
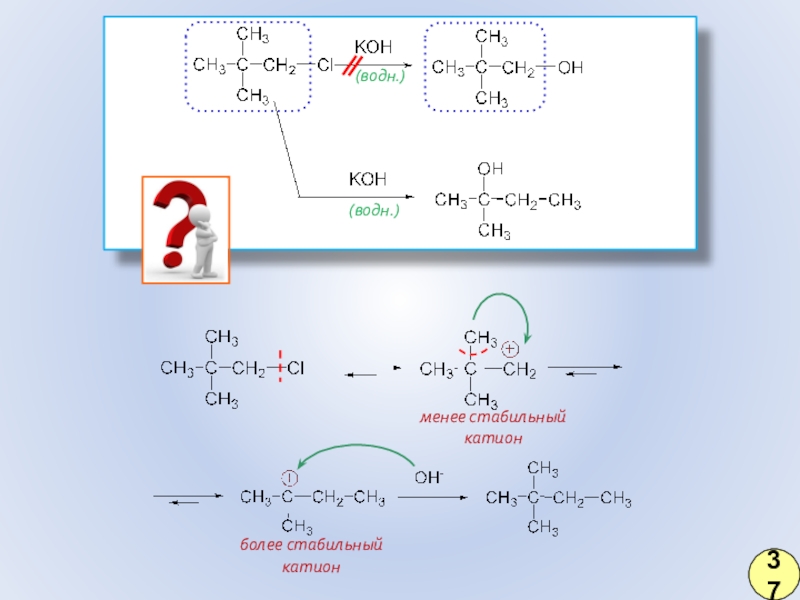
- 28. (водн.)(водн.)менее стабильный катионболее стабильный катион37
- 29. Кислотный катализ
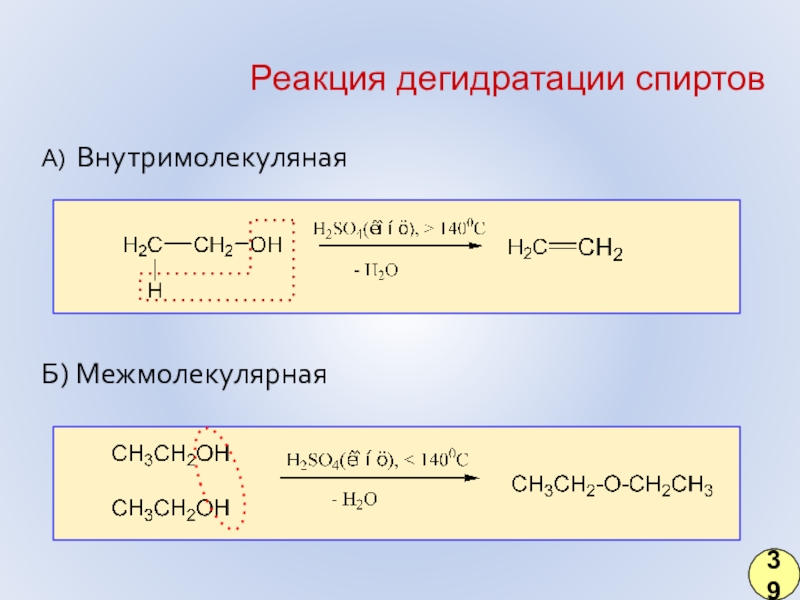
- 30. Реакция дегидратации спиртовА) Внутримолекуляная Б) Межмолекулярная 39
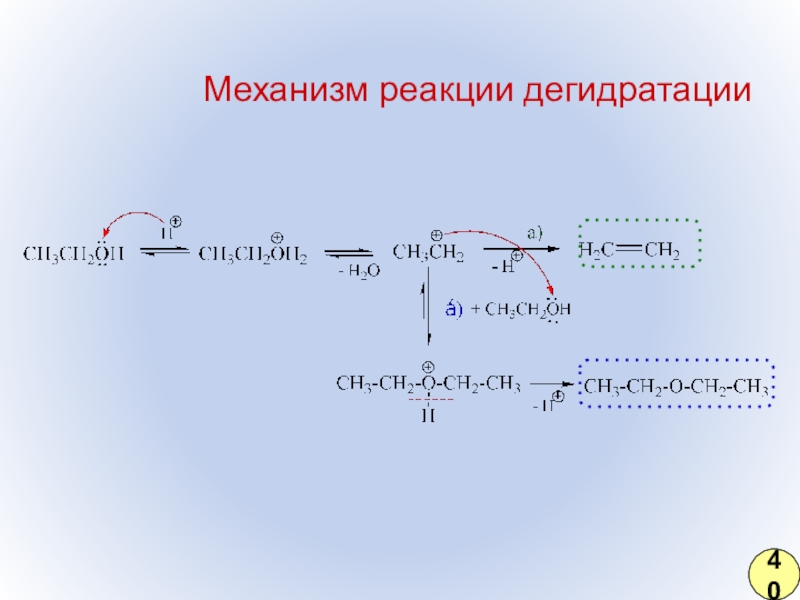
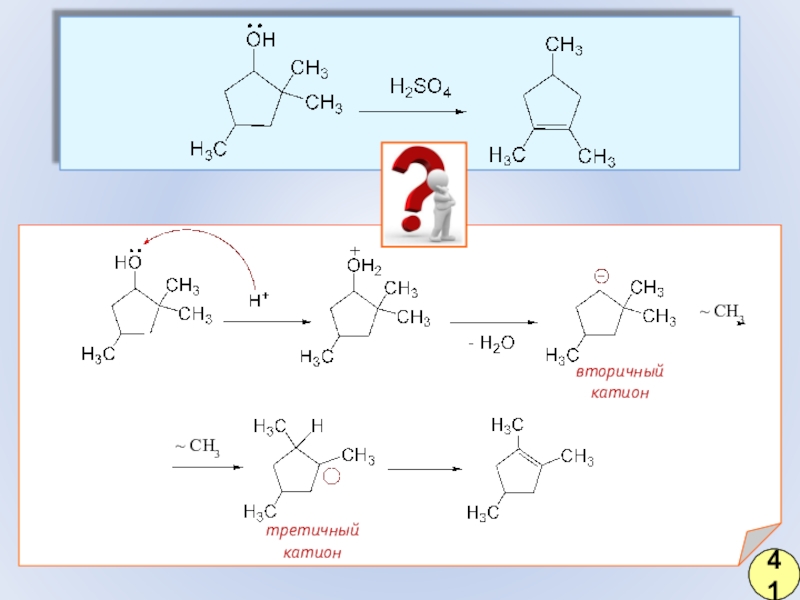
- 31. Механизм реакции дегидратации40
- 32. ?вторичный катионтретичный катион~ СH3~ СH341
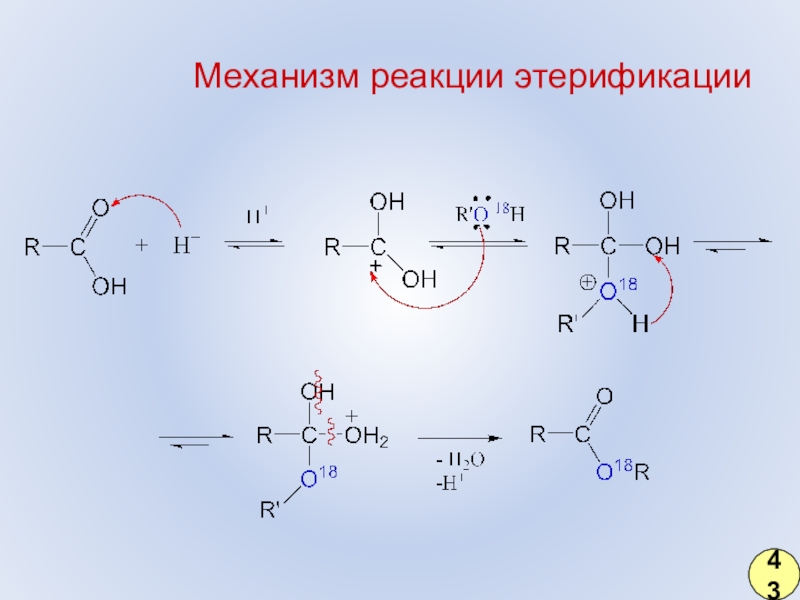
- 33. Этерификация – от лат. слова aether – эфир. ?Реакция этерификации42
- 34. Механизм реакции этерификации43
- 35. Основный катализАльдольная конденсацияРеакция КанниццароСтанислао Канниццаро(1826 - 1910 г.г.)итальянский химик
- 36. Слайд 36
- 37. Слайд 37
- 38. СO + H2Ru, 1000 атм, 1500CThO2, 600
- 39. При риформинге н-гептана образуется бензол.Винилацетилен получают димеризацией
- 40. Катализатор Циглера - НаттаЦис-полиизопрен511963 г. – Нобелевская
- 41. 1. С2H5OH 2. 2CH3OH + 2K3. С2H5OH
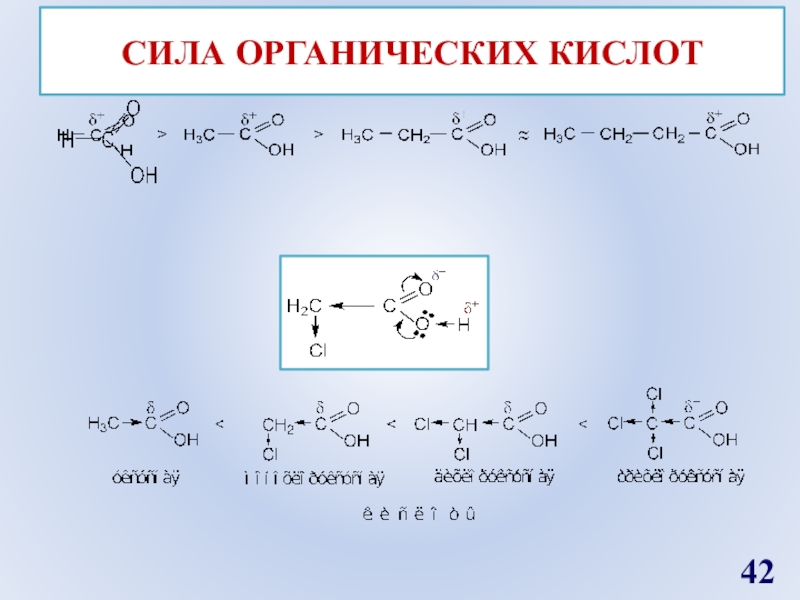
- 42. СИЛА ОРГАНИЧЕСКИХ КИСЛОТ
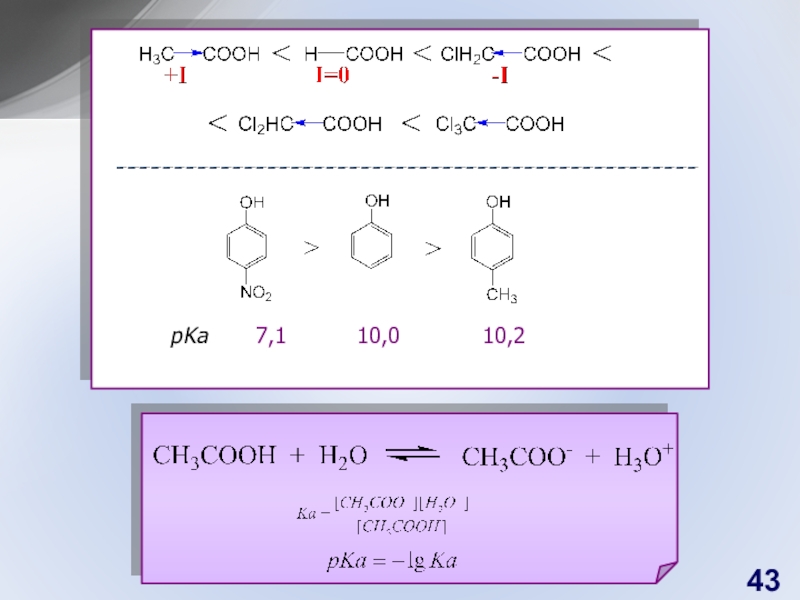
- 43. pKa7,110,010,2
- 44. Расположите в порядке усиления кислотных
- 45. Дипольные моменты (µ) винилхлорида и
- 46. Расположите в порядке увеличения кислотных
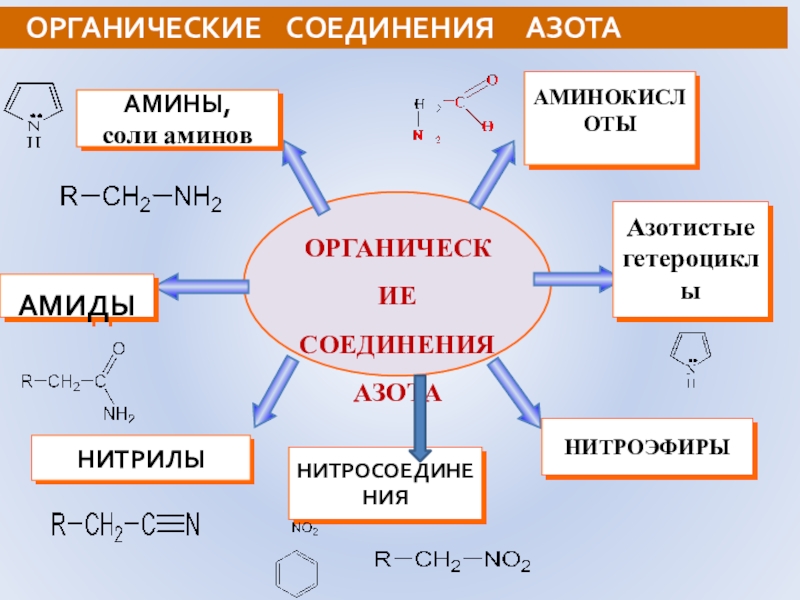
- 47. ОРГАНИЧЕСКИЕСОЕДИНЕНИЯ АЗОТА ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ АЗОТААМИНОКИСЛОТЫ Азотистые гетероциклыНИТРОЭФИРЫНИТРИЛЫАМИДЫАМИНЫ,соли аминовНИТРОСОЕДИНЕНИЯ
- 48. анилинN-метиланилинп-толуидинм-анизидинα-нафтиламинβ-нафтиламинАмины
- 49. Основность в газовой фазе
- 50. диэтиламинанилиндиметиламиндифениламинэтиламинпиридин
- 51. Расположите в ряд по увеличению
- 52. Аммиак и диметиламинМетиламин и анилинАнилин и аммиакДиэтиламин и дифениламин5. Триметиламин и метиламин6. Этиламин и пиридин
- 53. Анилин - жидкость, хорошо растворимая в водеАнилин
- 54. - HCl+ HNO3+ NaOH+ HNO3
- 55. Реагирует с КОНИмеет молекулярную структуруРеагирует с AgNO3Обесцвечивает бромную водуРеагирует c HCl
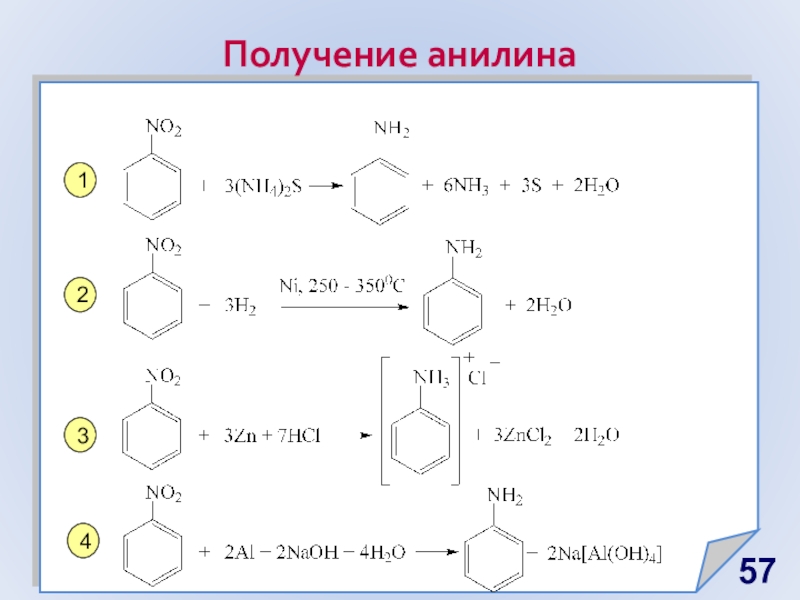
- 56. В кислой средеВ щелочной средеВ газовой фазе[H]250-350°C
- 57. Получение анилина1234
- 58. Слайд 58
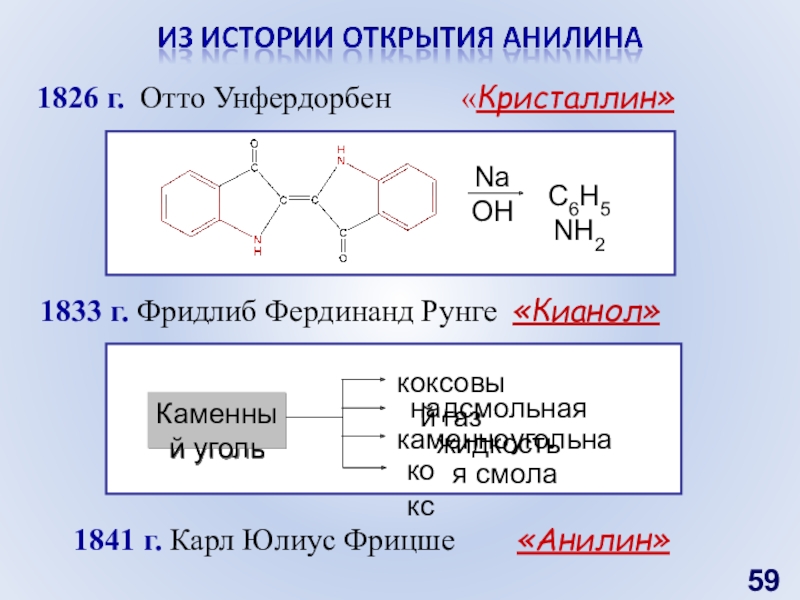
- 59. 1826 г. Отто Унфердорбен
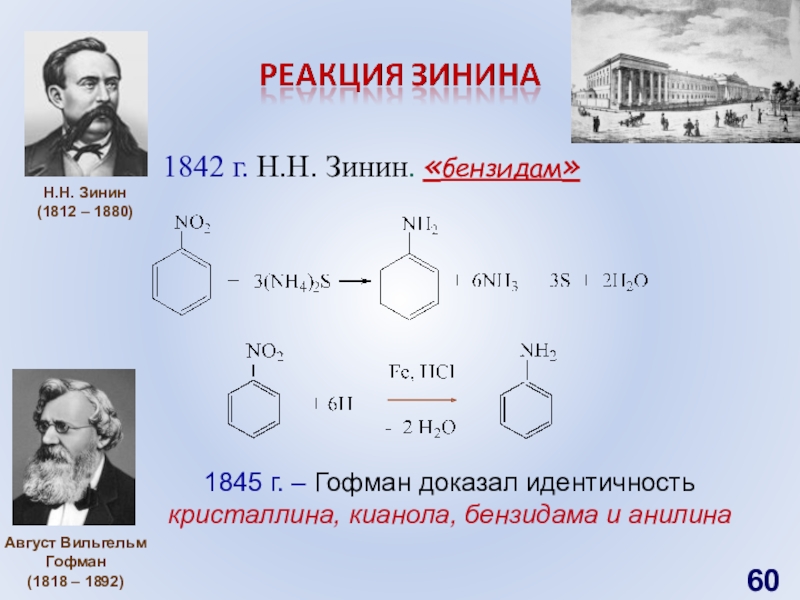
- 60. 1842 г. Н.Н. Зинин. «бензидам»Н.Н. Зинин(1812 –
- 61. (1809—1880) Ю́стус ЛИ́БИХ (1803— 1873) . Николай
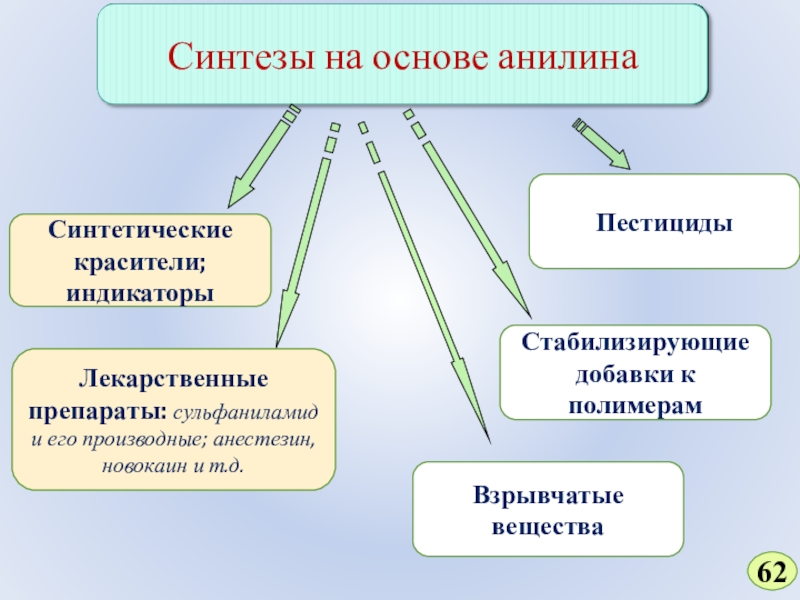
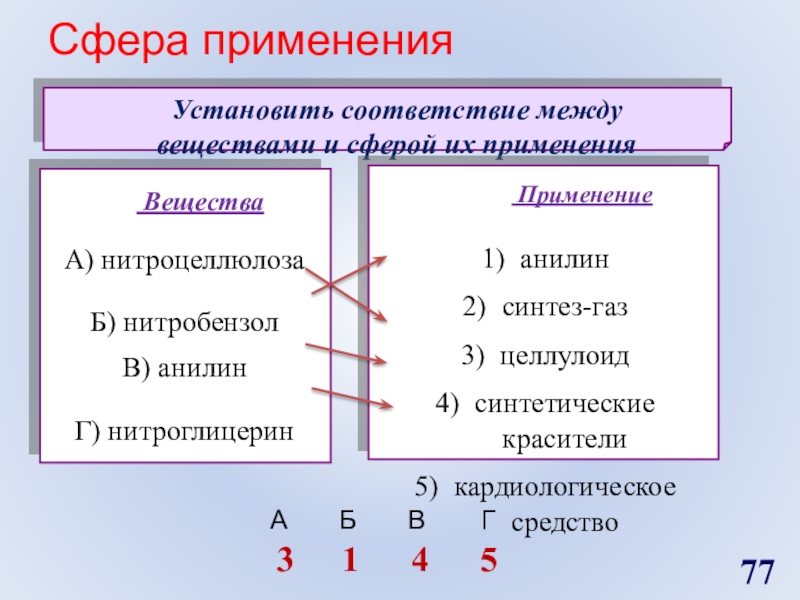
- 62. Синтетические красители;индикаторыЛекарственные препараты: сульфаниламид и его производные; анестезин, новокаин и т.д.Взрывчатые веществаПестицидыхиральное разделениеСтабилизирующие добавки к полимерам
- 63. Слайд 63
- 64. Анилиновый желтый 1863 г. Анилиновый черный Хромофорные группыАуксохромные группыМетиловый оранжевый
- 65. СвойстваВ отличие от триметиламина анилинРеагирует с НСIВзаимодействует
- 66. Почему при нитровании анилина азотной
- 67. СвойстваНельзя различить с помощью бромной водыбензол и
- 68. СвойстваУстановить соответствие между двумя веществами и реагентом, позволяющим их отличить: 1243
- 69. CH3ClX1NH3 (изб)X2X3X2H2 , t0HNO2HCOOH142CH3Cl + 2NH3CH3NH2+ NH4ClCH3NH2+ HNO2CH3OH + N2 + H2O+ 2H22CH3OHt0, кат 124
- 70. CH3СH2CH2CH2OHX1H2SO4 (конц)t0>1400 X2X3HBr, H2O2 NH3В схеме превращений вещество X3 1-аминобутан 2-аминобутанбромидбутиламмония1-бромбутан
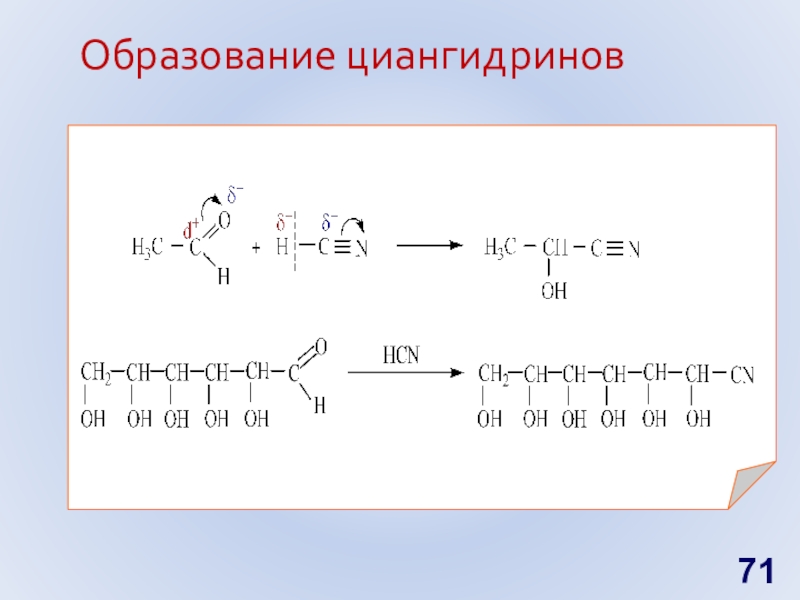
- 71. Образование циангидринов
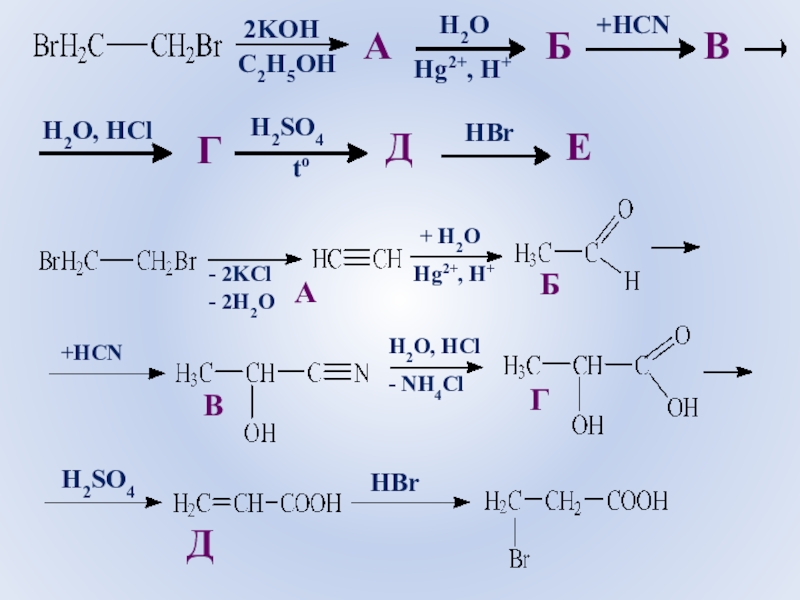
- 72. - 2KCl- 2H2OА+ H2OHg2+, H+А+HCNБВH2O, HCl- NH4ClГДHBrH2SO4
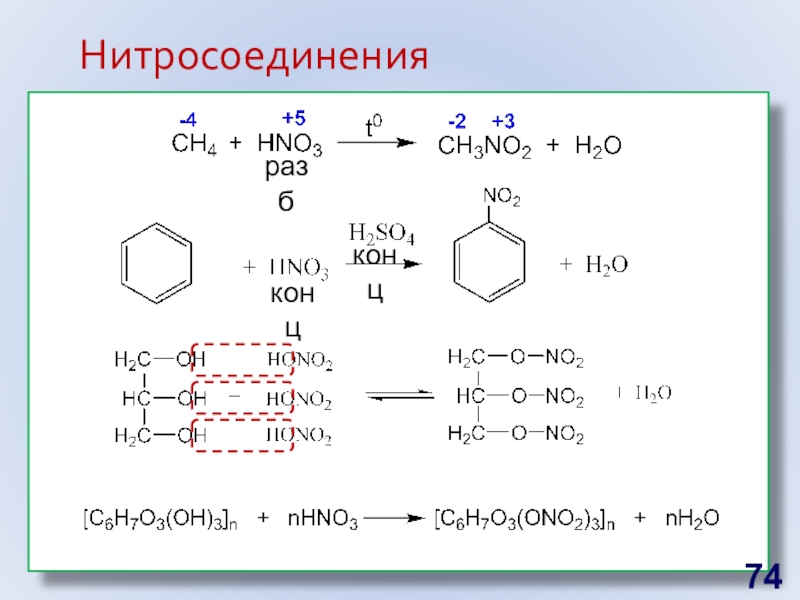
- 73. Нитросоединения Группа–NО2 – мета-ориентант
- 74. концконцразбНитросоединения
- 75. Кристиан Фридрих Шёнбейн(1799-1868 гг)профессор Базельскогго университетаНитроцеллюлоза и
- 76. NO Нитроглицерин -сосудорасширяющее средствоФерид Мурадамериканский врач1998 г.
- 77. Сфера примененияУстановить соответствие между веществами и сферой их применения314 5
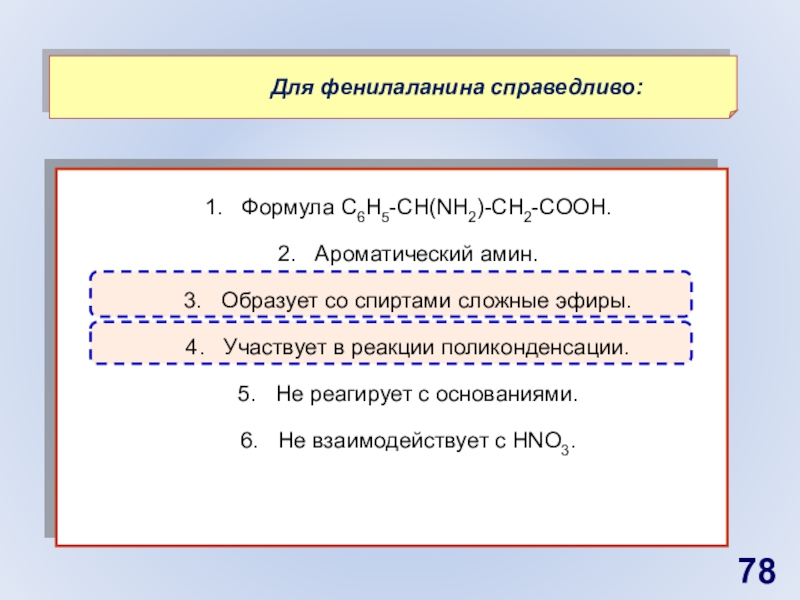
- 78. Формула С6H5-CH(NH2)-CH2-COOH.Ароматический амин.Образует со спиртами сложные эфиры.Участвует в реакции поликонденсации.Не реагирует с основаниями.Не взаимодействует с HNO3.
- 79. KOH, HCl, CH3NH2, СН3OHNaCl, KOH, NH3,
- 80. Синтез капронаКапрон (найлон-6)εε-аминомасляная кислотакапролактамαδγβкапрон
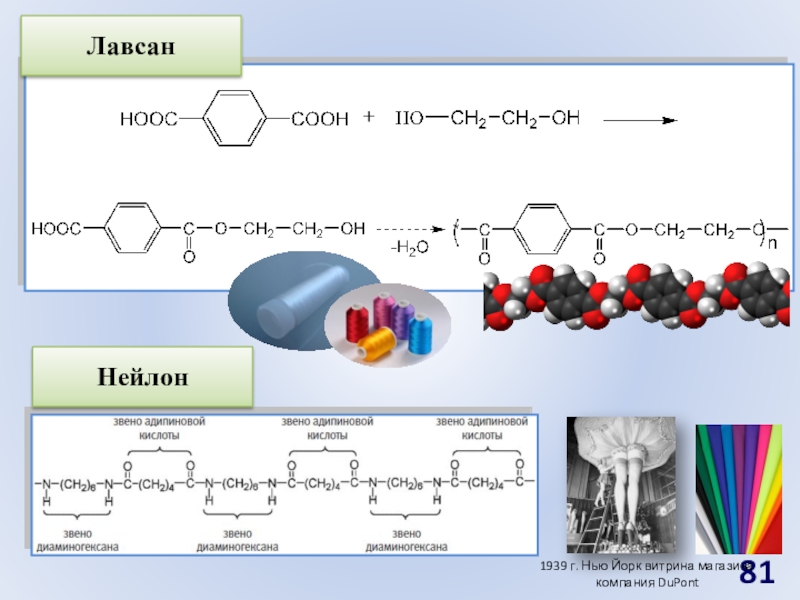
- 81. НейлонЛавсан1939 г. Нью Йорк витрина магазина компания DuPont
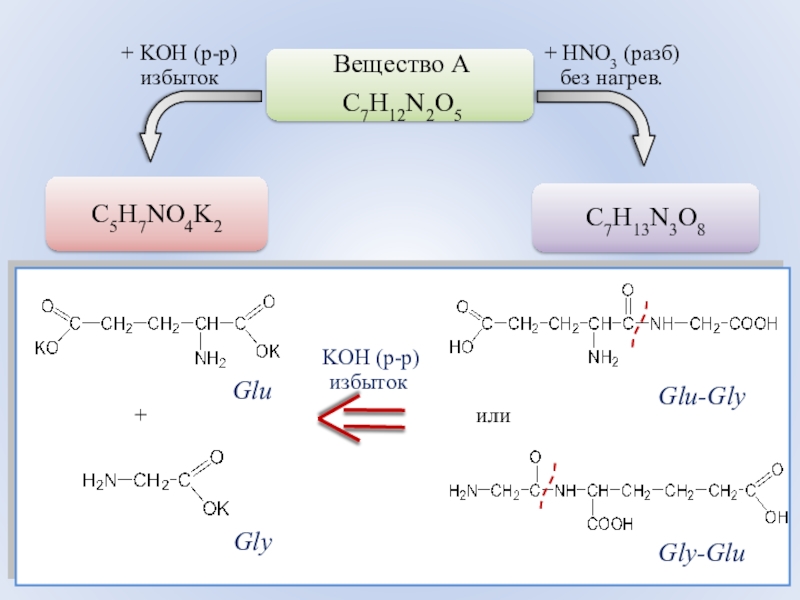
- 82. + KOH (р-р)избыток+ HNO3 (разб)без нагрев.Glu-GlyGly-GluGluGly + или
- 83. 6Защита группы. Cульфаниловая кислота Сульфаниловая кислота
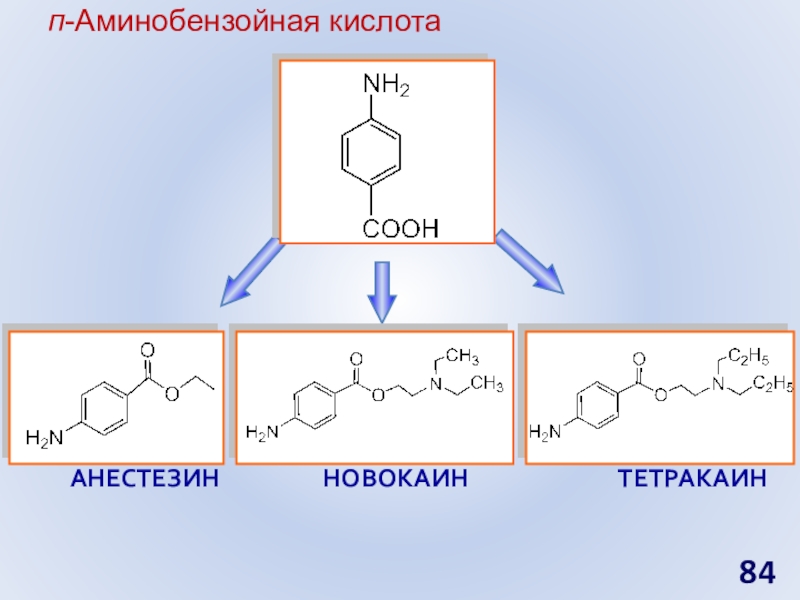
- 84. п-Аминобензойная кислотаНовокаинТетракаин Анестезин
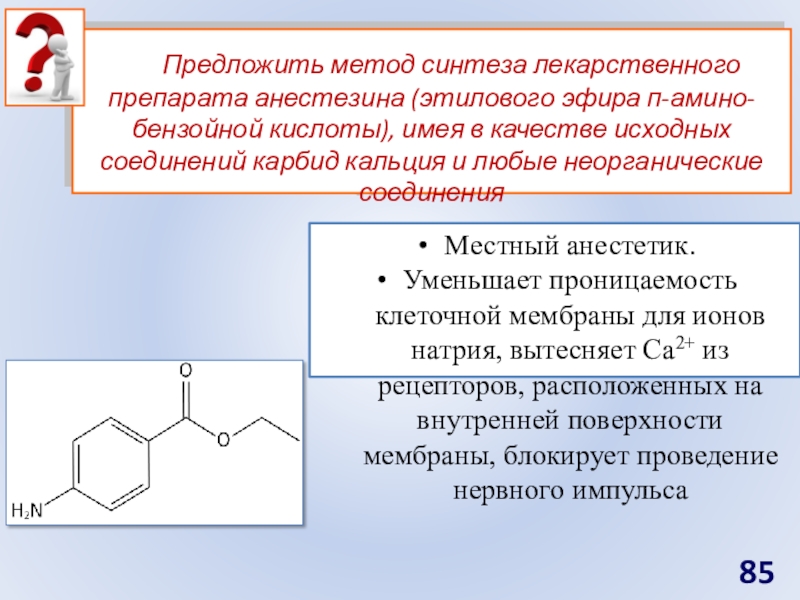
- 85. Предложить метод синтеза лекарственного препарата
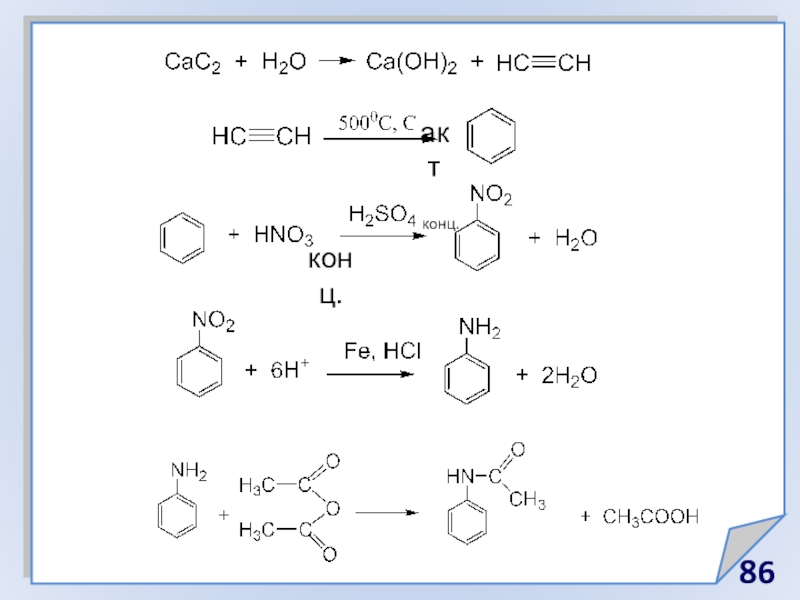
- 86. актконц.конц.
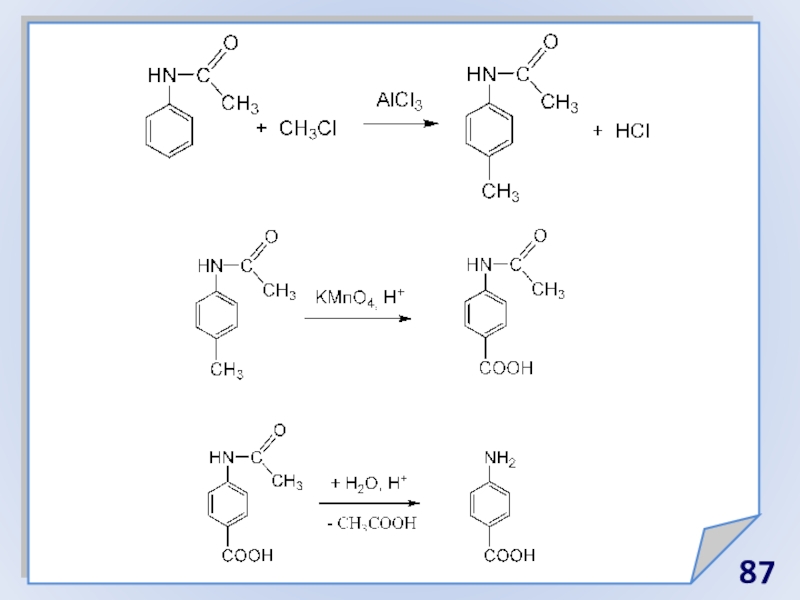
- 87. Слайд 87
- 88. НовокаинА дальше?
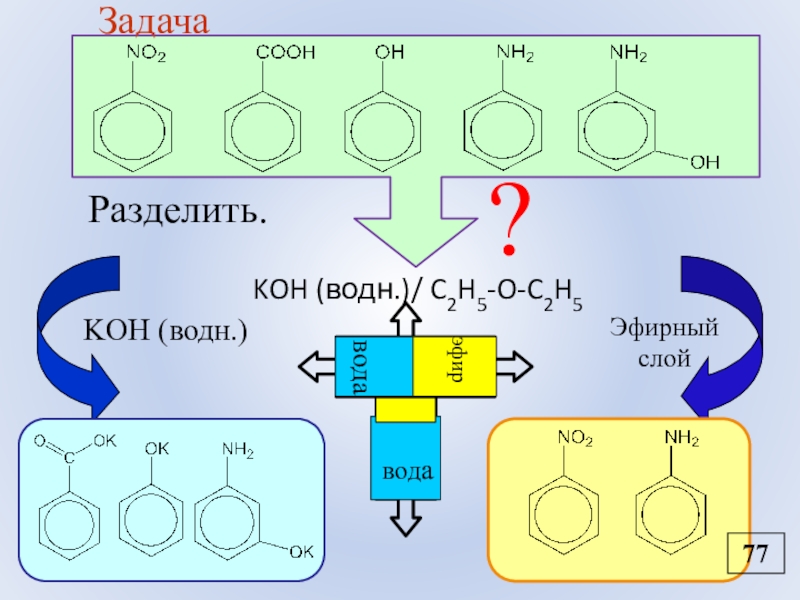
- 89. ?KOH (водн.)/ C2H5-O-C2H5KOH (водн.)Эфирный слойЗадачаРазделить.77
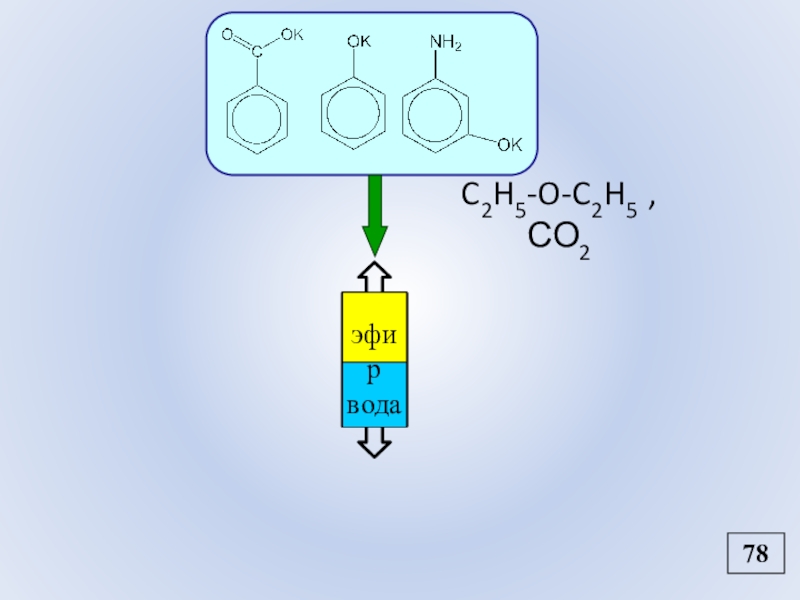
- 90. C2H5-O-C2H5 , СО2 78
- 91. 79
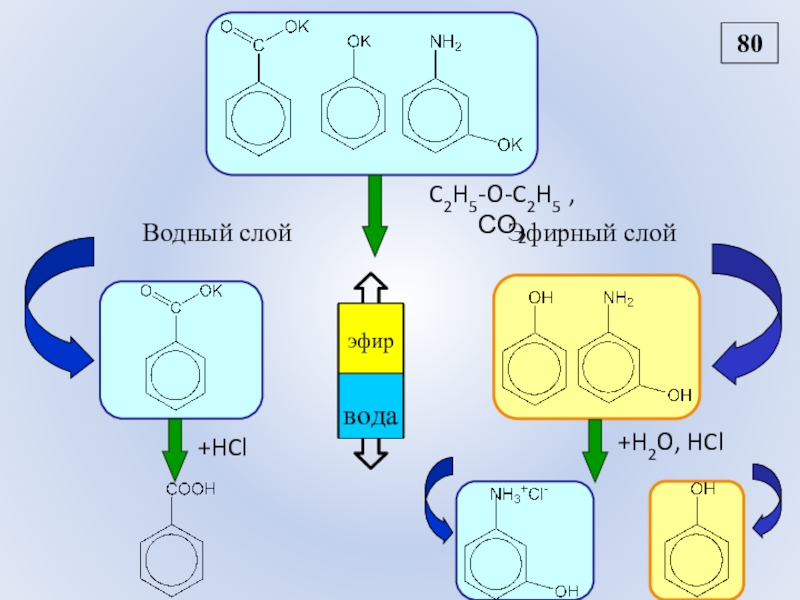
- 92. C2H5-O-C2H5 , СО2 +HCl +H2O, HCl Водный слойЭфирный слой80
- 93. +H2O, HCl Tкип (эфира) = 34,5˚С+ NaOH-NaClВодный слойЭфирный слой81
- 94. «Химия создает свой предмет. Эта творческая
- 95. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Механизм реакции
- последовательность элементарных стадий процесса, в результате которого
исходные вещества превращаются в продукты
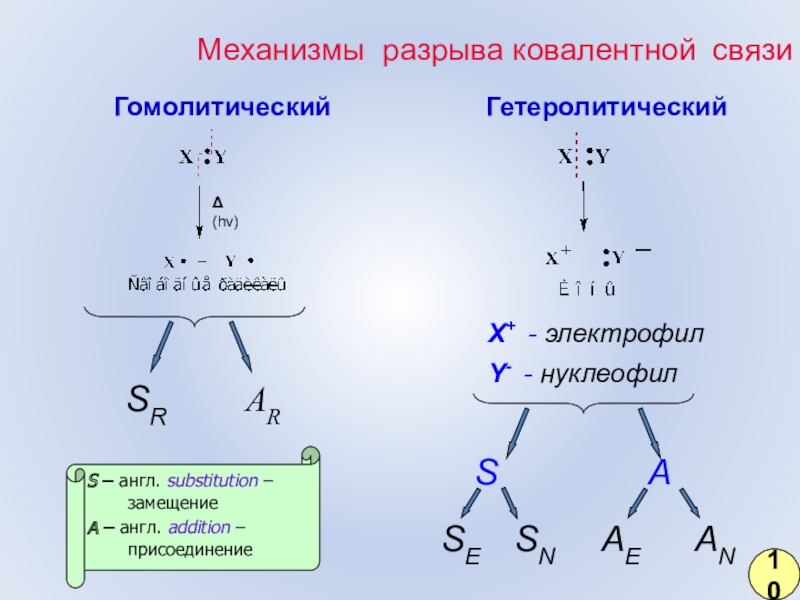
Слайд 3Механизмы разрыва ковалентной связи
Гомолитический
Гетеролитический
(h)
SR
AR
AE
AN
SE
SN
S
A
X+ - электрофил
Y- - нуклеофил
A –
англ. addition –
присоединение
10
Слайд 5SR Механизм реакции замещения
Н.Н. Семенов
(1896-1986)
1956 г. -
Н.Н. Семенов, С.
Хиншельвуд
Нобелевская
премия по химии
«за исследования
в области механизма
химических реакций»
12
…………….
Cl–Cl 242 кДж/моль
С-Н 435 кДж/моль
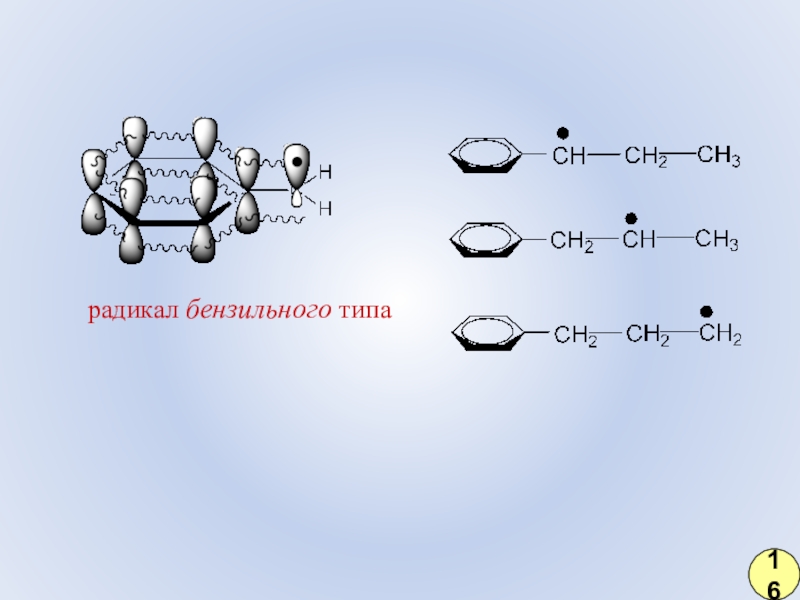
Слайд 7радикал аллильного типа
SR
(реакция Львова)
Радикальное замещение в алкенах
Львов
Михаил Дмитриевич
(1848–1899)
Ученик
А.М.Бутлерова.
14
Слайд 1319
ИЗМЕНЕНИЕ ЭЛЕКТРОННОЙ ПЛОТНОСТИ В МОЛЕКУЛЕ
РЕАКЦИОННАЯ СПОСОБНОСТЬ
Сsp3 Csp2 Csp
ЭО
2,5 2,8 3,2 δ+
δ-
С―С―С―С Х
I. Индуктивный эффект
-I
+I
ЭЛЕКТРОННЫЕ ЭФФЕКТЫ ЗАМЕСТИТЕЛЕЙ
(ДОНОРНЫЕ, АКЦЕПТОРНЫЕ)
20
Слайд 16II. Эффект сопряжения (мезомерный эффект, ± М)
а) π-π-сопряжение
б) р-π-сопряжение
Бутадиен-1,3
бензол
+М
+М
фенол
23
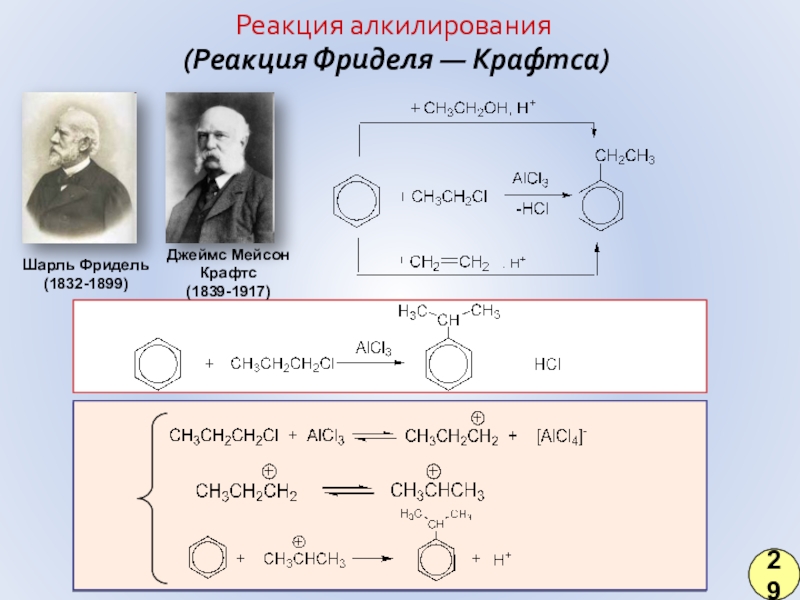
Слайд 23(Реакция Фриделя — Крафтса)
Шарль Фридель (1832-1899)
Джеймс Мейсон
Крафтс
(1839-1917)
Реакция алкилирования
29
Слайд 24орто- ,пара- ориентанты
мета- ориентанты
X:
Y:
R-, -OH, -NH2, -NHR, -NR2,-OR
F-,
Cl-, Br-, I-
- NO2, -COOH,
-C=O, -SO3H, -С≡N; -СОН
30
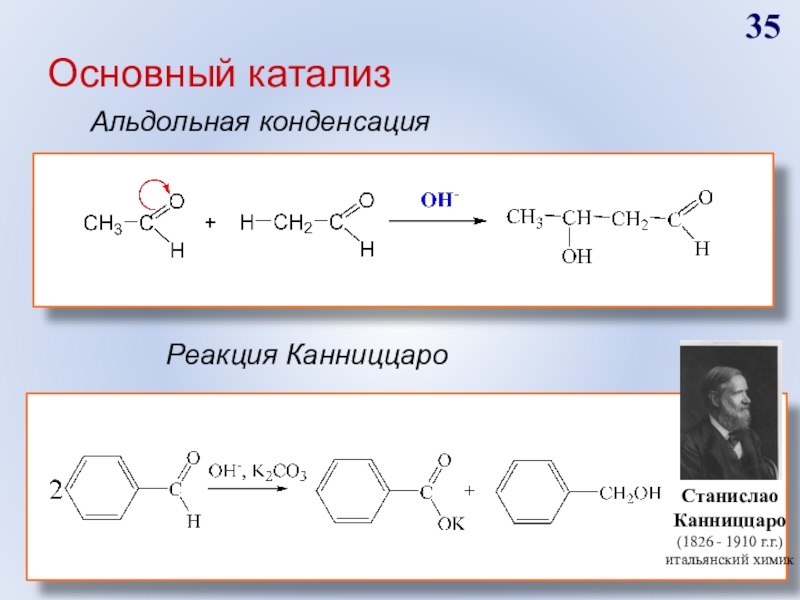
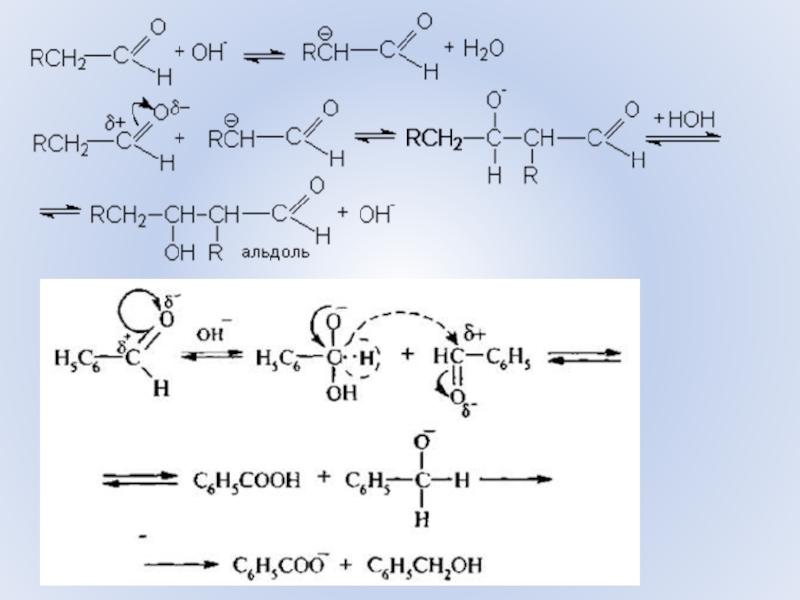
Слайд 35Основный катализ
Альдольная конденсация
Реакция Канниццаро
Станислао Канниццаро
(1826 - 1910 г.г.)
итальянский химик
Слайд 38СO + H2
Ru, 1000 атм, 1500C
ThO2, 600 атм, 4500 C
Cr2O3,
30 атм, 5000 C
Fe, 2000 атм, 1750 C
ZnO, Cr2O3, 250
атм, 2800 CПАРАФИНЫ
ИЗОПАРАФИНЫ
ТОЛУОЛ, КСИЛОЛЫ
ВЫСШИЕ СПИРТЫ
СH3OH
Реакция Фишера-Тропша
синтин
(синтетический бензин)
Fe/Al2O3, Ru, Co, Ni
Слайд 39При риформинге н-гептана образуется бензол.
Винилацетилен получают димеризацией ацетилена.
Ацетилен можно получить
в результате термического разложения метана.
Карбидный способ получения ацетилена заключается в
обработке карбида алюминия водой.Стереорегулярные каучуки получают при полимеризации 1,3-диеновых углеводородов в присутствии металлического натрия.
Слайд 40Катализатор Циглера - Натта
Цис-полиизопрен
51
1963 г. – Нобелевская премия по химии
«за открытия в области химии и технологии высокомолекулярных полимеров»
ЦИГЛЕР
Карл Вальдемар(1898 –1973)
НАТТА
Джулио
(1903–1979)
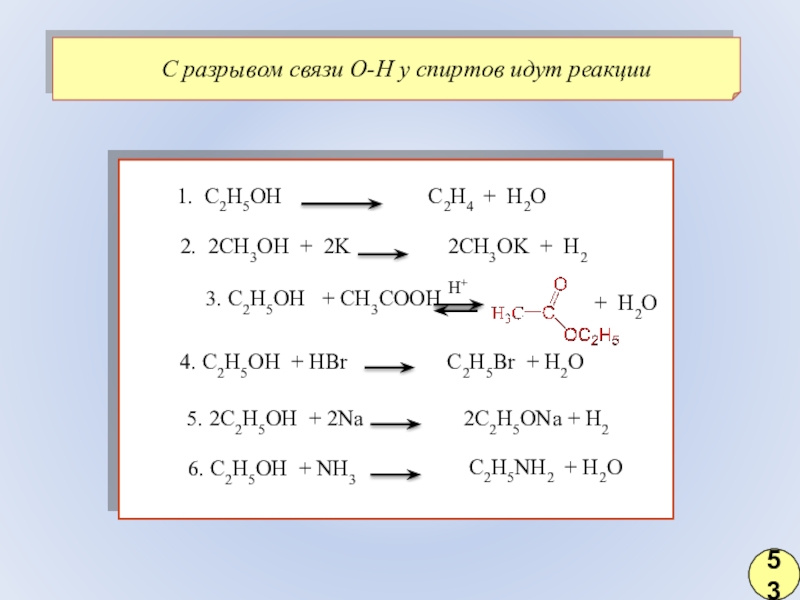
Слайд 411. С2H5OH
2. 2CH3OH + 2K
3. С2H5OH + СH3COOH
4. С2H5OH + HBr
5. 2С2H5OH + 2Na
6. С2H5OH + NH3
С2H4
+ H2O 2CH3OK + H2
H+
+ H2O
С2H5Br + H2O
2С2H5ONa + H2
С2H5NH2 + H2O
53
Слайд 44
Расположите в порядке усиления кислотных свойств перечисленные соединения:
а) фенол; муравьиная кислота; хлороводородная кислота; пропанол-1; угольная
кислота; б) этанол; п-крезол; бромоводородная кислота; вода; уксусная кислота.
Слайд 45
Дипольные моменты (µ) винилхлорида и этилхлорида равны, соответственно
1,44 D и 2, 05 D. Как можно объяснить это
различие на основании строения указанных хлоридов? Какие прогнозы относительно реакционной способности данных соединений можно сделать?СН3–СН2–Сl CH2=CH–Cl
C–Cl= 0.177 нм C–Cl = 0,169 нм
μ(C–Cl)=2.05 D μ(C–Cl)=1.44 D
Слайд 46
Расположите в порядке увеличения кислотных свойств следующие изомерные
спирты:
бутанол-1, 2-метилпропанол-2, бутанол-2.
СН3–С(ОН)(СН3)–СН3 <
СН3–СН(ОН)–СН2–СН3 < СН3–СН2–СН2–СН2–ОН 2-метилпропанол-2 бутанол-2 бутанол-1
Слайд 47 ОРГАНИЧЕСКИЕ
СОЕДИНЕНИЯ АЗОТА
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ АЗОТА
АМИНОКИСЛОТЫ
Азотистые
гетероциклы
НИТРОЭФИРЫ
НИТРИЛЫ
АМИДЫ
АМИНЫ,
соли аминов
НИТРОСОЕДИНЕНИЯ
Слайд 49Основность в газовой фазе
Основность
в жидкой фазе
Не обладают основными свойствами:
Основность аминов
Слайд 51
Расположите в ряд по увеличению основности следующие соединения:
этиламин, диэтиламин, триэтиламин
и дайте соответствующие пояснения.
Слайд 52Аммиак и диметиламин
Метиламин и анилин
Анилин и аммиак
Диэтиламин и дифениламин
5. Триметиламин
и метиламин
6. Этиламин и пиридин
Слайд 53Анилин - жидкость, хорошо растворимая в воде
Анилин легче реагирует с
бромом, чем бензол.
Анилин токсичен и легко окисляется на воздухе
Диметиламин –
твердое вещество , взаимодействует с ионами меди (II)Триэтиламин растворяется в воде лучше, чем этиламин и способен к образованию межмолекулярных водородных связей.
Слайд 55 Реагирует с КОН
Имеет молекулярную структуру
Реагирует с AgNO3
Обесцвечивает бромную воду
Реагирует
c HCl
Слайд 591826 г. Отто Унфердорбен «Кристаллин»
1833 г.
Фридлиб Фердинанд Рунге «Кианол»
1841 г. Карл Юлиус Фрицше
«Анилин»Слайд 601842 г. Н.Н. Зинин. «бензидам»
Н.Н. Зинин
(1812 – 1880)
1845 г. –
Гофман доказал идентичность
кристаллина, кианола, бензидама и анилина
Август Вильгельм
Гофман
(1818 –
1892)Слайд 61(1809—1880)
Ю́стус ЛИ́БИХ
(1803— 1873) .
Николай Николаевич ЗИНИН
(1812—
1880) .
Александр Абрамович ВОСКРЕСЕНСКИЙ
6 ноября 1868 г -
состоялось первое заседание Русского химического общества. Первым президентом стал Н.Н.Зинин.
«Если бы Зинин не сделал ничего более, кроме превращения нитробензола в анилин, то и тогда его имя осталось бы записанным золотыми буквами в истории химии»
А. В. Гофман. Президент немецкого химического общества
Слайд 62Синтетические красители;
индикаторы
Лекарственные препараты: сульфаниламид и его производные; анестезин, новокаин и
т.д.
Взрывчатые вещества
Пестициды
хиральное разделение
Стабилизирующие добавки к полимерам
Слайд 64Анилиновый желтый
1863 г. Анилиновый черный
Хромофорные группы
Ауксохромные группы
Метиловый оранжевый
Слайд 65Свойства
В отличие от триметиламина анилин
Реагирует с НСI
Взаимодействует с СН3СI
Образует с
бромной водой осадок
Является жидкостью
При горении образуются N2, CO2, H2O
Способен образовывать
межмолекулярные водородные связиСлайд 66
Почему при нитровании анилина азотной кислотой, несмотря на
явно выраженный орто-пара-ориентирующий эффект, амино-группы образуются значительные количества мета-изомера?
Группа–NH2 - сильный орто-пара - ориентант
! При действии хлорной
извести на анилин –
фиолетовое окрашивание!
Слайд 67Свойства
Нельзя различить с помощью бромной воды
бензол и фенол
бензол и анилин
анилин
и фенол
ацетилен и пропен
глюкоза и фруктоза
циклогексан и бензол
Слайд 68Свойства
Установить соответствие между двумя веществами и реагентом, позволяющим их отличить:
1
2
4
3
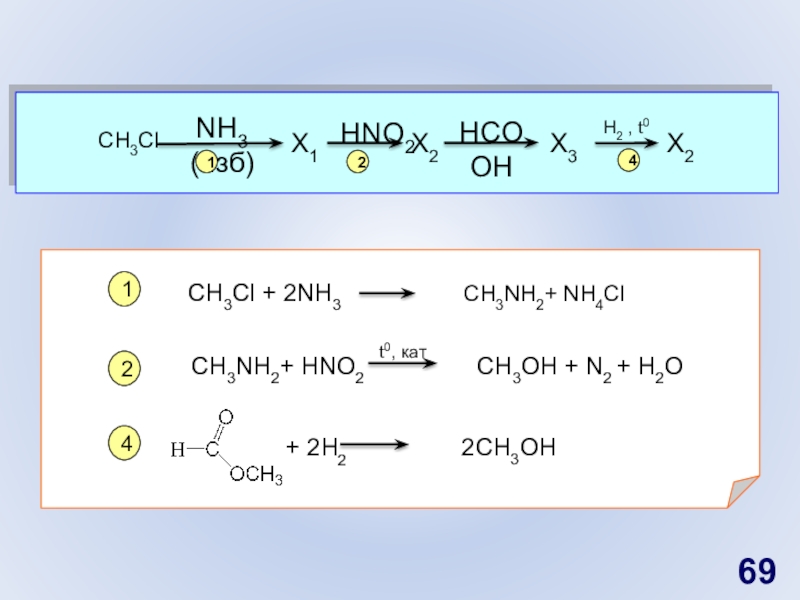
Слайд 69CH3Cl
X1
NH3 (изб)
X2
X3
X2
H2 , t0
HNO2
HCOOH
1
4
2
CH3Cl + 2NH3
CH3NH2+ NH4Cl
CH3NH2+ HNO2
CH3OH + N2
+ H2O
+ 2H2
2CH3OH
t0, кат
1
2
4
Слайд 70CH3СH2CH2CH2OH
X1
H2SO4 (конц)
t0>1400
X2
X3
HBr, H2O2
NH3
В схеме превращений вещество
X3
1-аминобутан
2-аминобутан
бромидбутиламмония
1-бромбутан
Слайд 75Кристиан Фридрих Шёнбейн
(1799-1868 гг)
профессор Базельскогго университета
Нитроцеллюлоза и ее производные
Начинка
для снарядов
и морских мин
«Бездымный порох» (кордит)
Целлулоид (нитроцеллюлоза + камфора)
– первая синтетическая пластмасса (заменитель слоновой кости)«Искусственный шелк Шардонне» (1884 г., патент;
«Гремучий студень» нитроцеллюлоза + нитроглицерин –
Слайд 76NO
Нитроглицерин -
сосудорасширяющее средство
Ферид Мурад
американский врач
1998 г. – Нобелевская премия
по физиологии и медицине
«За открытие роли оксида азота как сигнальной
молекулы в регуляции сердечно-сосудистой системы»Слайд 78Формула С6H5-CH(NH2)-CH2-COOH.
Ароматический амин.
Образует со спиртами сложные эфиры.
Участвует в реакции поликонденсации.
Не
реагирует с основаниями.
Не взаимодействует с HNO3.
Слайд 79 KOH, HCl, CH3NH2, СН3OH
NaCl, KOH, NH3, H2
HNO2, NaOH, СН3СI,
NH3,
Na, HCl, NaOH, N2
Na, CH3Cl, N2, CH3NH2
Слайд 85
Предложить метод синтеза лекарственного препарата анестезина (этилового эфира
п-амино-бензойной кислоты), имея в качестве исходных соединений карбид кальция и
любые неорганические соединенияМестный анестетик.
Уменьшает проницаемость клеточной мембраны для ионов натрия, вытесняет Ca2+ из рецепторов, расположенных на внутренней поверхности мембраны, блокирует проведение нервного импульса
Слайд 94«Химия создает свой предмет. Эта творческая способность, подобная искусству, коренным
образом отличает химию от остальных естественных и гуманитарных наук»
М. Бертло, 1860 г.35






























![Механизм реакции
- последовательность элементарных стадий процесса, в В кислой средеВ щелочной средеВ газовой фазе[H]250-350°C В кислой средеВ щелочной средеВ газовой фазе[H]250-350°C](/img/thumbs/4785e1312bbac3ef302846809e527c67-800x.jpg)