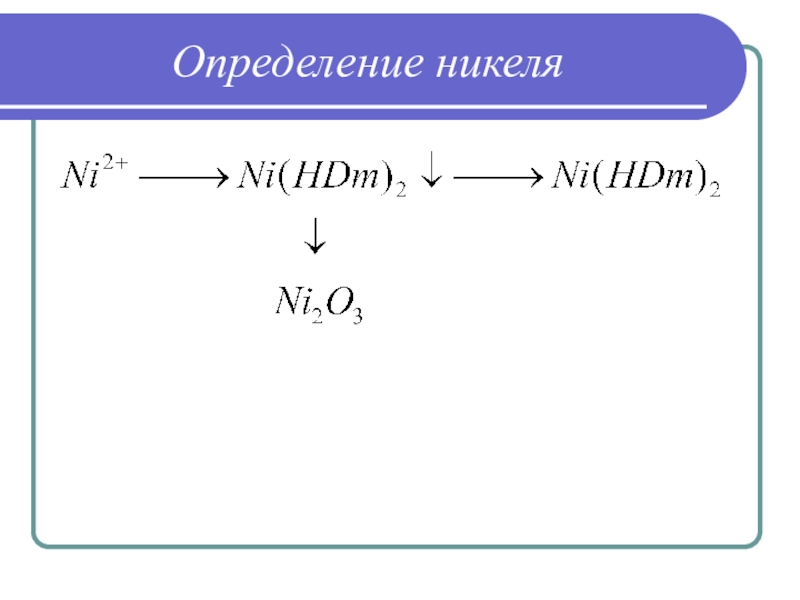
Слайд 2Классификация методов анализа
По характеру измеряемого свойства или по способу регистрации
соответствующего сигнала методы анализа делят на:
физические (основаны на физических явлениях
и процессах);
химические + физико-химические методы (базируются на химических и электрохимических реакциях);
биологические (основаны на явлениях жизни).
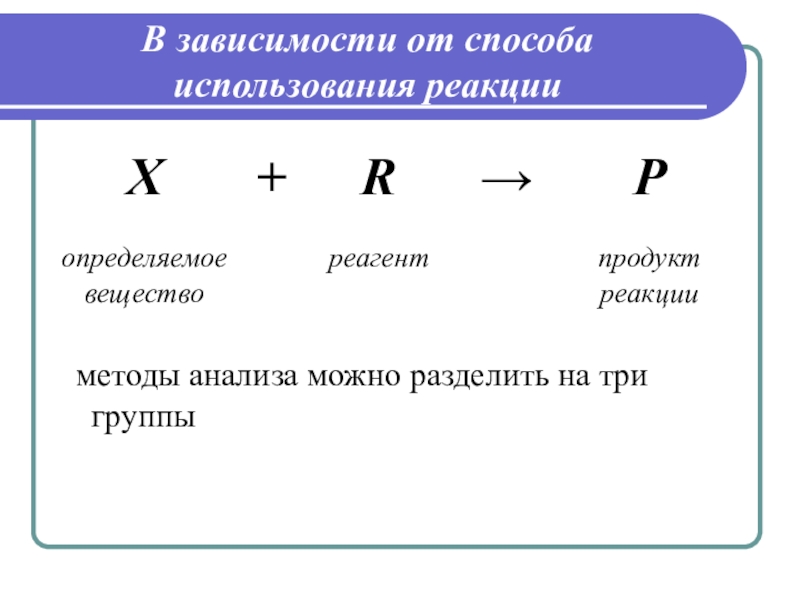
Слайд 3В зависимости от способа использования реакции
методы анализа можно разделить на
три группы
Слайд 41. Измеряют количество образовавшегося продукта реакции Р.
В гравиметрии измеряют массу
образовавшегося осадка.
В фотометрии – интенсивность поглощения света продуктом реакции.
Слайд 52. Измеряют количества реагента R, израсходованного на реакцию с определяемым
веществом Х.
В титриметрии измеряют объем титранта, пошедшего на реакцию с
определяемым веществом при условии, что известна концентрация титранта.
Слайд 63. Фиксируют изменения, происходящие с самим определяемым веществом Х в
процессе взаимодействия с реагентом R.
Определение содержания СО2 в смеси газов
– измерение его объема до и после пропускания через раствор щелочи, где происходит поглощение СО2 и объем смеси уменьшается.
Слайд 7По типу химической реакции
1. Методы, основанные на кислотно-основных реакциях;
2. Методы,
основанные на реакциях комплексообразования;
3. Методы, основанные на окислительно-восстановительных реакциях;
4. Методы,
основанные на реакциях осаждения.
Слайд 8Гравиметрический метод анализа
Слайд 9Гравиметрическим анализом
называют метод количественного химического анализа, основанный на точном измерении
массы определяемого вещества
или его составных частей, выделяемых в виде соединений
точно известного постоянного состава. Аналитическим сигналом в гравиметрии является масса.
Слайд 10Методы отгонки
Прямые методы – определяется масса отогнанного вещества
СаСО3 +
2Н+ → Са2+ + СО2 ↑ + Н2О,
CO2 + 2NaOH
→ Na2CO3 + H2O.
Слайд 11Методы отгонки
Косвенные методы – определяется масса остатка
BaCl2·2H2O → BaCl2 +
2H2O ↑.
Слайд 12Этапы гравиметрического определения
2) Осаждение соединения, содержащего определяемое вещество
Слайд 13Условие полноты осаждения
Чувствительность весов ± 0,1 мг
s ≤ 0,0001 г/л
Мr
= 100 г/моль
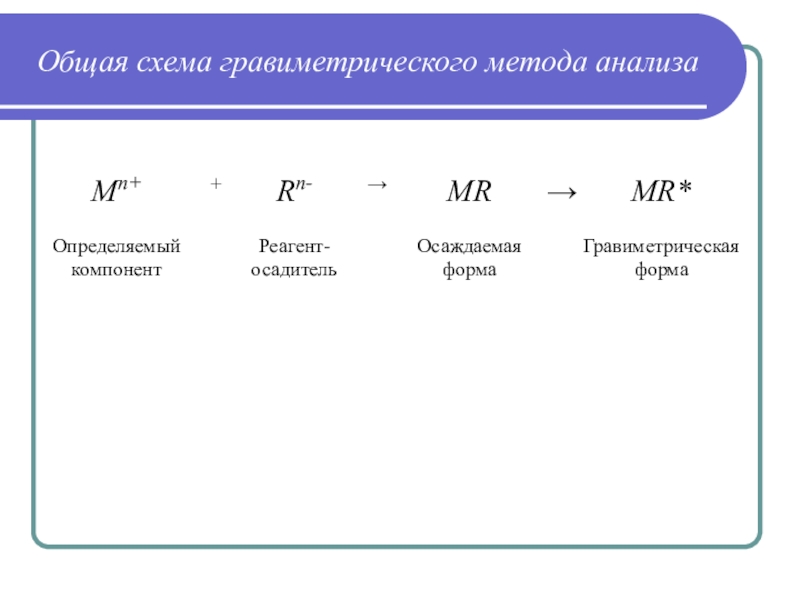
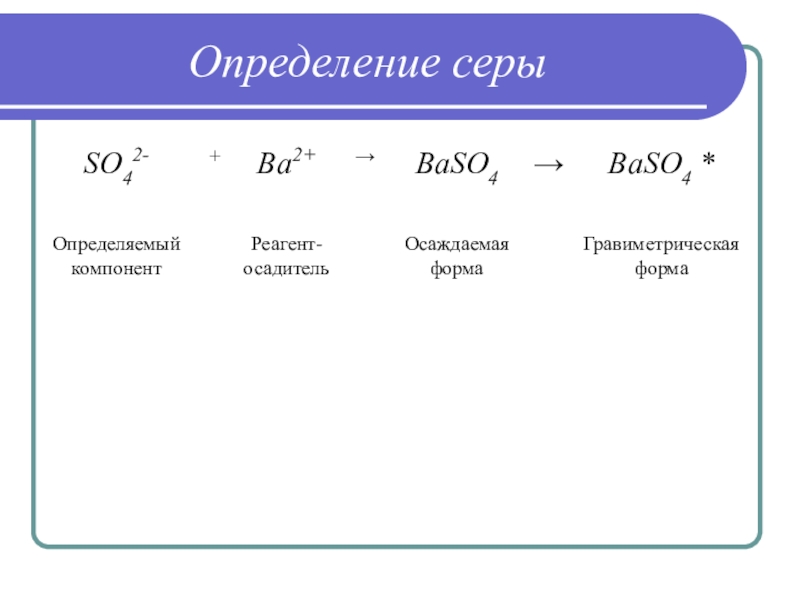
Слайд 14Общая схема гравиметрического метода анализа
Слайд 17Требования к осаждаемой форме
1. Малая растворимость (s < 10-5 моль/л),
что обеспечивает практически полное выделение определяемого компонента в осадок и
сводит к минимуму потерю от растворимости.
2. В осадок должна выделяться только осаждаемая форма.
3. Осаждаемая форма должна быть определенного состава, а также химически чистой. Если осаждаемая и гравиметрическая формы различаются по составу, то осаждаемая форма должна нацело и быстро переходить в гравиметрическую форму.
4. Желательно, чтобы осаждаемая форма имела достаточно хорошую структуру, что обеспечивает меньшее загрязнение осадка.
Слайд 18Требования к гравиметрической форме
1. Строгое соответствие состава химической формуле, т.к.
только в этом случае по массе гравиметрической формы можно рассчитать
содержание в ней определяемого компонента.
2. Гравиметрическая форма должна быть устойчивой при хранении, т.е. не окисляться кислородом воздуха, не взаимодействовать с углекислым газом, не поглощать влагу.
3. Содержание определяемого компонента в гравиметрической форме должно быть достаточно низким, чтобы обеспечить соответственно низкий фактор пересчета и меньшую ошибку определения.
Слайд 19Требования к осадителю
1. Осадитель должен селективно реагировать с определяемым компонентом
с образованием наименее растворимого соединения.
2. Осадитель должен быть по возможности
летучим, чтобы легко удаляться с поверхности осадка в ходе последующих операций (промывания осадка, перевода осаждаемой формы в гравиметрическую).
3. Для осаждения кристаллических и аморфных осадков следует брать избыток осадителя (от 30 до 300 %), т.к. растворимость малорастворимого электролита уменьшается в присутствии одноименных ионов.
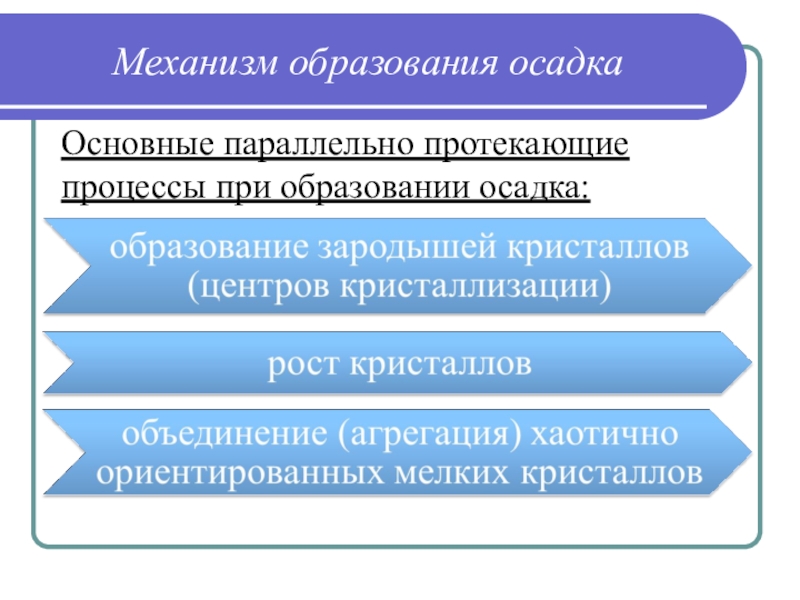
Слайд 20Механизм образования осадка
Основные параллельно протекающие процессы при образовании осадка:
Слайд 21Степень пересыщения
Q – концентрация кристаллизующегося вещества в растворе;
S – растворимость;
ΔS
– относительное пересыщение.
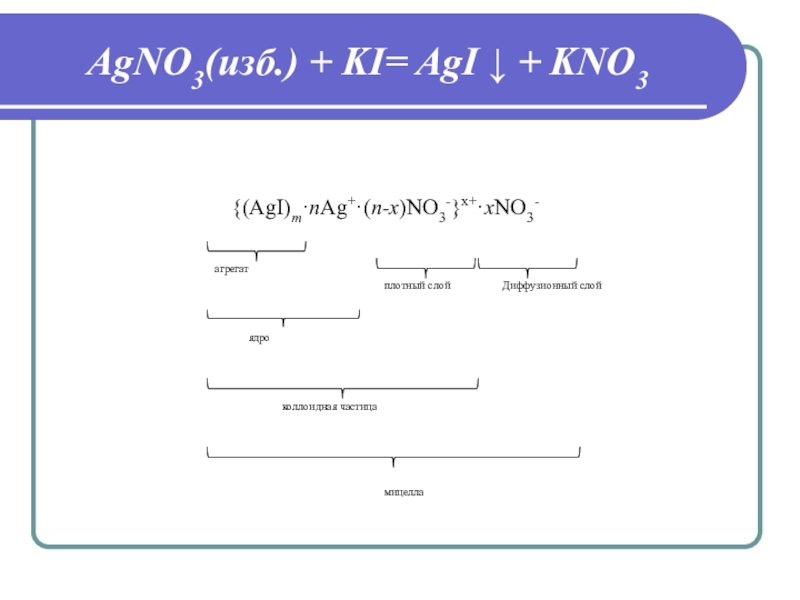
Слайд 23Коагуляция
Порог коагуляции
Электролиты-коагуляторы
Пептизация
Слайд 24Условия осаждения аморфных осадков
1. Осаждение ведут в присутствии подходящего электролита-коагулятора.
2.
Осаждение ведут из нагретого анализируемого раствора нагретым раствором осадителя при
перемешивании; после осаждения необходимо разбавление (при этом нарушается адсорбционное равновесие, часть адсорбированных ионов переходит в раствор, и осадок становится более чистым).
3. Осаждение ведут из достаточно концентрированного исследуемого раствора концентрированным раствором осадителя.
4. Осадки не требуют времени для созревания, их необходимо фильтровать сразу после разбавления раствора (аморфные осадки нельзя оставлять стоять более, чем несколько минут, т.к. сильное уплотнение их затрудняет последующее отмывание примесей; а также при стоянии увеличивается количество примесей, адсорбированных поверхностью осадка).
Слайд 25Условия осаждения кристаллических осадков
1. Осаждение ведут из достаточно разбавленного исследуемого
раствора разбавленным раствором осадителя (концентрации исследуемого вещества и осадителя должны
быть примерно одинаковыми).
2. Раствор осадителя прибавляют медленно, по каплям, при постоянном перемешивании стеклянной палочкой (это предотвращает явление окклюзии).
3. Осаждение ведут из подогретого исследуемого раствора горячим раствором осадителя (для предотвращения пептизации).
4. К раствору прибавляют вещества, способствующие повышению растворимости осадка (увеличивают I раствора), а затем понижают его растворимость путем прибавления избытка осадителя.
5. Осадок оставляют на «созревание».
Слайд 26Адсорбция
это соосаждение примесей на поверхности уже сформированного осадка, которое происходит
из-за неравноценности электростатического поля ионов внутри кристаллической решетки и на
поверхности.
Слайд 27Правила Панета-Фаянса-Гана
а) при одинаковых концентрациях – многозарядные ионы;
б) при одинаковых
зарядах – ион, присутствующий в большей концентрации;
в) при одинаковых концентрациях
и зарядах – ион, который с ионом решетки образует менее растворимое, менее диссоциирующее соединение или вообще соединение со значительным межионным взаимодействием;.
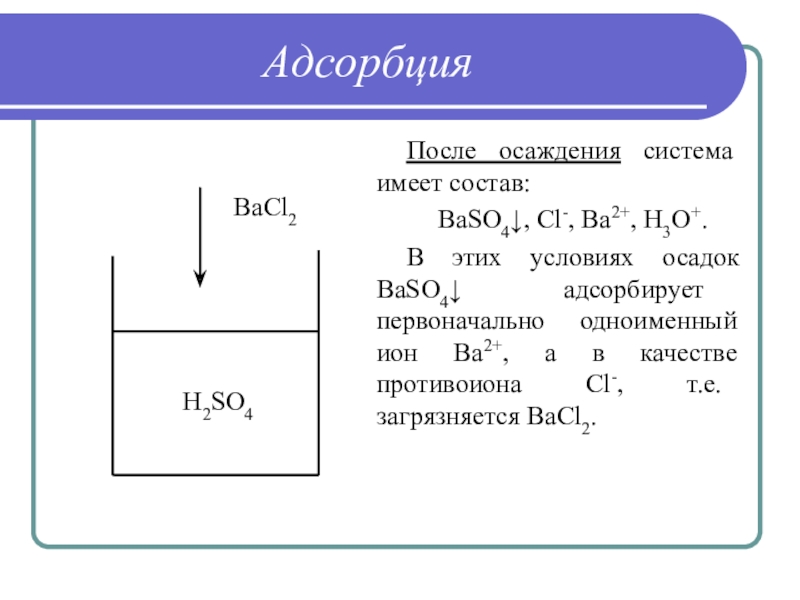
Слайд 28Адсорбция
После осаждения система имеет состав:
BaSO4↓, Cl-, Ba2+, H3O+.
В этих условиях
осадок BaSO4↓ адсорбирует первоначально одноименный ион Ва2+, а в качестве
противоиона Cl-, т.е. загрязняется BaCl2.
H2SO4
BaCl2
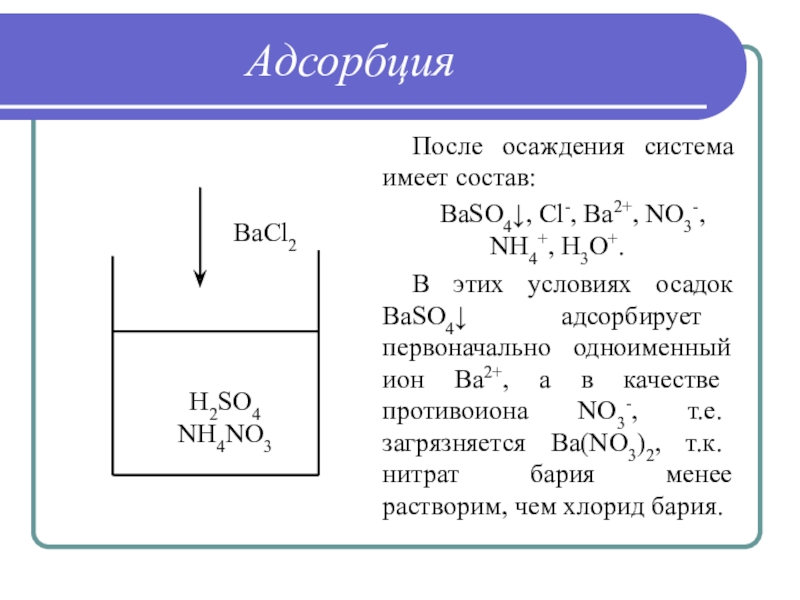
Слайд 29Адсорбция
После осаждения система имеет состав:
BaSO4↓, Cl-, Ba2+, NO3-, NH4+, H3O+.
В
этих условиях осадок BaSO4↓ адсорбирует первоначально одноименный ион Ва2+, а
в качестве противоиона NO3-, т.е. загрязняется Ba(NO3)2, т.к. нитрат бария менее растворим, чем хлорид бария.
H2SO4
NH4NO3
BaCl2
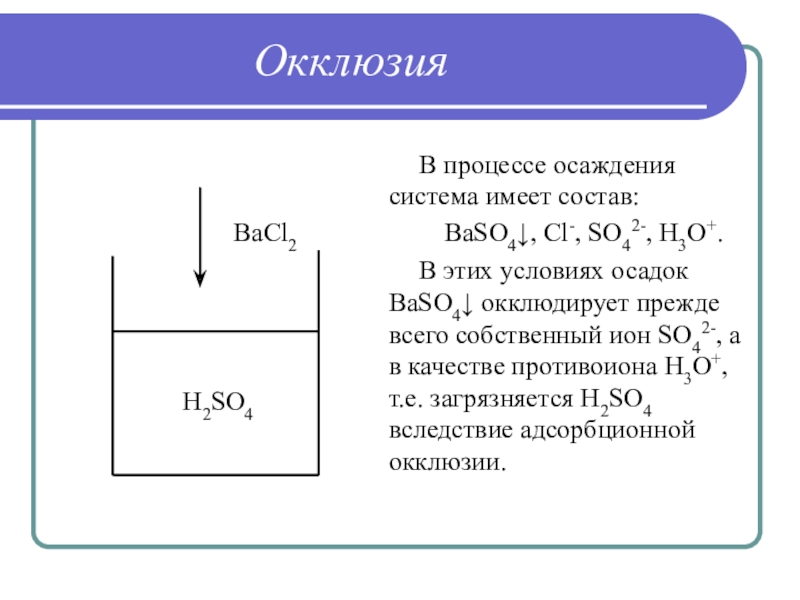
Слайд 30Окклюзия
Загрязнение осадка в результате захвата примесей внутрь растущих кристаллов осадка
основного компонента
Причина окклюзии – адсорбция примесей в процессе формирования осадка
Слайд 31Окклюзия
В процессе осаждения система имеет состав:
BaSO4↓, Cl-, SO42-, H3O+.
В этих
условиях осадок BaSO4↓ окклюдирует прежде всего собственный ион SO42-, а
в качестве противоиона H3O+, т.е. загрязняется H2SO4 вследствие адсорбционной окклюзии.
H2SO4
BaCl2
Слайд 32Изоморфное соосаждение
ZnCO3, MgCO3, FeCO3, MnCO3, CdCO3 и CaCO3;
BaSO4, PbSO4, SrSO4
и RaSO4;
MgNH4PO4 и MgKPO4;
MnNH4PO4 и ZnNH4PO4;
ZnHg(SCN)4, CoHg(SCN)4 и NiHg(SCN)4.
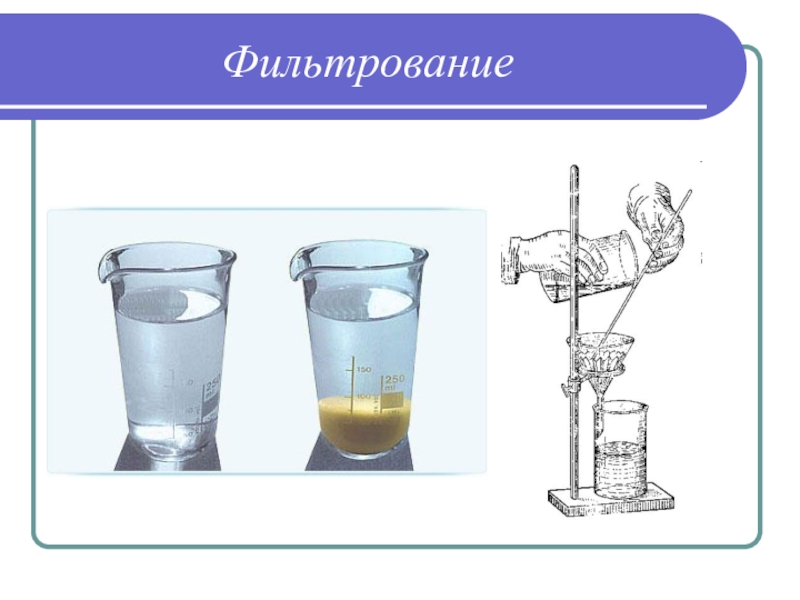
Слайд 33Этапы гравиметрического определения
3) Фильтрование полученной смеси для отделения осадка от
надосадочной жидкости
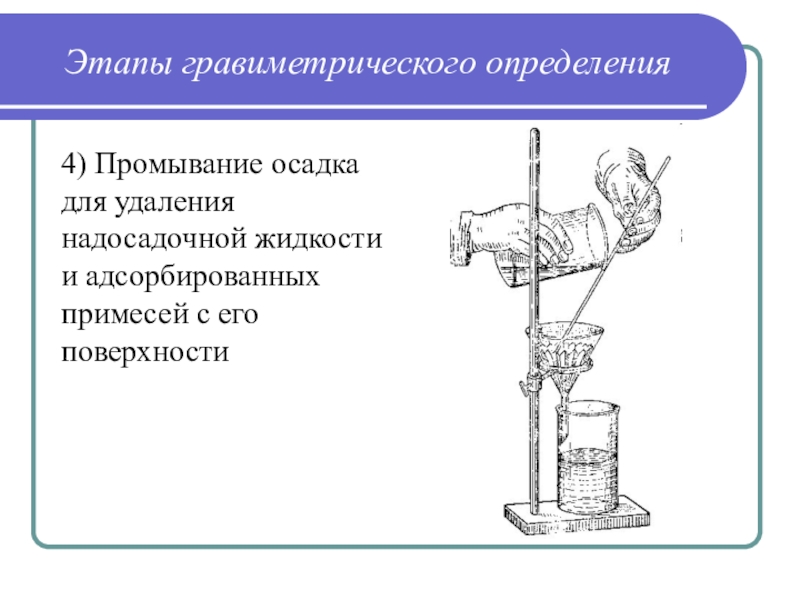
Слайд 36Этапы гравиметрического определения
4) Промывание осадка для удаления надосадочной жидкости и
адсорбированных примесей с его поверхности
Слайд 37Этапы гравиметрического определения
5) Высушивание при относительно низкой температуре для удаления
воды или прокаливание при высокой температуре для превращения осадка в
более подходящую для взвешивания форму
Слайд 41Определение магния
2Mg2+ → 2MgNH4PO4 → Mg2P2O7
Слайд 42Этапы гравиметрического определения
6) Взвешивание полученного осадка на аналитических весах
Слайд 43Результат гравиметрического метода анализа
Результат находится по формуле
ω – содержание определяемого
компонента в образце, %;
F – гравиметрический фактор;
mгр – масса полученного
осадка, г;
mH – масса навески, г.