Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Властивості газів, рідин і твердих тіл
Содержание
- 1. Властивості газів, рідин і твердих тіл
- 2. Основні положення МКТ речовини.Теорію, яка пояснює будову
- 3. Основні положення МКТ речовини. В основу МКТ
- 4. Основні положення МКТ речовини. Схематичне зображення молекули
- 5. Взаємодія атомів і молекул речовин у різних
- 6. Слайд 6
- 7. Дослідні підтвердження МКТ. Дифузія. Броунівський рух. Дослід
- 8. Основне завдання МКТ. Параметри газу, пов'язані з
- 9. Відносна молекулярна маса. Кількість речовини. Стала Авогадро.
- 10. Відносна молекулярна маса. Кількість речовини. Стала Авогадро.
- 11. Температура та її вимірювання. Для вимірювання температури
- 12. Температура та її вимірювання.
- 13. Основне рівняння молекулярно-кінетичної теорії ідеального газу.
- 14. Слайд 14
- 15. Скачать презентанцию
Основні положення МКТ речовини.Теорію, яка пояснює будову і властивості тіл на основі закономірностей руху і взаємодії молекул, називають молекулярно-кінетичною теорією.
Слайды и текст этой презентации
Слайд 3Основні положення МКТ речовини.
В основу МКТ покладено три найважливіші
положення:
1) усі речовини складаються з дрібних частинок (атомів, молекул, електронів,
йонів);2) частинки речовини перебувають у безперервному хаотичному русі (його часто називають тепловим рухом і у загальному випадку є сукупністю поступального, обертального і коливального рухів.);
3) частинки речовини взаємодіють одна з одною (молекули взаємодіють одна з одною із силами електромагнітної природи, причому на великих відстанях вони притягуються, а на малих – відштовхуються)
Слайд 4Основні положення МКТ речовини.
Схематичне зображення молекули води
Молекули - найменші
частинки, які мають хімічні властивості речовини. Молекули складаються з більш
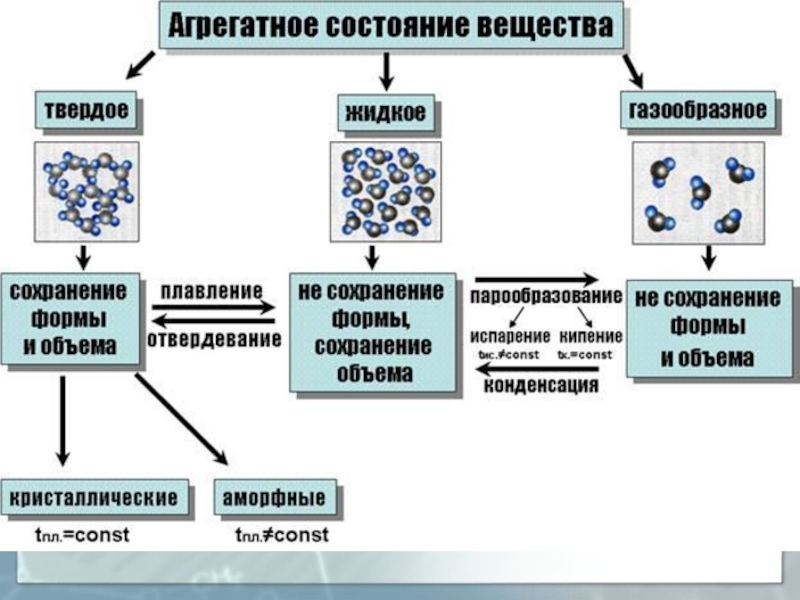
простих частинок - атомів хімічних елементів. У природі є 92 хімічні елементи. Разом із штучними наразі налічується 118 елементів.Молекули різних речовин по-різному взаємодіють одна з одною. Ця взаємодія залежить від типу молекул і відстані між ними. Залежно від характеру руху і взаємодії молекул розрізняють три стани речовини:
твердий,
рідкий,
газоподібний (плазма).
Відео: «Галілео. Суха вода»
Слайд 5Взаємодія атомів і молекул речовин у різних агрегатних станах.
Для
газів характерні великі міжмолекулярні відстані, малі сили притягання, тому гази
можуть необмежено розширюватись. Молекули газу хаотично рухаються, співударяються одна з одною і зі стінками посудиниУ рідинах молекули розміщені тісно і коливаються навколо положення рівноваги, а також перескакують з одного рівноважного положення в інше (ближній порядок)
У твердих тілах сили взаємодії кожної молекули із сусідніми настільки великі, що молекула здійснює малі коливання навколо деякого сталого положення рівноваги - вузла кристалічних грат - дальній порядок
Слайд 7Дослідні підтвердження МКТ.
Дифузія. Броунівський рух. Дослід Штерна.
Дифузія - явище
спонтанного проникнення молекул контактуючих речовин в міжмолекулярні проміжки кожної з
них.Бро́унівський рух — невпорядкований, хаотичний рух дрібних частинок речовини в розчинах. Названий на честь ботаніка Роберта Брауна, який спостерігав[1] це явище під мікроскопом у 1827 р.
Дослід Штерна – дослід проведений німецьким вченим фізиком О. Штерном 1920 року, який уперше експериментально визначив швидкість теплового руху атомів. Цей дослід є експериментальним доказом існування атомів речовини і правильності теорії в цілому.
Слайд 8Основне завдання МКТ.
Параметри газу, пов'язані з індивідуальними характеристиками молекул,
що складають його, називаються мікроскопічними параметрами (маси молекул, їхні швидкості,
концентрація).Параметри, які характеризують стан макроскопічних тіл без урахування їхньої молекулярної будови, називаються макроскопічними параметрами (об'єм, тиск, температура).
Співвідношення між макроскопічними параметрами — температурою, об'ємом і тиском — називається рівнянням стану.
Основне завдання молекулярно-кінетичної теорії: установити зв'язок між макроскопічними та мікроскопічними параметрами речовини й, виходячи з цього, визначити рівняння стану цієї речовини.
Наприклад, знаючи масу молекул, їхні середні швидкості й концентрацію, можна обчислити об'єм, тиск і температуру маси газу, а також виразити тиск газу через його об'єм і температуру.
Слайд 9Відносна молекулярна маса. Кількість речовини. Стала Авогадро. Молярна маса.
Більшість
молекул неорганічних речовин мають діаметр
d=10-10 м і m = 10-26 кг.
Для зручності
розрахунків ввели поняття "відносна атомна (молекулярна) маса"Mr(Ar)=[а.о.м.] - відносна молекулярна (атомна) маса (табл. Менделеєва);
m0 =[а.о.м.] - маса атома або молекули довільної речовини;
Відносну молекулярну масу речовин, молекули яких складаються з декількох атомів, знаходять за формулою
Наприклад, для Н2О:
Mr (Н2О)= 1·2 + 16·1 = 18(а.о.м)
Слайд 10Відносна молекулярна маса. Кількість речовини. Стала Авогадро. Молярна маса.
Маса
1 молекули речовини визначається з формули:
для молекули води
Фізичну величину,
що визначає число молекул у певному тілі, називають кількістю речовини.N – кількість молекул
NA – стала Авогадро – кількість атомів чи молекул в 1 молі речовини.
M - молярна маса – це маса одного моля речовини.
m=[кг] – маса речовини, визначається з формул:
ρ=[кг/м3] – густина речовини, V=[м3]- об’єм.
відношення числа молекул N до об’єму V, який займають молекули, називають концентрацією молекул і позначають n=[м-3]
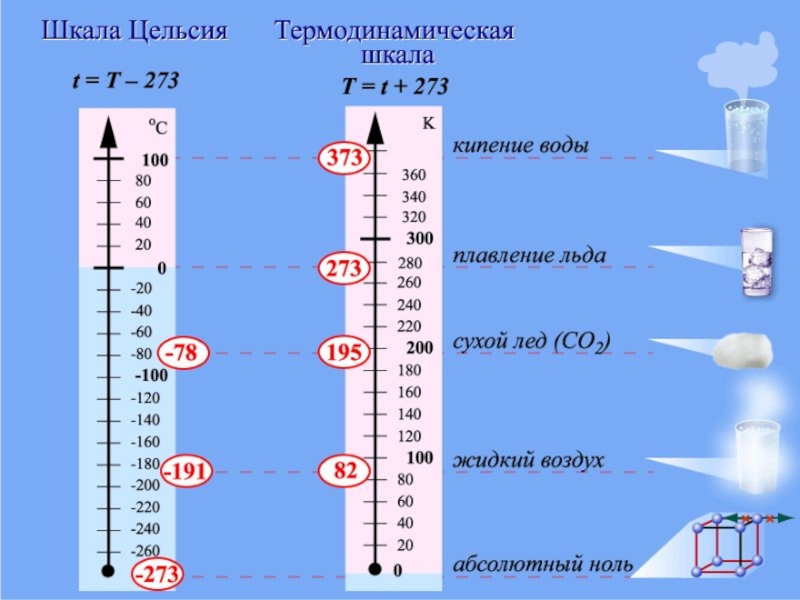
Слайд 11Температура та її вимірювання.
Для вимірювання температури тіла термометр приводять
в контакт з ним, але температура тіла може бути значно
нижчою, ніж температура танучого льоду, отже, вона буде від'ємною, якщо її вимірювати по заданій шкалі, названій в честь італійського вченого Цельсія. У середині ХІХ століття лорд Кельвін запропонував точку 0 °С температурної шкали Цельсія змістити до 273,15 кельвіна. Таку шкалу називають абсолютною температурною шкалою.Саме в одиницях цієї шкали - "кельвінах" - і вимірюють температуру в системі СІ. Головна перевага цієї шкали: немає від'ємних температур. Перехід від шкали Цельсія до абсолютної температурної шкали такий:
T(K) = (t °C + 273,15) K, але 1°С = 1 К.