Слайд 1МЕТОДЫ МИКРОБИОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
(окончательный ответ исследований)
Слайд 2МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ
Для микроскопических исследований (изучение бактерий под микроскопом) используют несколько
типов микроскопов: 1. биологический, 2. люминисцентный, 3. электронный.
С помощью этих
исследований определяют: подвижность (метод «висячей капли»), морфологию, наличие капсул и спор (приготовление фиксированных мазков с последующей окраской: по Граму, Цилю-Нильсену, Бурри-Гинсу и др.)
1
2
3
Слайд 3Световая микроскопия
Световая микроскопия предназначена для изучения окрашенных препаратов на предметных
стеклах. С помощью световой микроскопии можно исследовать подвижность микроорганизмов. Для
этого применяют метод висячей капли. Небольшую каплю микробной взвеси наносят на середину покровного стекла. Предметное стекло с углублением ("лункой"), края которого смазаны вазелином, осторожно накладывают на покровное стекло так, чтобы капля исследуемой жидкости оказалась в центре углубления, плотно прижимают к стеклу и быстро переворачивают кверху.
Слайд 4Строение светового микроскопа
Слайд 5Фазово-контрастная микроскопия
Фазово-контрастная микроскопия основана на интерференции света: прозрачные объекты, отличающиеся
по показателю преломления от окружающей среды, выглядят либо как темные
на светлом фоне (позитивный контраст), либо как светлые на темном фоне (негативный контраст). Фазово-контрастная микроскопия применяется для изучения живых микроорганизмов и клеток в культуре ткани.
Слайд 6Темнопольная микроскопия
Темнопольная микроскопия основана на рассеянии света микроскопическими объектами Объекты
при темнопольной микроскопии выглядят ярко светящимися на темном фоне. Применяется
темнопольная микроскопия преимущественно для изучения спирохет и обнаружения (но не изучения морфологии) крупных вирусов.
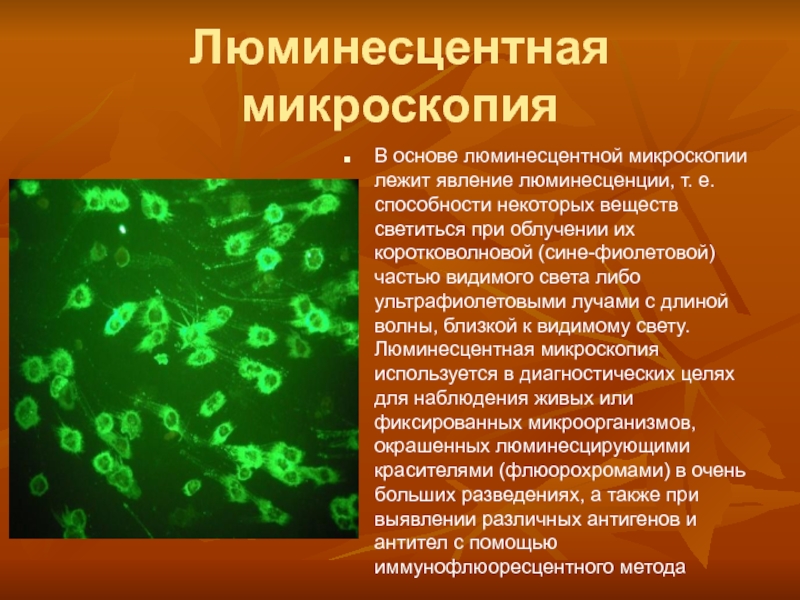
Слайд 7Люминесцентная микроскопия
В основе люминесцентной микроскопии лежит явление люминесценции, т. е.
способности некоторых веществ светиться при облучении их коротковолновой (сине-фиолетовой) частью
видимого света либо ультрафиолетовыми лучами с длиной волны, близкой к видимому свету. Люминесцентная микроскопия используется в диагностических целях для наблюдения живых или фиксированных микроорганизмов, окрашенных люминесцирующими красителями (флюорохромами) в очень больших разведениях, а также при выявлении различных антигенов и антител с помощью иммунофлюоресцентного метода
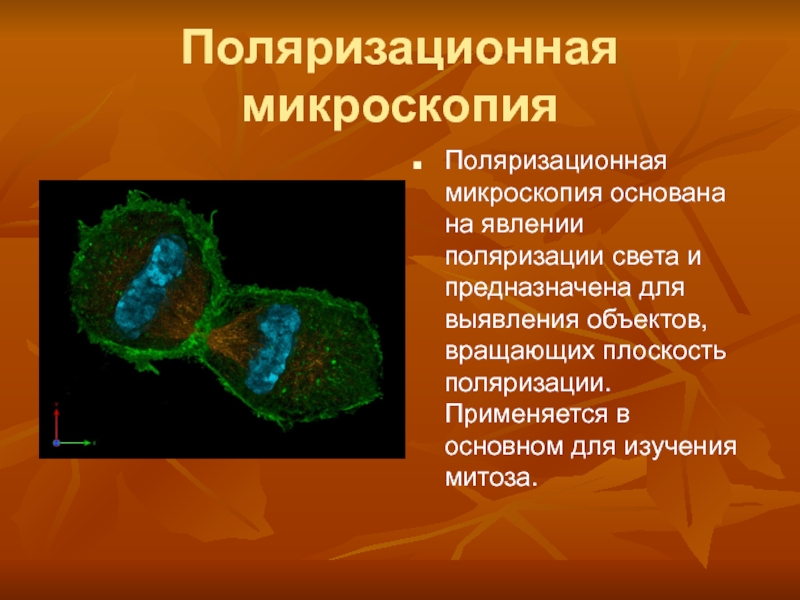
Слайд 8Поляризационная микроскопия
Поляризационная микроскопия основана на явлении поляризации света и предназначена
для выявления объектов, вращающих плоскость поляризации. Применяется в основном для
изучения митоза.
Слайд 9Ультрафиолетовая микроскопия
В основе ультрафиолетовой микроскопии лежит способность некоторых веществ (ДНК,
РНК) поглощать ультрафиолетовые лучи. Она дает возможность наблюдать и количественно
устанавливать распределение этих веществ в клетке без специальных методов окраски. В ультрафиолетовых микроскопах используется кварцевая оптика, пропускающая ультрафиолетовые лучи.
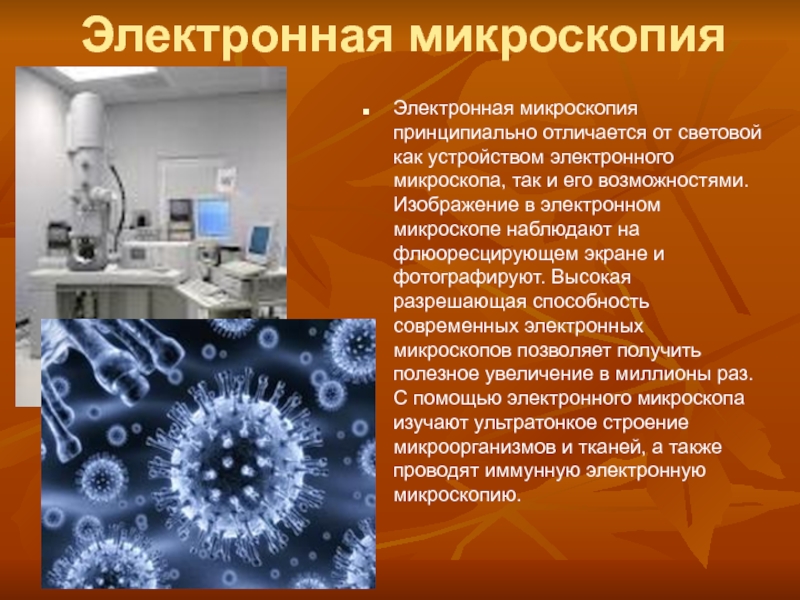
Слайд 10Электронная микроскопия
Электронная микроскопия принципиально отличается от световой как устройством электронного
микроскопа, так и его возможностями. Изображение в электронном микроскопе наблюдают
на флюоресцирующем экране и фотографируют. Высокая разрешающая способность современных электронных микроскопов позволяет получить полезное увеличение в миллионы раз. С помощью электронного микроскопа изучают ультратонкое строение микроорганизмов и тканей, а также проводят иммунную электронную микроскопию.
Слайд 11Методы окраски мазков
Простой метод. Фиксированный мазок окрасить каким-либо одним красителем,
например фуксином водным (1-2 мин) или метиленовым синим (3-5 мин),
промыть водой, высушить и микроскопировать.
Сложные методы. Последовательно нанести на препарат определенные красители, различающиеся по химическому составу и цвету, протравы, спирты, кислоты и др. Это позволяет выявить определенные структуры клеток и дифференцировать одни виды микроорганизмов от других. Окрас методом Грама является сложным методом.
Слайд 12 Окраска по методу Грама
На фиксированный мазок нанести карболово-спиртовой
раствор генцианового фиолетового через полоску фильтровальной бумаги. Через 1-2 мин
ее снять, а краситель слить.
Нанести раствор Люголя на 1-2 мин.
Обесцветить этиловым спиртом в течение 30-60 с до прекращения отхождения фиолетовых струек красителя.
Промыть водой.
Докрасить водным раствором фуксина в течение 1-2 мин, промыть водой, высушить и микроскопировать.
Грамположительные бактерии окрашиваются в темно-фиолетовый цвет, грамотрицательные - в красный
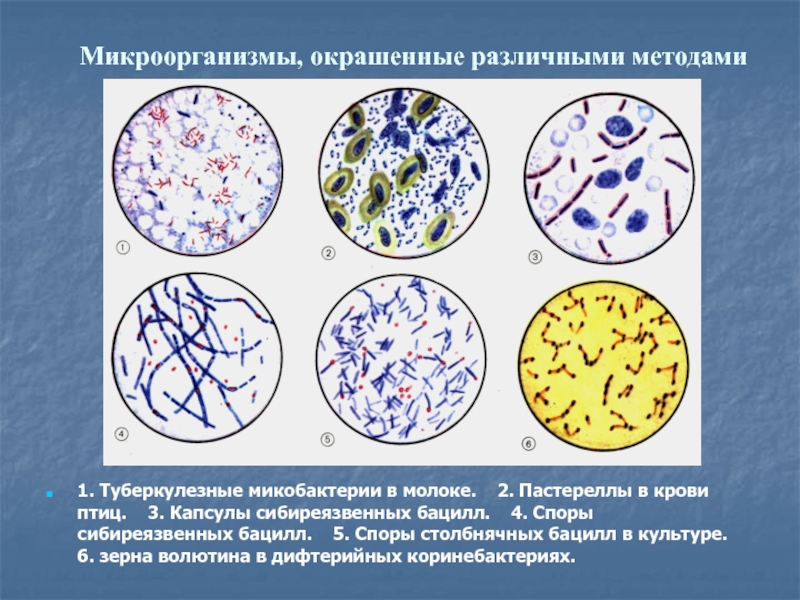
Слайд 13Микроорганизмы, окрашенные различными методами
1. Туберкулезные микобактерии в молоке. 2.
Пастереллы в крови птиц. 3. Капсулы сибиреязвенных бацилл.
4. Споры сибиреязвенных бацилл. 5. Споры столбнячных бацилл в культуре. 6. зерна волютина в дифтерийных коринебактериях.
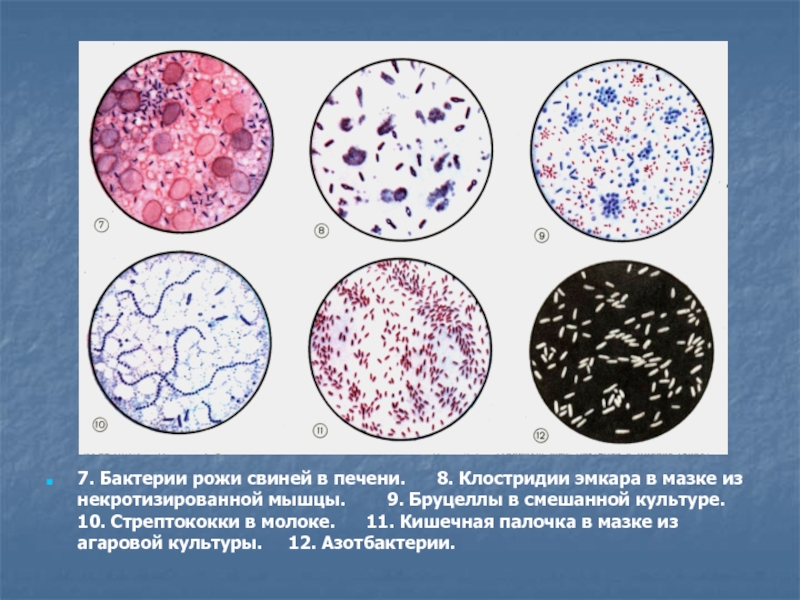
Слайд 147. Бактерии рожи свиней в печени. 8. Клостридии
эмкара в мазке из некротизированной мышцы. 9.
Бруцеллы в смешанной культуре. 10. Стрептококки в молоке. 11. Кишечная палочка в мазке из агаровой культуры. 12. Азотбактерии.
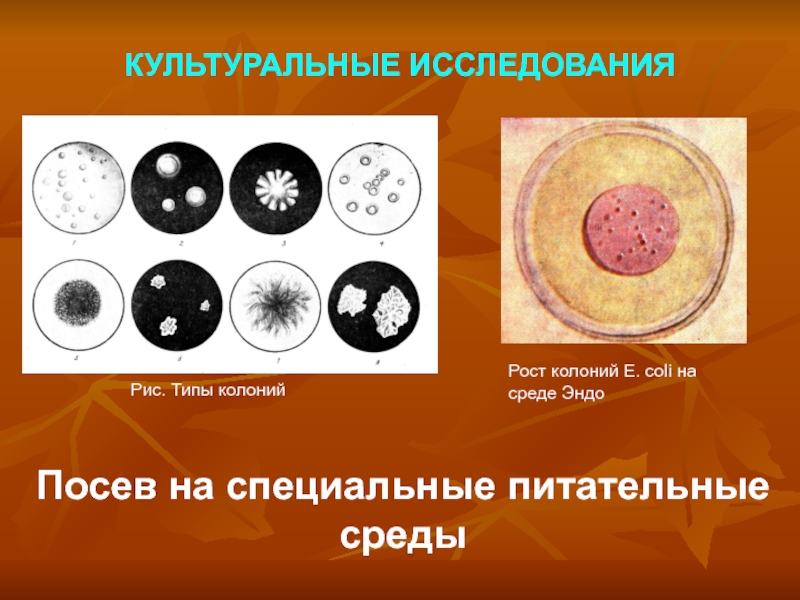
Слайд 15КУЛЬТУРАЛЬНЫЕ ИССЛЕДОВАНИЯ
Посев на специальные питательные среды
Рис. Типы колоний
Рост колоний E. coli на среде Эндо
Слайд 16Питательная среда
вещество или смесь веществ, применяемая для культивирования микроорганизмов.
Питательные среды
готовят из продуктов животного или растительного происхождения. Состав сред определяется
метаболическими потребностями той или иной группы бактерий. Все питательные среды должны отвечать следующим требованиям:
содержать основные питательные вещества в легкоусвояемой форме;
быть влажными, изотоничными и нетоксичными (для исследуемых микробов);
иметь определенную вязкость;
иметь оптимальный показатель pH и окислительно-восстановительный (редокс) потенциал;
обладать буферными свойствами;
быть стерильными;
по возможности быть прозрачными.
Слайд 17Классификация
По исходным компонентам:
натуральные среды — готовят из продуктов животного и
растительного происхождения(мясо, костная и рыбная мука, кормовые дрожжи, сгустки крови
и др.)
синтетические среды — готовят из определённых химически чистых органических и неорганических соединений, взятых в точно указанных концентрациях и растворённых в дважды дистиллированной воде.
По консистенции(степени плотности):
жидкие
полужидкие
плотные
Плотные и полужидкие среды готовят из жидких, к которым прибавляют агар-агар или желатин. Кроме того, в качестве плотных сред применяют свёрнутую сыворотку крови, свёрнутые яйца, картофель, среды с силикагелем. Некоторые микроорганизмы используют желатин как питательное вещество — при их росте среда разжижается.
Слайд 18По составу:
простые: мясопептонный бульон(МПБ), мясопептонный агар(МПА), питательный желатин,
сложные — готовят
прибавляя к простым средам кровь, сыворотку, углеводы и другие вещества.
По
назначению:
основные — служат для культивирования большинства патогенных микробов. МПБ, МПА, бульон и агар Хоттингера, пептонная вода.
специальные — служат для выделения и выращивания микроорганизмов, не растущих на простых средах.
селективные(избирательные) — служат для выделения определённого вида микробов, росту которых они благоприятствуют, задерживая или подавляя рост сопутствующих микроорганизмов. Среды становятся селективными при добавлении к ним определённых антибиотиков, солей, изменения pH. Жидкие элективные среды называют средами накопления.
дифференциально-диагностические — позволяют отличить один вид микробов от другого по ферментативной активности.
консервирующие — предназначены для первичного посева и транспортировки исследуемого материала.
Слайд 19I этап – Посев на питательные среды
В первый день исследования
производят посев материала последовательно на 2-3 чашки с агаром. В
некоторых случаях посев производят на жидкие среды. Посевы помещают в термостат на 18-24 часа. На дне чашки пишут дату посева, фамилию больного, номер анализа
Этапы:
Слайд 20II этап – Выделение чистой культуры (откол колоний)
Изучение внешнего вида
выращенных колоний, их формы, величины и окраски. Из подозрительных колоний
делают мазки и окрашивают их по Граму. Для получения чистой культуры делают петлей пересев подозрительной колонии на косой агар, который ставят в термостат.
Слайд 21III этап – Идентификация чистой культуры
Изучение чистой культуры по совокупности
морфологических, культуральных, биохимических и антигенных свойств. Для обнаружения этих свойств
делают пересев чистой культуры на соответствующие питательные среды, которые ставят в термостат.
Слайд 22IV этап – Определение чувствительности к антимикробным препаратам
Определяют свойства чистой
культуры, чувствительность к антибиотикам. Окончательное определение вида чистой культуры производят
при помощи реакции агглютинации на стекле микроба с иммунной сывороткой.
Слайд 23Биохимические исследования
1. Посев «чистых» колониаль-ных культур на «пестрый ряд» -
жидкие питательные среды с разными моноуглеводами и индикатором Андреде для
определения ферментативных свойств бактерий. При расщеплении углеводов образуются кислые продукты, изменяется цвет среды (индикатор рН) и выделяется газ.
2. Реакция на аммиак (лакмусовой бумагой под пробкой).
3. Реакция на сероводород (бумага с ацетатом свинца чернеет ).
4. Обнаружение каталазы.
Рис. «Пестрый» ряд: а-ферментация углеводов, б-отсутствие ферментации, в-индолообразование, г-образование сероводорода.
Слайд 24Биопроба
Биопроба – заражение лабораторных животных (белых мышей, крыс, морских свинок,
голубей, кроликов, кур и др.) с целью изучения патогенных и
вирулентных свойств бактерий, подтверждения инфекции, испытания лечебного действия лекарственных препаратов.
1. Культуру бактерий в физиологи-ческом растворе вводят животным: подкожно, внутримышечно, внутрибрюшинно или др. способом
2. После гибели животных вскрывают, определяют патологические изменения во внутренних органах и делают: а)мазки из внутренних органов; б)посев на питательные среды.
Рис. Внутрибрюшинное заражение белой мыши.
Силу возбудителя (вирулентность) выражают в летальных дозах, т.е. наименьшее число возбудителя, вызывающего гибель 50% (LD 50 ) лабораторных животных.
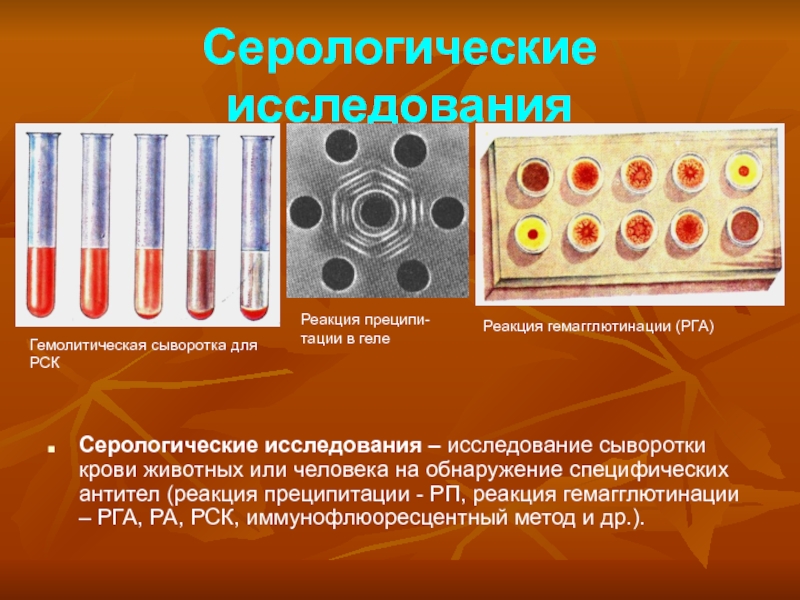
Слайд 25Серологические исследования
Серологические исследования – исследование сыворотки крови животных или человека
на обнаружение специфических антител (реакция преципитации - РП, реакция гемагглютинации
– РГА, РА, РСК, иммунофлюоресцентный метод и др.).
Гемолитическая сыворотка для РСК
Реакция преципи-тации в геле
Реакция гемагглютинации (РГА)
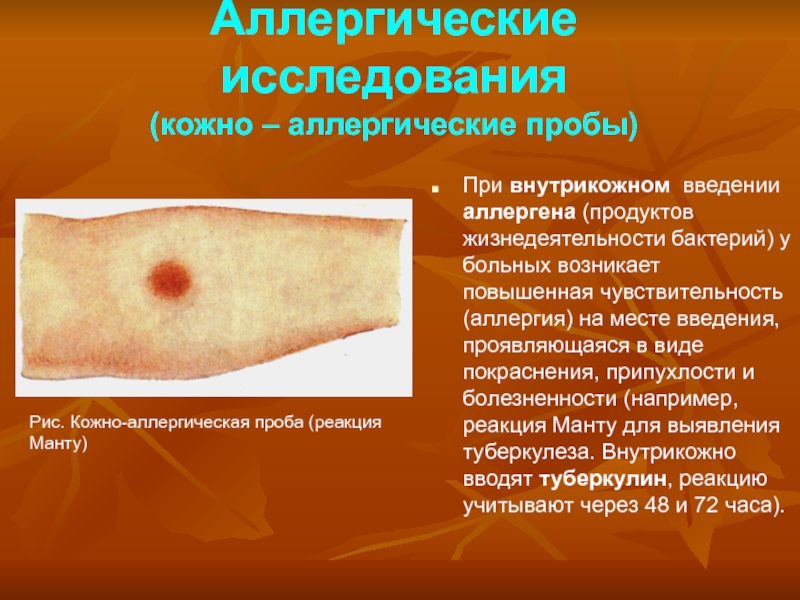
Слайд 26Аллергические исследования
(кожно – аллергические пробы)
При внутрикожном введении аллергена (продуктов жизнедеятельности
бактерий) у больных возникает повышенная чувствительность (аллергия) на месте введения,
проявляющаяся в виде покраснения, припухлости и болезненности (например, реакция Манту для выявления туберкулеза. Внутрикожно вводят туберкулин, реакцию учитывают через 48 и 72 часа).
Рис. Кожно-аллергическая проба (реакция Манту)