Слайд 1Методы сбора ихтиологической информации
Лекция 4.
Слайд 2При проведении полевых ихтиологических исследований собирается первичная информация и материал
для лабораторных исследований. Полученные данные используются при прогнозах будущих уловов.
Первое,
что должны знать ихтиологи – идентифицировать различные виды, а также различные внутривидовые и внутрипопуляционные группы, сохранить соотношение которых очень важно.
В некоторых случаях, рыбоводы не в состоянии воспроизводить некоторые экологические формы (летнюю севрюгу Волги или осеннюю кету на некоторых реках ДВ), которые являются наиболее многочисленными, поэтому рассчитывать ОДУ по виду в целом в таких случаях нельзя.
Классический пример с промыслом – каспийские кильки, когда селективно были подорваны запасы видов с положительным фототаксисом. Пустующие экологические ниши заняла обыкновенная килька, которую нельзя привлечь светом, в результаты промысел кильки полностью прекратился.
Слайд 3Длина. Используются 3 варианта длины – TL (total length)- абсолютная
длина, l – длина до развилки хвостового плавника и (редко)
– длина до конца чешуйчатого покрова.
Вес тела. Может использовать абсолютный вес (зависящий от накормленности рыбы в данный момент) и вес без внутренностей.
Пол и стадия зрелости гонад (очень важно при выделении различных экологических форм некоторых видов при расчетах ОДУ на вылов «для искусственного воспроизводства», например, севрюги или кеты).
Обычно в России используется следующие стадии зрелости:
1 – ювенильные рыбы, 2- первичные женские или мужские половые клетки, 3 – начальные стадии гаметогенеза (у самок – вителлогенетический рост ооцитов), 4 – завершающий этап гаметогенеза и переход в преднерестное состояние, 5 – нерестовое состояние (овуляция или спермиация), 6 – выбой (посленерестовое состояние).
Наиболее точную информацию о состоянии гонад у рыб дает гистологический анализ. Примерное состояние при наличии опыта определяется визуально.
Слайд 4Для проведения гистологического анализа пробы гонад фиксируются в жидкости Буэна
– смесь насыщенного раствора пикриновой кислоты (15 частей), формалина (5
частей) и ледяной уксусной кислоты).
После фиксации (не менее 48 час., хранение неограниченно долго) материал заливается в парафин (через пропитку спиртами возрастающей крепости и другими органическими растворителями). Затем приготавливаются срезы на микротоме, окрашиваются по специальным методикам и изучаются под микроскопом.
Слайд 5Первичные половые клетки в недифференцированных гонадах балтийского сига (1 стадия
зрелости). Масса тела – 71 г. визуально на этой стадии
гонады представляют тонкие бесцветные тяжи. Пол определить невозможно ни визуально, ни под микроскопом. Нельзя визуально определить пол и момент появления первых диференцированных половых клеток – сперматоцитов или ооцитов.
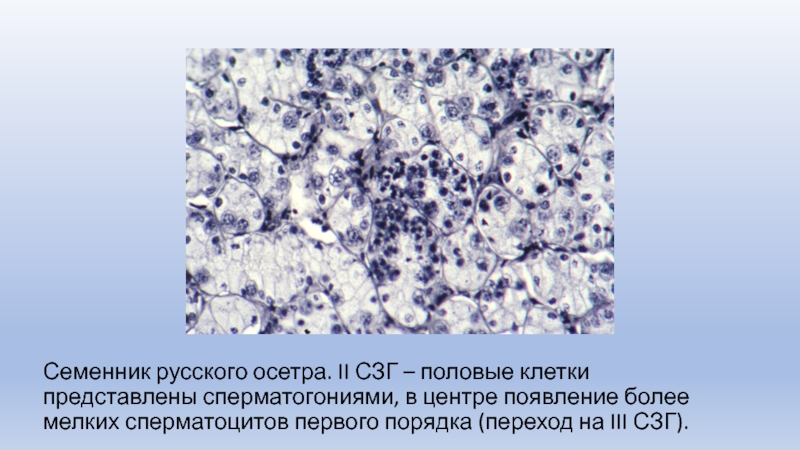
Слайд 6Семенник русского осетра. II СЗГ – половые клетки представлены сперматогониями,
в центре появление более мелких сперматоцитов первого порядка (переход на
III СЗГ).
Слайд 7Срез семенника балтийского сига. II-III СЗГ. Генеративная ткань представлена сперматогониями
и более темными сперматоцитами. Идет формирование семенного канальца. Об. 40х.
Визуально пол определить уже можно без гистологического анализа. Семенники – белые гладкие тяжи.
Слайд 8Срез семенника балтийского сига. III СЗГ - начало перехода на
IV СЗГ. Генеративные клетки представлены сперматоцитами. Образующиеся сперматиды меньшего размера
по сравнению со сперматоцитами переходят в полость семенных канальцев. Об. 40х
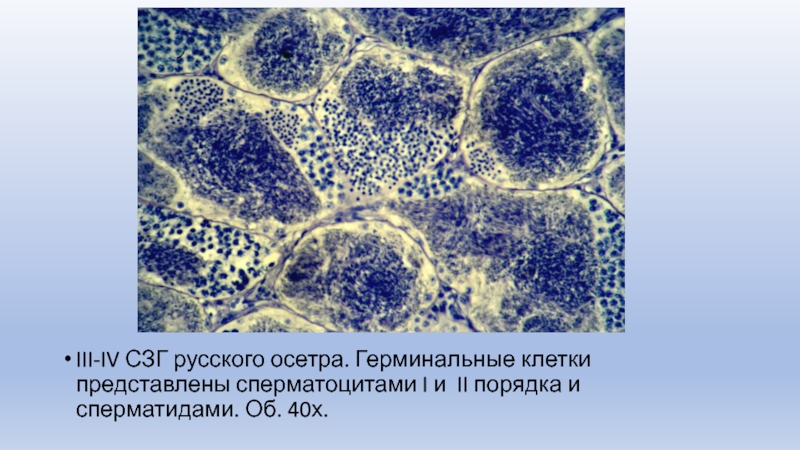
Слайд 9III-IV СЗГ русского осетра. Герминальные клетки представлены сперматоцитами I и
II порядка и сперматидами. Об. 40х.
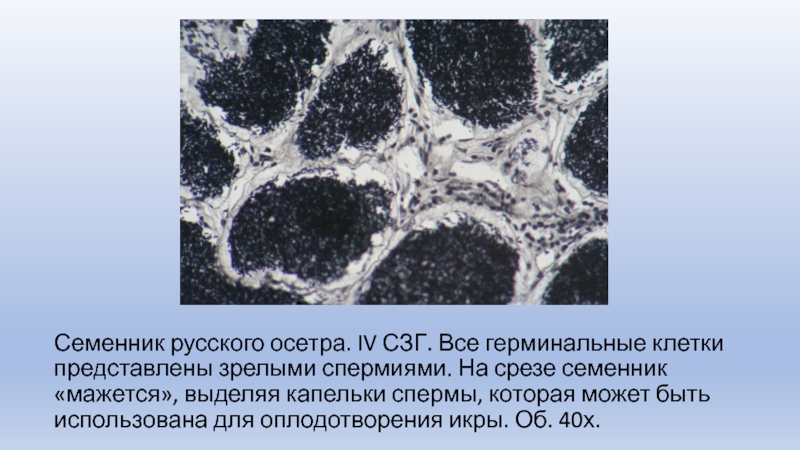
Слайд 10Семенник русского осетра. IV СЗГ. Все герминальные клетки представлены зрелыми
спермиями. На срезе семенник «мажется», выделяя капельки спермы, которая может
быть использована для оплодотворения икры. Об. 40х.
Слайд 11Севрюга. III СЗГ (нерест через год). Ядро почти в центре
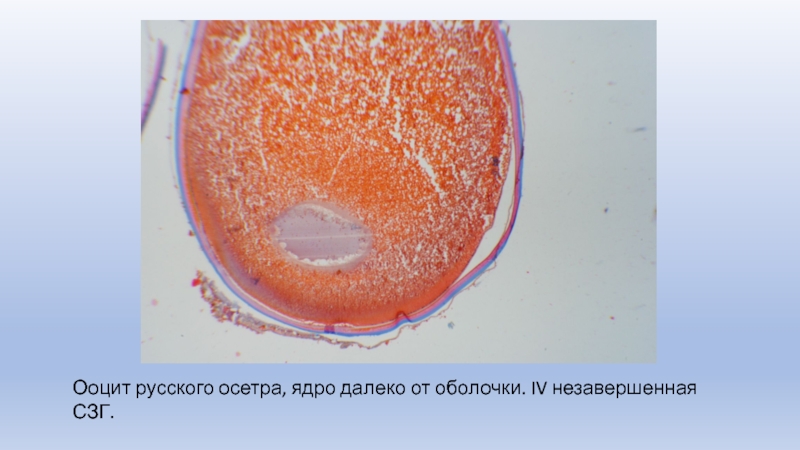
Слайд 12Ооцит русского осетра, ядро далеко от оболочки. IV незавершенная СЗГ.
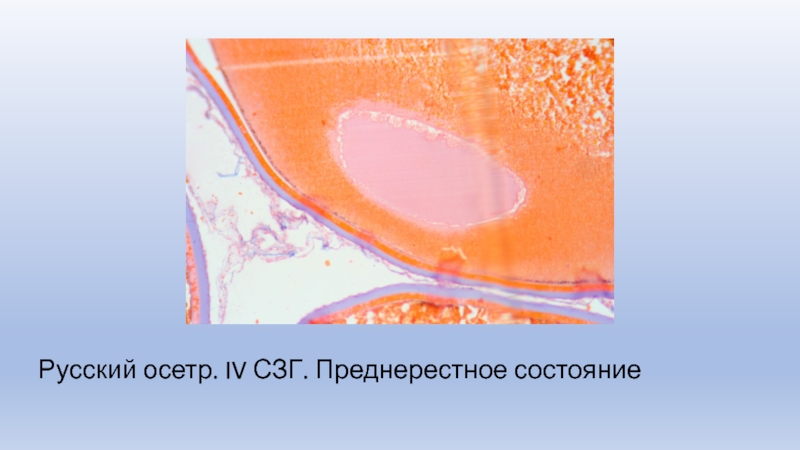
Слайд 13Русский осетр. IV СЗГ. Преднерестное состояние
Слайд 14Возраст рыбы
Отсчет возраста обычно ведется с момента вылупления из икры.
Иногда считают с момента оплодотворения (особенно на эибриональных стадиях развития).
Принятые обозначения – эмбрион, предличинка (до рассасывания желточного мешка), малек, молодь (в англ. литературе – фингерлинг), сеголеток (в конце лета текущего года у весенне-нерестящихся рыб, 0+), годовик, двухлеток (1+), двухгодовик, трехлеток (2+) и т.д.
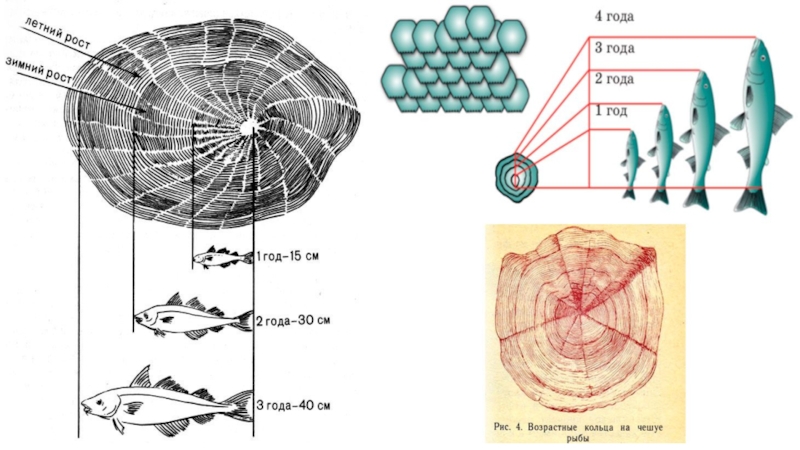
Для определения возраста берутся образцы чешуи (у костистых рыб) или отолитов и делаются спилы лучей грудных плавников (у осетровых рыб). Плакоидная и ганоидная чешуя для этой цели непригодна.
Первым русским ихтиологом, который применил метод определения возраста рыб по чешуе, был Е.К. Суворов, работавший в 1909—1910 гг. с такими видами как балтийская камбала, салака и килька.
Слайд 17Методы обработки чешуи
Чешую отмачивают в течение нескольких минут в 4%-ном
растворе аммиака, промывают в воде, очищают от остатков кожных покровов
и закладывают между двумя предметными стеклами.
Слайд 18Нерестовые отметки образуются в результате частичного разрушения чешуи во время
нереста и последующего ее восстановления. Нерестовые отметки хорошо видны на
чешуе атлантических лососей, каспийских и азово-черноморских сельдей и некоторых других рыб. По нерестовым кольцам можно установить время (возраст) наступления половой зрелости, число нерестов, а также их периодичность.
Мальковые кольца образуются на чешуе, не имеющей годового кольца, т. е. на первом году жизни, в период резко изменяющихся условий обитания молоди, например, при скате молоди из рек в море (вобла, лещ и др.), переходе от обитания в прибрежных водах к жизни в открытых участках моря (азово-черноморская сельдь), переходе с пелагического образа жизни на придонный (черноморская султанка). Эти кольца обычно менее отчетливы, чем годовые. Изучая чешую мальков перед зимовкой, можно установить наличие или отсутствие малькового кольца.
У проходных рыб (атлантических лососей) на чешуе наблюдаются речные и морские зоны роста, образующиеся в речные и морские периоды жизни, отражающие продолжительность обитания и скорость роста этих рыб в реке и море.
Миграционные кольца могут образовываться у некоторых рыб в период миграций. Если такие кольца появляются на первом году жизни, то они относятся к мальковым.

Слайд 19
У некоторых рыб число колец не соответствует количеству прожитых рыбой
лет. Например, у речного угря закладка чешуи происходит на 3-м,
4-м или даже 5-м году жизни. В этих случаях может облегчить или уточнить определение возраста использование костей и отолитов.
Слайд 20Отолиты костистых рыб представлены тремя парами кальций-протеиновых образований в полукружных
каналах слуховых капсул и выполняют функции внутреннего уха млекопитающих. Три
пары отолитов называются lapilli, asterisci, and sagittae. У лососевых рыб первые две пары очень маленькие (около 1 мм), поэтому изучают главным образом sagittae, имеющие размеры около 5 мм.
У эмбрионов лососей отолиты сформировываются к началу стадии "пигментации глаз". Дальнейший рост отолитов происходит на протяжении жизни рыбы в результате ежесуточного наслоения кальций-протеиновых слоев. Изменения окружающей среды оставляют свой след в структуре отолита за счет изменения скорости оседания кальция; в результате различной ширины светлые слои кальция и темные слои органики перемежаются, создавая уникальный для каждой рыбы рисунок отолита.
Слайд 21Методы обработки отолитов
Отолиты без какой-либо предварительной обработки просветляют в течение
5-7 мин в глицерине и просматривают под микроскопом в падающем
свете (типа МБС-10). Для улучшения информативности отолиты шлифуют
Источник: http://naukarus.com/metodika-opredeleniya-vozrasta-chernomorsko-kaspiyskoy-tyulki-clupeonella-cultriventris-clupeiformes-clupeoidei-po-cheshu
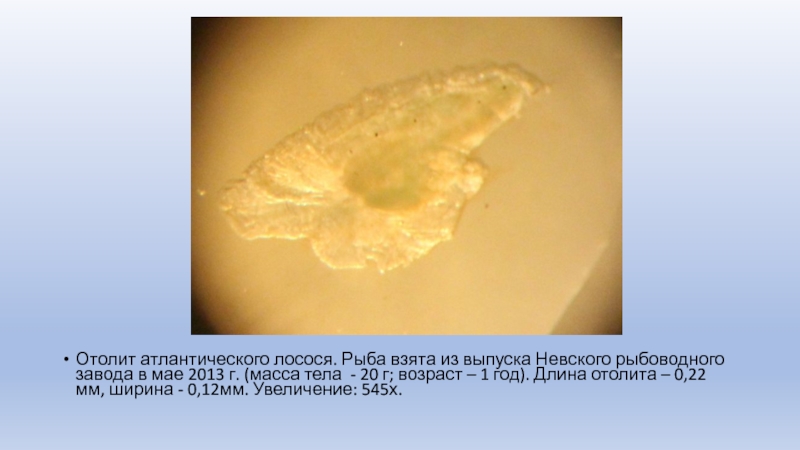
Слайд 22Отолит атлантического лосося. Рыба взята из выпуска Невского рыбоводного завода
в мае 2013 г. (масса тела - 20 г; возраст
– 1 год). Длина отолита – 0,22 мм, ширина - 0,12мм. Увеличение: 545х.
Слайд 23Отолит балтийского сига. Рыба взята из стада Нарвского рыбоводного завода
в октябре 2013 г. (масса тела - 162 г; абсолютная
длина тела – 262 мм, длина тела до развилки хвостового плавника – 245 мм; возраст - 1+). Длина отолита - 0,58 мм, ширина - 0,23 мм. Увеличение: 200х. Просматривается первое годовое кольцо.
Слайд 25Манипулируя условиями среды, можно направленно формировать элементы структуры отолита и
таким образом вносить в отолит заранее заданную метку. Использование различных
режимов мечения позволяет формировать компактные метки (состоящие из чередующихся темных и светлых полос, по типу штрих-кода), несущие большое количество информации.
Существуют несколько способов маркирования отолитов лососей. Наиболее известны термическое маркирование и мечение с использованием стронция, заключающиеся в маркировании отолитов за счет периодических повышений фоновой температуры инкубирования икры (Munk et al., 1993, Акиничева, Рогатных, 1996). Полученные метки сохраняются на протяжении всей жизни рыбы. Способ заключается в следующем: в инкубационные аппараты закладывают оплодотворенную икру и проводят инкубирование до стадии пигментации глаз зародыша по стандартной методике.
Слайд 26Термический метод разработан и широко применяемый за рубежом (США, Канада,
Япония, Южная Корея) и на российском Дальнем Востоке (http://www.npafc.org/new/science_statistics.html, http://www.npafc.org/new/publications/Annual%20Report/2012/Annual%20Report%202012/index.html)
Есть и разработанный российскими авторами «сухой» метод.
Полученные в результате термического или "сухого" мечения метки на отолитах лососей принципиально не различаются. Такие биологические метки сохраняются на протяжении всей жизни рыбы и могут быть "прочитаны" на любом этапе онтогенеза.
Ежегодно организация NPACF утверждает для различных стран применяемые метки и объемы продукции рыбоводных заводов, подлежащие маркированию.
Слайд 27http://www.freepatent.ru/patents/2150827
Слайд 28Начиная со стадии пигментации глаз производят периодические изменения температуры инкубации
в сторону повышения или понижения ее от фонового значения на
3,0-3,5oC. Такие изменения температуры фиксируются на отолитах эмбрионов лососей в слоях суточных приростов в виде чередований контрастных темных и светлых слоев. Наиболее подходящей для нанесения метки является зона отолита, соответствующая этапу онтогенеза от начала пигментации глаз у эмбриона до начала экзогенного питания личинки. Таким способом получают искусственные метки, состоящие из определенного набора полос. Эти метки сохраняются в течение всей жизни рыбы и легко "прочитываются" под микроскопом
Слайд 29Массовое мечение кеты "сухим" способом на рыбоводном заводе.
В аппарат
Аткинса закладывают на инкубацию икру кеты в количестве 70 тыс.
икринок. Инкубирование проводят по стандартной методике до стадии пигментации глаз зародыша. С этого момента (36 суток с момента оплодотворения) начинают мечение. Температура воды в инкубаторе в период проведения мечения в среднем изменяется от 8,5 до 8,0oC.
Для получения метки проводят осушение икры, отключая водоснабжение в аппарате Аткинса. Оставшуюся в инкубаторе воду сливают (путем поднятия шандорок), а икру перемешивают в целях предотвращения образования слежавшихся комков и улучшения вентиляции. Для снижения обмена между внешней средой и осушенной икрой инкубатор накрывают полиэтиленовой пленкой. В таком относительно "сухом" состоянии икра находится 24 часа, после чего включают водоподачу и закрывают шандорки. Инкубационный аппарат начинает функционировать в обычном режиме, когда икра омывается водой. Следующее отключение водоподачи производится через 24 часа. Осушение икры, таким образом, осуществляется с суточной периодичностью.
В течение одного цикла мечения икра 24 часа находится в сухом состоянии (без воды, во влажной атмосфере) и 24 часа омывается водой (в нормально работающем инкубационном аппарате). Таких циклов мечения (24 часа через 24 часа) проведено пять. Данные изменения условий инкубации фиксируются на отолитах эмбрионов в слоях суточных приростов в виде чередований контрастных темных и светлых слоев. В результате получена метка, состоящая из 5 темных полос, равноудаленных друг от друга (фиг. 1). Для сравнения на фиг. 2 представлен отолит эмбриона кеты без метки.

Слайд 31100% мечение рыбоводной продукции позволяет определять соотношение «заводской» и «естественной»
рыбы в популяциях, оценивать коэффициенты промыслового возврата по годам рождения,
заводам и различным вариантам выращивания, а также строить прогнозы на развитие пастбищного лососевого хозяйства.
Для других групп рыб используются иные методики, прежде всего, маркирование окситетрациклином (за рубежом).
Более того, в США выпуск в водоемы немаркированной молоди приравнивается к выпуску любой другой немаркированной продукции и преследуется по закону (простейшие методы маркирования – подрезание жирового плавничка у лососевых или других плавничков в остальных группах рыб, что помогает проводить рекреационный лов с выпуском диких рыб без метки обратно в водоем).
Слайд 32тетрациклиновое маркирование отолитов
Проходные северо-американские сельди. При искусственном разведении на р.
Саскуэханна (США) с 1986 г. личинки сельдей маркируются через иммерсию
в растворе окситетрациклина или окситетрациклина гидрохлорида (256 мг на 1 л – для американского шеда Alosa sadipissima и 512 мг – для хикори A. mediocris), который создает специфическую метку на отолитах, видимую при ультрафиолетовом освещении. Иммерсия проводится на 1-2-й день после вылупления в течение 4-6 час. и может быть повторена через 3-4 дня.
С 2003 г. на заводе Van Dyke Hatcherу используют однократную иммерсию для личинок, выпускаемых ниже плотины, и двукратную – для выпускаемых выше плотины.
В последние годы концентрацию окситетрациклина для шеда повысили до 300-426 мг/л.
Белоперый судак Sander vitreus. В первые дни после выклева (1-4-й день) личинки маркируются через иммерсию в растворе окситетрациклина (700 мг/л). Продолжительность обработки – 6 час.
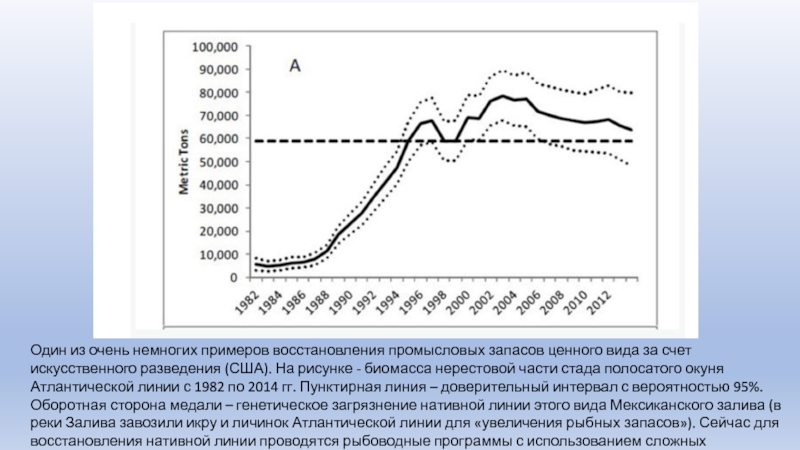
Слайд 33Один из очень немногих примеров восстановления промысловых запасов ценного вида
за счет искусственного разведения (США). На рисунке - биомасса нерестовой
части стада полосатого окуня Атлантической линии с 1982 по 2014 гг. Пунктирная линия – доверительный интервал с вероятностью 95%. Оборотная сторона медали – генетическое загрязнение нативной линии этого вида Мексиканского залива (в реки Залива завозили икру и личинок Атлантической линии для «увеличения рыбных запасов»). Сейчас для восстановления нативной линии проводятся рыбоводные программы с использованием сложных генетических методов.
Слайд 34Генетическое маркирование
Разведение полосатого окуня Morone saxatilis линии Мексиканского залива в
р. Апалачикола. Под плотиной Woodruff Lock and Dam заготавливается икра
для 6 федеральных заводов, выращивающих ежегодно 1 млн фингерлингов для выпуска на территории 7 штатов.
Для выявления генетически чистых особей линии Мексиканского залива проводится несколько вариантов генетического анализа и составляется генетический каталог всех использованных производителей и вернувшихся заводских рыб, что позволило отказаться от маркирования окситетрациклином.
Идентификация метки позволяет получить всю информацию о рыбе – не только возраст, но и точную дату рождения, а также установить ее родителей.
Анализ чешуи и отолитов становятся ненужными (но метод остается достаточно дорогим, особенно при использовании большого числа производителей с небольшой рабочей плодовитостью – лососевые рыбы).