Слайд 1Кто, зачем и почему
Митохондрии, пероксисомы и пластиды
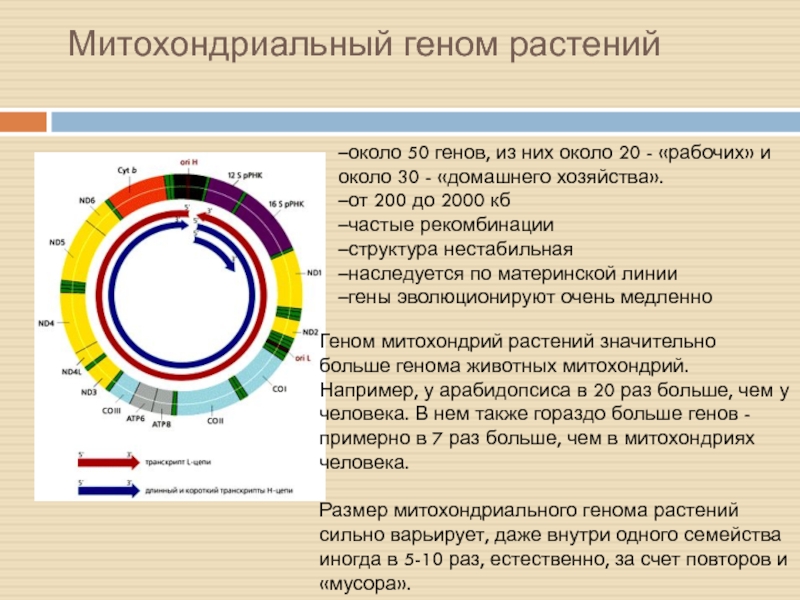
Слайд 2Митохондриальный геном растений
Геном митохондрий растений значительно больше генома животных митохондрий.
Например, у арабидопсиса в 20 раз больше, чем у человека.
В нем также гораздо больше генов - примерно в 7 раз больше, чем в митохондриях человека.
Размер митохондриального генома растений сильно варьирует, даже внутри одного семейства иногда в 5-10 раз, естественно, за счет повторов и «мусора».
–около 50 генов, из них около 20 - «рабочих» и около 30 - «домашнего хозяйства».
–от 200 до 2000 кб
–частые рекомбинации
–структура нестабильная
–наследуется по материнской линии
–гены эволюционируют очень медленно
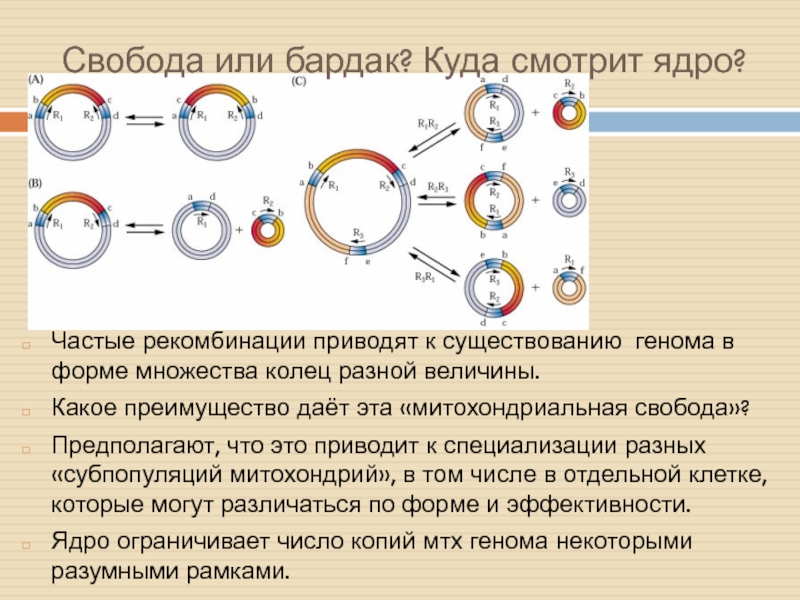
Слайд 3Свобода или бардак? Куда смотрит ядро?
Частые рекомбинации приводят к существованию
генома в форме множества колец разной величины.
Какое преимущество даёт эта
«митохондриальная свобода»?
Предполагают, что это приводит к специализации разных «субпопуляций митохондрий», в том числе в отдельной клетке, которые могут различаться по форме и эффективности.
Ядро ограничивает число копий мтх генома некоторыми разумными рамками.
Слайд 4Пластидный геном
–гены организованы в форме оперонов
-есть интроны
–кольцевая
-около 100 генов
–от 130
до 160 кб
–стабильная структура
–эволюционирует очень медленно
–наследуется только по материнской линии,
рекомбинации очень редки
У разных растений, за редким исключением,
структура генома примерно одинакова. Она состоит из большого и малого однокопийных
участков, разделенных инвертированными повторами, которые содержат гены хлоропластных рРНК. Повторы отсутствуют у голосеменных и некоторых бобовых растений.
Слайд 5Митохондрии… что интересно?
Нестабильный геном вследствие постоянных рекомбинаций
Постоянное взаимодействие с ядром:
импорт и… экспорт?
Цитоплазматическая мужская стерильность
Биохимические отличия: фотодыхание, ярко выраженная синтетическая
функция (поставка углеродных скелетов), альтернативные компоненты ЭТЦ.
Обмен метаболитами с пластидами (в т.ч. НАДФН)
РНК-полимераза фагового типа кодируется в ядре
Слайд 6Про мембраны митохондрий
Внешняя мембрана. Проницаема для веществ с молекулярной массой
до 10 000 через порины (неспецифичные каналы)
Преобладают насыщенные жирные кислоты.
Мало белков.
Разрушается при набухании митохондрий.
Внутренняя мембрана. Непроницаема для ионов. Транспорт контролируется белками переносчиками.
Преобладают ненасыщенные жирные кислоты (90%), в том числе кардиолипин.
Высокое содержание белка.
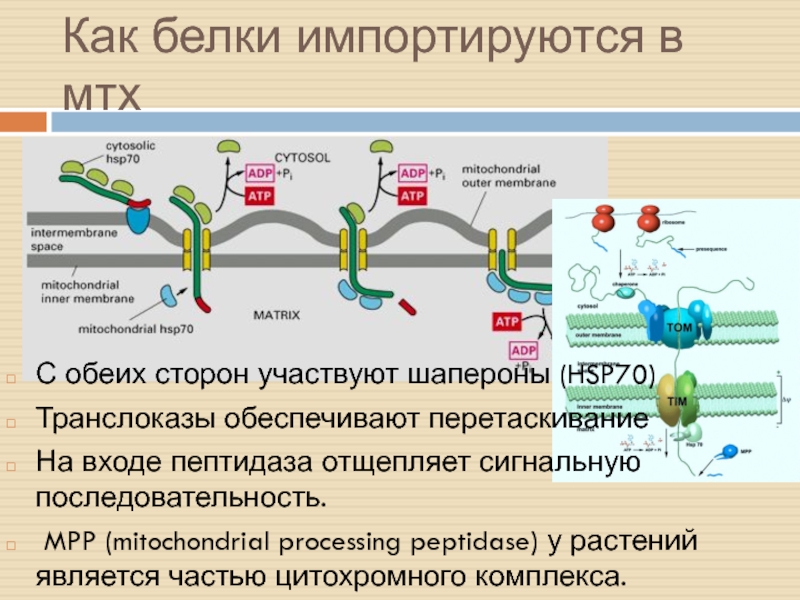
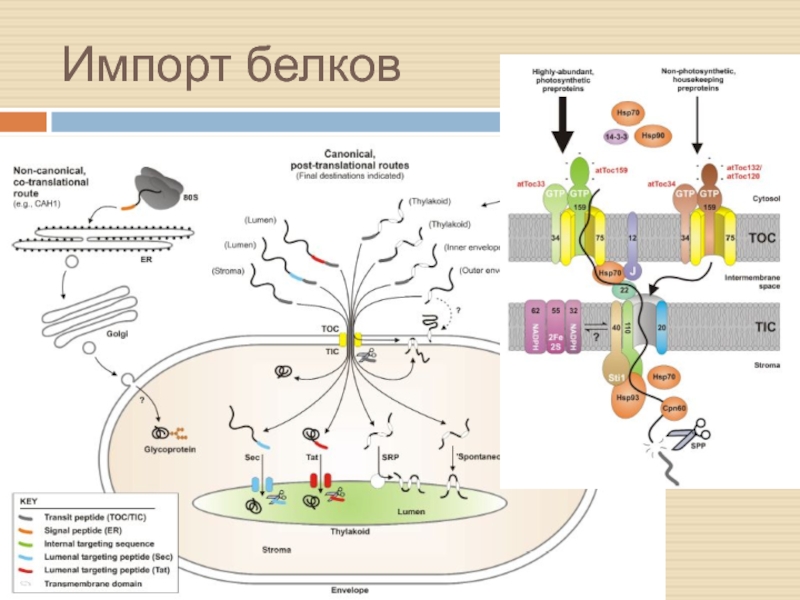
Слайд 7Как белки импортируются в мтх
С обеих сторон участвуют шапероны (HSP70)
Транслоказы
обеспечивают перетаскивание
На входе пептидаза отщепляет сигнальную последовательность.
MPP (mitochondrial processing
peptidase) у растений является частью цитохромного комплекса.
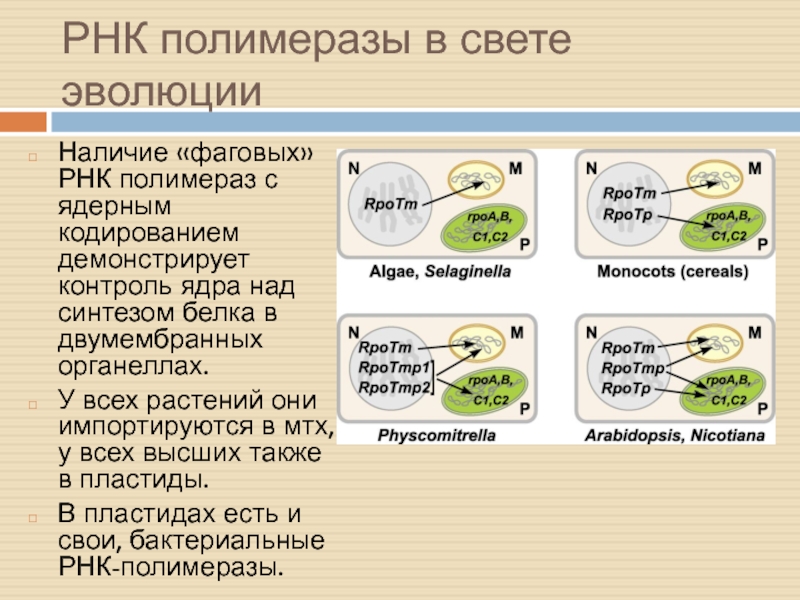
Слайд 8РНК полимеразы в свете эволюции
Наличие «фаговых» РНК полимераз с ядерным
кодированием демонстрирует контроль ядра над синтезом белка в двумембранных органеллах.
У всех растений они импортируются в мтх, у всех высших также в пластиды.
В пластидах есть и свои, бактериальные РНК-полимеразы.
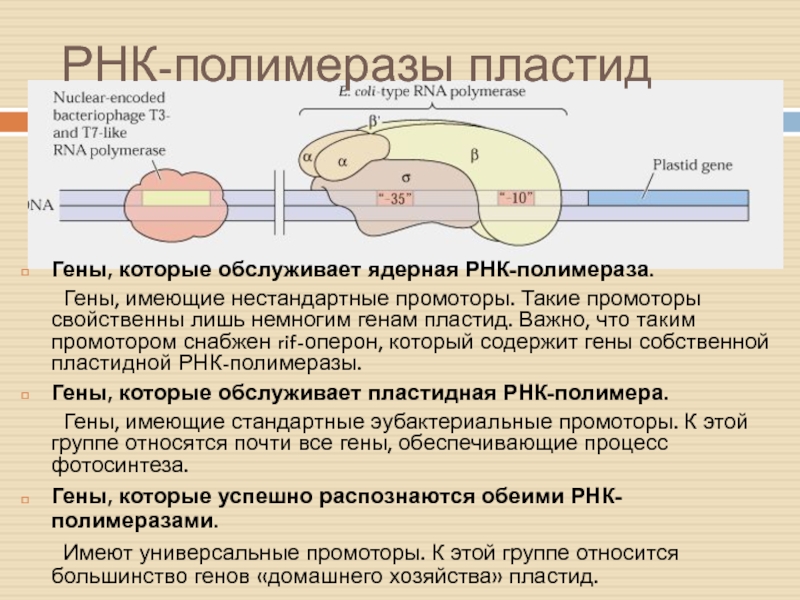
Слайд 9РНК-полимеразы пластид
Гены, которые обслуживает ядерная РНК-полимераза.
Гены, имеющие нестандартные промоторы. Такие
промоторы свойственны лишь немногим генам пластид. Важно, что таким промотором
снабжен rif-оперон, который содержит гены собственной пластидной РНК-полимеразы.
Гены, которые обслуживает пластидная РНК-полимера.
Гены, имеющие стандартные эубактериальные промоторы. К этой группе относятся почти все гены, обеспечивающие процесс фотосинтеза.
Гены, которые успешно распознаются обеими РНК-полимеразами.
Имеют универсальные промоторы. К этой группе относится большинство генов «домашнего хозяйства» пластид.
Слайд 10Кто регулирует АФК?
Митохондрии являются сенсорами редокс-статуса клетки
Они являются одним из
основных мест образования АФК, причём это образование могут эффективно модулировать
Одним
из способов регуляции является экспрессия АО в ядре в ответ на стресс
Слайд 11Митохондрии динамичны и «общительны»
Считается, что «нестехиометричность» генома (т.е. его неравномерное
распределение между митохондриями) может служить причиной их слияний и делений
А
для слияний и делений необходима подвижность, которая обеспечивается взаимодействием с цитоскелетом.
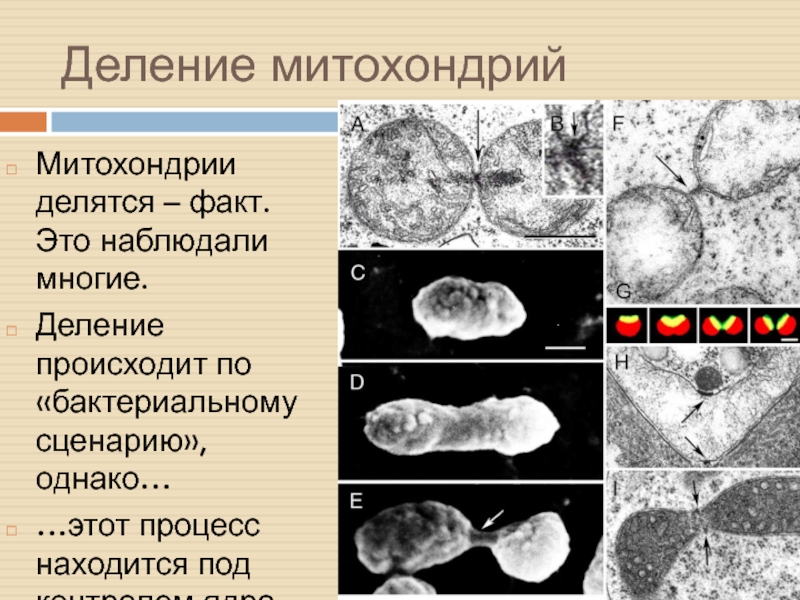
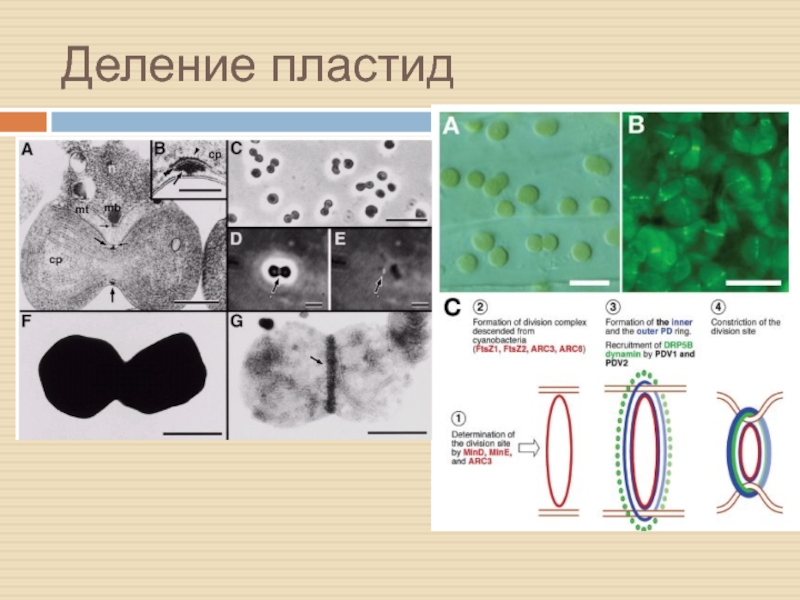
Слайд 12Деление митохондрий
Митохондрии делятся – факт. Это наблюдали многие.
Деление происходит по
«бактериальному сценарию», однако…
…этот процесс находится под контролем ядра.
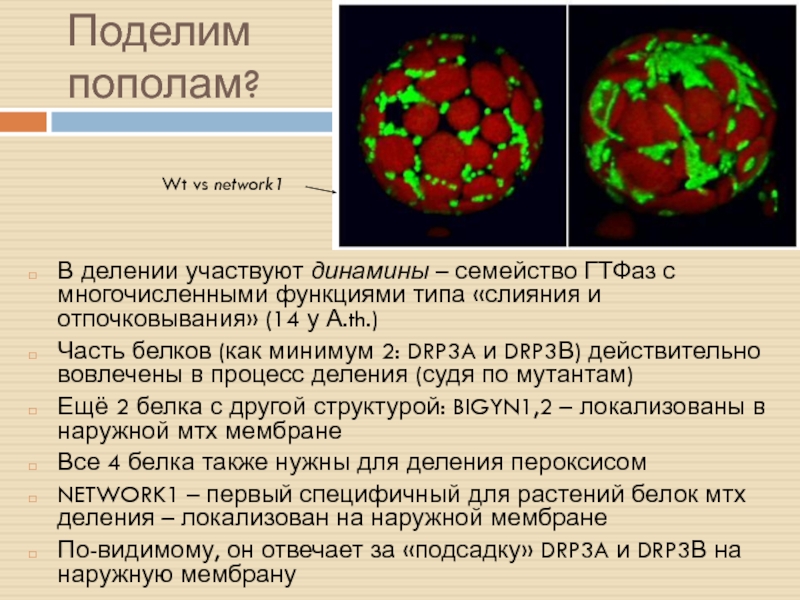
Слайд 13Поделим пополам?
В делении участвуют динамины – семейство ГТФаз с многочисленными
функциями типа «слияния и отпочковывания» (14 у А.th.)
Часть белков (как
минимум 2: DRP3A и DRP3В) действительно вовлечены в процесс деления (судя по мутантам)
Ещё 2 белка с другой структурой: BIGYN1,2 – локализованы в наружной мтх мембране
Все 4 белка также нужны для деления пероксисом
NETWORK1 – первый специфичный для растений белок мтх деления – локализован на наружной мембране
По-видимому, он отвечает за «подсадку» DRP3A и DRP3В на наружную мембрану
Wt vs network1
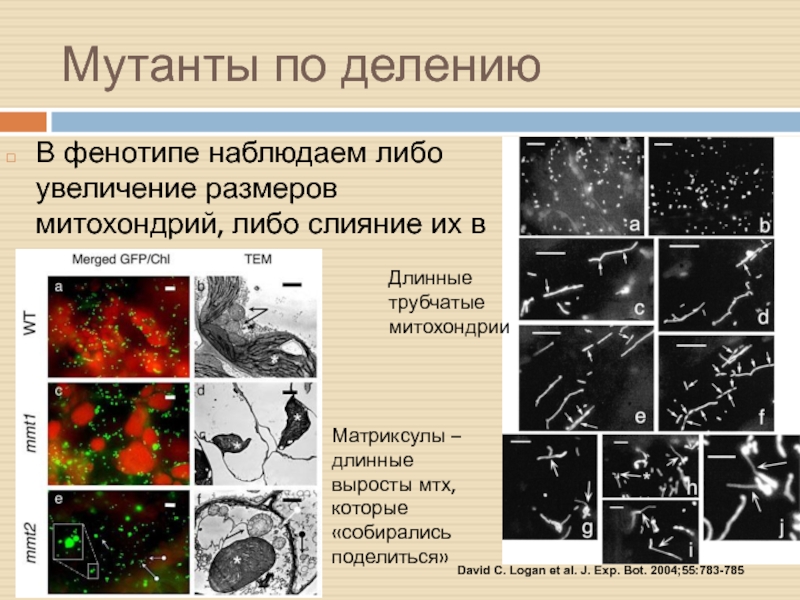
Слайд 14Мутанты по делению
В фенотипе наблюдаем либо увеличение размеров митохондрий, либо
слияние их в сеть…
David C. Logan et al. J. Exp.
Bot. 2004;55:783-785
Матриксулы – длинные выросты мтх, которые «собирались поделиться»
Длинные трубчатые митохондрии
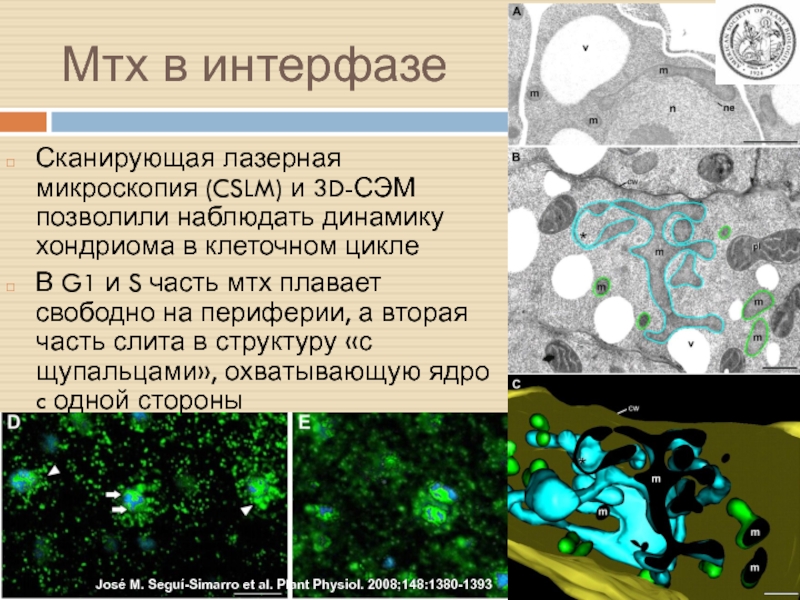
Слайд 15Мтх в интерфазе
Сканирующая лазерная микроскопия (CSLM) и 3D-СЭМ позволили наблюдать
динамику хондриома в клеточном цикле
В G1 и S часть мтх
плавает свободно на периферии, а вторая часть слита в структуру «с щупальцами», охватывающую ядро c одной стороны
José M. Seguí-Simarro et al. Plant Physiol. 2008;148:1380-1393
Слайд 16José M. Seguí-Simarro et al. Plant Physiol. 2008;148:1380-1393
©2008 by American
Society of Plant Biologists
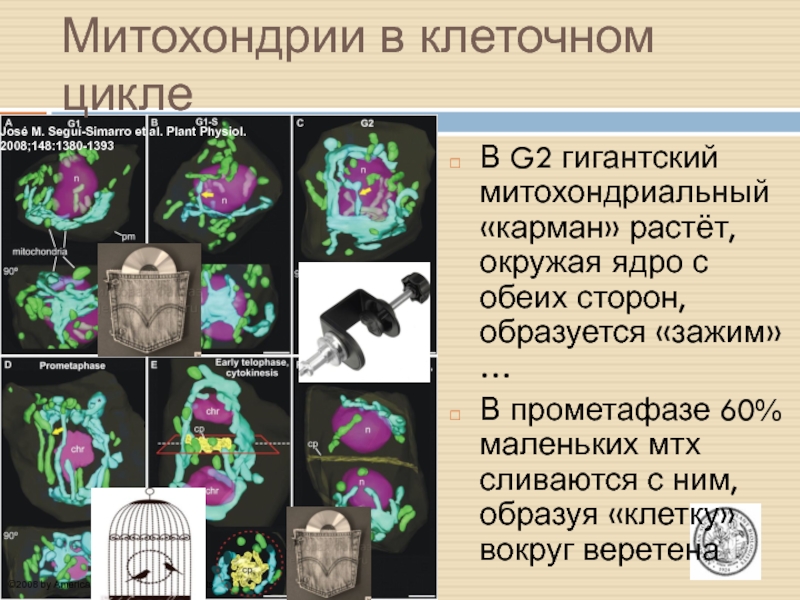
Митохондрии в клеточном цикле
В G2 гигантский митохондриальный
«карман» растёт, окружая ядро с обеих сторон, образуется «зажим»…
В прометафазе 60% маленьких мтх сливаются с ним, образуя «клетку» вокруг веретена
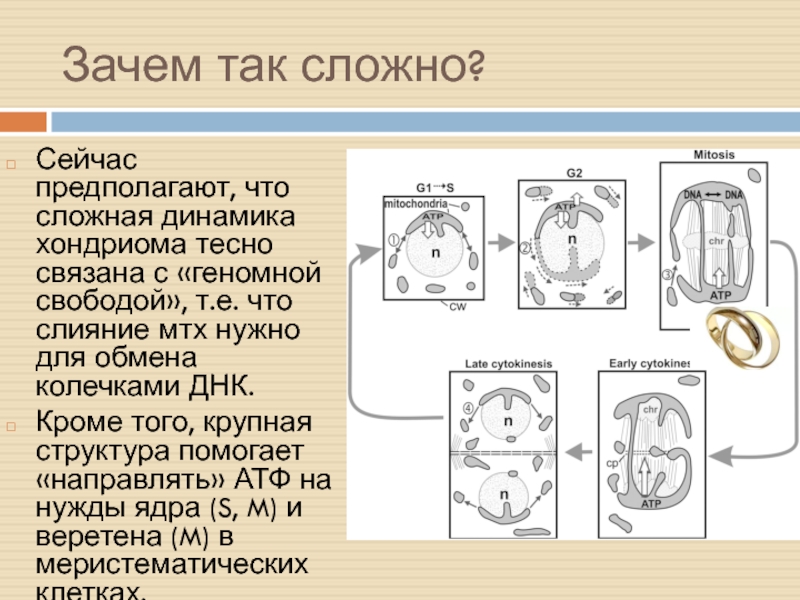
Слайд 17Зачем так сложно?
Сейчас предполагают, что сложная динамика хондриома тесно связана
с «геномной свободой», т.е. что слияние мтх нужно для обмена
колечками ДНК.
Кроме того, крупная структура помогает «направлять» АТФ на нужды ядра (S, M) и веретена (M) в меристематических клетках.
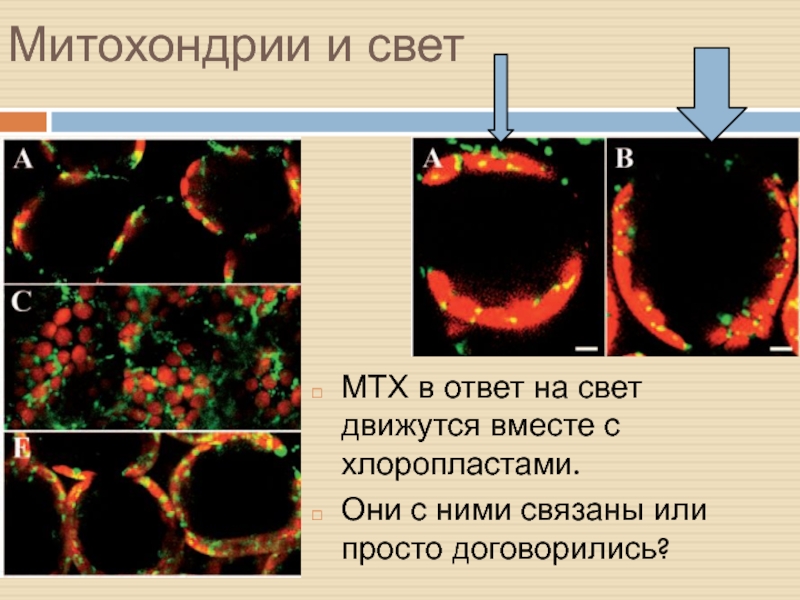
Слайд 18Митохондрии и свет
МТХ в ответ на свет движутся вместе с
хлоропластами.
Они с ними связаны или просто договорились?
Слайд 19Подвижность мтх
Митохондрии очень подвижны, передвигаются в основном по МФ (миозины).
Средняя
скорость около 0,5 µм/с, в КВ до 10 µм/с.
D.C. Logan
/ Seminars in Cell & Developmental Biology 21 (2010) 550–557
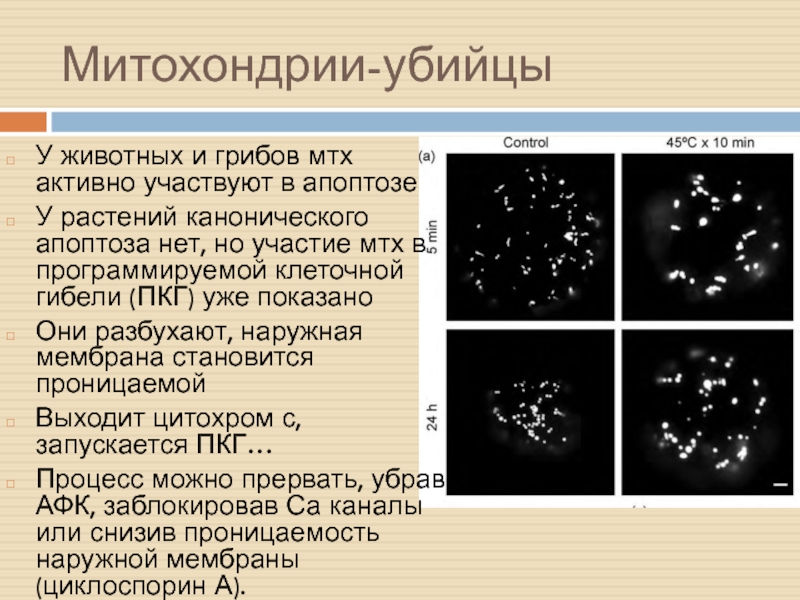
Слайд 20Митохондрии-убийцы
У животных и грибов мтх активно участвуют в апоптозе
У растений
канонического апоптоза нет, но участие мтх в программируемой клеточной гибели
(ПКГ) уже показано
Они разбухают, наружная мембрана становится проницаемой
Выходит цитохром с, запускается ПКГ…
Процесс можно прервать, убрав АФК, заблокировав Са каналы или снизив проницаемость наружной мембраны (циклоспорин А).
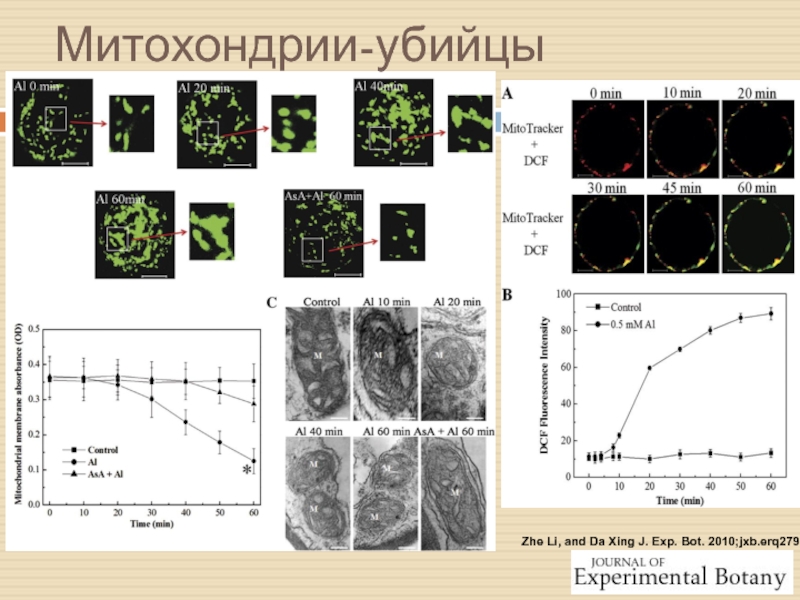
Слайд 21Zhe Li, and Da Xing J. Exp. Bot. 2010;jxb.erq279
Митохондрии-убийцы
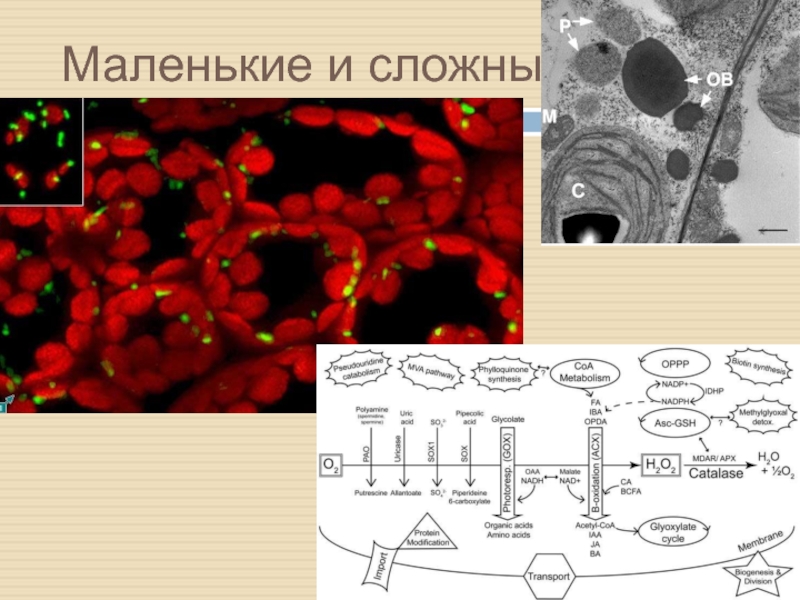
Слайд 22Пероксисомы – загадочные и отважные
Пероксисомы – одномембранные органеллы с диаметром
0,1-1 µм.
Основные функции:
липидный метаболизм (β-окисление ЖК)
элиминация АФК (в основном
Н2О2).
Дополнительные функции:
Фотодыхание (взаимод-е с мтх и пластидами)
Глиоксилатный цикл
Биосинтез гормона жасмоновой к-ты
Сигналинг в патоген-индуцированном ответе
Около 130 ядерных генов связаны с работой пероксисом (для сравнения, у человека и дрожжей – 85 и 61, соответственно)
Это указывает на особое значение этих органелл у растений
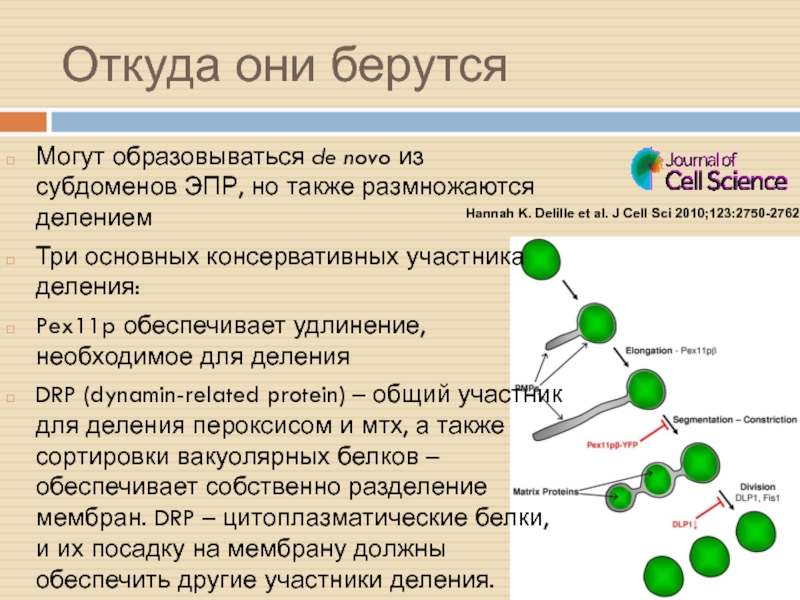
Слайд 24Откуда они берутся
Могут образовываться de novo из субдоменов ЭПР, но
также размножаются делением
Три основных консервативных участника деления:
Pex11p обеспечивает удлинение,
необходимое для деления
DRP (dynamin-related protein) – общий участник для деления пероксисом и мтх, а также сортировки вакуолярных белков – обеспечивает собственно разделение мембран. DRP – цитоплазматические белки, и их посадку на мембрану должны обеспечить другие участники деления.
BIGYN (ортолог FIS) – ещё один общий фактор
Hannah K. Delille et al. J Cell Sci 2010;123:2750-2762
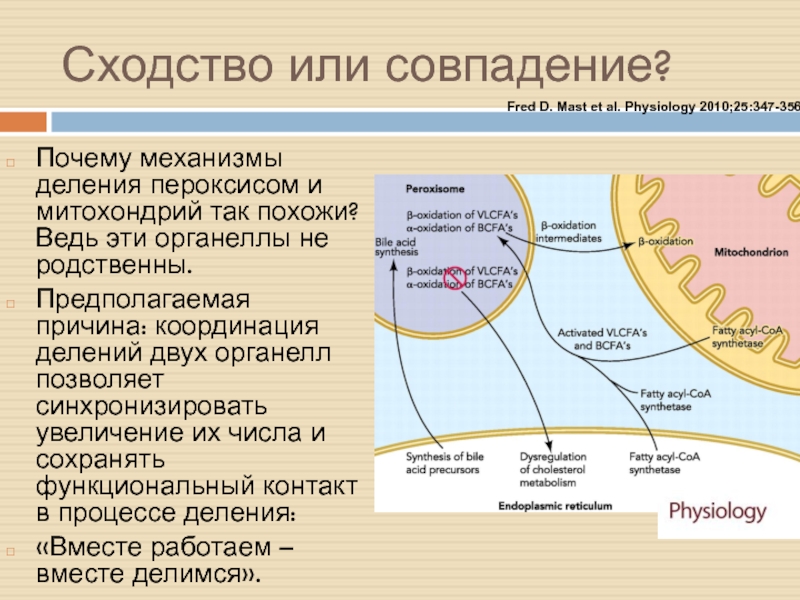
Слайд 25Сходство или совпадение?
Почему механизмы деления пероксисом и митохондрий так похожи?
Ведь эти органеллы не родственны.
Предполагаемая причина: координация делений двух органелл
позволяет синхронизировать увеличение их числа и сохранять функциональный контакт в процессе деления:
«Вместе работаем – вместе делимся».
Fred D. Mast et al. Physiology 2010;25:347-356
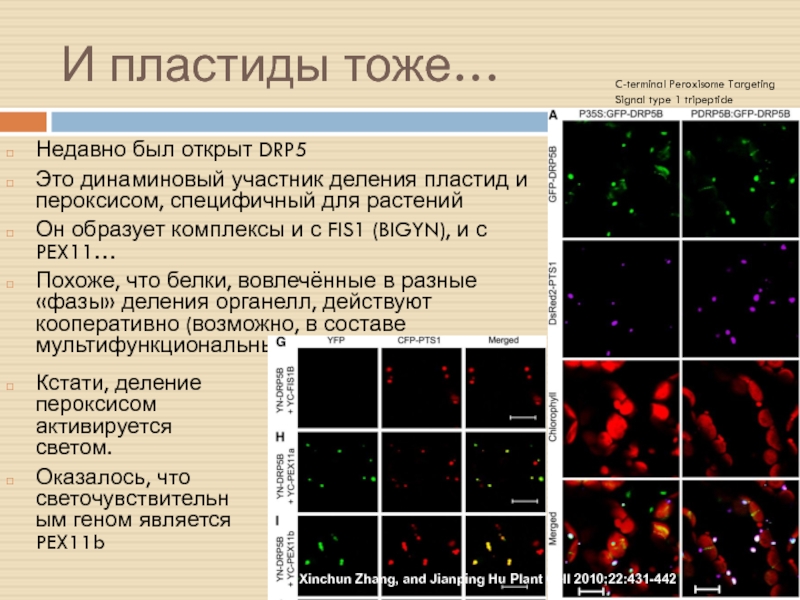
Слайд 26И пластиды тоже…
Недавно был открыт DRP5
Это динаминовый участник деления пластид
и пероксисом, специфичный для растений
Он образует комплексы и с FIS1
(BIGYN), и с PEX11…
Похоже, что белки, вовлечённые в разные «фазы» деления органелл, действуют кооперативно (возможно, в составе мультифункциональных комплексов).
Xinchun Zhang, and Jianping Hu Plant Cell 2010;22:431-442
Кстати, деление пероксисом активируется светом.
Оказалось, что светочувствительным геном является PEX11b
C-terminal Peroxisome Targeting Signal type 1 tripeptide
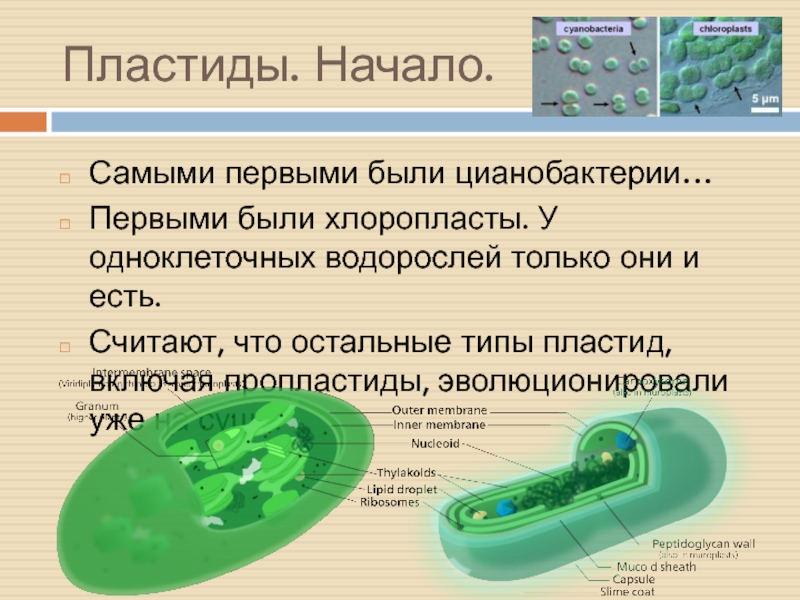
Слайд 28Пластиды. Начало.
Самыми первыми были цианобактерии…
Первыми были хлоропласты. У одноклеточных водорослей
только они и есть.
Считают, что остальные типы пластид, включая пропластиды,
эволюционировали уже на суше.
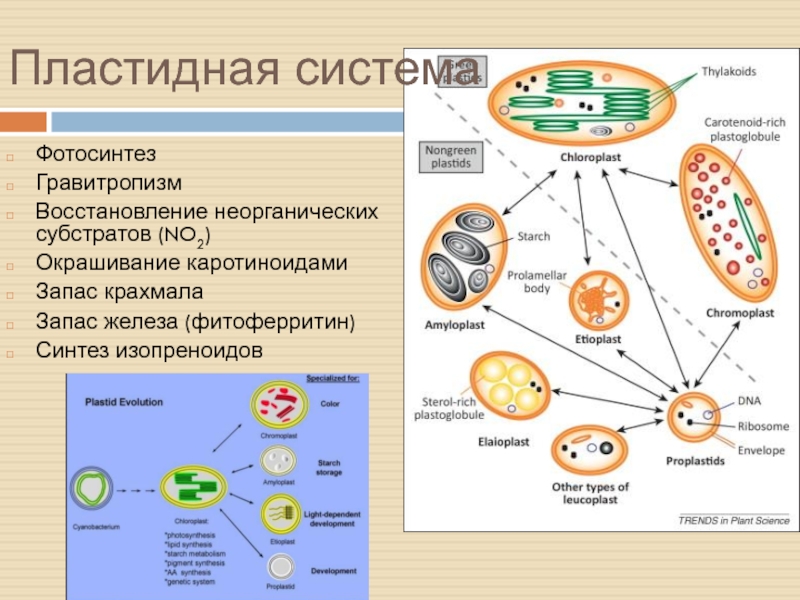
Слайд 29Фотосинтез
Гравитропизм
Восстановление неорганических субстратов (NO2)
Окрашивание каротиноидами
Запас крахмала
Запас железа (фитоферритин)
Синтез изопреноидов
Пластидная
система
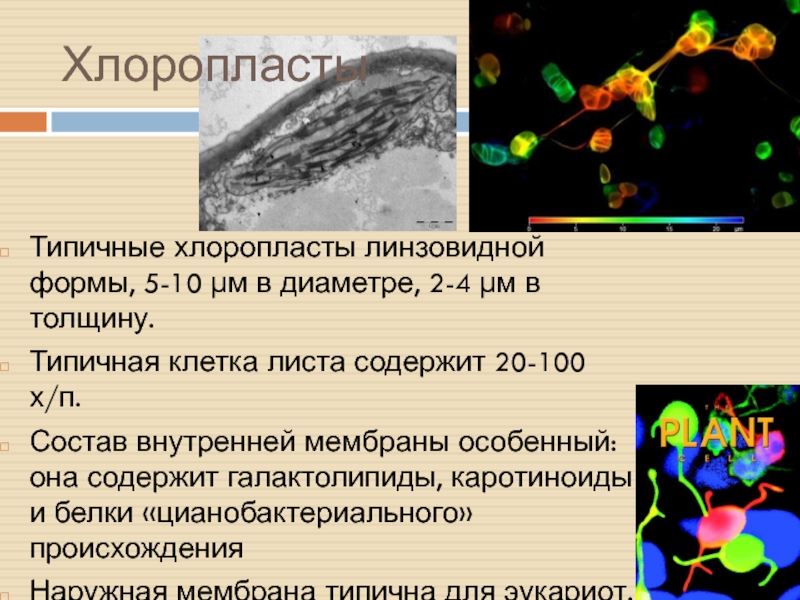
Слайд 30Хлоропласты
Типичные хлоропласты линзовидной формы, 5-10 µм в диаметре, 2-4 µм
в толщину.
Типичная клетка листа содержит 20-100 х/п.
Состав внутренней мембраны особенный:
она содержит галактолипиды, каротиноиды и белки «цианобактериального» происхождения
Наружная мембрана типична для эукариот.
Стромули – выросты, соединяющие соседние пластиды.
Слайд 31Хлоропласты
Люмен тилакоидов образует единое пространство, топологически эквивалентное ММП
Тилакоиды собираются в
граны
ФС II локализуется в местах стэкинга, ФС I – на
краях тилакоидов, обращённых к строме
Пластоглобулы – запасы липидов и белков
Строма содержит примерно 50% хлоропластных белков, а также пластоглобулы, ДНК и рибосомы
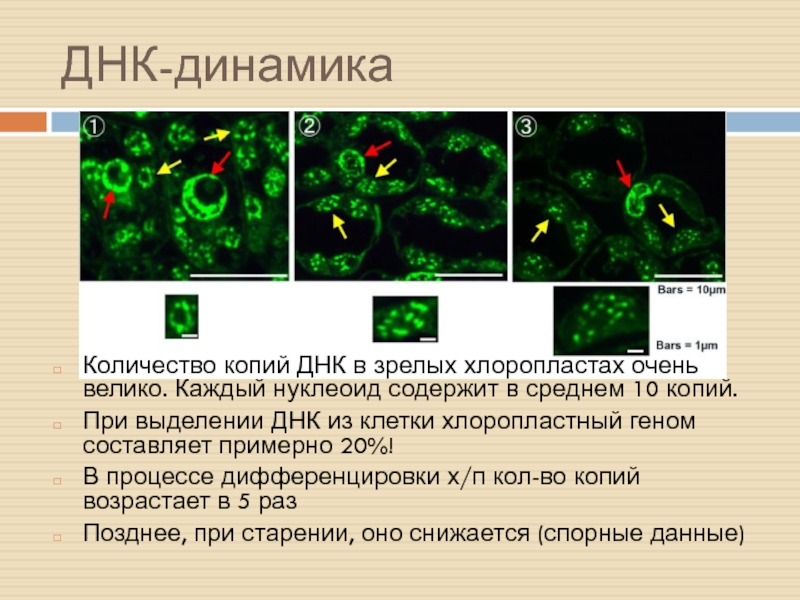
Слайд 32ДНК-динамика
Количество копий ДНК в зрелых хлоропластах очень велико. Каждый нуклеоид
содержит в среднем 10 копий.
При выделении ДНК из клетки хлоропластный
геном составляет примерно 20%!
В процессе дифференцировки х/п кол-во копий возрастает в 5 раз
Позднее, при старении, оно снижается (спорные данные)
Слайд 33Ещё немного о РНК-полимеразах
Начало дифференцировки пропластиды в хлоропласт сопровождается активацией
ядерной РНК-полимеразы (NEP)
Она запускает транскрипцию генов пластидной РНК-полимеразы (PEP), а
также генов домашнего хозяйства
Таким образом, машина белкового синтеза в х/п готова
Далее на свету при максимальной активности PEP синтезируются белки фотосистем и идёт сборка комплексов.
После того, как за дело взялась PEP, регуляция транскрипции осуществляется с участием сигма-факторов (SIG). Их как минимум 6, и без них дифференцировка пластид не завершается, листья остаются бледными.
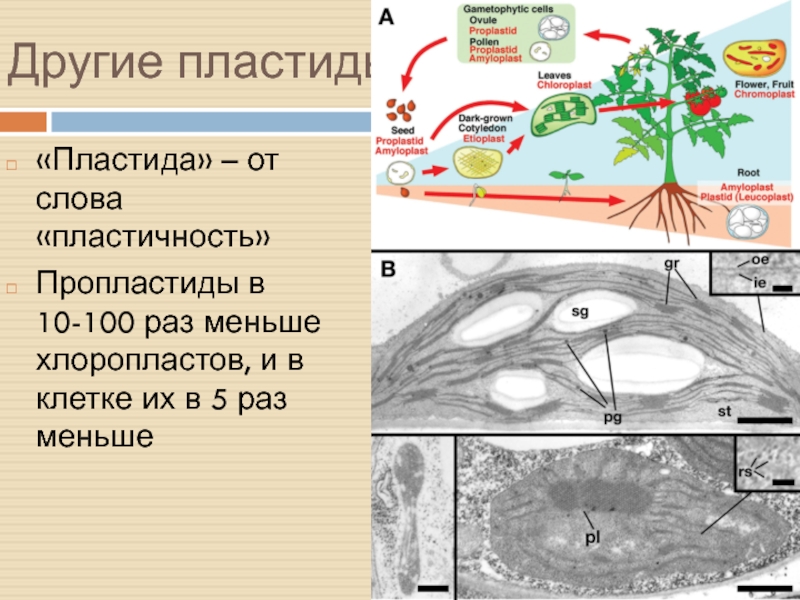
Слайд 34Другие пластиды
«Пластида» – от слова «пластичность»
Пропластиды в 10-100 раз меньше
хлоропластов, и в клетке их в 5 раз меньше
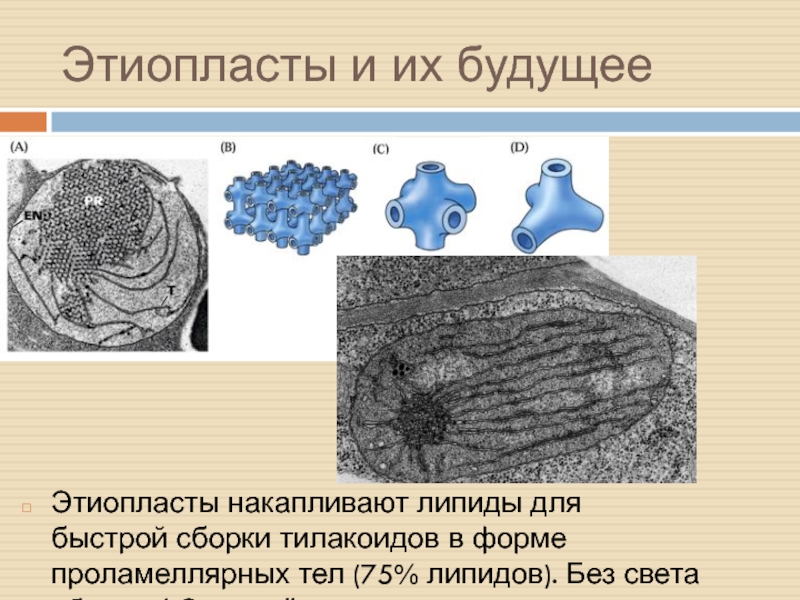
Слайд 35Этиопласты и их будущее
Этиопласты накапливают липиды для быстрой сборки тилакоидов
в форме проламеллярных тел (75% липидов). Без света сборка ФС
не идёт.
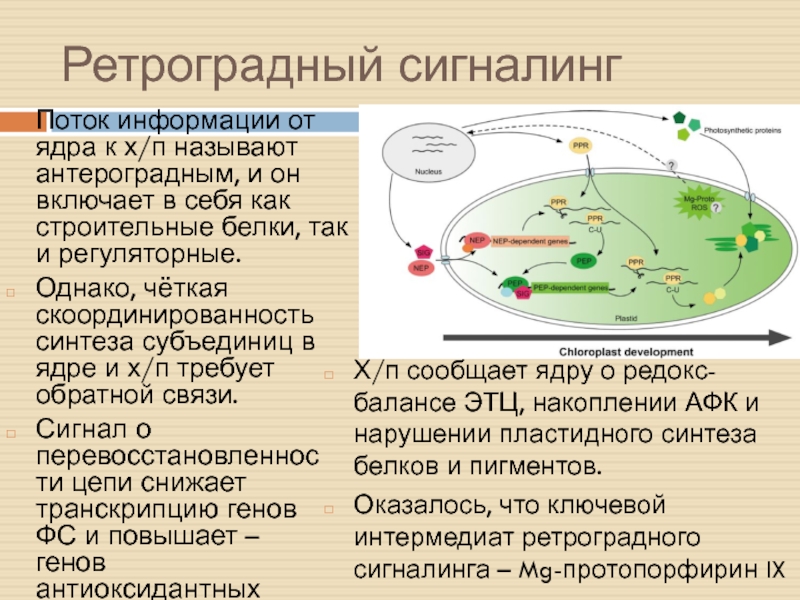
Слайд 37Ретроградный сигналинг
Поток информации от ядра к х/п называют антероградным, и
он включает в себя как строительные белки, так и регуляторные.
Однако,
чёткая скоординированность синтеза субъединиц в ядре и х/п требует обратной связи.
Х/п сообщает ядру о редокс-балансе ЭТЦ, накоплении АФК и нарушении пластидного синтеза белков и пигментов.
Оказалось, что ключевой интермедиат ретроградного сигналинга – Mg-протопорфирин IX
Сигнал о перевосстановленности цепи снижает транскрипцию генов ФС и повышает – генов антиоксидантных систем
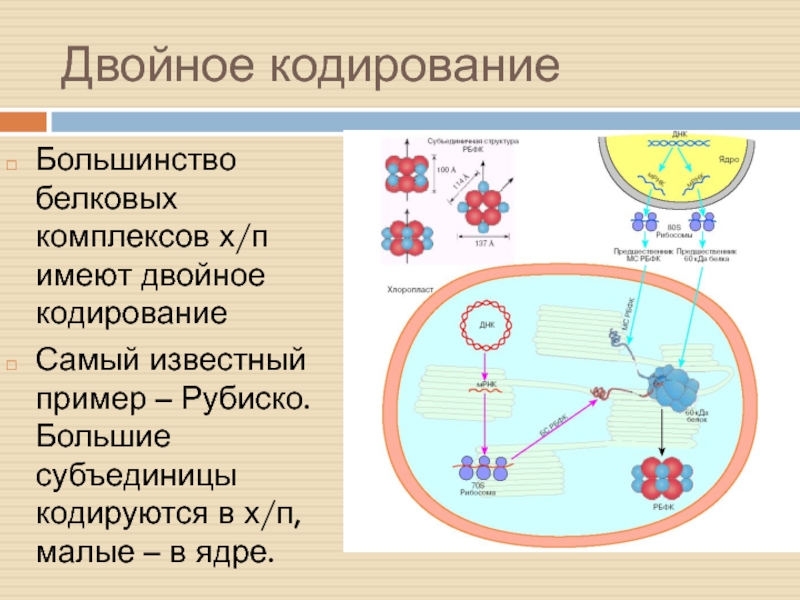
Слайд 38Двойное кодирование
Большинство белковых комплексов х/п имеют двойное кодирование
Самый известный пример
– Рубиско. Большие субъединицы кодируются в х/п, малые – в
ядре.