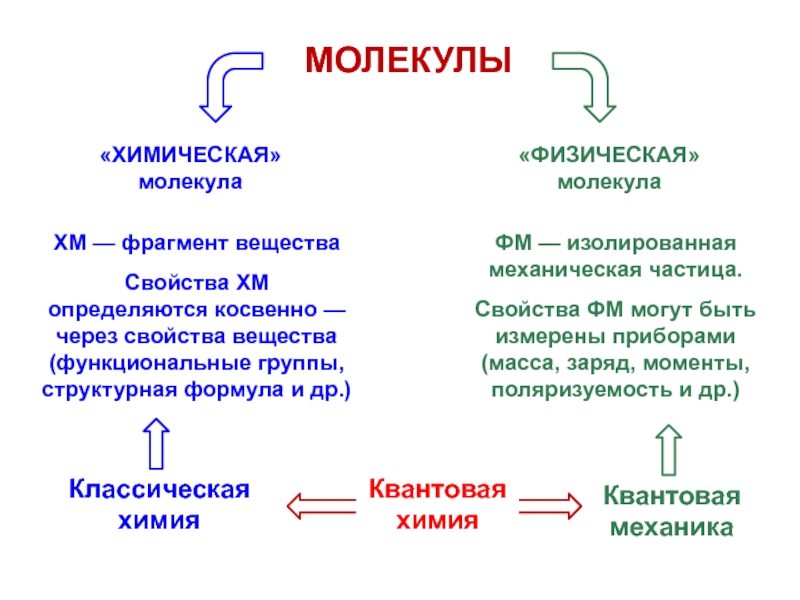
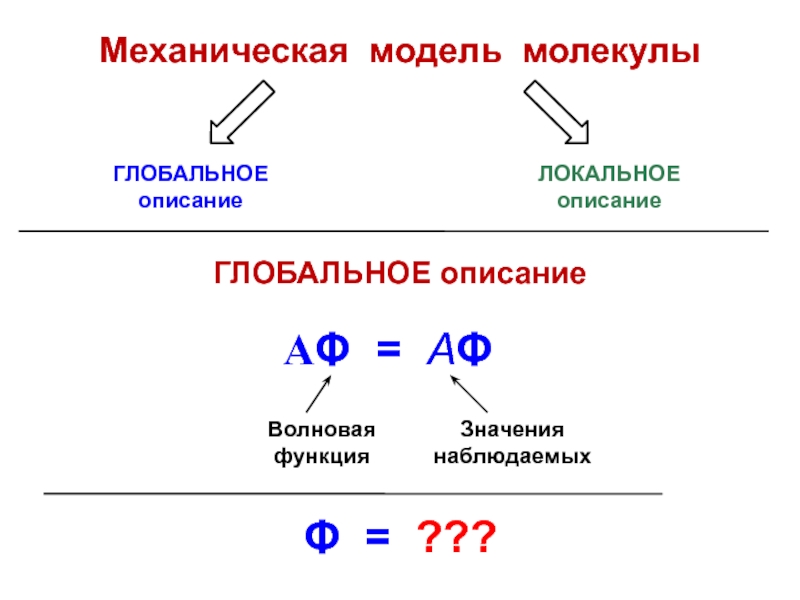
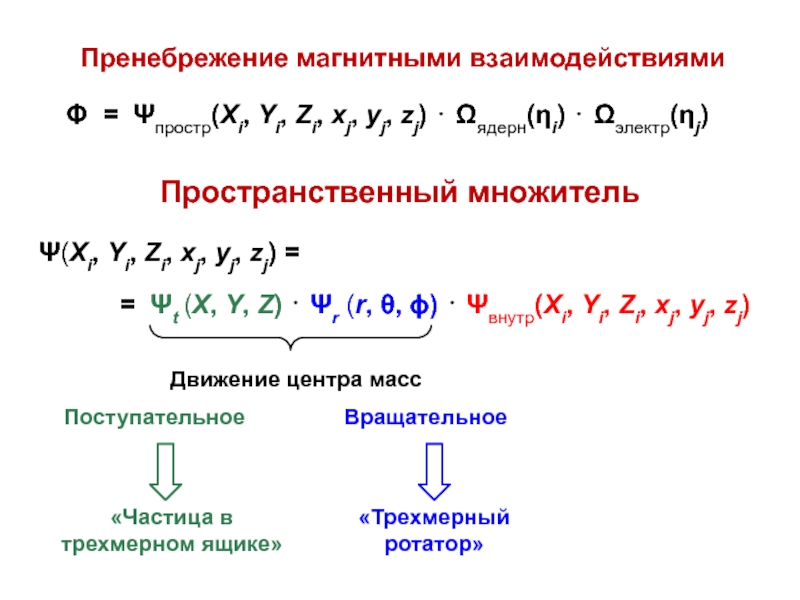
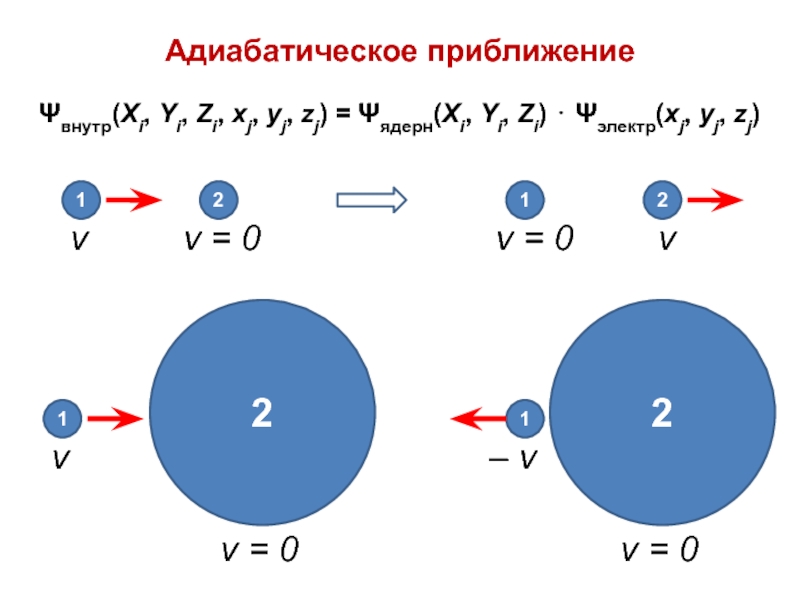
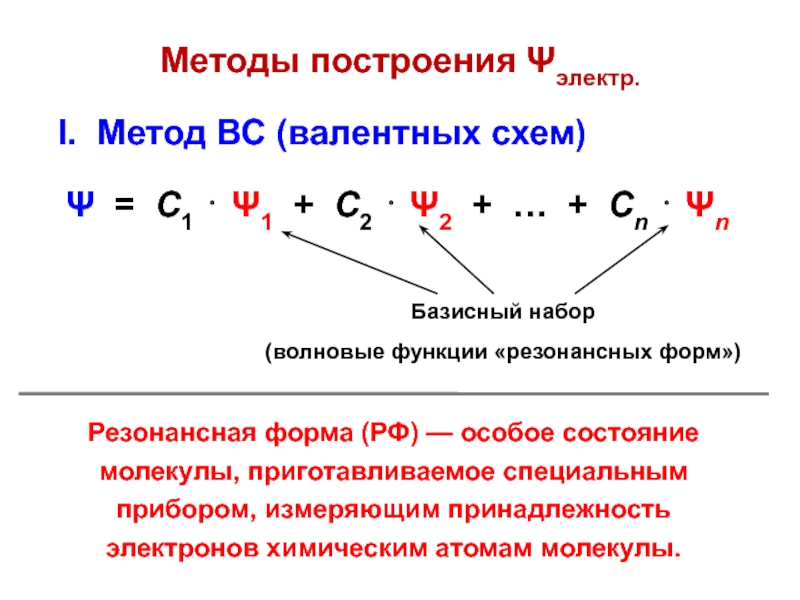
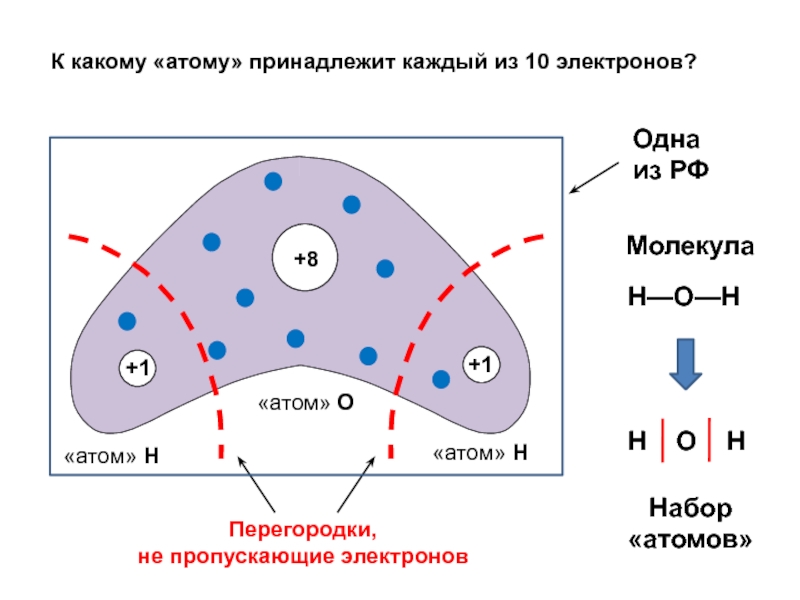
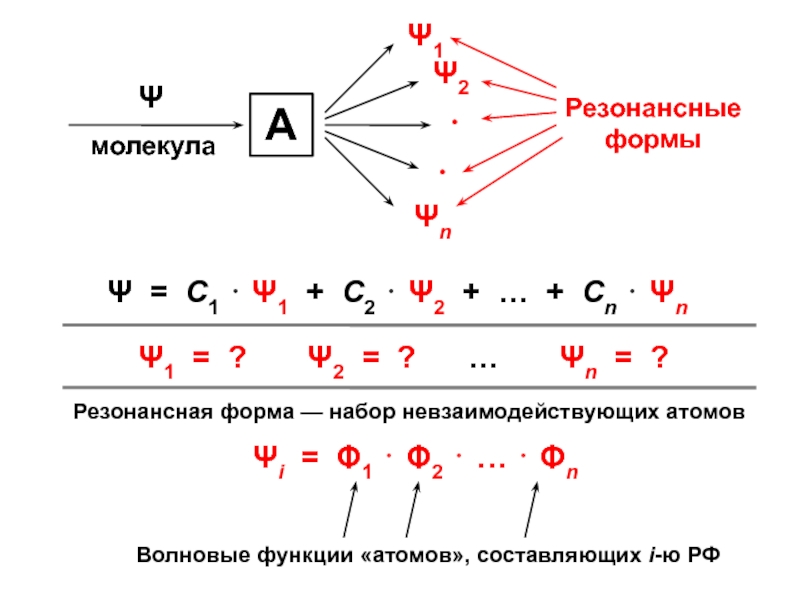
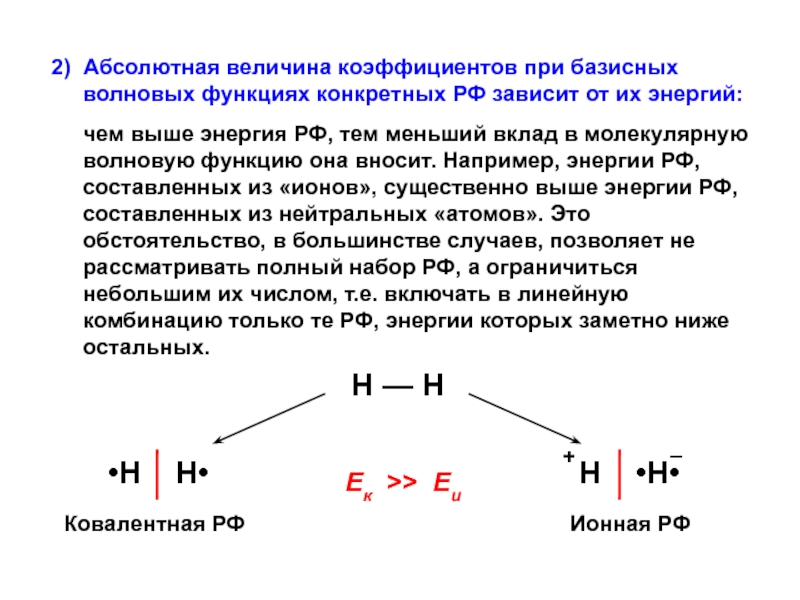
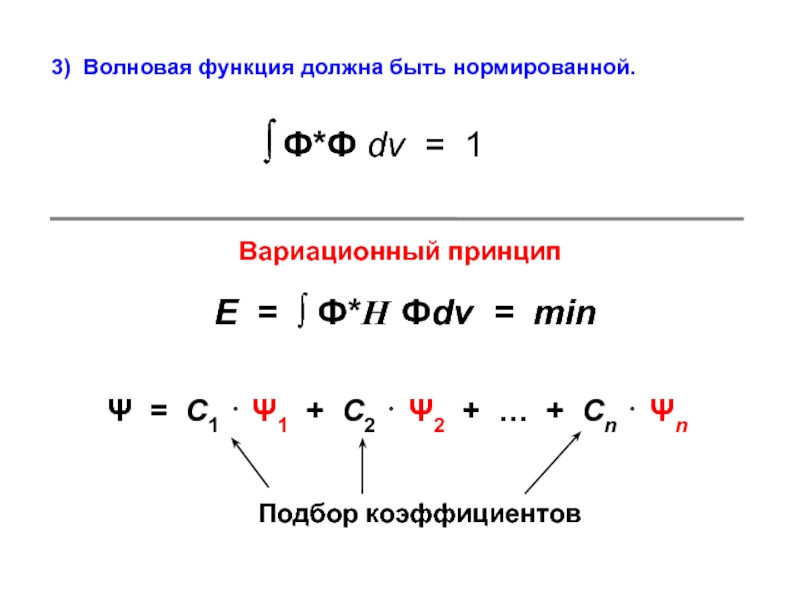
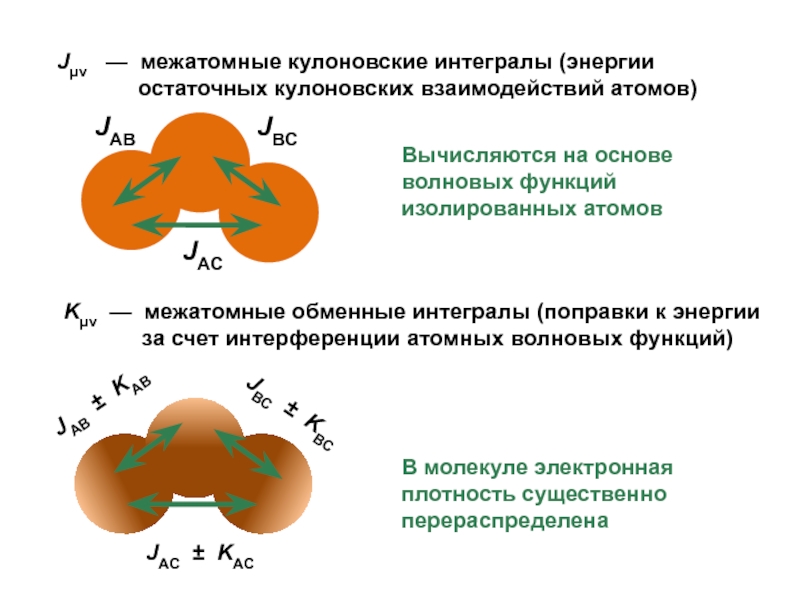
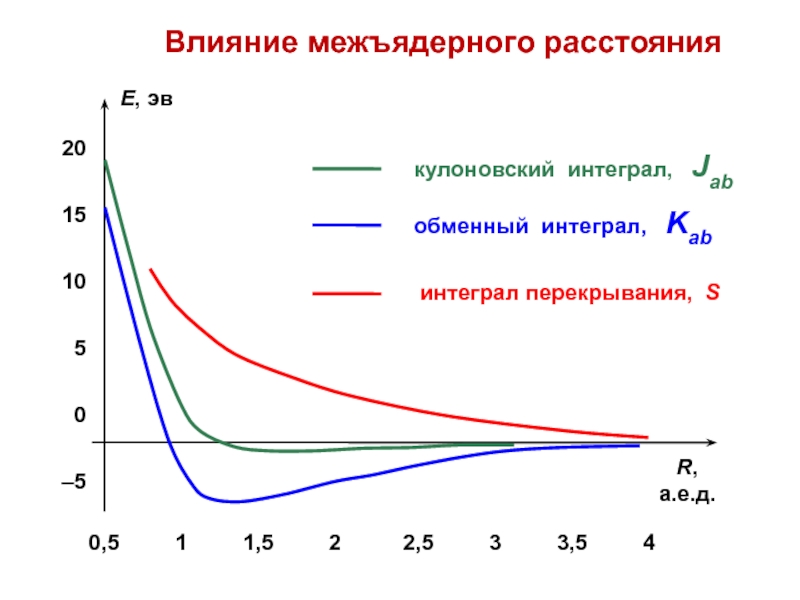
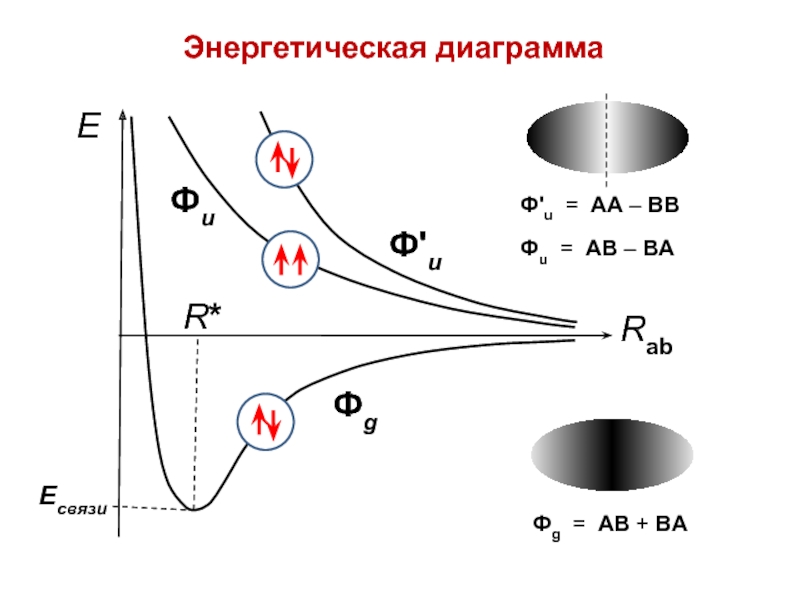
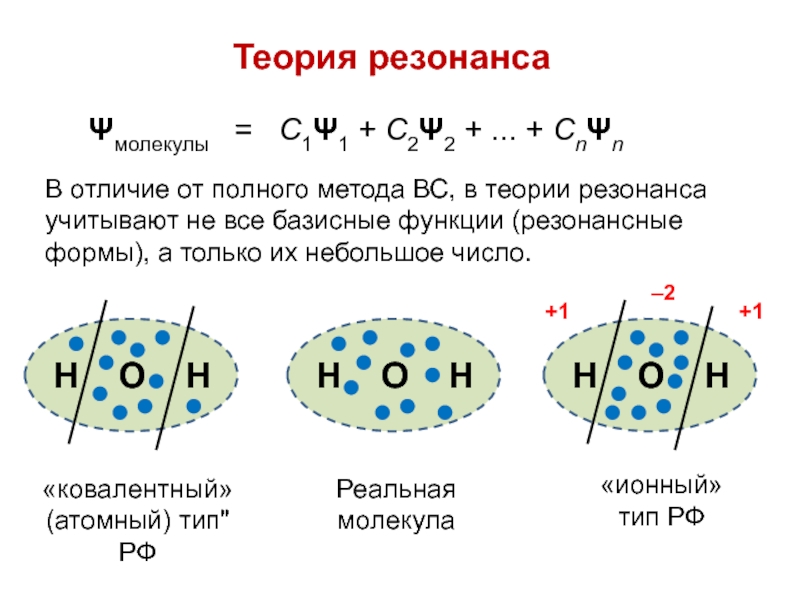
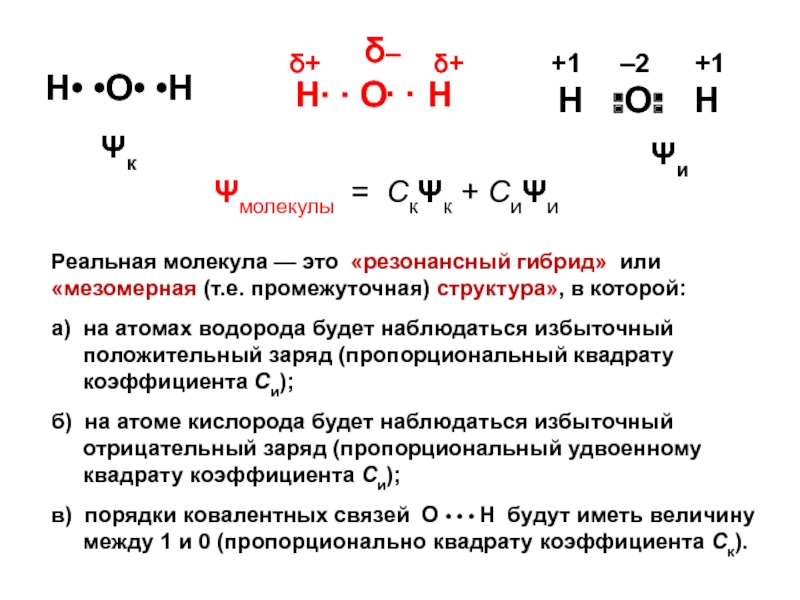
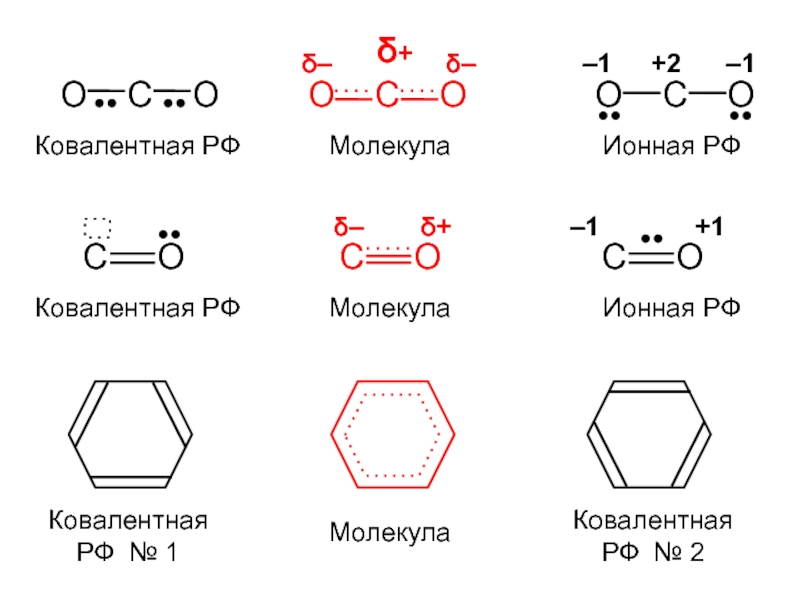
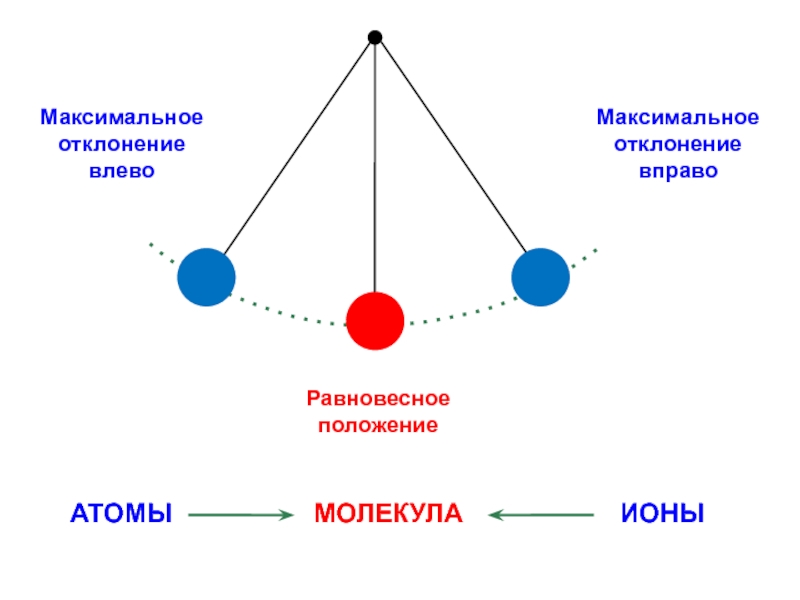
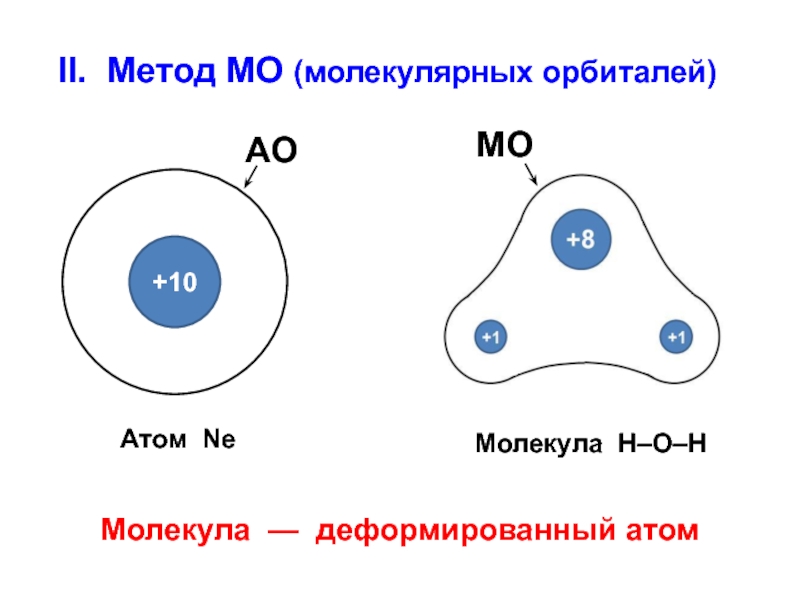
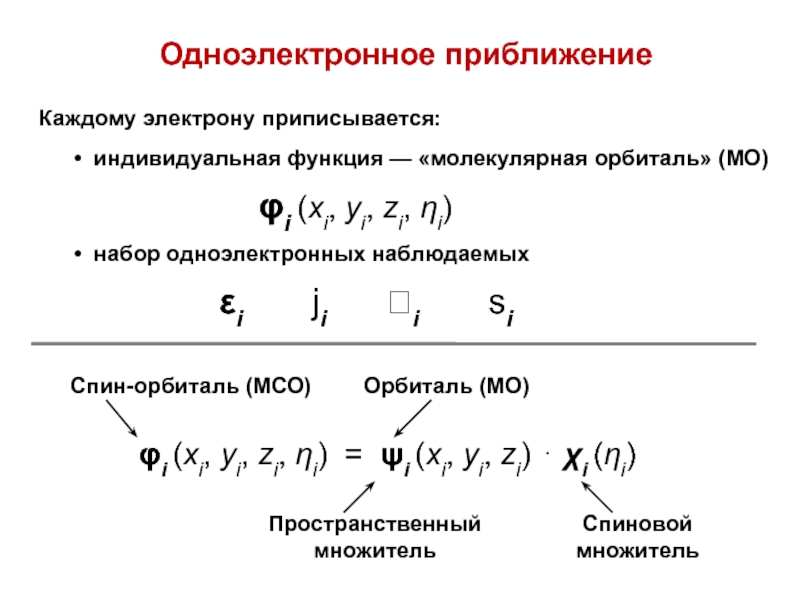
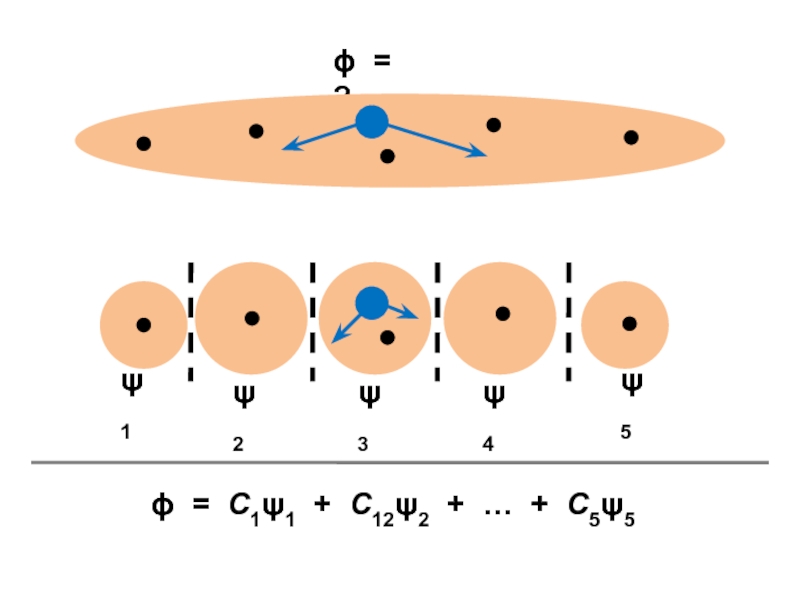
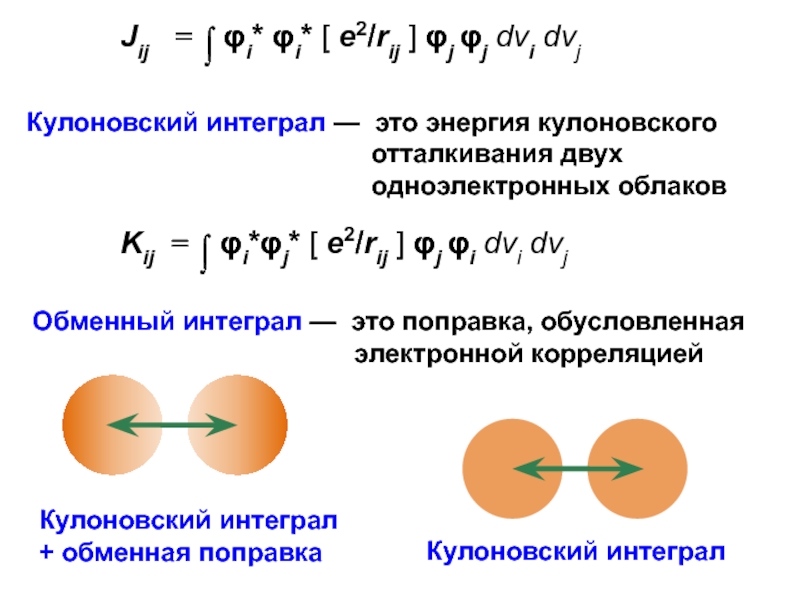
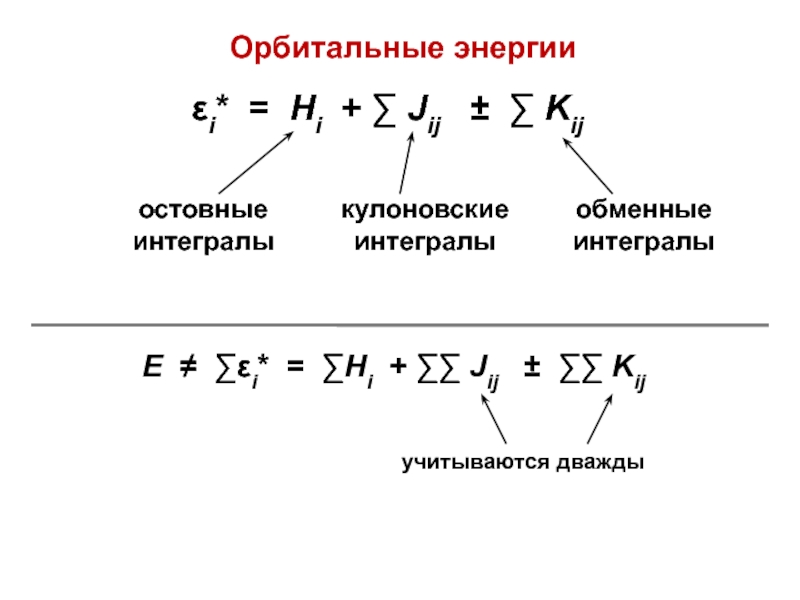
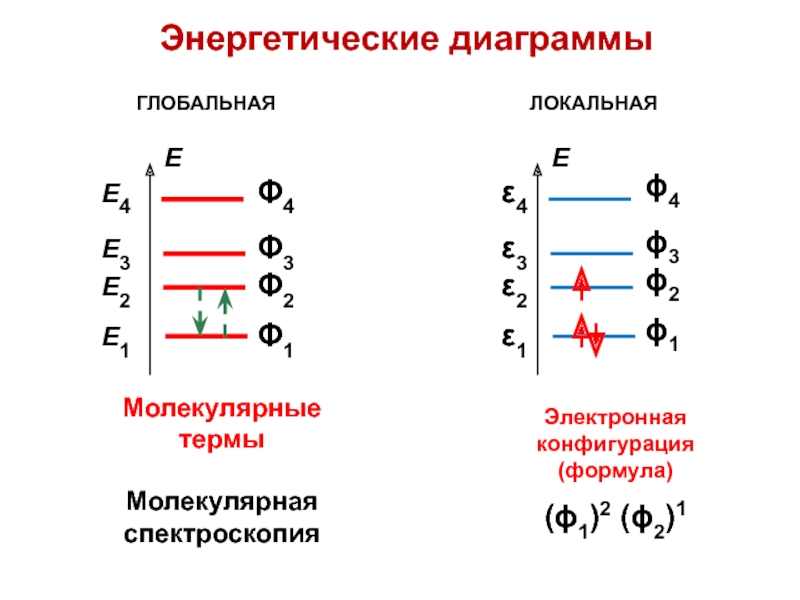
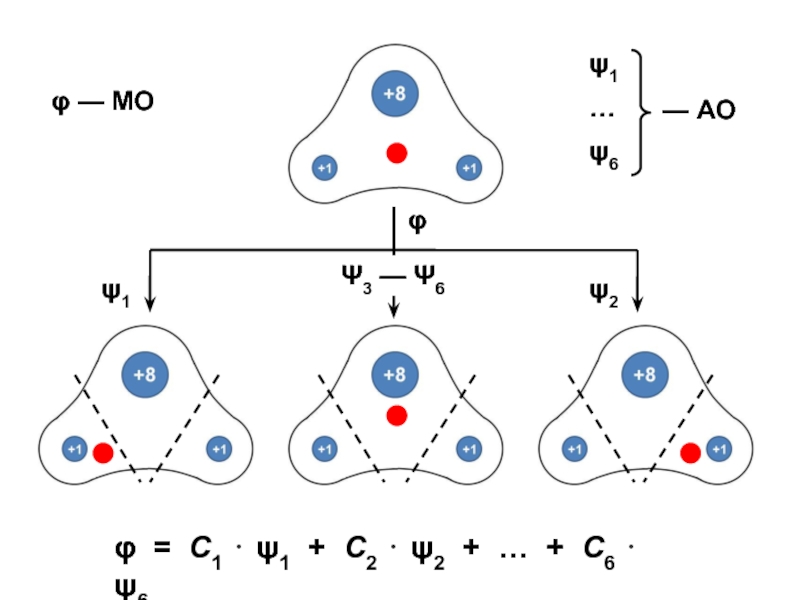
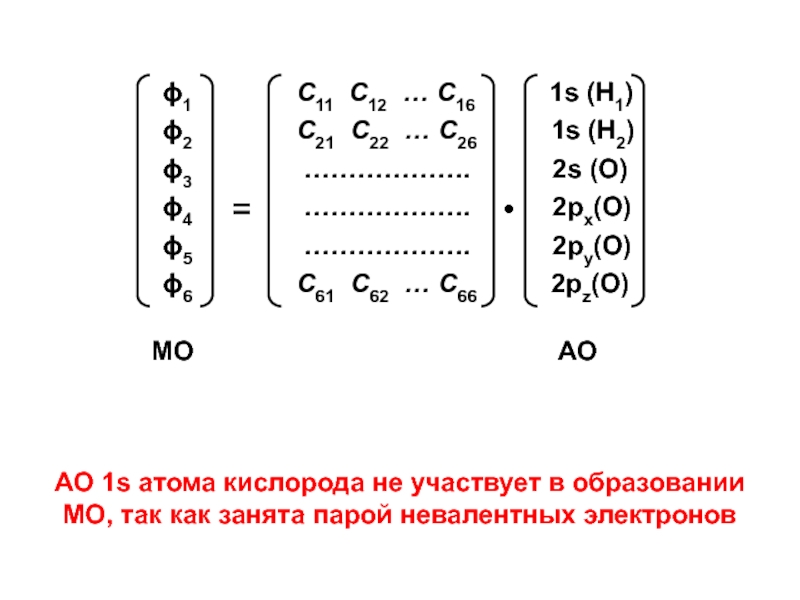
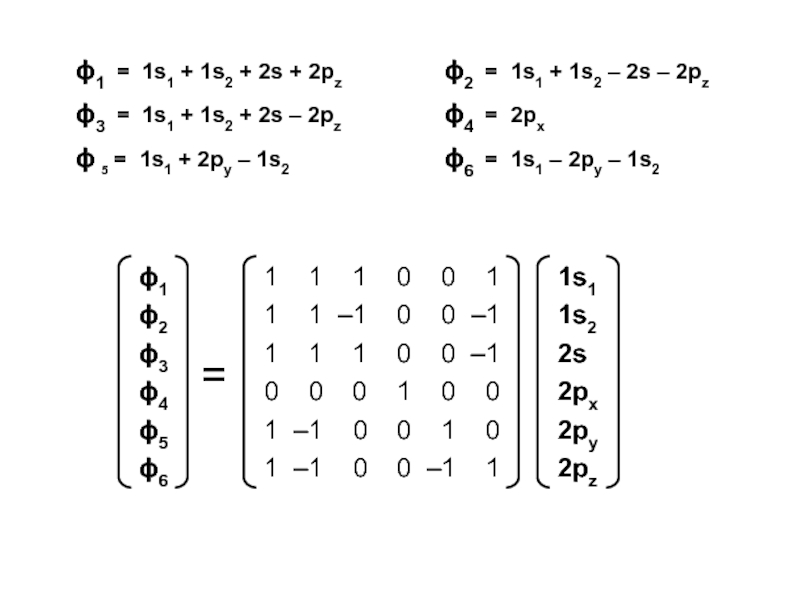
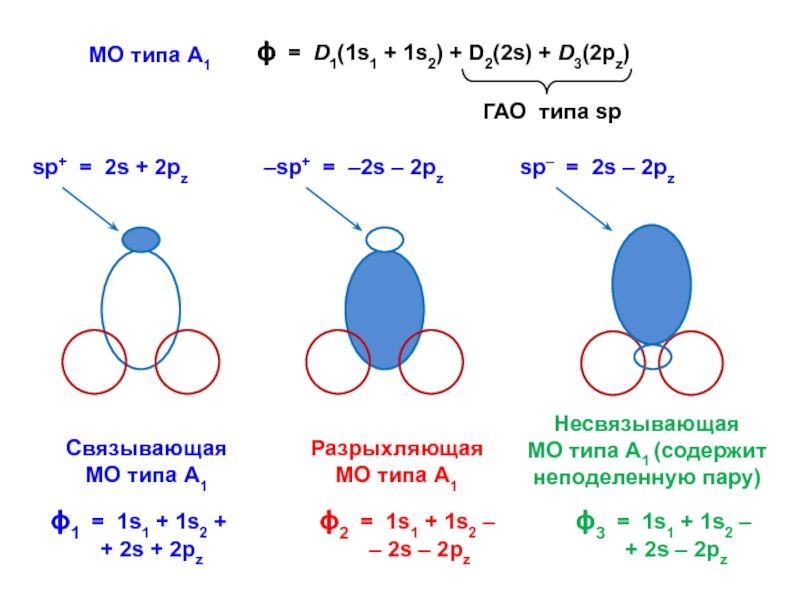
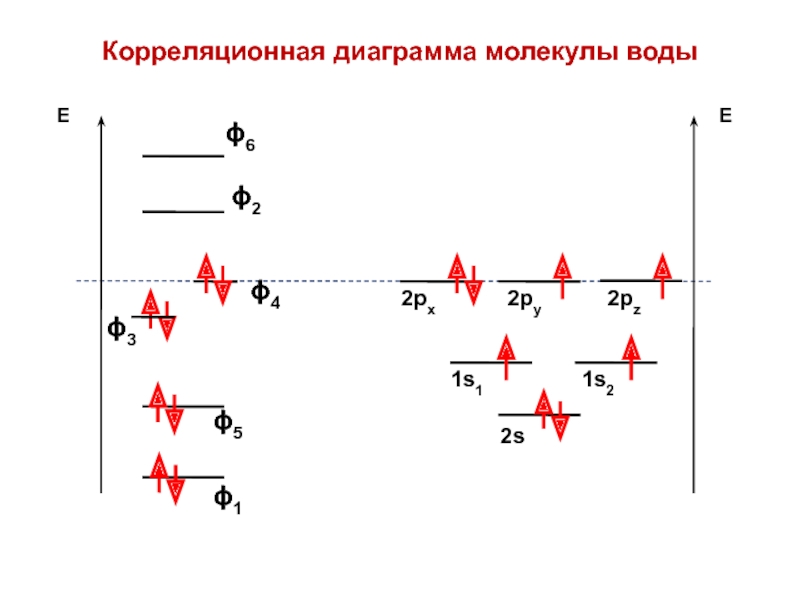
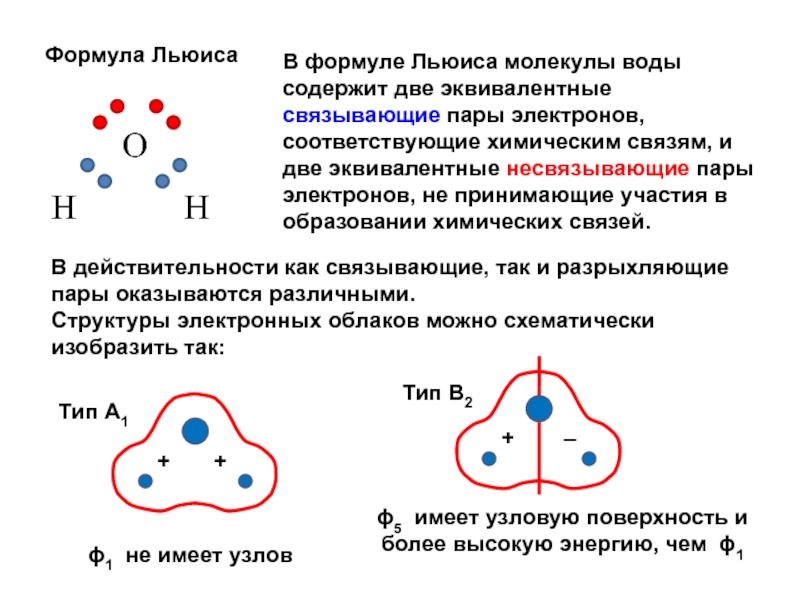
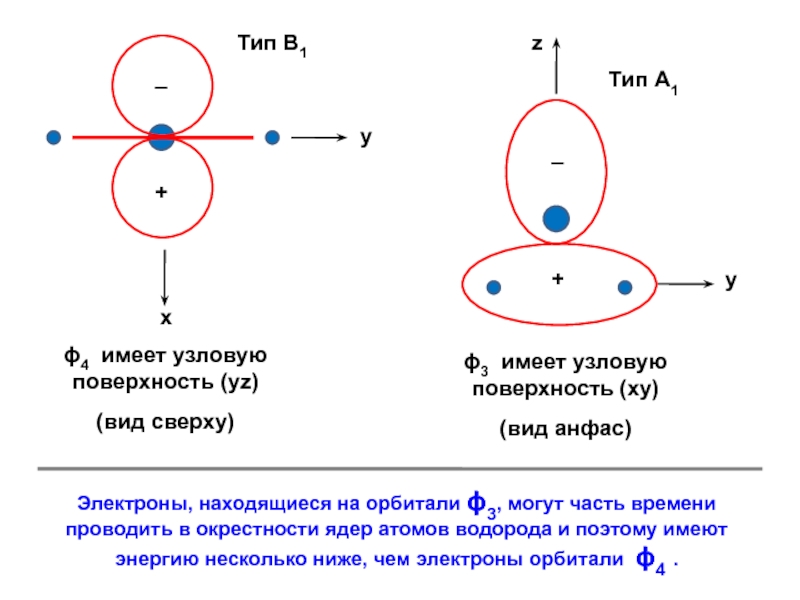
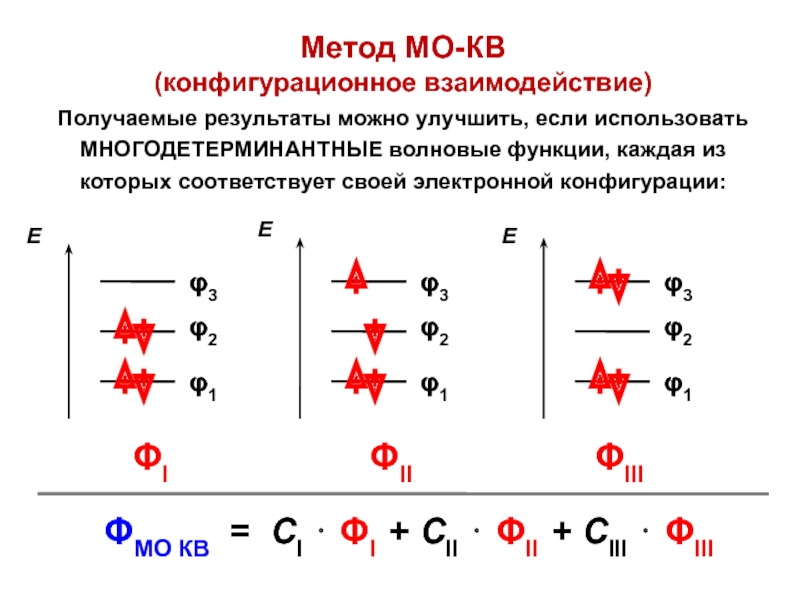
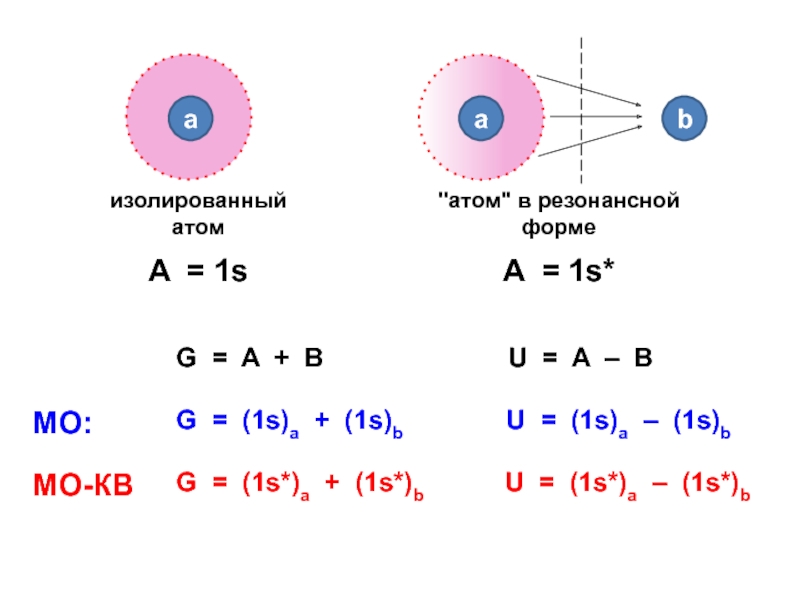
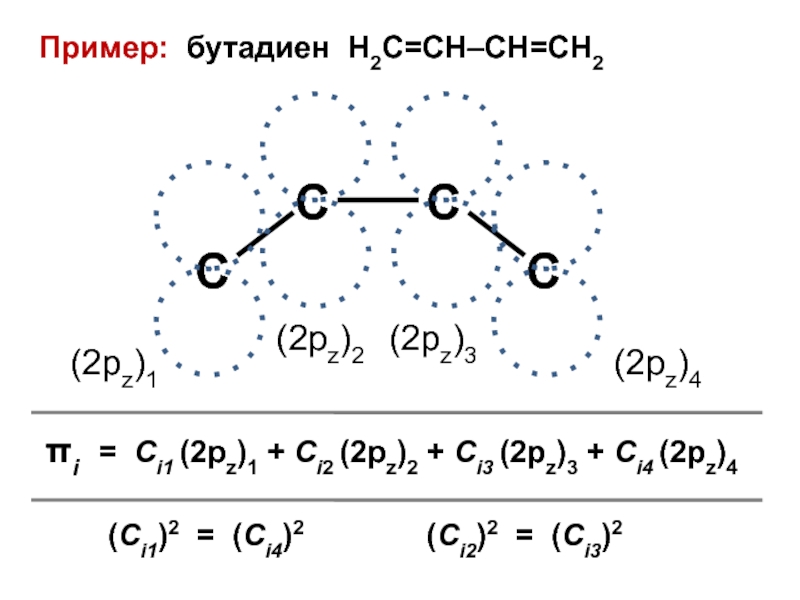
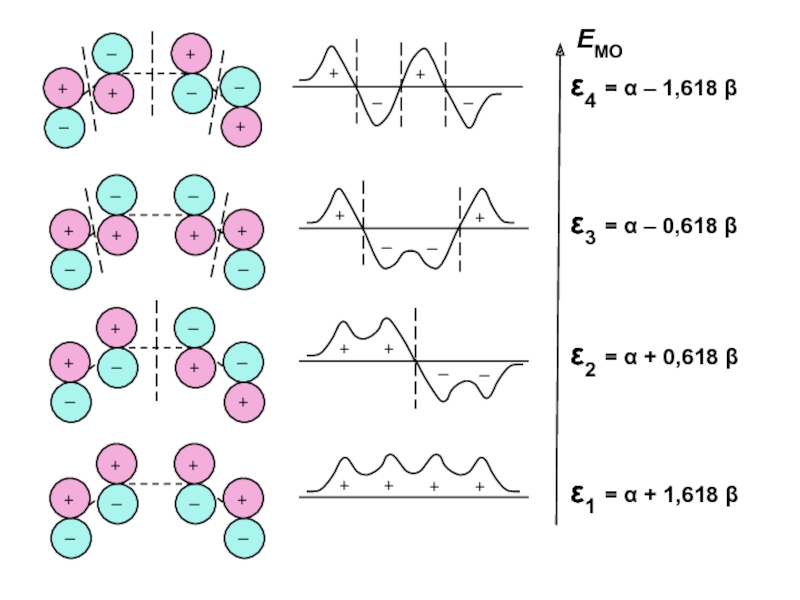
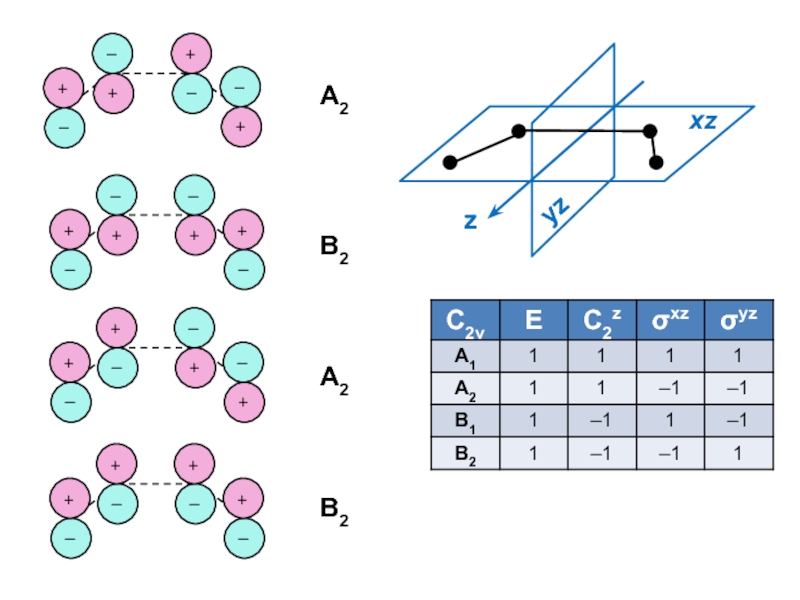
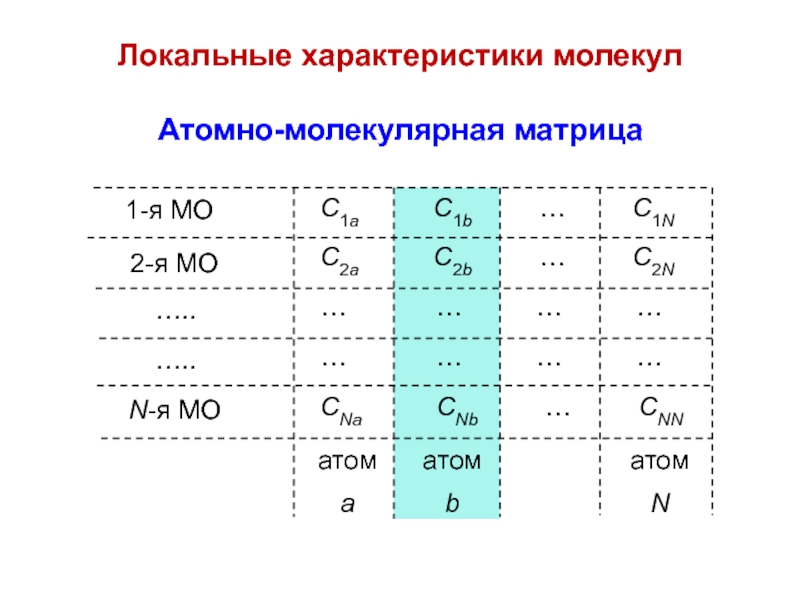
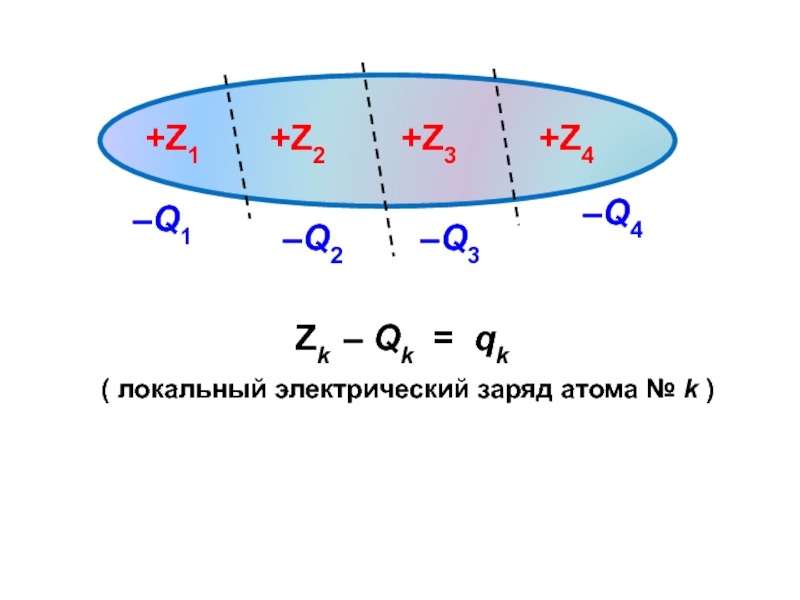
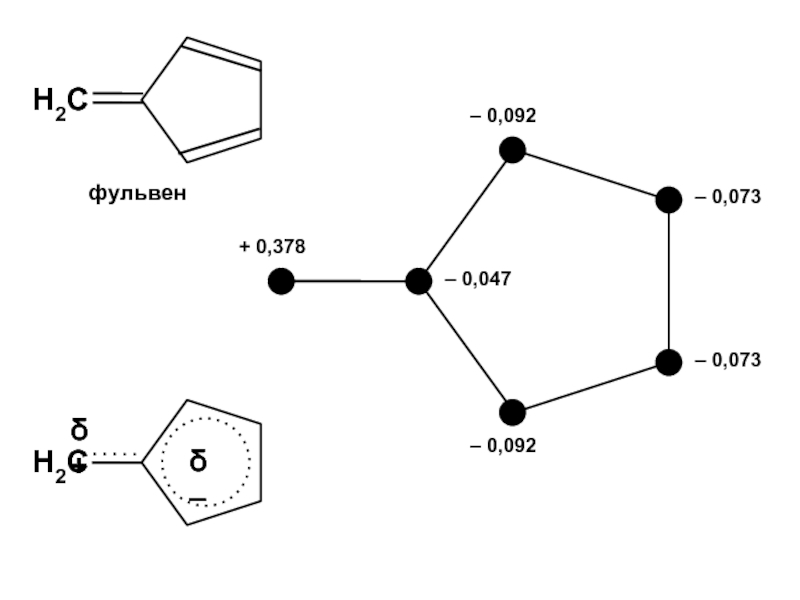
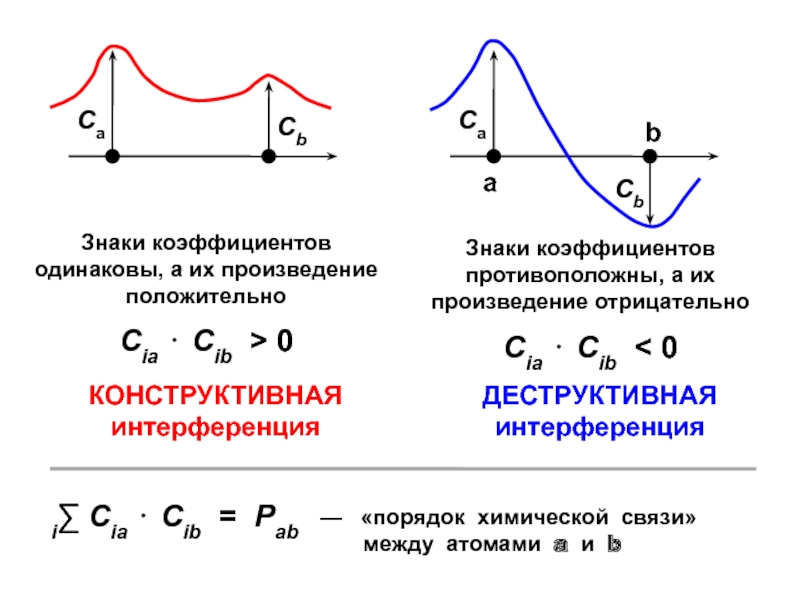
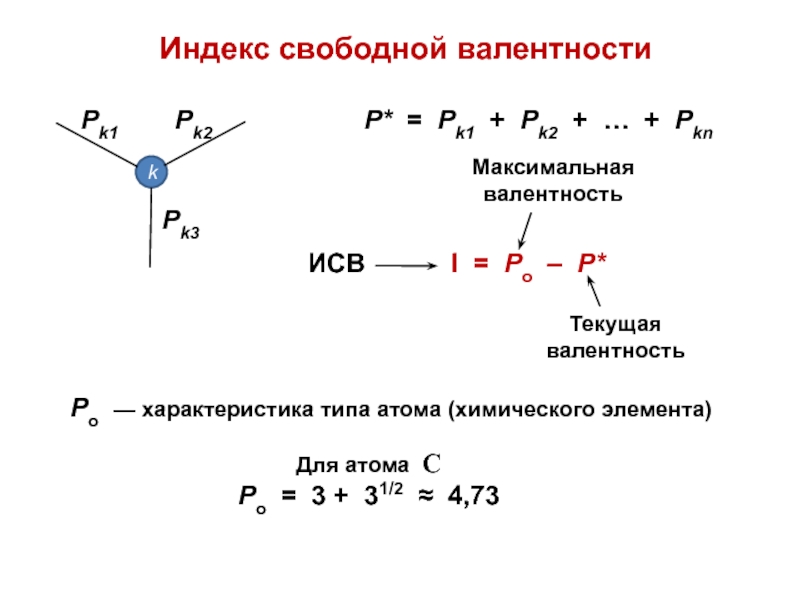
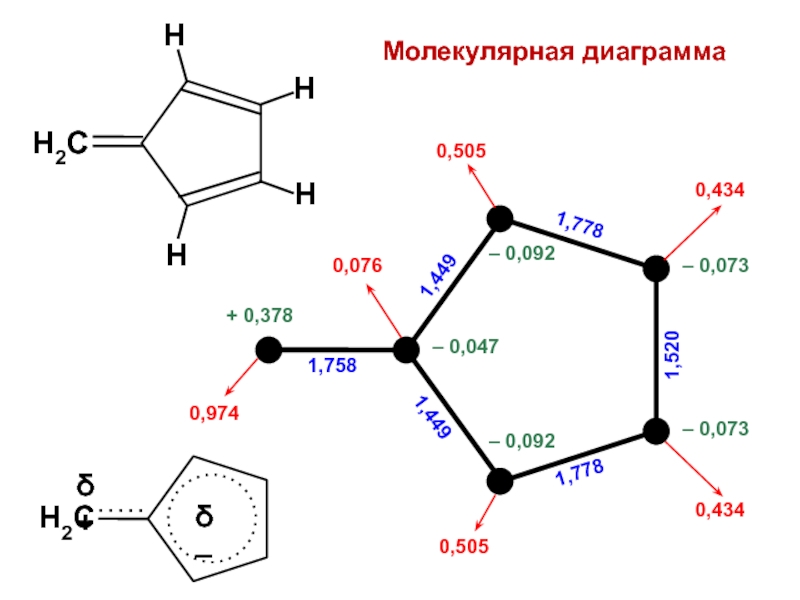
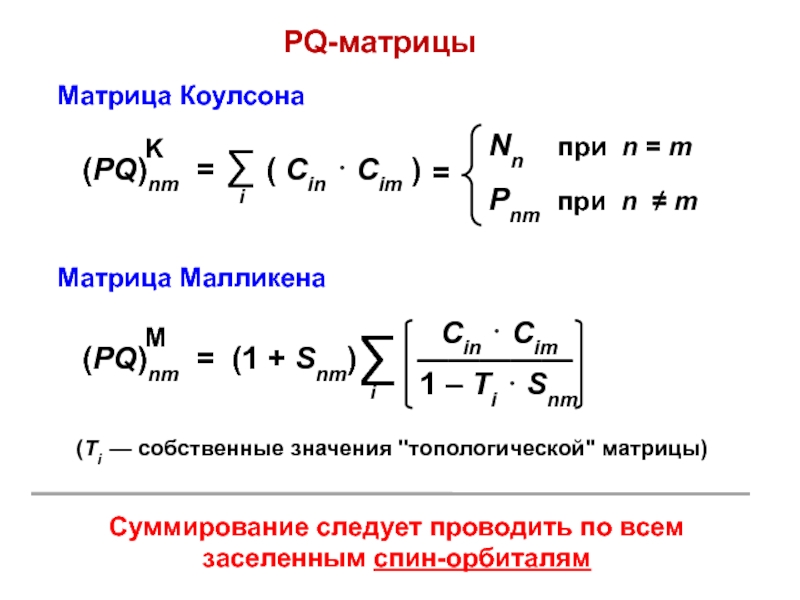
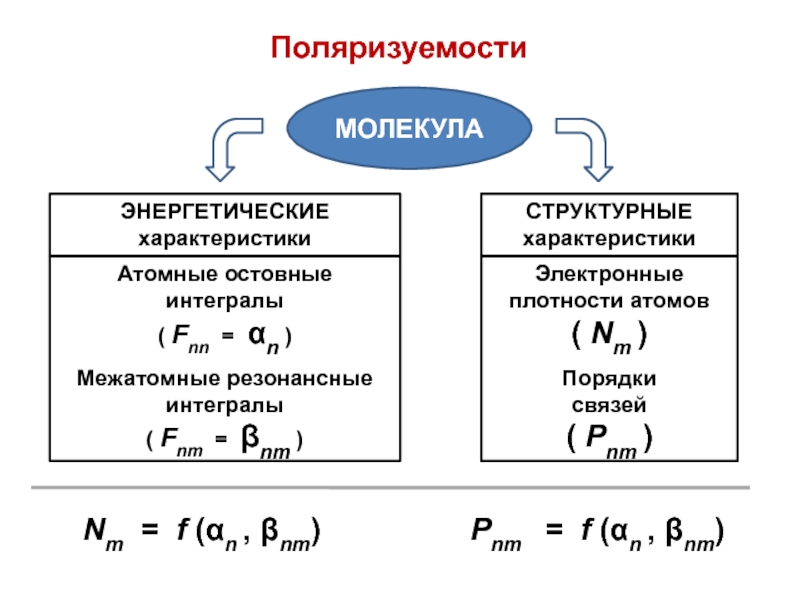
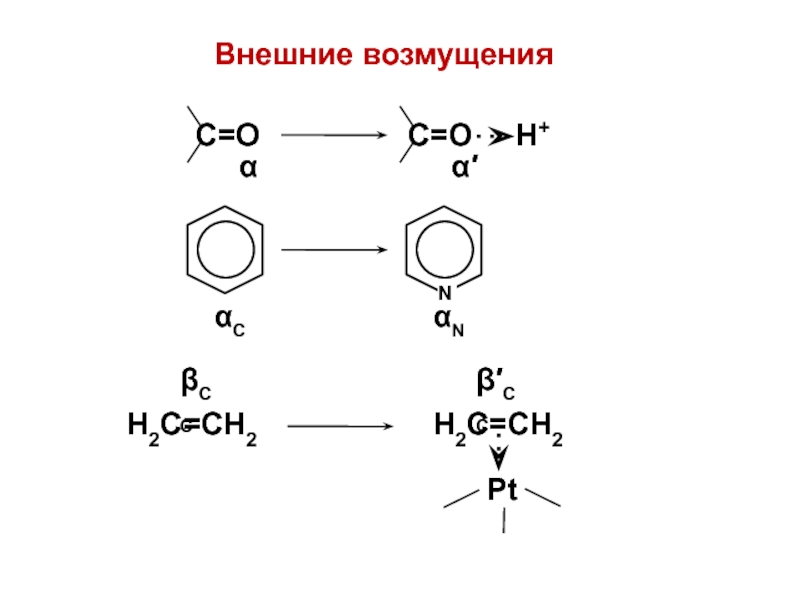
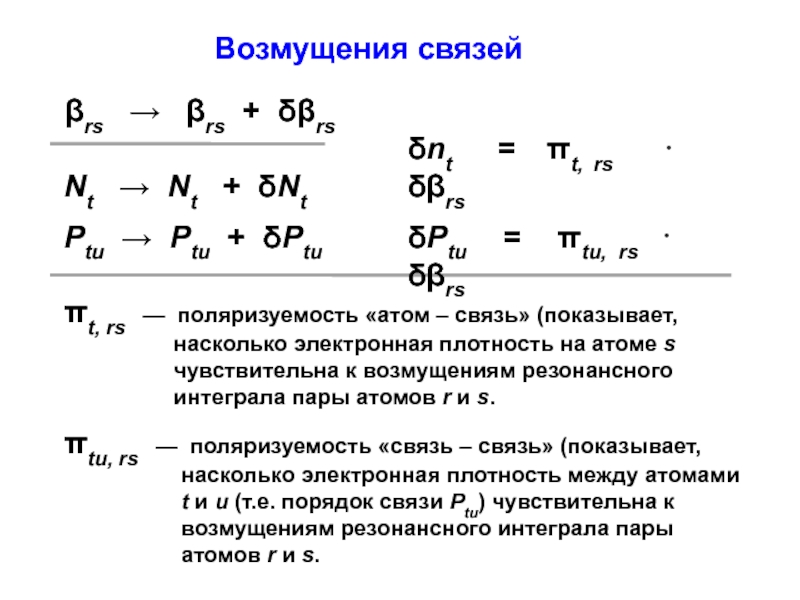
вещества (функциональные группы, структурная формула и др.)
ФМ — изолированная
механическая частица. Свойства ФМ могут быть измерены приборами
(масса, заряд, моменты, поляризуемость и др.)
Квантовая химия