Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Молекулы
Содержание
- 1. Молекулы
- 2. Вопрос 15. Молекулы. Основы физики молекул. Молекулярные
- 3. Основы физики молекул. Вращение ядер (атомных остовов).Вращательные уровниErJ0123456формулы 19
- 4. Основы физики молекул. Колебания ядер (атомных остовов).Колебательные уровни012345012345EvЛинейный гармонический осцилляторАнгармонический осцилляторформулы 19
- 5. Основы физики молекул. Виды энергии и спектры.Сплошной
- 6. Молекулярные спектры поглощенияРобертсон, Б. Современная физика в
- 7. Молекулярные спектры излученияМноголинейчатый спектр Н2Сплошной спектр Н2Серия Бальмераатомарного водорода Н
- 8. Молекулярные спектры излученияПолосатый спектр ОН (молекулы гидроксила)
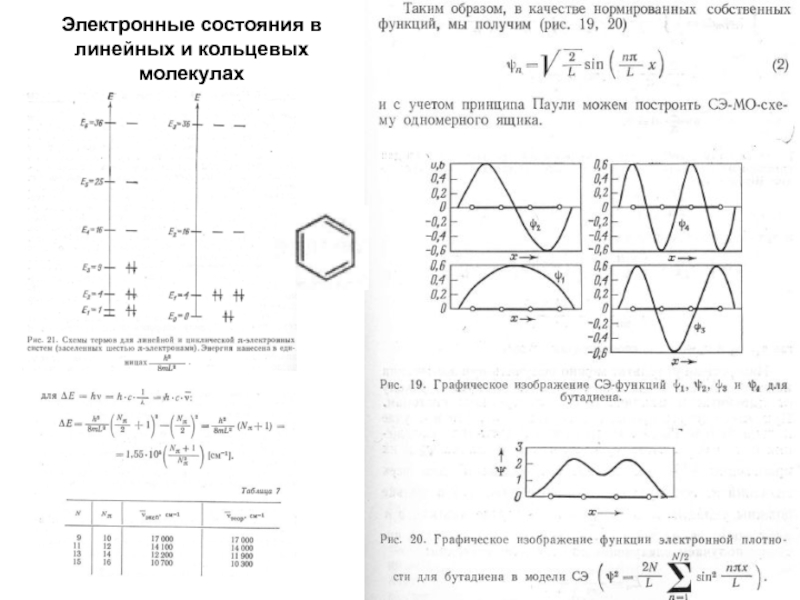
- 9. Электронные состояния в линейных и кольцевых молекулах
- 10. Основы физики молекул. Движение валентных электронов.Движение электронов
- 11. Адиабатическое приближение:В молекуле можно считать движение тяжелых
- 12. Адиабатическое приближение:В молекуле можно считать движение тяжелых
- 13. Адиабатическое приближение:В молекуле можно считать движение тяжелых
- 14. Адиабатическое приближение:Примеры энергий и плотностей вероятности для
- 15. Пример 2-х центровой модели для молекулы:АОобъединенногоядраПримеры энергий
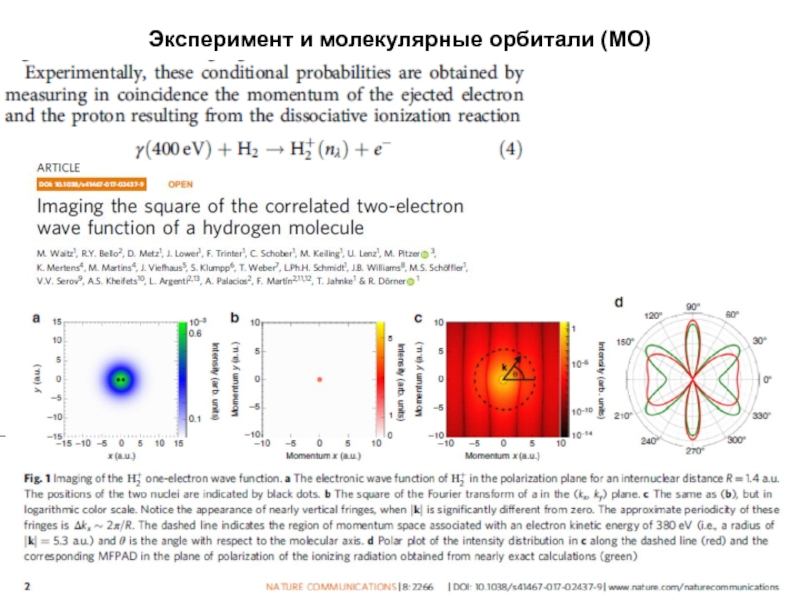
- 16. Эксперимент и молекулярные орбитали (МО)
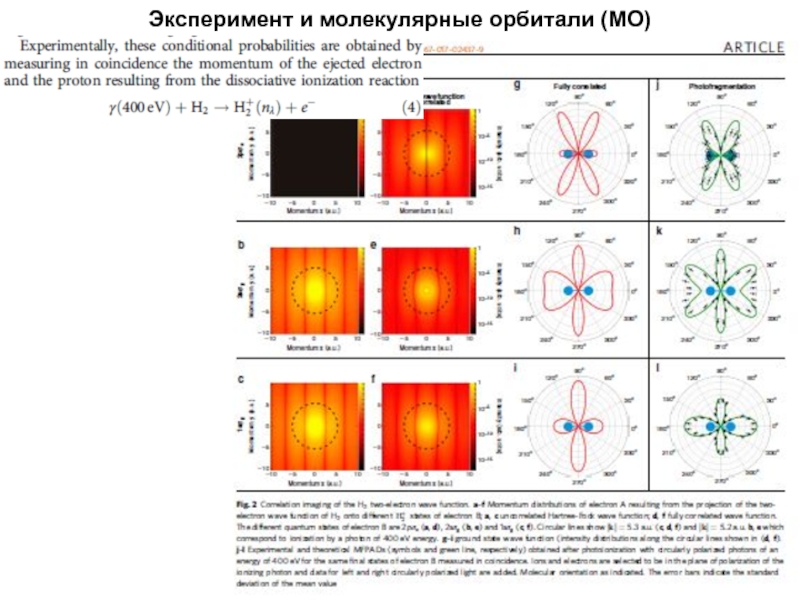
- 17. Эксперимент и молекулярные орбитали (МО)
- 18. Эксперимент и молекулярные орбитали (МО)
- 19. Адиабатическое приближение: молекулярные орбитали (МО ЛКАО)Линейные Комбинации Атомных Орбиталей++=
- 20. Адиабатическое приближение: молекулярные орбитали (МО ЛКАО)Линейные Комбинации Атомных Орбиталей=
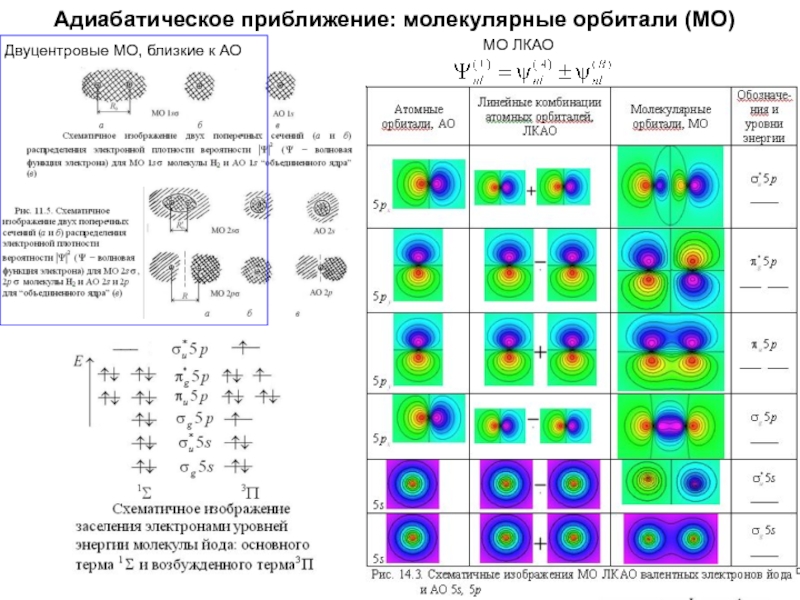
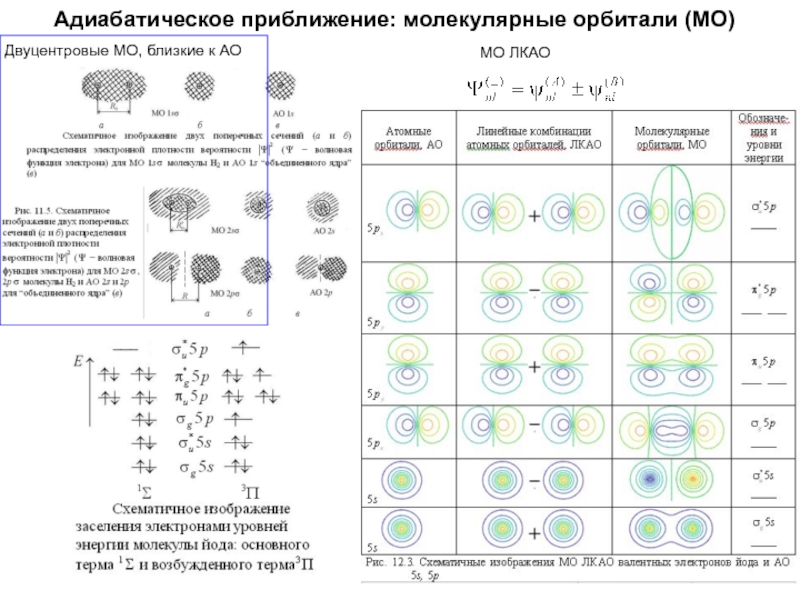
- 21. Адиабатическое приближение: молекулярные орбитали (МО)Двуцентровые МО, близкие к АОМО ЛКАО
- 22. Адиабатическое приближение: молекулярные орбитали (МО)МО ЛКАОДвуцентровые МО, близкие к АО
- 23. Термы двухатомной молекулыМолекула водорода Н2:2 валентных электронаМолекула
- 24. Типы химической связиОбразование молекул из атомов и
- 25. Типы химической связи: гомеополярная связьСилы, приводящие к
- 26. ЛитератураЛандау Л.Д. Лифшиц Е.М. Краткий курс теоретической
- 27. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Вопрос 15. Молекулы.
Основы физики молекул.
Молекулярные спектры излучения и
поглощения.
Адиабатическое приближение.
Термы двухатомной молекулы.
Типы химической связи.
Слайд 3Основы физики молекул. Вращение ядер (атомных остовов).
Вращательные
уровни
Er
J
0
1
2
3
4
5
6
формулы 19
Слайд 4Основы физики молекул. Колебания ядер (атомных остовов).
Колебательные уровни
0
1
2
3
4
5
0
1
2
3
4
5
Ev
Линейный
гармонический
осциллятор
Ангармонический
осциллятор
формулы 19
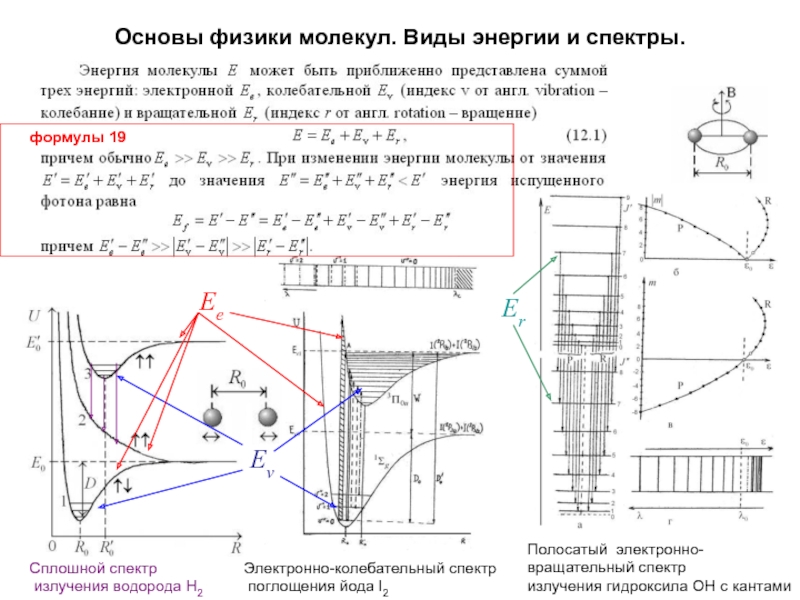
Слайд 5Основы физики молекул. Виды энергии и спектры.
Сплошной спектр
излучения водорода
Н2
Электронно-колебательный спектр
поглощения йода I2
Полосатый электронно-
вращательный спектр
излучения гидроксила ОН с
кантамиEе
Ev
Er
формулы 19
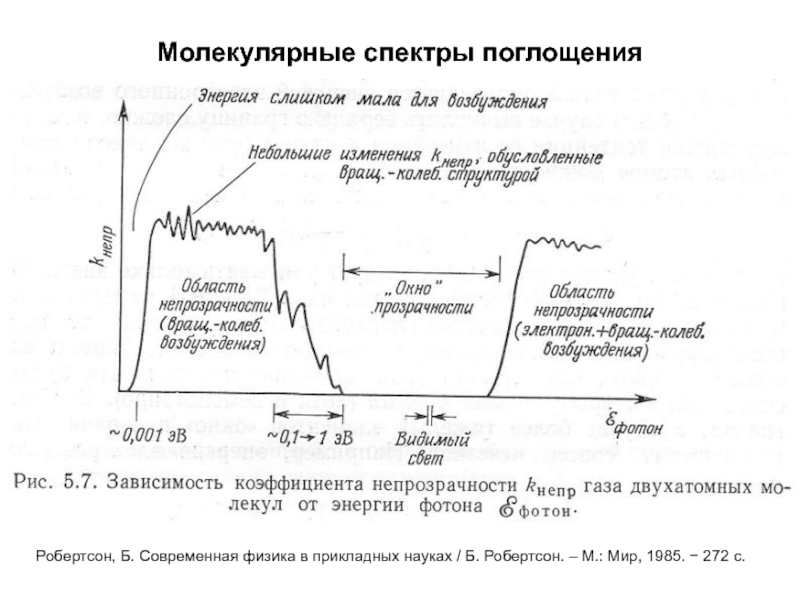
Слайд 6Молекулярные спектры поглощения
Робертсон, Б. Современная физика в прикладных науках /
Б. Робертсон. – М.: Мир, 1985. 272 с.
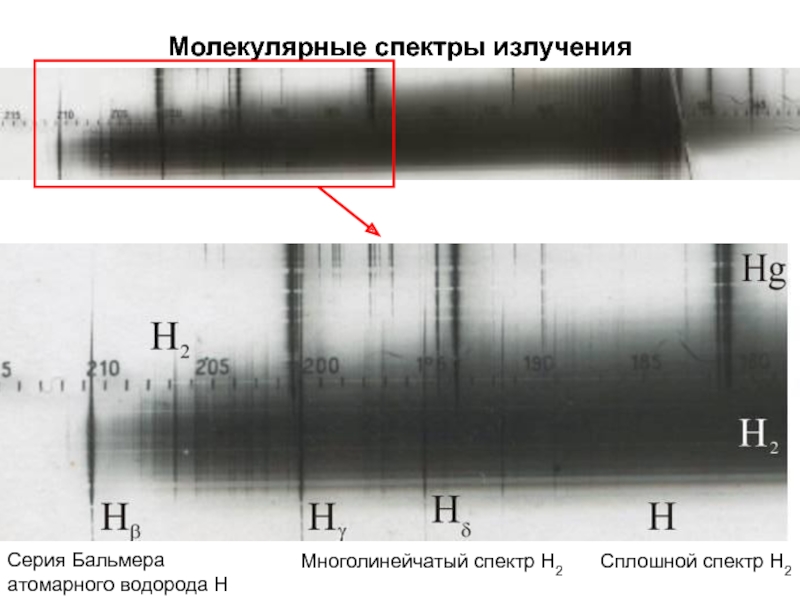
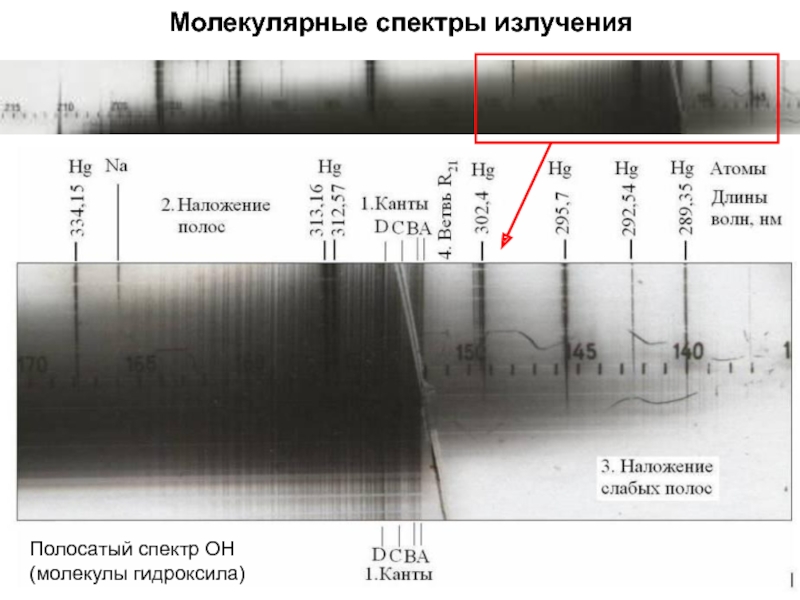
Слайд 7Молекулярные спектры излучения
Многолинейчатый спектр Н2
Сплошной спектр Н2
Серия Бальмера
атомарного водорода Н
Слайд 10Основы физики молекул. Движение валентных электронов.
Движение электронов и ядер в
молекулах можно рассматривать по отдельности из-за большой разницы в массах.
Оба электрона атомов водорода, образующих молекулу Н2, обобществляются и могут двигаться в пределах всей молекулы. Качественную картину движения одного из электронов в поле двух ядер водорода (протонов) дают классические траектории на рис. Верхняя траектория на рис. соответствует положительной проекции Mz>0 момента импульса электрона на ось молекулы ОА, вращению в противоположном направлении соответствует отрицательная проекция момента Mz<0. Нижняя траектория соответствует нулевой проекции Mz=0.Слайд 11Адиабатическое приближение:
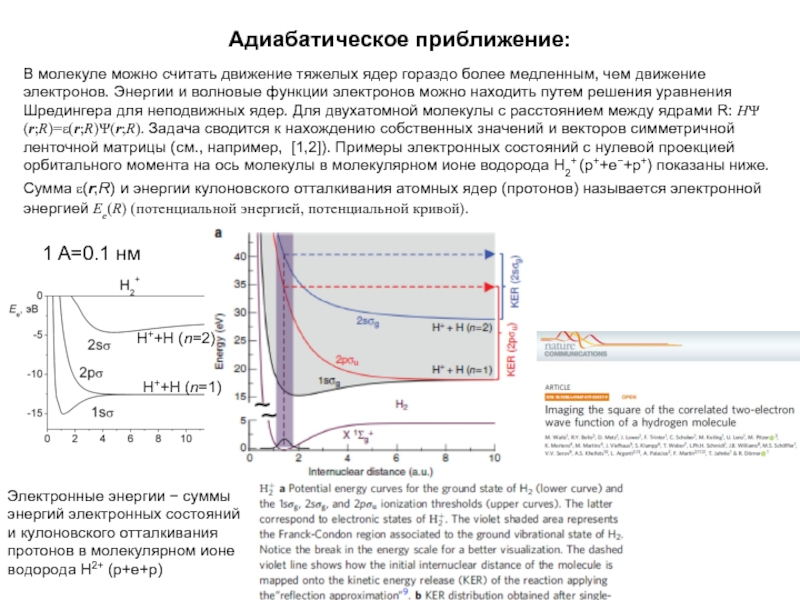
В молекуле можно считать движение тяжелых ядер гораздо более
медленным, чем движение электронов. Энергии и волновые функции электронов можно
находить путем решения уравнения Шредингера для неподвижных ядер. Для двухатомной молекулы с расстоянием между ядрами R: HY(r;R)=e(r;R)Y(r;R). Задача сводится к нахождению собственных значений и векторов симметричной ленточной матрицы (см., например, [1,2]). Примеры электронных состояний с нулевой проекцией орбитального момента на ось молекулы в молекулярном ионе водорода Н2+ (p++e−+p+) показаны ниже. Сумма e(r;R) и энергии кулоновского отталкивания атомных ядер (протонов) называется электронной энергией Ee(R) (потенциальной энергией, потенциальной кривой).1. В. И. Загребаев, В. В. Самарин, ЯФ, 67, 1488, (2004)
2. V. I. Zagrebaev, V.V. Samarin, W. Greiner, Phys Rev. C 75, 035809 (2007).
1 A=0.1 нм
e(r;R)
Энергии электронных состояний
в молекулярном ионе водорода Н2+
(p+e+p)
Электронные энергии суммы
энергий электронных состояний
и кулоновского отталкивания протонов
в молекулярном ионе водорода Н2+ (p+e+p)
Н++Н (n=1)
Н++Н (n=2)
Слайд 12Адиабатическое приближение:
В молекуле можно считать движение тяжелых ядер гораздо более
медленным, чем движение электронов. Энергии и волновые функции электронов можно
находить путем решения уравнения Шредингера для неподвижных ядер. Для двухатомной молекулы с расстоянием между ядрами R: HY(r;R)=e(r;R)Y(r;R). Задача сводится к нахождению собственных значений и векторов симметричной ленточной матрицы (см., например, [1,2]). Примеры электронных состояний с нулевой проекцией орбитального момента на ось молекулы в молекулярном ионе водорода Н2+ (p++e−+p+) показаны ниже. Сумма e(r;R) и энергии кулоновского отталкивания атомных ядер (протонов) называется электронной энергией Ee(R) (потенциальной энергией, потенциальной кривой).1 A=0.1 нм
Электронные энергии суммы
энергий электронных состояний
и кулоновского отталкивания
протонов в молекулярном ионе
водорода Н2+ (p+e+p)
Н++Н (n=1)
Н++Н (n=2)
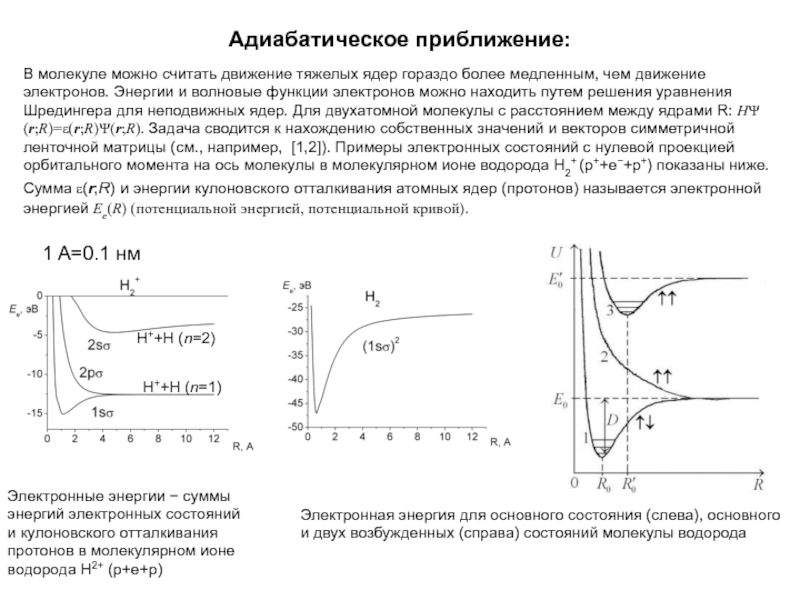
Слайд 13Адиабатическое приближение:
В молекуле можно считать движение тяжелых ядер гораздо более
медленным, чем движение электронов. Энергии и волновые функции электронов можно
находить путем решения уравнения Шредингера для неподвижных ядер. Для двухатомной молекулы с расстоянием между ядрами R: HY(r;R)=e(r;R)Y(r;R). Задача сводится к нахождению собственных значений и векторов симметричной ленточной матрицы (см., например, [1,2]). Примеры электронных состояний с нулевой проекцией орбитального момента на ось молекулы в молекулярном ионе водорода Н2+ (p++e−+p+) показаны ниже. Сумма e(r;R) и энергии кулоновского отталкивания атомных ядер (протонов) называется электронной энергией Ee(R) (потенциальной энергией, потенциальной кривой).1 A=0.1 нм
Электронные энергии суммы
энергий электронных состояний
и кулоновского отталкивания
протонов в молекулярном ионе
водорода Н2+ (p+e+p)
Электронная энергия для основного состояния (слева), основного
и двух возбужденных (справа) состояний молекулы водорода
Н++Н (n=1)
Н++Н (n=2)
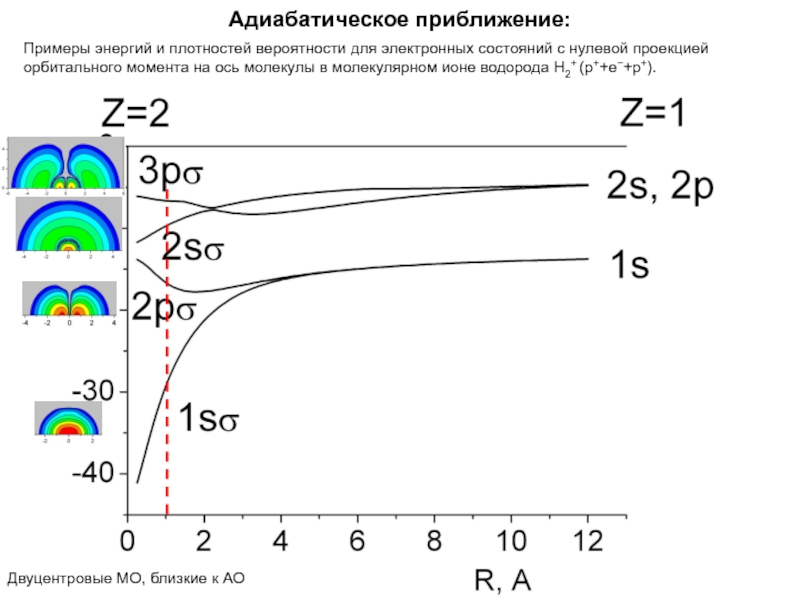
Слайд 14Адиабатическое приближение:
Примеры энергий и плотностей вероятности для электронных состояний с
нулевой проекцией орбитального момента на ось молекулы в молекулярном ионе
водорода Н2+ (p++e−+p+).Двуцентровые МО, близкие к АО
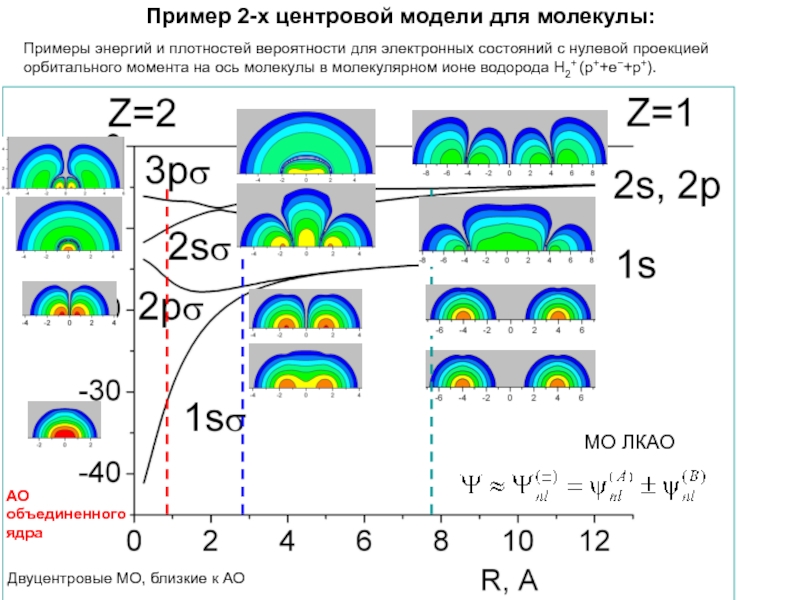
Слайд 15Пример 2-х центровой модели для молекулы:
АО
объединенного
ядра
Примеры энергий и плотностей вероятности
для электронных состояний с нулевой проекцией орбитального момента на ось
молекулы в молекулярном ионе водорода Н2+ (p++e−+p+).МО ЛКАО
Двуцентровые МО, близкие к АО
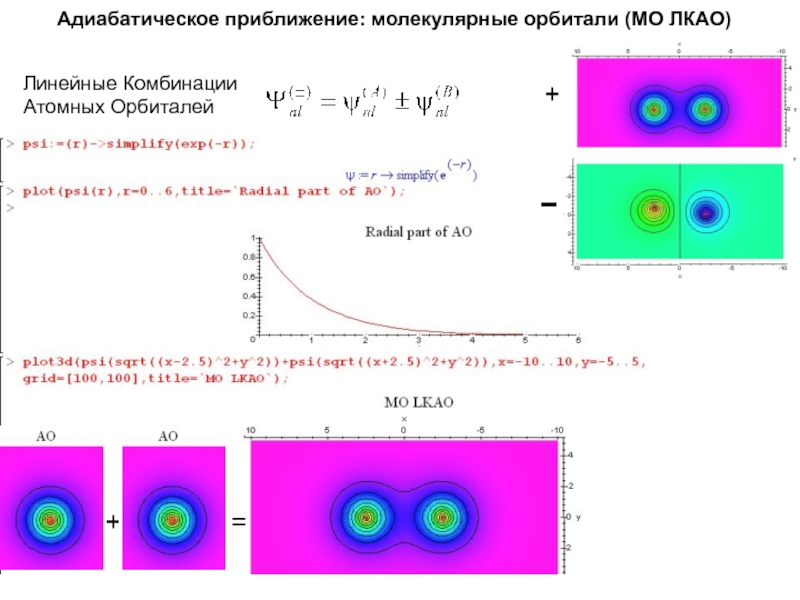
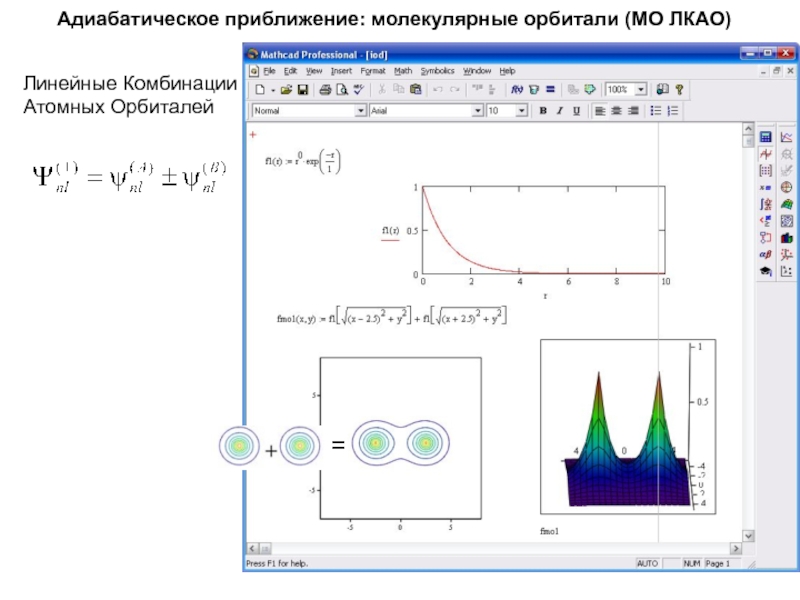
Слайд 19Адиабатическое приближение: молекулярные орбитали (МО ЛКАО)
Линейные Комбинации
Атомных Орбиталей
+
+
=
Слайд 20Адиабатическое приближение: молекулярные орбитали (МО ЛКАО)
Линейные Комбинации
Атомных Орбиталей
=
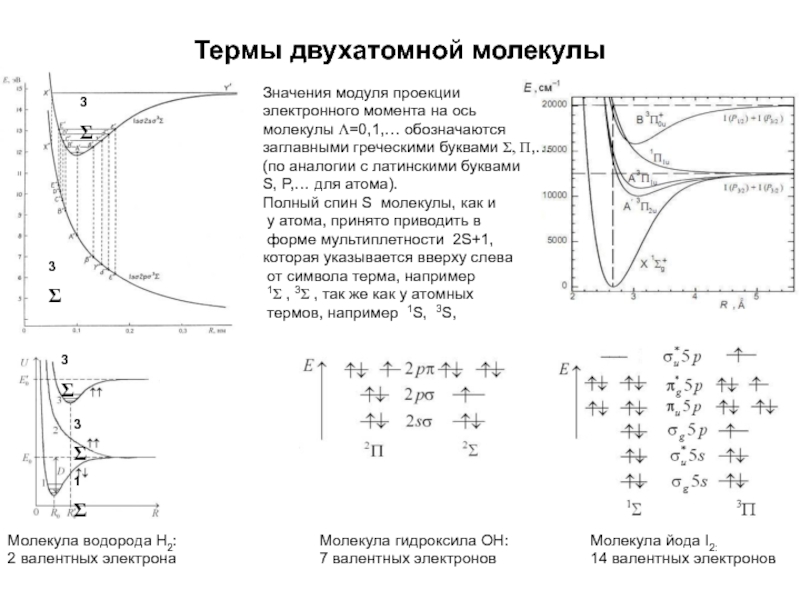
Слайд 23Термы двухатомной молекулы
Молекула водорода Н2:
2 валентных электрона
Молекула йода I2:
14 валентных
электронов
Молекула гидроксила ОН:
7 валентных электронов
Значения модуля проекции
электронного момента на
ось молекулы L=0,1,… обозначаются заглавными греческими буквами S, P,… (по аналогии с латинскими буквами S, P,… для атома). Полный спин S молекулы, как и
у атома, принято приводить в
форме мультиплетности 2S+1,
которая указывается вверху слева
от символа терма, например
1S , 3S , так же как у атомных
термов, например 1S, 3S,
1S
3S
3S
3S
3S
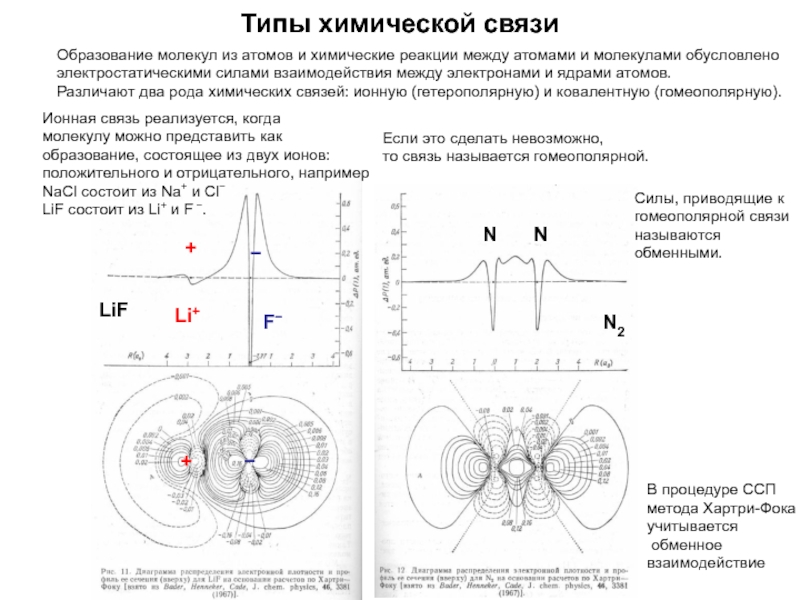
Слайд 24Типы химической связи
Образование молекул из атомов и химические реакции между
атомами и молекулами обусловлено электростатическими силами взаимодействия между электронами и ядрами
атомов. Различают два рода химических связей: ионную (гетерополярную) и ковалентную (гомеополярную).Ионная связь реализуется, когда
молекулу можно представить как
образование, состоящее из двух ионов:
положительного и отрицательного, например
NaCl состоит из Na+ и Cl
LiF состоит из Li+ и F .
Если это сделать невозможно,
то связь называется гомеополярной.
Силы, приводящие к
гомеополярной связи
называются
обменными.
В процедуре ССП
метода Хартри-Фока
учитывается
обменное
взаимодействие
Li+
+
+
−
−
LiF
F−
N2
N
N
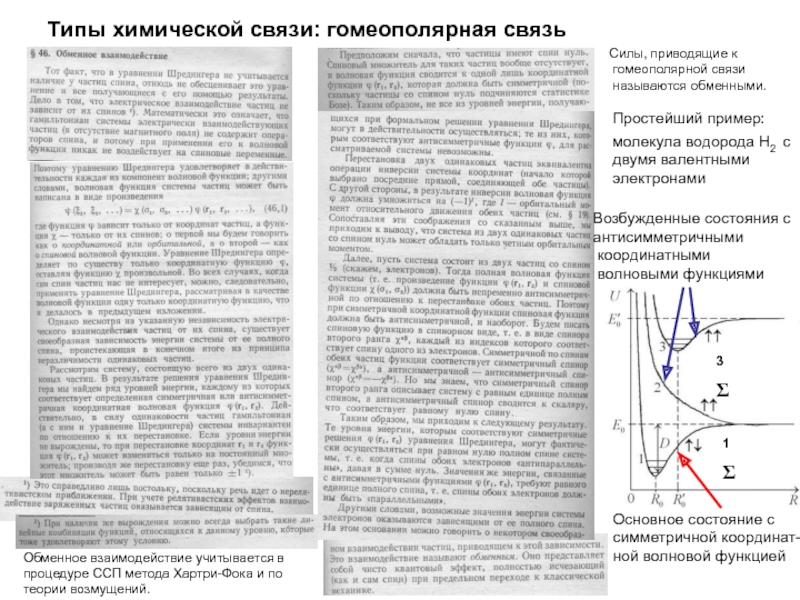
Слайд 25Типы химической связи: гомеополярная связь
Силы, приводящие к
гомеополярной связи
называются
обменными.
Простейший пример:
молекула водорода Н2 с
двумя валентными
электронами
3S
1S
Основное состояние с
симметричной координат-
ной
волновой функциейВозбужденные состояния с
антисимметричными
координатными
волновыми функциями
Обменное взаимодействие учитывается в процедуре ССП метода Хартри-Фока и по
теории возмущений.
Слайд 26Литература
Ландау Л.Д. Лифшиц Е.М. Краткий курс теоретической физики. Т. 2.
Квантовая механика. − М. Наука. 1971.
Ландау Л.Д. Лифшиц Е.М. Курс
теоретической физики. Т. 3. Квантовая механика. Нерелятивистская теория − М. Наука. 1971.Берестецкий В.Б., Лифшиц Е.М., Питаевский Л.П. Квантовая электродинамика. Ландау Л.Д. Лифшиц Е.М. Курс теоретической физики. Т. 4. − М. Наука. 1971.
Сивухин, Д. В. Общий курс физики. В 5 Т. Т 5: Атомная и ядерная физика: учеб. пособие– М.: Физматлит, 2002
Робертсон, Б. Современная физика в прикладных науках / Б. Робертсон. – М.: Мир, 1985. 272 с.
Хабердитцл, В. Строение материи и химическая связь. /В. Хабердитцл. – М.: Мир, 1974. – 296 с.