Слайд 1Молекулярная физика и термодинамика
Слайд 2Методы рассмотрения систем многих частиц
Молекулярная физика и термодинамика – это
по существу две разные по своим подходам, но тесно связанные
науки, занимающиеся одним и тем же – изучением макроскопических свойств физических систем, но совершенно разными методами.
Молекулярная физика является статистической теорией, т. е. теорией, которая рассматривает поведение систем, состоящих из огромного числа частиц (атомов, молекул), на основе вероятностных моделей. Она стремится на основе статистического подхода установить связь между экспериментально измеренными макроскопическими величинами (давление, объем, температура и т.д.) и микроскопическими характеристиками частиц, входящих в состав системы (масса, импульс, энергия и т.д.).
В отличие от молекулярно-кинетической теории, термодинамика при изучении свойств макроскопических систем не опирается ни на какие представления о молекулярной структуре вещества. Термодинамика является наукой феноменологической. Она делает выводы о свойствах вещества на основе законов, установленных на опыте, таких, как закон сохранения энергии. Термодинамика оперирует только с макроскопическими величинами (давление, температура, объем и т.п.), которые вводятся на основе физического эксперимента.
Оба подхода – термодинамический и статистический – не противоречат, а дополняют друг друга. Только совместное использование термодинамики и молекулярно-кинетической теории может дать наиболее полное представление о свойствах систем, состоящих из большого числа частиц.

Слайд 3Физические основы молекулярно-кинетической теории
В основе молекулярной физики или молекулярно-кинетической теории
лежат определенные представления о строении вещества. Для установления законов поведения
макроскопических систем, состоящих из огромного числа частиц, в молекулярной физике используются различные модели вещества, например, модели идеального газа, несжимаемой жидкости , кристаллического твердого тела.
В основе молекулярно-кинетической теории лежат три основных положения:
1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
2. Атомы и молекулы находятся в непрерывном хаотическом движении.
3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.

Слайд 4Опытное обоснование основных положений МКТ. Броуновское движение
Наиболее ярким экспериментальным подтверждением
представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является
броуновское движение. Это тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Р.Броуном в 1827 г.
Броуновские частицы движутся под влиянием беспорядочных ударов молекул. Из-за хаотического теплового движения молекул эти удары никогда не уравновешивают друг друга. В результате скорость броуновской частицы беспорядочно меняется по модулю и направлению, а ее траектория представляет собой сложную зигзагообразную кривую.
Слайд 5Опытное обоснование основных положений МКТ. Диффузия
Постоянное хаотичное движение молекул вещества
проявляется также в другом легко наблюдаемом явлении – диффузии.
Диффузией
называется явление проникновения двух или нескольких соприкасающихся веществ друг в друга. Наиболее быстро процесс протекает в газе, если он неоднороден по составу. Диффузия приводит к образованию однородной смеси независимо от плотности компонентов.
Значительно медленнее протекают подобные процессы в жидкостях. Взаимопроникновение двух разнородных жидкостей друг в друга, растворение твердых веществ в жидкостях (например, сахара в воде) и образование однородных растворов – примеры диффузионных процессов в жидкостях.
Наиболее медленно процесс диффузии протекает в твердых телах. Однако, опыты показывают, что при контакте хорошо очищенных поверхностей двух металлов через длительное время в каждом из них обнаруживается атомы другого металла.
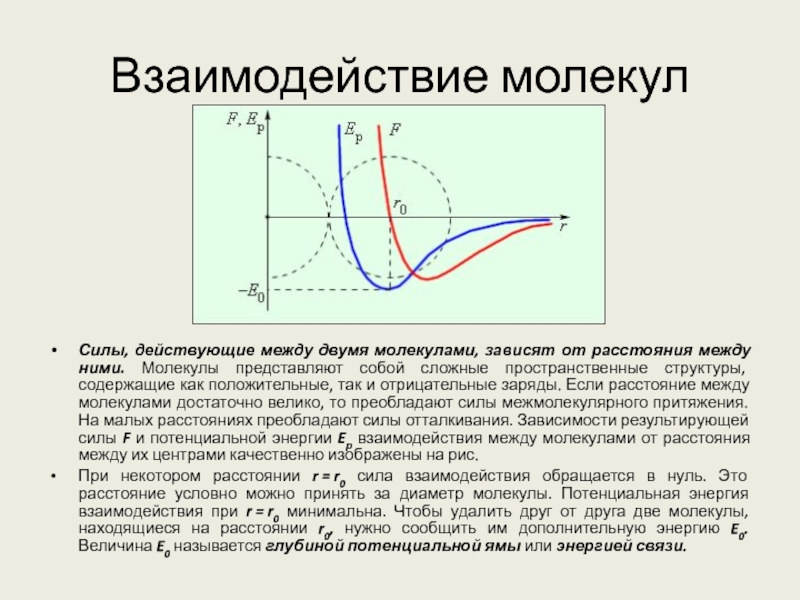
Слайд 6Взаимодействие молекул
Силы, действующие между двумя молекулами, зависят от расстояния между
ними. Молекулы представляют собой сложные пространственные структуры, содержащие как положительные,
так и отрицательные заряды. Если расстояние между молекулами достаточно велико, то преобладают силы межмолекулярного притяжения. На малых расстояниях преобладают силы отталкивания. Зависимости результирующей силы F и потенциальной энергии Eр взаимодействия между молекулами от расстояния между их центрами качественно изображены на рис.
При некотором расстоянии r = r0 сила взаимодействия обращается в нуль. Это расстояние условно можно принять за диаметр молекулы. Потенциальная энергия взаимодействия при r = r0 минимальна. Чтобы удалить друг от друга две молекулы, находящиеся на расстоянии r0, нужно сообщить им дополнительную энергию E0. Величина E0 называется глубиной потенциальной ямы или энергией связи.
Слайд 7Агрегатные состояния вещества
Беспорядочное хаотическое движение молекул называется тепловым движением.
Кинетическая
энергия теплового движения растет с возрастанием температуры.
При низких температурах
средняя кинетическая энергия молекулы может оказаться меньше глубины потенциальной ямы E0. В этом случае молекулы конденсируются в жидкое или твердое вещество; при этом среднее расстояние между молекулами будет приблизительно равно r0. При повышении температуры средняя кинетическая энергия молекулы становится больше E0, молекулы разлетаются, и образуется газообразное вещество.
В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров (положений равновесия). Эти центры могут быть расположены в пространстве нерегулярным образом (аморфные тела) или образовывать упорядоченные объемные структуры (кристаллические тела).
Слайд 8Основное уравнение МКТ
Используя модель идеального газа, вычислим давление газа на
стенку сосуда. В процессе взаимодействия молекулы со стенкой сосуда между
ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция υx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция υy скорости, параллельная стенке, остается неизменной.
Поэтому изменение импульса молекулы будет равно 2m0υx, где m0 – масса молекулы.
Слайд 9Основное уравнение МКТ
Выделим на стенке некоторую площадку S. За время
Δt с этой площадкой столкнутся все молекулы, имеющие проекцию скорости
υx, направленную в сторону стенки, и находящиеся в цилиндре с основанием площади S и высотой υxΔt.
Пусть в единице объема сосуда содержатся n молекул; тогда число молекул в объеме цилиндра равно nSυxΔt. Из этого числа половина движется в сторону стенки, а другая половина движется в противоположном направлении.
Число ударов молекул о площадку S за время Δt равно
Каждая молекула при столкновении со стенкой изменяет свой импульс на величину 2m0υx,
то полное изменение импульса всех молекул, столкнувшихся за время Δt с площадкой S, равно
Это изменение импульса всех столкнувшихся со стенкой молекул происходит под действием импульса силы FΔt,
Но по 3-му з-ну Ньютона такая же по модулю сила действует
со стороны молекул на площадку S.
Поэтому можно записать:
Разделив обе части на SΔt, получим:
где p – давление газа на стенку сосуда.
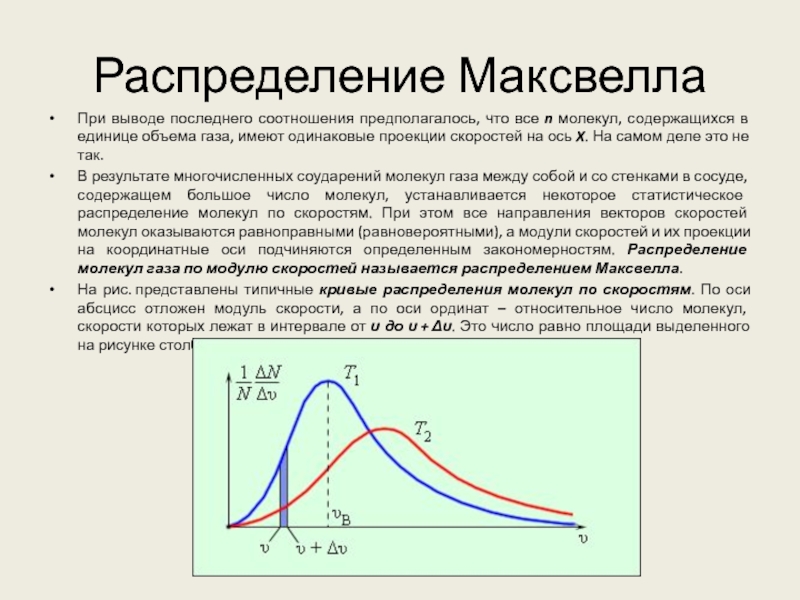
Слайд 10Распределение Максвелла
При выводе последнего соотношения предполагалось, что все n молекул,
содержащихся в единице объема газа, имеют одинаковые проекции скоростей на
ось X. На самом деле это не так.
В результате многочисленных соударений молекул газа между собой и со стенками в сосуде, содержащем большое число молекул, устанавливается некоторое статистическое распределение молекул по скоростям. При этом все направления векторов скоростей молекул оказываются равноправными (равновероятными), а модули скоростей и их проекции на координатные оси подчиняются определенным закономерностям. Распределение молекул газа по модулю скоростей называется распределением Максвелла.
На рис. представлены типичные кривые распределения молекул по скоростям. По оси абсцисс отложен модуль скорости, а по оси ординат – относительное число молекул, скорости которых лежат в интервале от υ до υ + Δυ. Это число равно площади выделенного на рисунке столбика.
Слайд 11Основное уравнение МКТ
Чтобы уточнить формулу для давления газа на стенку
сосуда, предположим, что все молекулы, содержащиеся в единице объема, разбиты
на группы. Каждая группа молекул вносит свой вклад в давление газа. В результате соударений со стенкой молекул с различными значениями проекций υxi скоростей возникает суммарное давление
Входящая в это выражение сумма – это сумма квадратов проекций υx всех n молекул в единичном объеме газа. Если эту сумму разделить на n, то мы получим среднее значение квадрата проекции скорости молекул:
Теперь формулу для давления газа можно записать в виде
Так как все направления для векторов скоростей молекул равновероятны, среднее значение квадратов их проекций на координатные оси равны между собой:
Формула для среднего давления газа на стенку сосуда запишется в виде
Это уравнение называют основным уравнением молекулярно-кинетической теории газов.
Таким образом, давление газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
Слайд 12Внутренняя энергия
Одним из важнейших понятий термодинамики является внутренняя энергия тела.
Все макроскопические тела обладают энергией, заключенной внутри самих тел.
С
точки зрения молекулярно-кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом.
Внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема (закон Джоуля).
Молекулярно-кинетическая теория приводит к следующему выражению для внутренней энергии одного моля идеального одноатомного газа (гелий, неон и др.), молекулы которого совершают только поступательное движение:
Поскольку потенциальная энергия взаимодействия молекул зависит от расстояния между ними, в общем случае внутренняя энергия U тела зависит наряду с температурой T также и от объема V:
U = U(T,V).
Таким образом, внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное состояние. Принято говорить, что внутренняя энергия является функцией состояния.

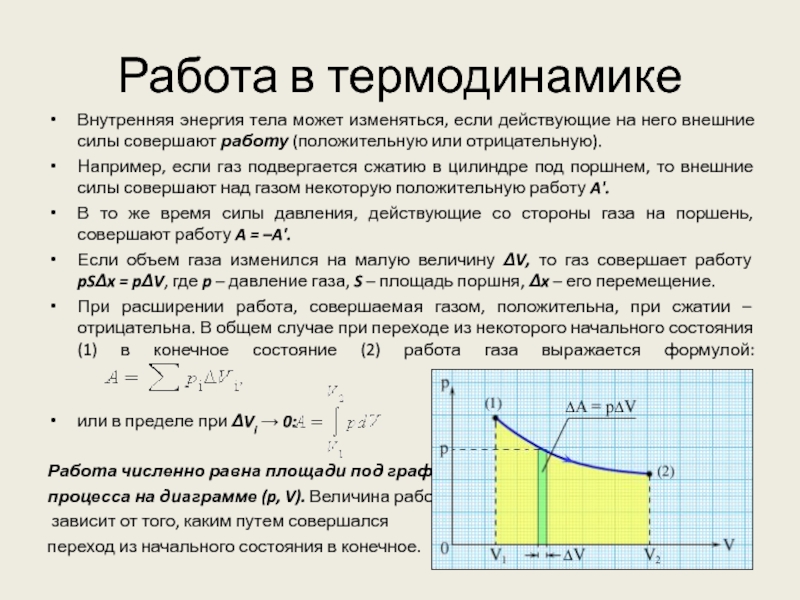
Слайд 13Работа в термодинамике
Внутренняя энергия тела может изменяться, если действующие на
него внешние силы совершают работу (положительную или отрицательную).
Например, если
газ подвергается сжатию в цилиндре под поршнем, то внешние силы совершают над газом некоторую положительную работу A'.
В то же время силы давления, действующие со стороны газа на поршень, совершают работу A = –A'.
Если объем газа изменился на малую величину ΔV, то газ совершает работу pSΔx = pΔV, где p – давление газа, S – площадь поршня, Δx – его перемещение.
При расширении работа, совершаемая газом, положительна, при сжатии – отрицательна. В общем случае при переходе из некоторого начального состояния (1) в конечное состояние (2) работа газа выражается формулой:
или в пределе при ΔVi → 0:
Работа численно равна площади под графиком
процесса на диаграмме (p, V). Величина работы
зависит от того, каким путем совершался
переход из начального состояния в конечное.
Слайд 14Первое начало термодинамики
Первый закон термодинамики является обобщением закона сохранения и
превращения энергии для термодинамической системы:
Изменение ΔU внутренней энергии неизолированной
термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
ΔU = Q – A.
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
Q = ΔU + A.
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую.
Важным следствием первого закона термодинамики является утверждение о невозможности создания машины, способной совершать полезную работу без потребления энергии извне и без каких-либо изменений внутри самой машины. Такая гипотетическая машина получила название вечного двигателя (perpetuum mobile) первого рода.
Слайд 15Первое начало термодинамики в различных изопроцессах
1. В изохорном процессе (V = const)
газ работы не совершает, A = 0. Следовательно,
Q = ΔU = U(T2) – U(T1).
Здесь U(T1) и
U(T2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0).
В изобарном процессе (p = const) A = p(V2 – V1) = pΔV.
Первый закон термодинамики для изобарного процесса имеет вид:
Q = U(T2) – U(T1) + p(V2 – V1) = ΔU + pΔV.
При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, ΔU < 0.
3. В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, ΔU = 0.
Первый закон термодинамики для изотермического процесса выражается соотношением
Q = A.
Количество теплоты Q, полученной газом в процессе изотермического расширения, превращается в работу над внешними телами. При изотермическом сжатии работа внешних сил, произведенная над газом, превращается в тепло, которое передается окружающим телам.

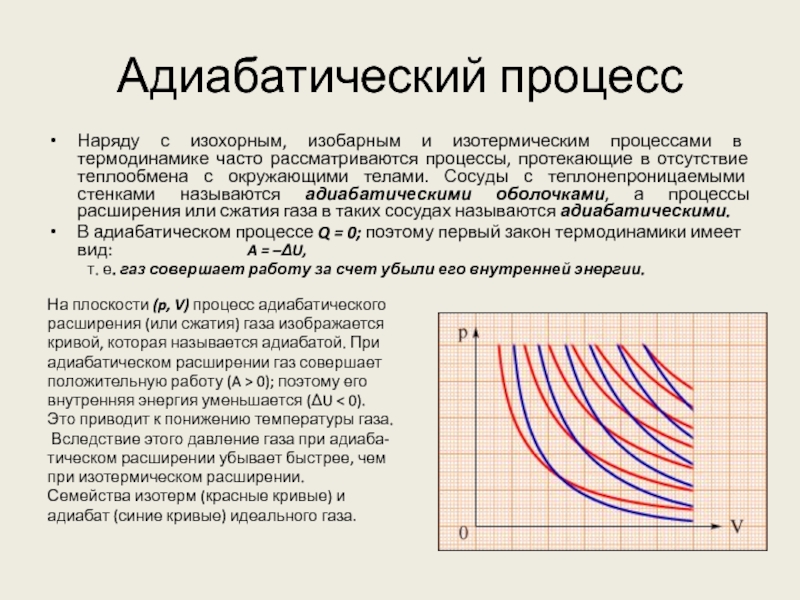
Слайд 16Адиабатический процесс
Наряду с изохорным, изобарным и изотермическим процессами в термодинамике
часто рассматриваются процессы, протекающие в отсутствие теплообмена с окружающими телами.
Сосуды с теплонепроницаемыми стенками называются адиабатическими оболочками, а процессы расширения или сжатия газа в таких сосудах называются адиабатическими.
В адиабатическом процессе Q = 0; поэтому первый закон термодинамики имеет вид: A = –ΔU,
т. е. газ совершает работу за счет убыли его внутренней энергии.
На плоскости (p, V) процесс адиабатического
расширения (или сжатия) газа изображается
кривой, которая называется адиабатой. При
адиабатическом расширении газ совершает
положительную работу (A > 0); поэтому его
внутренняя энергия уменьшается (ΔU < 0).
Это приводит к понижению температуры газа.
Вследствие этого давление газа при адиаба-
тическом расширении убывает быстрее, чем
при изотермическом расширении.
Семейства изотерм (красные кривые) и
адиабат (синие кривые) идеального газа.
Слайд 17Адиабатический процесс
Уравнение адиабатического процесса для идеального газа в координатах (p, V)
имеет вид :
pVγ = const.
Это соотношение называют уравнением Пуассона.
Здесь γ = Cp / CV –
показатель адиабаты, Cp и CV – теплоемкости газа в процессах с постоянным давлением и с постоянным объемом.
Работа газа в адиабатическом процессе просто выражается через температуры T1 и T2 начального и конечного состояний:
A = CV(T2 – T1).
Адиабатический процесс также можно отнести к изопроцессам.
В термодинамике важную роль играет физическая величина, которая называется энтропией.
Изменение энтропии в каком-либо квазистатическом процессе равно приведенному теплу ΔQ/T, полученному системой.
Поскольку на любом участке адиабатического процесса ΔQ = 0, энтропия в этом процессе остается неизменной.