Слайд 1МОЛЕКУЛЯРНАЯ ФИЗИКА И
ТЕРМОДИНАМИКА
Слайд 2изучает строение и свойства вещества, исходя из молекулярно-кинетических представлений: любое
тело (твердое, жидкое или газообразное) состоит из большого числа малых
частиц (атомов, молекул или ионов), находящихся в состоянии непрерывного беспорядочного движения. МКТ истолковывает наблюдаемые свойства тел как суммарный результат действия молекул, пользуясь статистическими методами: т.е. МКТ не интересуется движением отдельных молекул, но оперирует со средними величинами, характеризующими движение всей совокупности молекул.
изучает свойства веществ и изменение их состояний путем анализа процессов превращения энергии в них без рассмотрения движения отдельных частиц, из которых они состоят. В основе термодинамики лежит несколько фундаментальных законов, установленных в результате обобщений опытных фактов.
Молекулярно-кинетическая теория (МКТ) и термодинамика,
подходя к рассмотрению изменений состояния вещества с различных точек зрения, дополняют друг друга,
образуя по существу одно целое.
Системы, состоящие из очень большого числа частиц (атомов, молекул и т.д.), называют макросистемами. Примером макросистемы может служить газ.
Два метода изучения макросистем:
статистический термодинамический

Слайд 3Состояние системы. Термодинамические параметры и процессы
Термодинамическими параметрами (или параметрами состояния)
системы называются физические величины, служащие для характеристики состояния системы. В
качестве термодинамических параметров используются температура Т, давление р и объем V.
Состояние системы называется равновесным, если все ее параметры остаются неизменными произвольно долгое время при постоянных внешних условиях. Состояние системы, в котором хотя бы один из параметров не имеет определенного значения, называется неравновесным.
Термодинамическим процессом называется процесс перехода системы из одного состояния в другое.
Всякий термодинамический процесс связан с нарушением равновесия системы. Следовательно, при протекании какого-либо процесса система последовательно проходит через неравновесные состояния. Однако, при достаточно медленном протекании реального процесса (например, медленное сжатие газа, находящегося в цилиндре под поршнем) состояние системы в каждый момент времени можно считать равновесным, и бесконечно медленный процесс будет состоять из последовательных равновесных состояний. Таким образом, процесс называется равновесным или квазистатическим, если он состоит из последовательных равновесных состояний.
При изменении направления равновесного процесса (например, замене сжатия газа расширением) система будет проходить через те же состояния, что и при прямом процессе, но в обратной последовательности. Поэтому равновесные процессы являются обратимыми.
Круговым процессом или циклом называют такой процесс, в результате которого термодинамическая система возвращается в исходное состояние.

Слайд 4Равновесное состояние системы может быть изображено точкой. Например, на рисунке
а точка 1 соответствует равновесному состоянию системы, имеющему давление p1
и объем V1. Неравновесное состояние не может быть изображено таким же способом, как равновесное.
Равновесный процесс перехода системы из состояния 1 в состояние 2 изображен на рисунке а.
Неравновесные процессы условно изображаются штриховыми линиями (рисунок б).
Равновесные круговые процессы изображаются в виде замкнутых кривых (рисунок в).
Слайд 5Уравнение состояние. Основные положения МКТ
Параметры состояния системы, находящейся в равновесном
состоянии, связаны между собой определенной функциональной зависимостью типа
Соотношение, определяющее связь
между параметрами состояния какой-либо системы, называется уравнением состояния системы.
Уравнение состояния в статистической физике выводится теоретически, а в термодинамике получается опытным путем, и в этом состоит взаимосвязь статистического метода исследования с термодинамическим методом.
Молекулярная физика базируется на молекулярно-кинетической теории строения вещества (МКТ), исходными положениями которой являются следующие:
все вещества состоят из очень большого числа частиц (атомов, молекул или ионов)
частицы вещества находятся в непрерывном хаотическом движении (это движение называется тепловым);
частицы вещества взаимодействуют между собой, причем это взаимодействие существенно зависит от типа частиц и расстояния между ними.
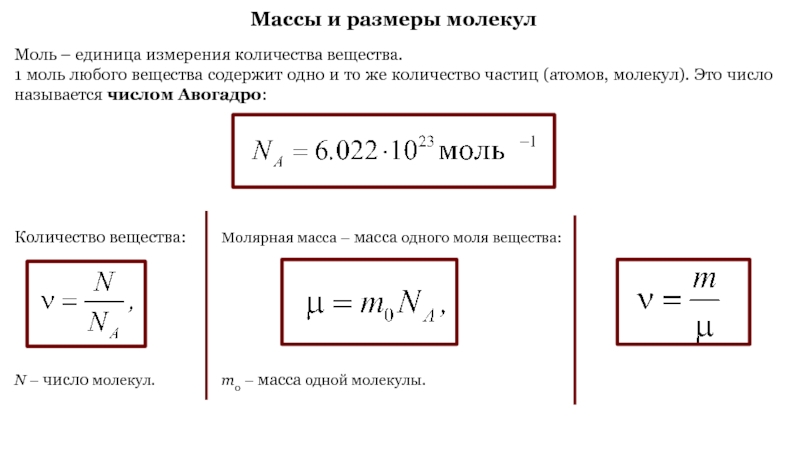
Слайд 6Массы и размеры молекул
Моль – единица измерения количества вещества.
1
моль любого вещества содержит одно и то же количество частиц
(атомов, молекул). Это число называется числом Авогадро:
Молярная масса – масса одного моля вещества:
m0 – масса одной молекулы.
Количество вещества:
N – число молекул.
Слайд 7Идеальный газ
Для описания свойств каких-либо объектов обычно пользуются модельными представлениями.
Вид модели выбирается в зависимости от характера решаемой задачи. В
частности, при исследовании свойств достаточно разреженных газов в молекулярной физике применяется модель так называемого идеального газа.
Идеальным газом называется газ, молекулы которого не взаимодействуют друг с другом на расстоянии и имеют малые собственные размеры.
Кроме того, считается, что:
молекулы идеального газа при взаимных столкновениях и ударах о стенки сосуда ведут себя как абсолютно упругие шарики;
движение каждой молекулы идеального газа подчиняется законам классической механики, при этом между столкновениями каждая молекула движется равномерно и прямолинейно;
связи между атомами в многоатомных молекулах идеального газа абсолютно жесткие (это положение нарушается при высоких температурах газа: атомы получают возможность совершать колебания друг относительно друга, и связи между ними в этом случае следует считать упругими).
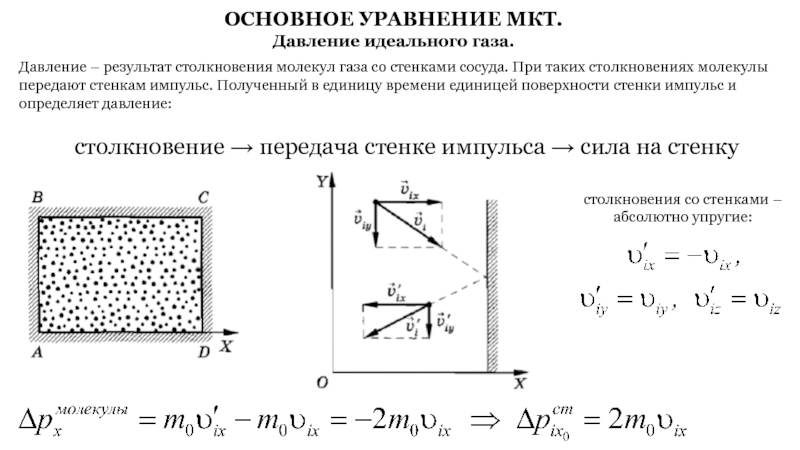
Слайд 8ОСНОВНОЕ УРАВНЕНИЕ МКТ.
Давление идеального газа.
Давление – результат столкновения молекул
газа со стенками сосуда. При таких столкновениях молекулы передают стенкам
импульс. Полученный в единицу времени единицей поверхности стенки импульс и определяет давление:
столкновение → передача стенке импульса → сила на стенку
столкновения со стенками – абсолютно упругие:
Слайд 9ni - концентрация молекул i-той группы (число молекул в единице
объема, x-составляющие скоростей которых близки к υix > 0 )
число
молекул со скоростями υix > 0, которые за время Δt долетят до рассматриваемой стенки сосуда:
Импульс, который молекулы со скоростями, близкими к υix>0, передают стенке за время Δt:
Импульс, который все молекулы, летящие к стенке, передают за время Δt:
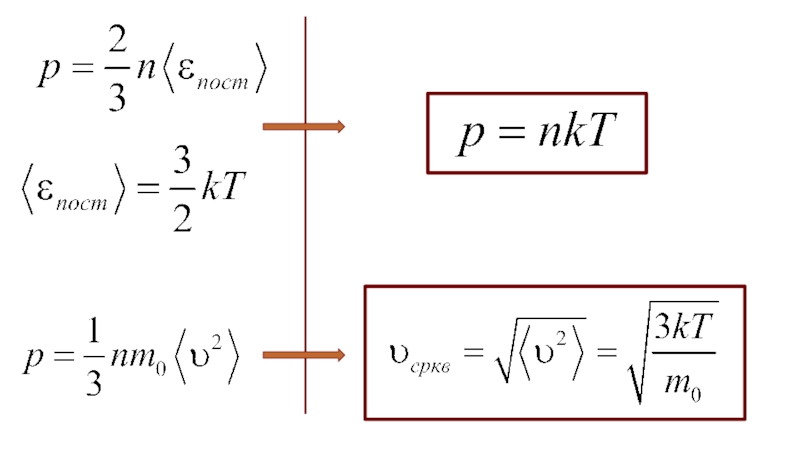
Слайд 10Средний квадрат проекции скорости на ось Х:
Все направления равновероятны::
Давление –
импульс, переданный в единицу времени единице поверхности
Слайд 12ТЕМПЕРАТУРА
Температура характеризует состояние теплового равновесия макроскопической системы: во всех частях
системы, находящейся в состоянии теплового равновесия, температура имеет одно и
то же значение.
К отдельным молекулам понятие температуры неприменимо.
С точки зрения МКТ температура – мера средней кинетической энергии хаотического движения молекул в макроскопических телах:
средняя кинетическая энергия поступательного движения молекул
Дж/К – постоянная Больцмана
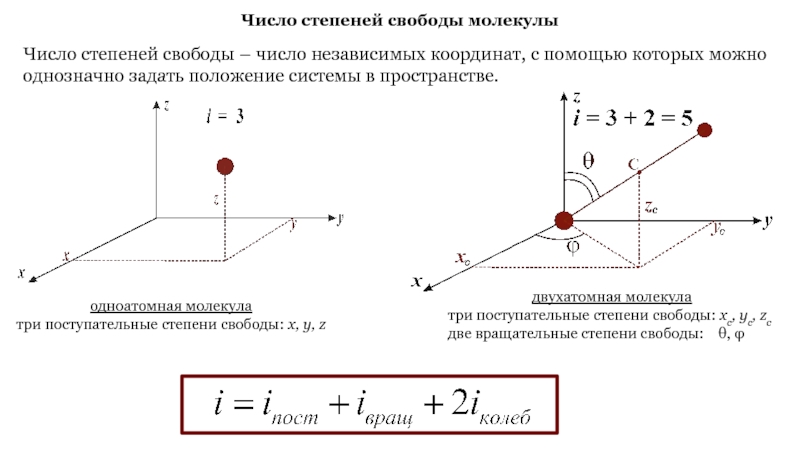
Слайд 13Число степеней свободы молекулы
Число степеней свободы – число независимых
координат, с помощью которых можно однозначно задать положение системы в
пространстве.
одноатомная молекула
три поступательные степени свободы: x, y, z
двухатомная молекула
три поступательные степени свободы: xc, yc, zc
две вращательные степени свободы: θ, φ
Слайд 14Теорема о равномерном распределении кинетической энергии по степеням свободы:
в состоянии
теплового равновесия на каждую степень свободы приходится в среднем одна
и та же кинетическая энергия
средняя энергия
молекулы
Слайд 16Уравнение состояния идеального газа.
Газовые законы.
Дж/моль∙К –
универсальная газовая постоянная
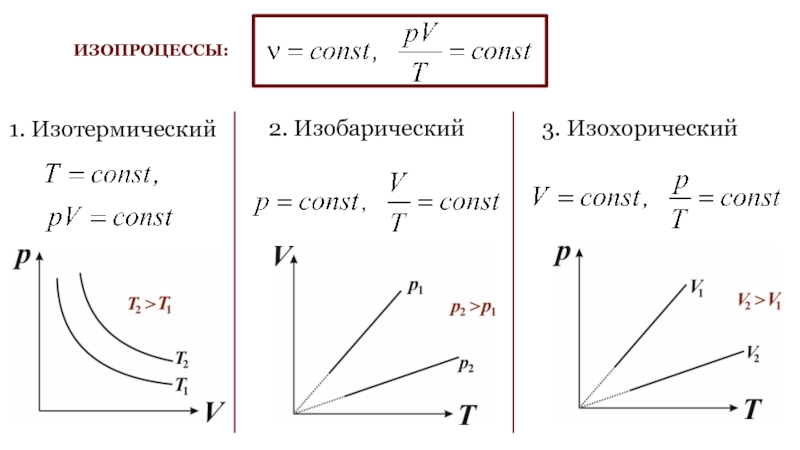
Слайд 17ИЗОПРОЦЕССЫ:
1. Изотермический
2. Изобарический
3. Изохорический
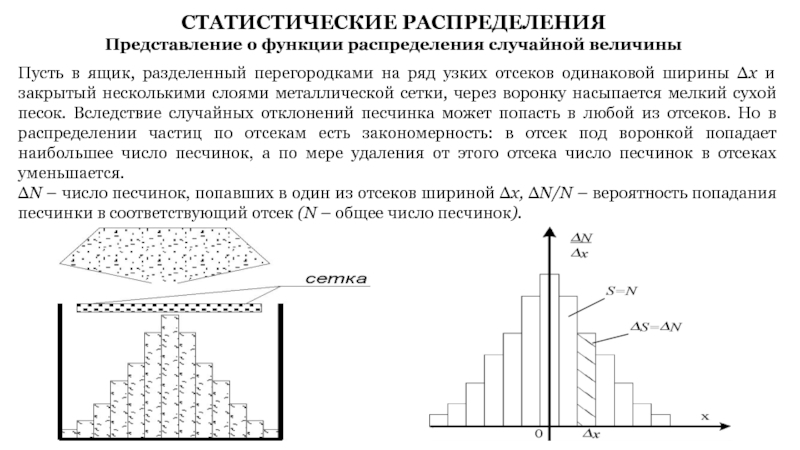
Слайд 18СТАТИСТИЧЕСКИЕ РАСПРЕДЕЛЕНИЯ
Представление о функции распределения случайной величины
Пусть в ящик, разделенный
перегородками на ряд узких отсеков одинаковой ширины Δx и закрытый
несколькими слоями металлической сетки, через воронку насыпается мелкий сухой песок. Вследствие случайных отклонений песчинка может попасть в любой из отсеков. Но в распределении частиц по отсекам есть закономерность: в отсек под воронкой попадает наибольшее число песчинок, а по мере удаления от этого отсека число песчинок в отсеках уменьшается.
ΔN – число песчинок, попавших в один из отсеков шириной Δx, ΔN/N – вероятность попадания песчинки в соответствующий отсек (N – общее число песчинок).
Слайд 19Функция f(x) называется функцией распределения:
При уменьшении ширины отсека (в пределе
Δx→0) ступенчатая диаграмма перейдет в плавную линию f(x).
вероятность попадания
песчинки в точку,
имеющую координату в интервале
от x до x+dx
Площадь под кривой:
Среднее значение х:
Среднее значение х2:
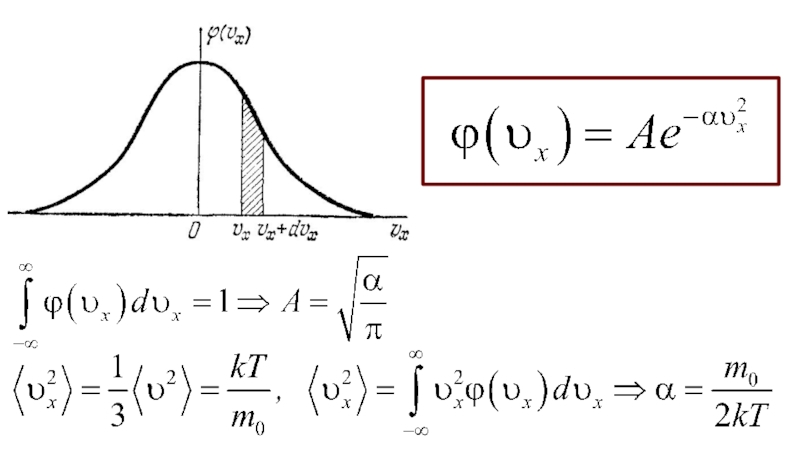
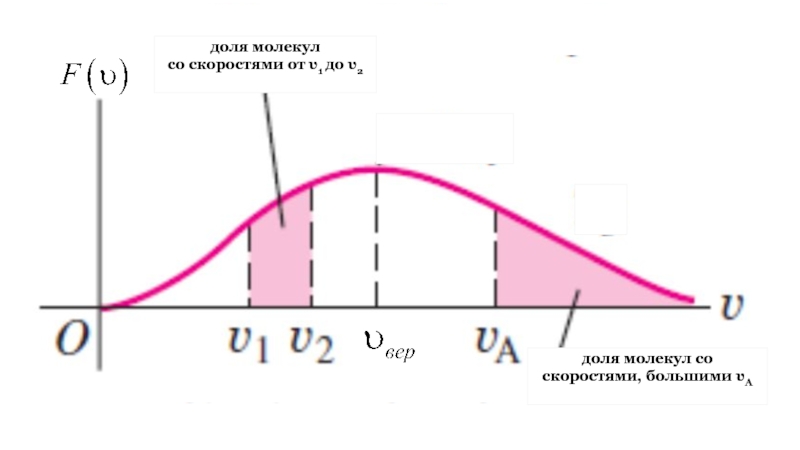
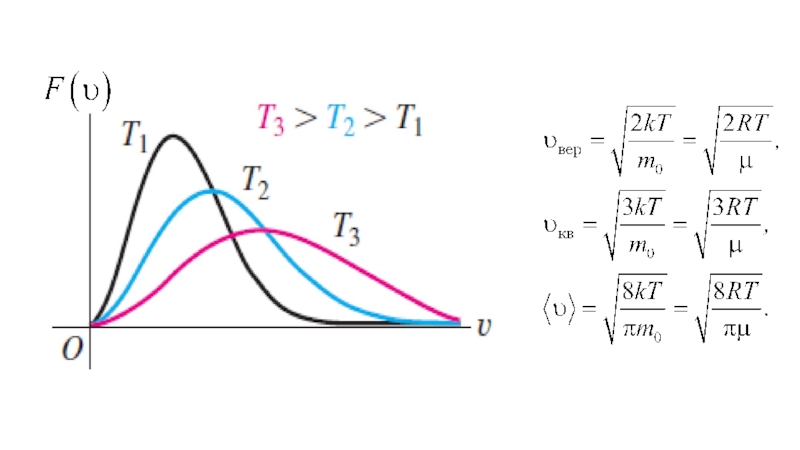
Слайд 20РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО СКОРОСТЯМ (РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА)
Молекулы газа, участвуя в непрерывном
хаотическом движении, сопровождающемся многочисленными столкновениями их друг с другом, в
каждый момент времени обладают разными по модулю и направлению скоростями. То, что в газе имеются молекулы как с очень большими, так и с очень малыми скоростями, подтверждается опытами по их измерению.
И хотя скорости отдельных молекул газа непостоянны, в состоянии теплового равновесия существует некоторое стационарное распределение молекул по модулям скоростей, то есть доля молекул со скоростями в том или ином диапазоне не изменяется.
доля молекул,
компоненты скоростей которых
лежат в интервалах между
υx и υx +dυx, υy и υy +dυy, υz и υz +dυz.
Слайд 21Идея Максвелла:
попадания компонент скорости молекулы в интервалы
(υx; υx
+dυx), (υy; υy +dυy) и (υz; υz +dυz) – независимые
события:
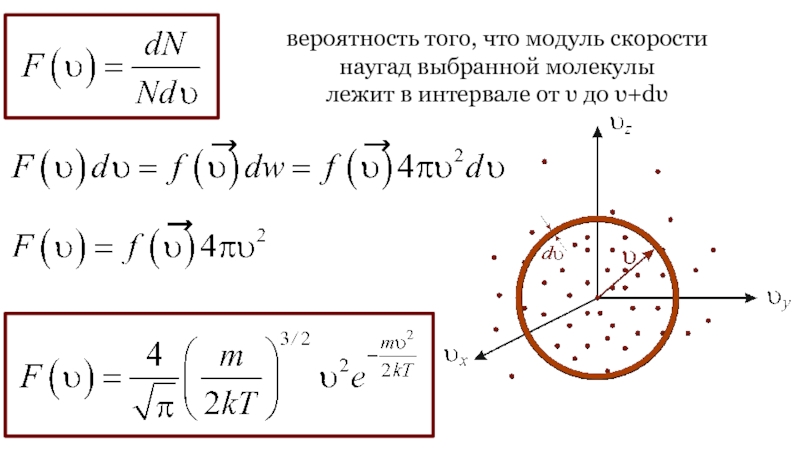
Слайд 24вероятность того, что модуль скорости
наугад выбранной молекулы
лежит в
интервале от υ до υ+dυ
Слайд 27РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ В ПОТЕНЦИАЛЬНОМ СИЛОВОМ ПОЛЕ
(РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА)
Выделим мысленно
вертикальный столб воздуха с площадью основания S. Пусть на высоте
h давление равно p, тогда на высоте (h+dh) давление равно (p+dp). Так как давление с увеличением высоты падает, то его приращение будет отрицательным (dp< 0).
Для идеального газа давление равно
где n – концентрация молекул газа.
Масса dm может быть записана как
где m0 – масса одной молекулы, dN – число молекул в объеме столба dV.
Условие равновесия выделенного столба газа имеет вид:
Слайд 28Тогда
Интегрируя, получим:
где n0 - концентрация на высоте h = 0.
распределение Больцмана
U – потенциальная энергия молекулы газа в потенциальном силовом
поле,
n0 – концентрация при U = 0.
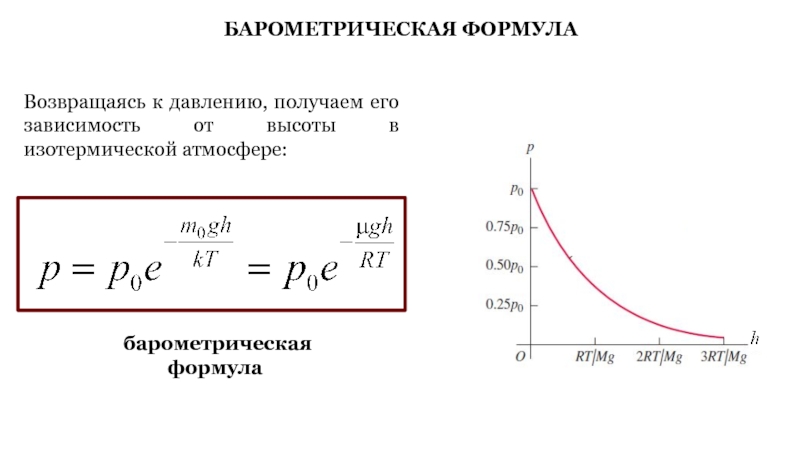
Слайд 29БАРОМЕТРИЧЕСКАЯ ФОРМУЛА
Возвращаясь к давлению, получаем его зависимость от высоты в
изотермической атмосфере:
барометрическая формула
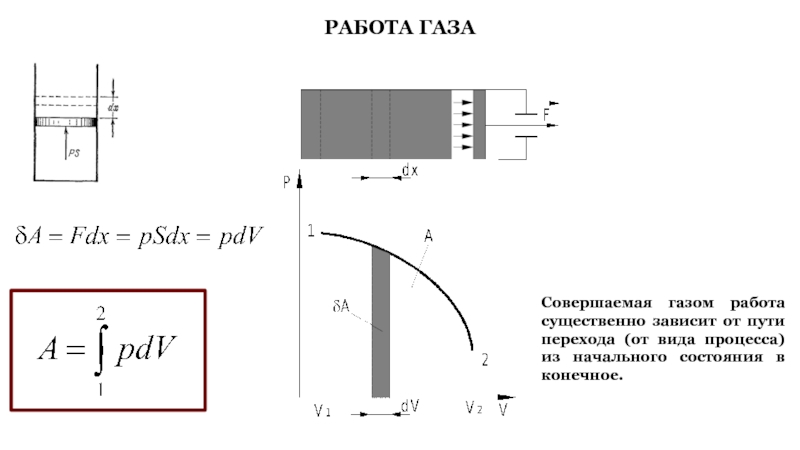
Слайд 30РАБОТА ГАЗА
Совершаемая газом работа существенно зависит от пути перехода (от
вида процесса) из начального состояния в конечное.
Слайд 31Оболочка называется адиабатической, если состояние заключенной в ней системы остается
неизменным при любых изменениях температуры окружающих тел, если только значения
внешних параметров поддерживаются постоянными. Т.е. изменить состояние системы в адиабатической оболочке можно только путем изменения внешних параметров.
Система, заключенная в адиабатическую оболочку, называется адиабатически изолированной.
Если система тел адиабатически изолирована, то работа внешних сил над этой системой зависит только от ее начального и конечного состояний, но не зависит от способа (пути) перехода.
АДИАБАТИЧЕСКАЯ ОБОЛОЧКА
Слайд 32Внутренней энергией системы U называется функция состояния, приращение которой во
всяком процессе, совершаемом системой в адиабатической оболочке, равно работе внешних
сил над системой при ее переходе из начального состояния в конечное.
ВНУТРЕННЯЯ ЭНЕРГИЯ СИСТЕМЫ
Понятие внутренней энергии относится только к равновесным состояниям термодинамических систем.
Слайд 33КОЛИЧЕСТВО ТЕПЛОТЫ
Процесс обмена внутренними энергиями соприкасающихся тел, не сопровождающийся производством
макроскопической работы, называется теплообменом.
Энергия, переданная телу окружающей средой в результате
теплообмена, называется количеством теплоты Q.
Количество теплоты – функция процесса.
Слайд 34ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Система (I+II) заключена в адиабатическую оболочку.
Граница АВ –
теплопроводящая.
Оболочка системы II – жесткая.
Тепло, полученное системой, идет на приращение
ее внутренней энергии и на совершение ею работы.
Слайд 35Если U1 = U2 и Q = 0, то А
= 0.
Т.е. невозможен процесс, единственным результатом которого является производство
работы без каких бы то ни было изменений в других телах (невозможность вечного двигателя первого рода).
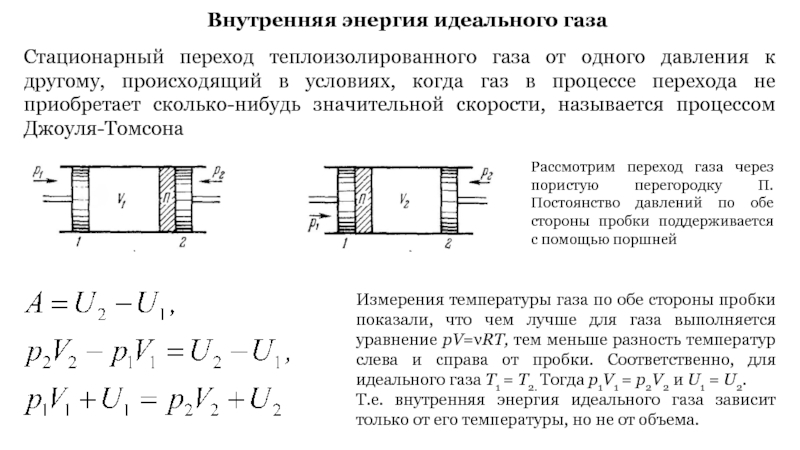
Слайд 36Стационарный переход теплоизолированного газа от одного давления к другому, происходящий
в условиях, когда газ в процессе перехода не приобретает сколько-нибудь
значительной скорости, называется процессом Джоуля-Томсона
Рассмотрим переход газа через пористую перегородку П. Постоянство давлений по обе стороны пробки поддерживается с помощью поршней
Измерения температуры газа по обе стороны пробки показали, что чем лучше для газа выполняется уравнение pV=νRT, тем меньше разность температур слева и справа от пробки. Соответственно, для идеального газа Т1 = Т2. Тогда p1V1 = p2V2 и U1 = U2.
Т.е. внутренняя энергия идеального газа зависит только от его температуры, но не от объема.
Внутренняя энергия идеального газа
Слайд 37внутренняя энергия идеального газа
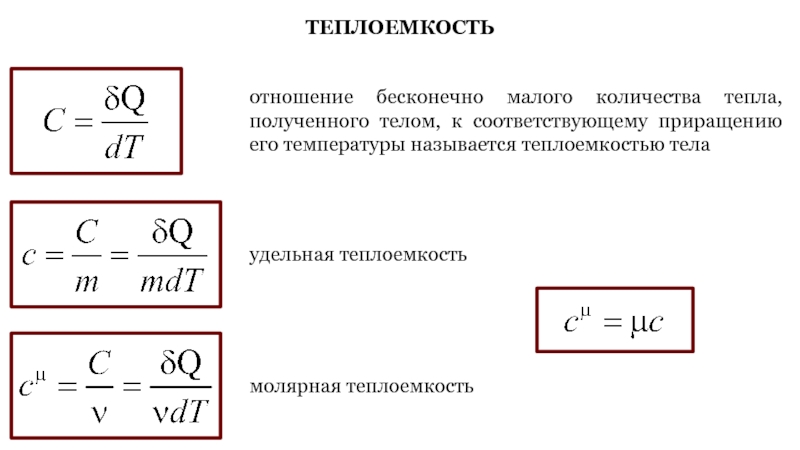
Слайд 38ТЕПЛОЕМКОСТЬ
отношение бесконечно малого количества тепла, полученного телом, к соответствующему приращению
его температуры называется теплоемкостью тела
удельная теплоемкость
молярная теплоемкость
Слайд 39Молярные теплоемкости идеального газа
при постоянном объеме и постоянном давлении
Слайд 40Для одного моля идеального газа:
уравнение Майера
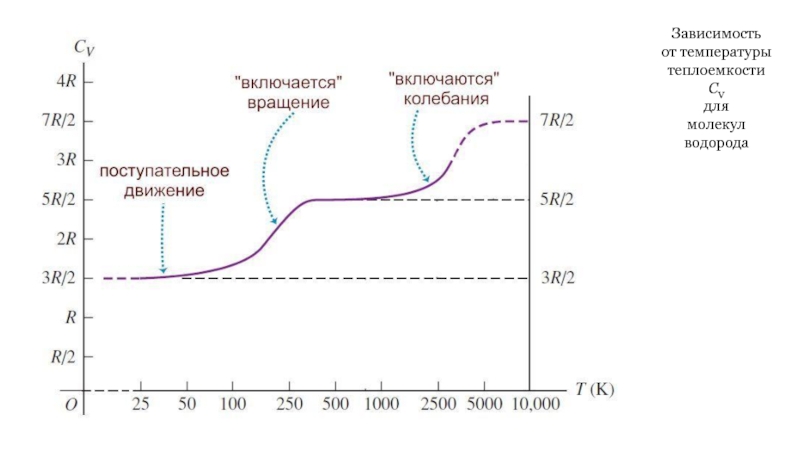
Слайд 41Зависимость
от температуры
теплоемкости
СV
для
молекул
водорода
Слайд 42АДИАБАТНЫЙ ПРОЦЕСС
Процесс, происходящий без подвода и отвода тепла, называется адиабатным:
Слайд 43показатель адиабаты
уравнение Пуассона
(уравнение адиабаты
в координатах (p, V))
уравнения адиабаты
в
координатах
(T, V) и (p, T)
при адиабатическом расширении температура газа понижается
Слайд 44ПОЛИТРОПНЫЙ ПРОЦЕСС
Процесс, в котором теплоемкость остается постояннной, называется адиабатным:
Слайд 45показатель политропы
молярная теплоемкость
идеального газа
в политропном процессе
уравнения политропы
в
координатах
(p, V), (T, V) и (p, T)
примеры политропных процессов
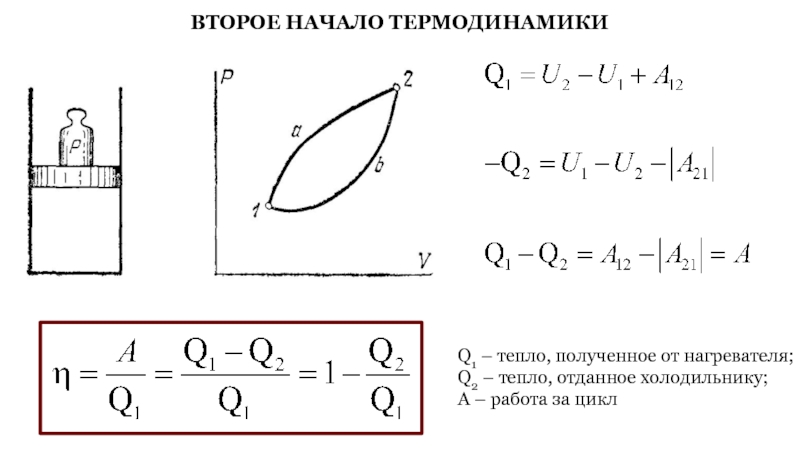
Слайд 46ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Q1 – тепло, полученное от нагревателя;
Q2 – тепло,
отданное холодильнику;
A – работа за цикл
Слайд 47?
Можно ли построить периодически действующую тепловую машину
без холодильника
(перпетуум
мобиле второго рода)?
НЕВОЗМОЖНОСТЬ ПОСТРОЕНИЯ
ТАКОЙ МАШИНЫ
БЫЛА ВОЗВЕДЕНА В ПОСТУЛАТ
ВТОРОГО НАЧАЛА ТЕРМОДИНАМИКИ
Слайд 48ФОРМУЛИРОВКИ ВТОРОГО НАЧАЛА ТЕРМОДИНАМИКИ
Формулировка Планка:
невозможно построить периодически действующую машину, единственным
результатом которой было бы поднятие груза за счет охлаждения теплового
резервуара
2. Формулировка Томсона:
невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара
3. Формулировка Клаузиуса:
Теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому
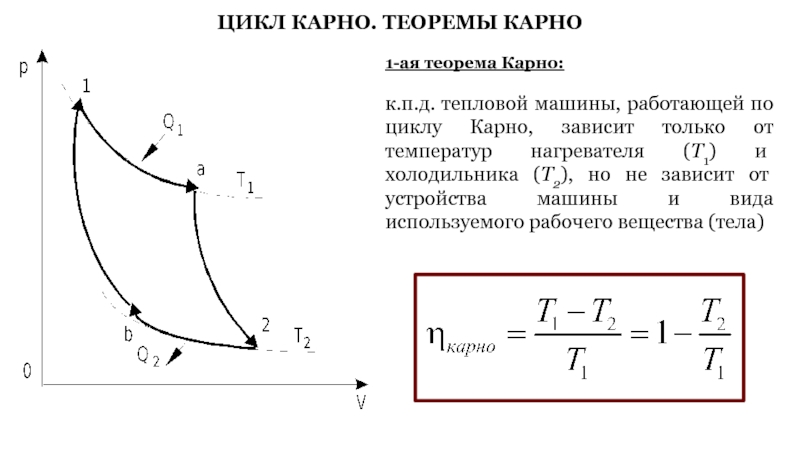
Слайд 49ЦИКЛ КАРНО. ТЕОРЕМЫ КАРНО
1-ая теорема Карно:
к.п.д. тепловой машины, работающей по
циклу Карно, зависит только от температур нагревателя (Т1) и холодильника
(Т2), но не зависит от устройства машины и вида используемого рабочего вещества (тела)
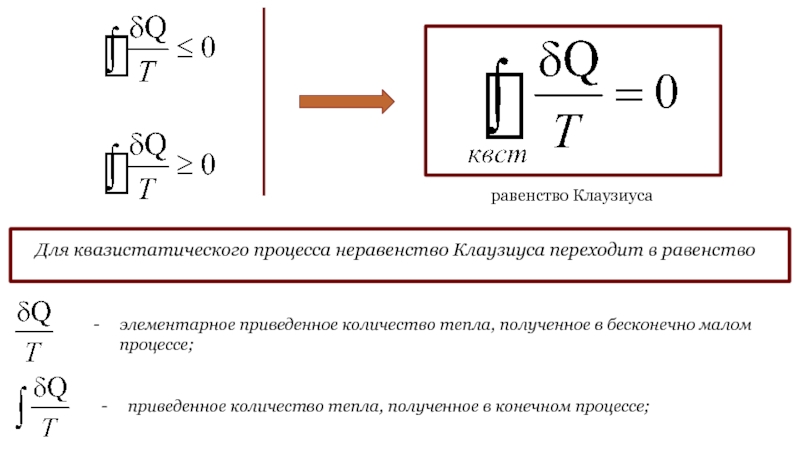
Слайд 50НЕРАВЕНСТВО КЛАУЗИУСА (ЧАСТНЫЙ СЛУЧАЙ)
2-ая теорема Карно:
к.п.д. всякой тепловой машины не
может превосходить к.п.д. идеальной машины, работающей по циклу Карно с
теми же самыми температурами нагревателя (Т1) и холодильника (Т2):
Не будем далее различать, какой тепловой резервуар является нагревателем, а какой – холодильником. Условимся считать количество теплоты, полученное системой (и, соответственно, отданное резервуаром), положительным. Тогда:
неравенство Клаузиуса
в частном случае
Слайд 51НЕРАВЕНСТВО КЛАУЗИУСА (ОБЩИЙ СЛУЧАЙ).
РАВЕНСТВО КЛАУЗИУСА. ЭНТРОПИЯ
При окончательной формулировке неравенства
можно пользоваться представлением о теплообмене между рассматриваемой системой и окружающей
средой. В таком представлении Т – температура среды, δQ – бесконечно малое количество тепла, переданное системе при температуре Т. Процесс, совершаемый системой, должен быть круговым.
Пусть совершаемый системой круговой процесс квазистатический. Тогда он обратим и может идти в обратном направлении:
Слайд 52 - элементарное приведенное количество тепла, полученное в
бесконечно малом процессе;
- приведенное количество
тепла, полученное в конечном процессе;
Для квазистатического процесса неравенство Клаузиуса переходит в равенство
Слайд 53пути I и II перехода системы из состояния 1 в
состояние 2 –квазистатические
приведенное количество тепла, квазистатически полученное системой,
не зависит от пути перехода, а определяется лишь начальным и конечным состояниями системы
Слайд 54ЭНТРОПИЯ
Энтропия – функция состояния системы. Разность энтропий в двух равновесных
состояниях равна приведенному количеству тепла, которое нужно сообщить системе, чтобы
перевести ее из состояния 1 в состояние 2 по любому квазистатическому пути:
Слайд 55:Приращение энтропии идеального газа:
Слайд 56ЗАКОН ВОЗРАСТАНИЯ ЭНТРОПИИ
Путь I – необратимый, путь II – квазистатический.
Если
система адиабатически изолирована:
Слайд 57СТАТИСТИЧЕСКИЙ СМЫСЛ
ВТОРОГО НАЧАЛА ТЕРМОДИНАМИКИ
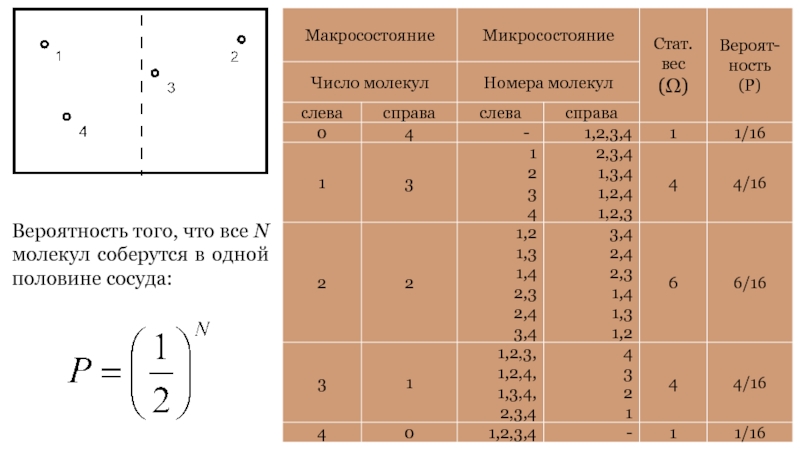
Состояние системы может быть задано с
помощью макроскопических (то есть характеризующих систему в целом) параметров: объема,
давления, температуры. Охарактеризованное таким образом состояние называется макросостоянием.
Если состояние системы охарактеризовано настолько детально, что оказываются заданными состояния всех ее частиц, то состояние называют микросостоянием.
Всякое макросостояние может быть реализовано различными микросостояниями.
Число различных микросостояний, соответствующих данному макросостоянию, называется его статистическим весом.
Слайд 58Вероятность того, что все N молекул соберутся в одной половине
сосуда:
Слайд 59Предоставленная самой себе система стремится переходить от менее вероятных состояний
к более вероятным.
Самопроизвольные процессы в изолированных системах сопровождаются возрастанием энтропии.
формула
Больцмана
энтропия характеризует степень беспорядка в системе
идея: наличие связи между энтропией и вероятностью состояния (статистическим весом)