Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
МОЛЕКУЛЯРНАЯ ФИЗИКА ТЕРМОДИНАМИКА Энтропия 1
Содержание
- 1. МОЛЕКУЛЯРНАЯ ФИЗИКА ТЕРМОДИНАМИКА Энтропия 1
- 2. ВопросыПриведенная теплота. ЭнтропияИзменение энтропии3. Поведение энтропии в процессах изменения агрегатного состояния
- 3. 1. Приведенная теплота. Энтропия Из рассмотренного
- 4. Отношение теплоты Q в
- 5. Слайд 5
- 6. Суммируя приведенную теплоту на всех участках процесса,
- 7. Этот результат справедлив для любого обратимого
- 8. Это позволяет ввести новую функцию состояния S:
- 9. Понятие энтропии было впервые введено Рудольфом Клаузиусом
- 10. Слайд 10
- 11. В 1850 г. получил общие соотношения между
- 12. 2. Изменение энтропии в изопроцессах
- 13. Таким образом, по этой формуле можно
- 14. Так как, а
- 15. т.е. изменение энтропии S12 идеального газа при
- 16. изобарический:
- 17. Изменение энтропии в изопроцессах:
- 18. 3. Поведение энтропии в процессах изменения агрегатного
- 19. 1. Переход вещества из твердого состояния (фазы)
- 20. 4. Закон плавления: количество тепла Q, которое
- 21. Этот закон справедлив и для кристаллизации, правда,
- 22. Изменение энтропии в процессе этого фазового перехода
- 23. Тогда можно использовать термодинамический смысл энтропии: с
- 24. или
- 25. Так как температура системы в данном фазовом
- 26. Из этой формулы следует, что при плавлении
- 27. Поэтому при равной температуре энтропия твердого тела
- 28. Фазовый переход «жидкость – газ» Этот
- 29. 2: при испарении система поглощает тепло, при
- 30. В процессе фазового перехода «жидкость – газ»
- 31. Коэффициент пропорции r в этом выражении, есть
- 32. Изменение энтропии в этом процессе можно найти
- 33. Из формулы следует, что при испарении энтропия возрастает, а при конденсации уменьшается.
- 34. Физический смысл этого результата состоит в
- 35. занятой жидкостью, но не имеет возможности «оторваться
- 36. Молекулы газа ведут себя иначе. У них
- 37. Поэтому при равных температурах фазовая область молекул
- 38. Скачать презентанцию
ВопросыПриведенная теплота. ЭнтропияИзменение энтропии3. Поведение энтропии в процессах изменения агрегатного состояния
Слайды и текст этой презентации
Слайд 2Вопросы
Приведенная теплота. Энтропия
Изменение энтропии
3. Поведение энтропии в процессах изменения агрегатного
состояния
Слайд 31. Приведенная теплота. Энтропия
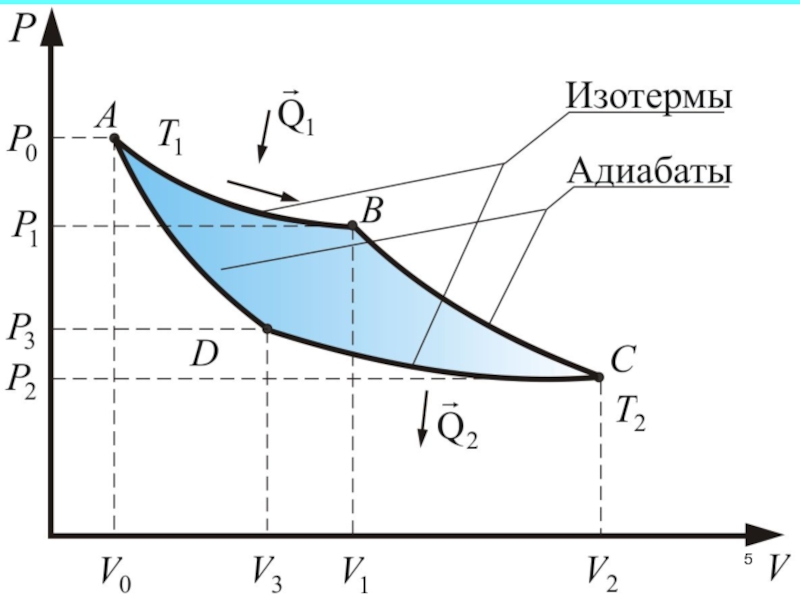
Из рассмотренного цикла Карно видно,
что равны между собой отношения теплот к температурам, при которых
они были получены или отданы в изотермическом процессе:Слайд 4 Отношение теплоты Q в изотермическом процессе к
температуре, при которой происходила передача теплоты, называется приведенной теплотой
: (1) Для подсчета приведенной теплоты в произвольном процессе необходимо разбить этот процесс на бесконечно малые участки, где Т можно считать константой. Приведенная теплота на таком участке будет равнаСлайд 6 Суммируя приведенную теплоту на всех участках процесса, получим: Тогда в обратимом
цикле Карно имеем:
Слайд 7 Этот результат справедлив для любого обратимого процесса. Таким образом, для
процесса, происходящего по замкнутому циклу
(2) Из равенства нулю интеграла, взятого по замкнутому контуру, следует, что подынтегральное выражение - есть полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит от пути, каким система пришла в это состояние.Слайд 8 Это позволяет ввести новую функцию состояния S:
(3) Функция состояния, полный дифференциал которой равен , называется энтропией. Энтропия S – это отношение получен-ной или отданной теплоты к температу-ре, при которой происходил этот процесс.
Слайд 9 Понятие энтропии было впервые введено Рудольфом Клаузиусом в 1865 г. Для
обратимых процессов изменение энтропии:
(4) - это выражение называется равенство Клаузиуса.Слайд 10
Клаузиус Рудольф Юлиус
Эмануэль (1822 – 1888) – немецкий физик-теоретик, один из создателей термодинамики и кинетической теории газов. Его работы посвящены молекулярной физике, термодинамике, теории паровых машин, теоретической механике, математической физике. Развивая идеи Н. Карно, точно сформулировал принцип эквивалентности теплоты и работы.Слайд 11 В 1850 г. получил общие соотношения между теплотой и механической
работой (первое начало термодинамики) и разработал идеальный термодинамический цикл паровой
машины (цикл Ранкина-Клаузиуса). Ввел понятие энтропии.Слайд 122. Изменение энтропии в изопроцессах
Энтропия системы
является функцией ее состояния, определенная с точностью до произвольной постоянной.
Если система совершает равновесный переход из состояния 1 в состояние 2, то изменение энтропии:(5)
Слайд 13 Таким образом, по этой формуле можно определить энтропию лишь с
точностью до аддитивной постоянной, т.е. начало энтропии произвольно. Физический смысл имеет
лишь разность энтропий. Исходя из этого, найдем изменения энтропии в процессах идеального газа.Слайд 15т.е. изменение энтропии S12 идеального газа при переходе его из
состояния 1 в состояние 2 не зависит от вида перехода
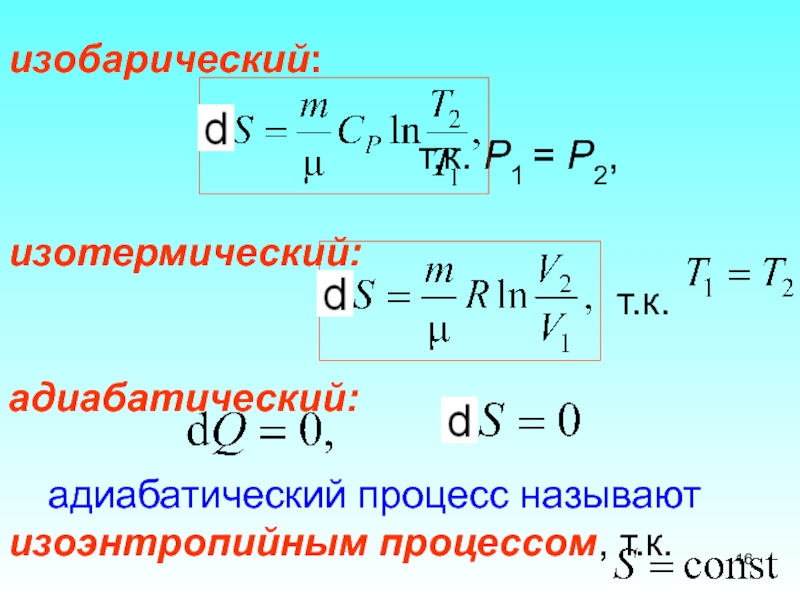
1 2. Каждый из изопроцессов идеального газа характеризуется своим изменением энтропии, а именно: изохорический: ,т.к., V1= V2Слайд 16изобарический:
т.к. Р1 = Р2, изотермический:
т.к. адиабатический: адиабатический процесс называют изоэнтропийным процессом, т.к.Слайд 183. Поведение энтропии в процессах изменения агрегатного состояния
Рассмотрим три
агрегатных состояния: твердое, жидкое и газообразное и два перехода к
ним.Фазовый переход «твердое тело – жидкость»
Из школьного курса физики хорошо известны четыре факта об этом переходе.
Слайд 191. Переход вещества из твердого состояния (фазы) в жидкое называется
плавлением, а обратный – кристаллизация. 2. При плавлении система поглощает тепло,
а при отвердевании – отдает….тепло. 3. В процессе плавления температура системы остается постоянной до тех пор, пока вся система не расплавится эта температура называется температурой плавления.Слайд 204. Закон плавления: количество тепла Q, которое необходимо для плавления
вещества массой dm, пропорционально этой массе:
(7) Коэффициент пропорциональности λ есть константа, зависящая только от вещества системы и называемая удельной теплотой плавления.Слайд 21 Этот закон справедлив и для кристаллизации, правда, с одним отличием:
Q в этом случае – тепло выделяемое системой. В обобщенном
виде закон можно записать так: при плавлении при кристаллизацииСлайд 22 Изменение энтропии в процессе этого фазового перехода можно найти просто,
если считать процесс равновесным. Это вполне допустимое приближение, если считать, что
разность температур между системой и тем объектом, который поставляет системе тепло, не слишком велика, намного меньше температуры плавления.Слайд 23 Тогда можно использовать термодинамический смысл энтропии: с точки зрения термодинамики
энтропия – это такая функция состояния системы, изменение которой dS
в элементарном равновесном процессе равно отношению порции тепла Q, которое система получает в этом процессе, к температуре системы Т:Слайд 25 Так как температура системы в данном фазовом переходе не меняется
и равна температуре плавления, то подынтегральное выражение это величина, которая
в ходе процесса не меняется, поэтому она от массы m вещества не зависит. Тогда: . (8)Слайд 26 Из этой формулы следует, что при плавлении энтропия возрастает, а
при кристаллизации уменьшается. Физический смысл этого результата достаточно ясен:
фазовая область молекулы в твердом теле гораздо меньше, чем в жидкости, так как в твердом теле каждой молекуле доступна только малая область пространства между соседними узлами кристаллической решетки, а в жидкости молекулы занимают всю область пространства.Слайд 27 Поэтому при равной температуре энтропия твердого тела меньше энтропии жидкости. Это
означает, что твердое тело представляет собой более упорядоченную, и менее
хаотичную систему, поэтому и энтропия его меньше, чем у жидкости.Слайд 28Фазовый переход «жидкость – газ»
Этот переход обладает всеми
свойствами перехода «твердое тело – жидкость».
Существует четыре факта
также знакомые из школьного курса физики.1: переход вещества из жидкости в газовую фазу называется испарением, а обратный переход – конденсацией.