Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Молекулярно-генетические методы диагностики
Содержание
- 1. Молекулярно-генетические методы диагностики
- 2. Метод ПЦР позволяет тестировать состояния генов у
- 3. Полимеразная цепная реакция (ПЦР)Полимеразная цепная реакция (ПЦР) или специфическая
- 4. Слайд 4
- 5. Слайд 5
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
- 15. Электрофорез ДНКЭлектрофорез ДНК принципиально не отличается от белкового
- 16. Молекулярная диагностика точковых мутаций миссенс- или нонсенс-типа
- 17. Универсальным методом диагностики точковых мутаций является метод аллель-специфических
- 18. Экспресс-методы — это быстрые предварительные методы изучения
- 19. Скачать презентанцию
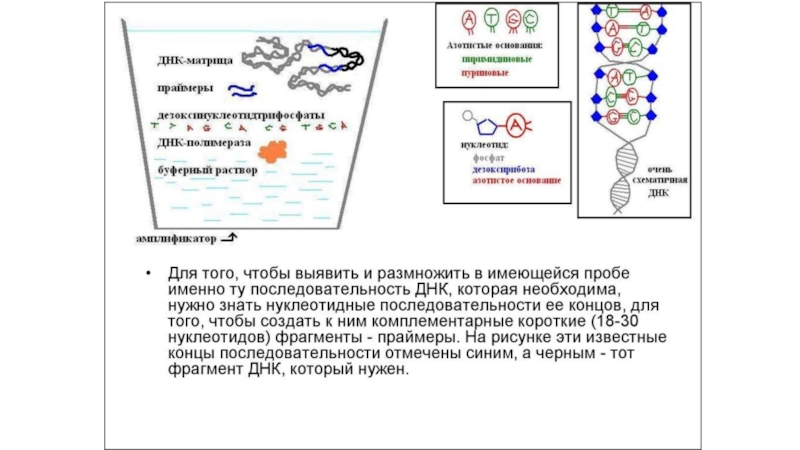
Метод ПЦР позволяет тестировать состояния генов у отдельных индивидуумов. Его суть заключается в избирательном копировании in vitro небольшого фрагмента гена, в котором предположительно может быть локализована мутация, с использованием в качестве
Слайды и текст этой презентации
Слайд 1Молекулярно-генетические методы диагностики
Выполнил: студент 2 курса
Группы СТО17/201-3
Прохорова к.с.
Слайд 3Полимеразная цепная реакция (ПЦР)
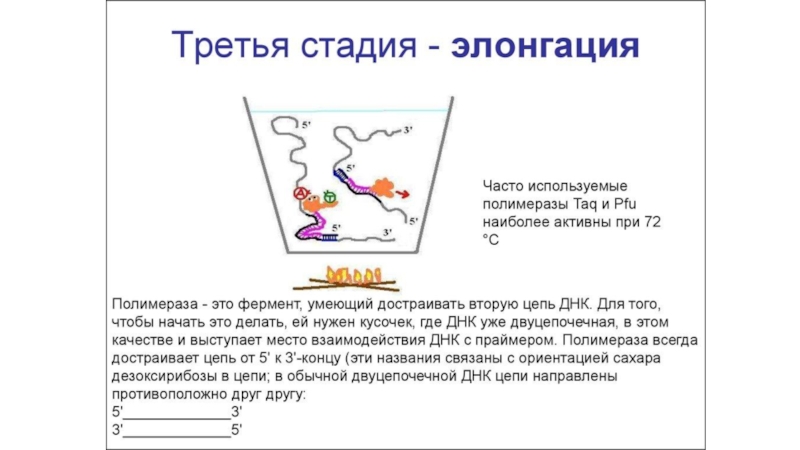
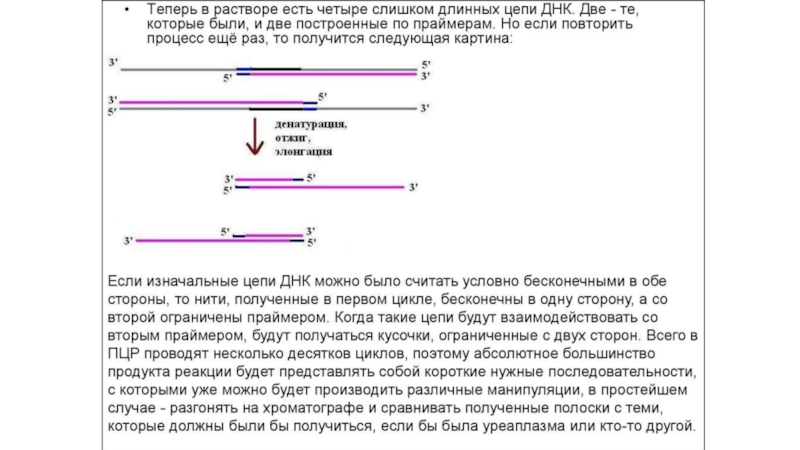
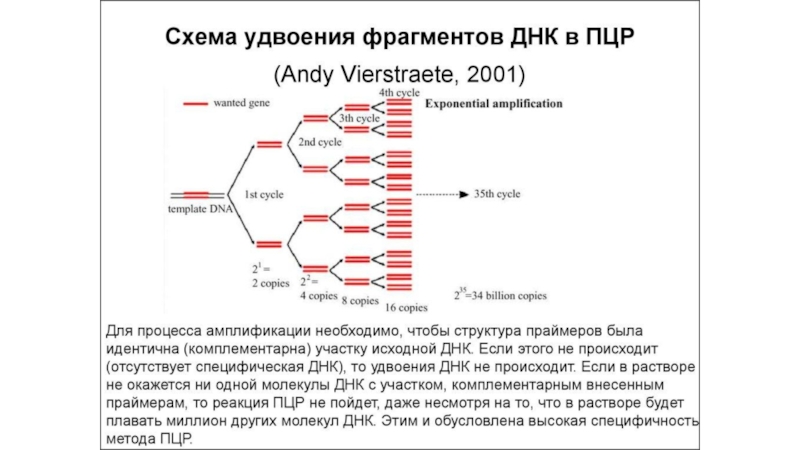
Полимеразная цепная реакция (ПЦР) или специфическая амплификация ДНК это избирательный
синтез in vitro большого количества копий (порядка миллиона) небольшого фрагмента
ДНК размером, обычно, в сотни нуклеотидов по матричной молекуле ДНК. Для проведения ПЦР необходимо искусственно синтезировать небольшие однонитевые молекулы ДНК размером от 15 до 30 нуклеотидов, комплементарные концам амплифицируемого фрагмента ДНК. Эти молекулы носят название праймеры. Они служат «затравкой» для синтеза ДНК и потому определяют его специфичность. ПЦР проводится в специальных одноразовых пробирках в очень небольшом объеме, не превышающем, обычно, 50 мкл. В этот объем определенного буфера добавляют матричную ДНК (ДНК обследуемого), два типа искусственно синтезированных на коммерческой основе праймеров, фермент комплементарного синтеза ДНК – термофильную ДНК-полимеразу, выделенную из термофильных бактерий и потому способную выдерживать высокие температуры, и 4 типа дезокситрифосфатов (dNTP), которые служат в качестве строительного материала для синтеза ДНК.Слайд 15Электрофорез ДНК
Электрофорез ДНК принципиально не отличается от белкового электрофореза. Амплифицированную ДНК
наносят на полиакриломидный или агарозный гель и включают ток. При
этом начинается продвижение ДНК в геле от минуса к плюсу, и скорость этого продвижения зависит от длины молекулы и ее конфигурации. Через определенное время молекулы ДНК одинаковой длины сконцентрируются в узких зонах. Количество копий синтезированных в процессе проведения ПЦР ДНК, обычно, бывает достаточным для ее визуализации при использовании рутинного метода окрашивания ДНК этидиумом бромидом. При добавлении этого красителя к гелю полосы ДНК высвечиваются красным цветом при просмотре геля под ультрафиолетовой лампой.Слайд 16 Молекулярная диагностика точковых мутаций миссенс- или нонсенс-типа более сложна, так
как длина амплифицированного фрагмента при этом не меняется. Наиболее распространенным
методом диагностики таких мутаций является метод рестрикционного анализа. Этот метод может быть использован только в тех случаях, когда мутации случайным образом изменяют последовательности, специфичные для узнавания рестриктазами - эндонуклеазами, катализирующими разрезание двунитевых последовательностей ДНК в местах локализации этих специфических сайтов. При наличии в норме сайта рестрикции произойдет разрезание амплифицированного фрагмента и на электрофореграмме будет две полосы, соответствующие фрагментам ДНК, суммарная длина которых равна величине исходного амплифицированного фрагмента. Исчезновение сайта рестрикции в результате мутации приведет к тому, что у мутантных гомозигот разрезания амплифицированного фрагмента не произойдет и на электрофореграмме будет одна полоса, причем характер ее расположения будет аналогичен тому, который можно наблюдать после электрофореза до рестрикции. У гетерозигот выявятся все три полосы, одна из которых соответствует неразрезанному амплифицированному фрагменту, а две – продуктам рестрикции. В настоящее время идентифицировано более 500 различных рестриктаз, и для каждого из этих ферментов существует свой сайт узнавания.Слайд 17 Универсальным методом диагностики точковых мутаций является метод аллель-специфических олигонуклеотидов (АСО). Этот
метод основан на гибридизации амплифицированных ДНК со специфическими олигонуклеотидными ДНК-зондами. Он более
трудоемок, так как требует синтеза и специфического мечения ДНК-зондов. Однако этот метод поддается автоматизации, и на его базе разрабатываются технологии, позволяющие одновременно тестировать десятки или даже сотни мутаций. При этом используются микрочиповые технологии, то есть меченные олигонуклеотиды в микроколичестве наносятся на твердые носители (чипы), а затем проводится их гибридизация с исследуемыми образцами ДНК.Сходная технология – «микроэррей» – используется для анализа экспрессионного профиля генов, то есть множества генов, избирательно экспрессирующихся в специфических тканях или клетках, у пациентов с определенными патологическими состояниями, различающихся по возрасту, этнической принадлежности и другим параметрам. Техника «микроэррей» позволяет одновременно анализировать экспрессию десятков тысяч генов.
Секвенирование ДНК является самым объективным методом регистрации мутаций, при котором точно идентифицируется молекулярный характер повреждения. Однако в клинической практике этот метод используются редко в виду его трудоемкости и высокой стоимости.
Слайд 18 Экспресс-методы — это быстрые предварительные методы изучения генетики человека. Они
часто используются для исследования больших контингентов людей с целью выявления
наследственной патологии как скрининг-методы, применяемые при проведении просеивающих программ. Например, скрининг новорожденных на фенилкетонурию, гипотиреоз, беременных на альфа-фетопротеин, при помощи которого можно пренаталь-но определить у плода некоторые пороки развития (например, анэнцефалию, открытые формы спинномозговых грыж, синдром Дауна).К этим методам предъявляются определенные требования:
1) метод должен быть диагностически значимым, то есть положительные и отрицательные результаты должны соответствовать наличию или отсутствию заболевания;
2) метод должен быть надежным: один и тот же образец при независимой двукратной проверке должен одинаково оцениваться;
3) исследованию должен подвергаться легкодоступный материал (кровь, моча) в малых количествах (например, пятна капиллярной крови, высушенной на фильтровальной бумаге);
4) метод должен быть приемлемым для обследуемых, исполнителей и врачей;
5) метод должен быть экономичным.