Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХ ГАЗОВ
Содержание
- 1. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХ ГАЗОВ
- 2. Ек >> Еп → газообразное состояниеЕк ≈ Еп → жидкое состояние Ек
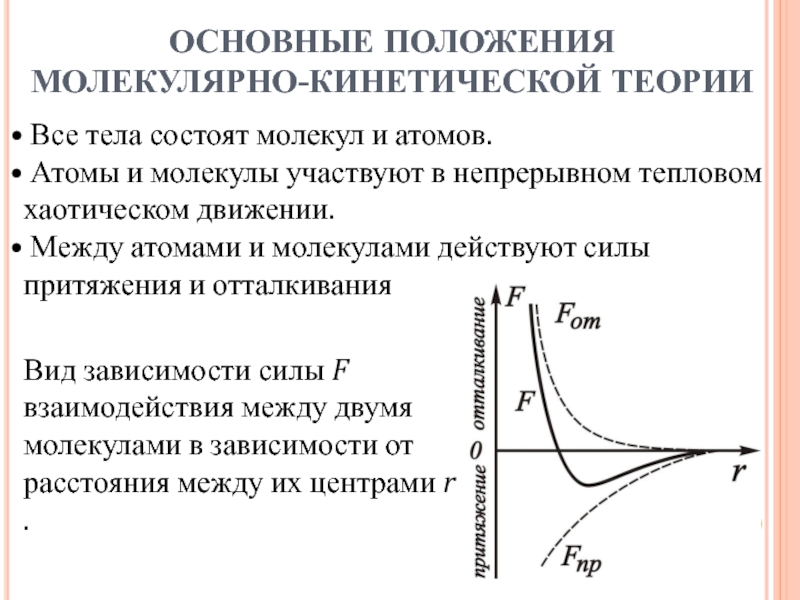
- 3. Все тела состоят молекул и атомов.
- 4. Относительная атомная масса: Относительная молекулярная масса: [1][2]ОСНОВНЫЕ
- 5. NA = 6,02·1023 моль-1 [3]μ = Mr
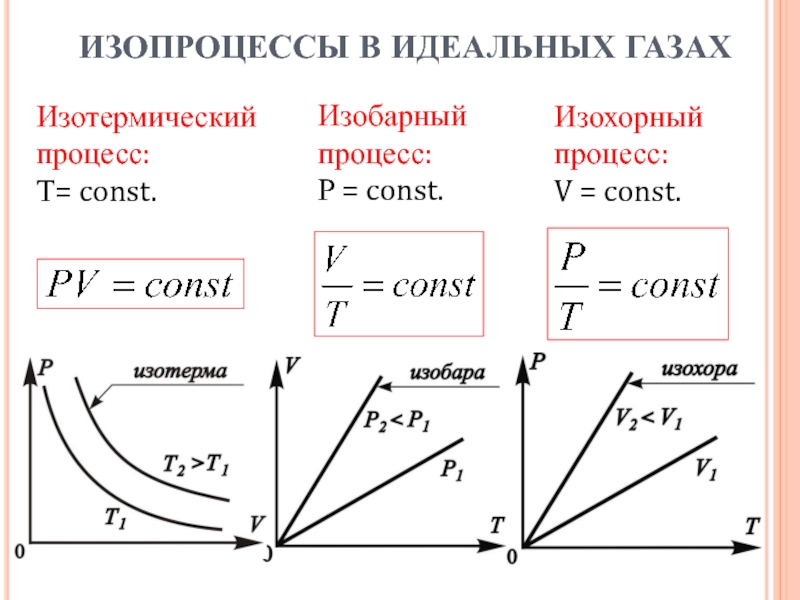
- 6. Изотермическийпроцесс:Т= const. Изобарныйпроцесс: Р = const.Изохорныйпроцесс:V = const. ИЗОПРОЦЕССЫ В ИДЕАЛЬНЫХ ГАЗАХ
- 7. Идеальный газ – это газ, молекулы которого
- 8. Концентрация вещества: [1/м3][5] илиУРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО
- 9. Закон Дальтона: давление смеси идеальных газов равно
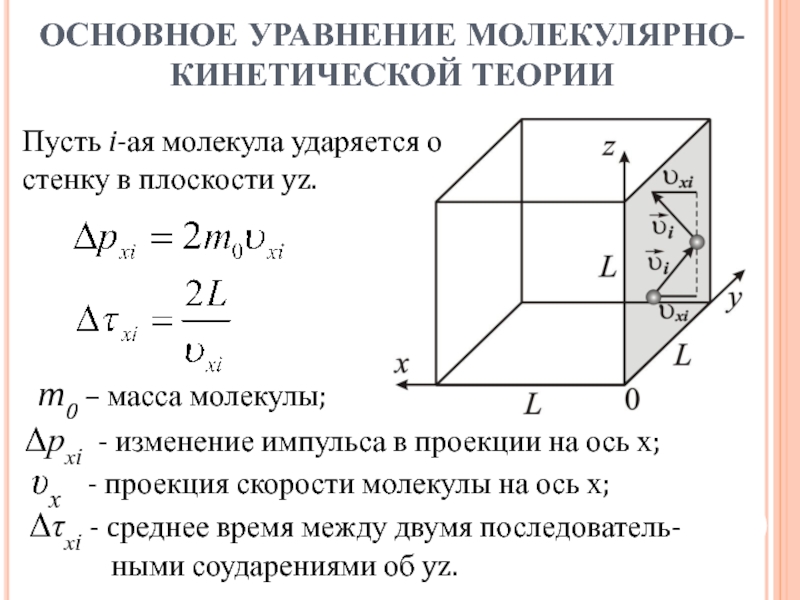
- 10. Рассмотрим идеальный газ в кубическом сосуде со
- 11. Δрхi - изменение импульса в проекции
- 12. Найдем давление как отношение силы к площади
- 13. – среднее значение квадрата скорости молекул
- 14. Среднеквадратичная скорость молекулы:– формула Клаузиуса – основное уравнение МКТ идеальных газов. [11][10]ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
- 15. T = t0С + 273,15 - термодинамическая
- 16. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЙ СМЫСЛ ТЕМПЕРАТУРЫ [12]Кинетическая энергия поступательного движения молекулы:[11][13][7][11]Найдем связь между среднеквадратичной скоростью и температурой.
- 17. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЙ СМЫСЛ ТЕМПЕРАТУРЫ Абсолютная температура есть мера
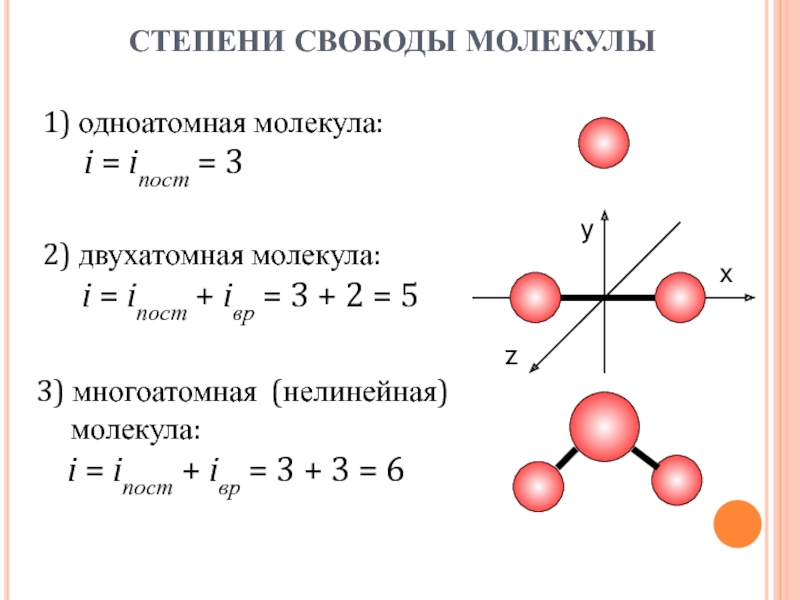
- 18. 1) одноатомная молекула: i =
- 19. РАВНОМЕРНОЕ РАСПРЕДЕЛЕНИЕ КИНЕТИЧЕСКОЙ ЭНЕРГИИ ПО СТЕПЕНЯМ СВОБОДЫ
- 20. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХ ГАЗОВ
Основные положения МКТ
Уравнение состояния идеального газа
Изопроцессы в
газах
молекулыСлайд 2Ек >> Еп → газообразное состояние
Ек ≈ Еп → жидкое
состояние
Ек
различных состоянияхАГРЕГАТНЫЕ СОСТОЯНИЯ
Слайд 3 Все тела состоят молекул и атомов.
Атомы и
молекулы участвуют в непрерывном тепловом хаотическом движении.
Между атомами
и молекулами действуют силы притяжения и отталкивания Вид зависимости силы F взаимодействия между двумя молекулами в зависимости от расстояния между их центрами r .
ОСНОВНЫЕ ПОЛОЖЕНИЯ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
Слайд 4Относительная атомная масса:
Относительная молекулярная масса:
[1]
[2]
ОСНОВНЫЕ ПОЛОЖЕНИЯ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
-
масса изотопа углерода 12
Масса легких атомов и молекул ~ 10-27
кг.Слайд 5NA = 6,02·1023 моль-1
[3]
μ = Mr (г/моль)
(моль) -
количество вещества
N – число частиц вещества
μ - молярная масса
-
ОСНОВНЫЕ
ПОЛОЖЕНИЯ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ1 моль – это такое количество вещества, в котором содержится число частиц, равное числу атомов в 12 г углерода С12.
Число частиц, содержащихся в одном моле любого вещества называется числом Авогадро:
Слайд 6Изотермический
процесс:
Т= const.
Изобарный
процесс:
Р = const.
Изохорный
процесс:
V = const.
ИЗОПРОЦЕССЫ В
ИДЕАЛЬНЫХ ГАЗАХ
Слайд 7Идеальный газ – это газ, молекулы которого можно считать материальными
точками, т. е. расстояния между ними намного превосходят их размеры и
взаимодействием между молекулами можно пренебречь.R = 8,31 Дж/моль⋅К – универсальная газовая постоянная
[4]
УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
Уравнение состояния – уравнение, связывающее параметры состояния термодинамической системы.
Слайд 8Концентрация вещества:
[1/м3]
[5] или
УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
Уравнение (4) можно
записать в виде:
[6]
[7]
Рассмотрим смесь идеальных газов.
Парциальное давление – это давление,
оказываемое на стенки сосуда только молекулами данного сортаСлайд 9Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений
этих газов
Уравнение состояния смеси идеальных газов:
Эффективная молярная масса
газовой смеси:[8]
СМЕСЬ ИДЕАЛЬНЫХ ГАЗОВ
[9]
Слайд 10Рассмотрим идеальный газ в кубическом сосуде со стороной L. Положим:
скорость
молекул одинакова и равна средней υ;
все направления движений молекул равновероятны;
молекулы
не сталкиваются друг с другом, а только со стенками сосуда. ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
Давление газа возникает вследствие ударов молекул о стенки сосуда и определяется средним по времени импульсом передаваемым стенке.
Найдем связь между давлением идеального газа и средней скоростью движения молекул.
Слайд 11
Δрхi - изменение импульса в проекции на ось х;
υх - проекция скорости молекулы на ось х;
Δτхi - cреднее время между двумя последователь- ными соударениями об yz.
Пусть i-ая молекула ударяется о стенку в плоскости yz.
m0 – масса молекулы;
ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
Слайд 12Найдем давление как отношение силы к площади стенки S =
L2:
(V = L3)
Аналогичные уравнения запишем для давления вдоль осей
y и z:Средняя сила с которой молекула действует на стенку yz (согласно 2-му закону Ньютона):
ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
Слайд 13
– среднее значение квадрата скорости молекул
Все направления движений
молекул равновероятны
Просуммируем давления Рxi, Рyi , Рzi :
[10]
ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ
ТЕОРИИСлайд 14Среднеквадратичная скорость молекулы:
– формула Клаузиуса – основное уравнение МКТ идеальных
газов.
[11]
[10]
ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
Слайд 15T = t0С + 273,15
- термодинамическая температура
1oС = 1
К
Т = 0 К – абсолютный ноль
Современные методы охлаждения
позволяют получать Т ~ 6⋅10-12 К.[К]
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЙ СМЫСЛ ТЕМПЕРАТУРЫ
В физике применяется абсолютная термодинамическая шкала температур:
Слайд 16
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЙ СМЫСЛ ТЕМПЕРАТУРЫ
[12]
Кинетическая энергия поступательного движения молекулы:
[11]
[13]
[7]
[11]
Найдем связь между
среднеквадратичной скоростью и температурой.
Слайд 17МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЙ СМЫСЛ ТЕМПЕРАТУРЫ
Абсолютная температура есть мера кинетической энергии поступатель-ного
движения молекул.
[14]
[7]
Найдем связь между
и температурой. [14]
[13]
Слайд 181) одноатомная молекула:
i = iпост = 3
х
y
z
2)
двухатомная молекула:
i = iпост + iвр =
3 + 2 = 5 3) многоатомная (нелинейная)
молекула:
i = iпост + iвр = 3 + 3 = 6
СТЕПЕНИ СВОБОДЫ МОЛЕКУЛЫ
Слайд 19РАВНОМЕРНОЕ РАСПРЕДЕЛЕНИЕ КИНЕТИЧЕСКОЙ ЭНЕРГИИ ПО СТЕПЕНЯМ СВОБОДЫ МОЛЕКУЛЫ
[12]
На каждую
степень свободы поступательного дви-жения молекулы одноатомного газа приходится в среднем
кинетическая энергия, равная ½kT.Средняя кинетическая энергия, приходящаяся при тепловом равновесии на одну любую степень свободы молекулы, равна ½·kT.
[14]
Все направления движения равновероятны
Средняя кинетическая энергия одной молекулы:


![МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХ ГАЗОВ Относительная атомная масса: Относительная молекулярная масса: [1][2]ОСНОВНЫЕ ПОЛОЖЕНИЯ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ- масса Относительная атомная масса: Относительная молекулярная масса: [1][2]ОСНОВНЫЕ ПОЛОЖЕНИЯ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ- масса изотопа углерода 12Масса легких атомов и](/img/thumbs/b272b428e1f6707a6198454d284ff959-800x.jpg)
![МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХ ГАЗОВ NA = 6,02·1023 моль-1 [3]μ = Mr (г/моль) (моль) - количество NA = 6,02·1023 моль-1 [3]μ = Mr (г/моль) (моль) - количество веществаN – число частиц веществаμ -](/img/thumbs/cbea05dd1cb789040f849e6a0c9c3e1e-800x.jpg)

![МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХ ГАЗОВ Концентрация вещества: [1/м3][5] илиУРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗАУравнение (4) можно записать в Концентрация вещества: [1/м3][5] илиУРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗАУравнение (4) можно записать в виде:[6][7]Рассмотрим смесь идеальных газов.Парциальное давление](/img/thumbs/488c2e91833d50a3fb28992a7ee4a71b-800x.jpg)




![МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХ ГАЗОВ Среднеквадратичная скорость молекулы:– формула Клаузиуса – основное уравнение МКТ идеальных газов. [11][10]ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ Среднеквадратичная скорость молекулы:– формула Клаузиуса – основное уравнение МКТ идеальных газов. [11][10]ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ](/img/thumbs/7f34e4586dc76fd31e9fb6293e096591-800x.jpg)

![МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХ ГАЗОВ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЙ СМЫСЛ ТЕМПЕРАТУРЫ [12]Кинетическая энергия поступательного движения молекулы:[11][13][7][11]Найдем связь между среднеквадратичной скоростью и температурой. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЙ СМЫСЛ ТЕМПЕРАТУРЫ [12]Кинетическая энергия поступательного движения молекулы:[11][13][7][11]Найдем связь между среднеквадратичной скоростью и температурой.](/img/thumbs/b9f412ec2006c55d376d090a427f87cc-800x.jpg)
![МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХ ГАЗОВ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЙ СМЫСЛ ТЕМПЕРАТУРЫ Абсолютная температура есть мера кинетической энергии поступатель-ного движения МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЙ СМЫСЛ ТЕМПЕРАТУРЫ Абсолютная температура есть мера кинетической энергии поступатель-ного движения молекул. [14][7]Найдем связь между](/img/thumbs/7d6bcf1c5ae74e83bf55d2b98cbc3be3-800x.jpg)
![МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХ ГАЗОВ РАВНОМЕРНОЕ РАСПРЕДЕЛЕНИЕ КИНЕТИЧЕСКОЙ ЭНЕРГИИ ПО СТЕПЕНЯМ СВОБОДЫ МОЛЕКУЛЫ [12]На каждую степень РАВНОМЕРНОЕ РАСПРЕДЕЛЕНИЕ КИНЕТИЧЕСКОЙ ЭНЕРГИИ ПО СТЕПЕНЯМ СВОБОДЫ МОЛЕКУЛЫ [12]На каждую степень свободы поступательного дви-жения молекулы одноатомного газа](/img/thumbs/e0e199f26a85698abb8868388d7ed89e-800x.jpg)



















