Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Московский Государственный Университет Тонких Химических Технологий им. М.В
Содержание
- 1. Московский Государственный Университет Тонких Химических Технологий им. М.В
- 2. ЛЕКЦИЯ №1Вводная часть. Химический элемент. Периодическая система
- 3. Лекция 12ВВОДНАЯ ЧАСТЬ1. Список необходимых принадлежностей:Толстая тетрадь
- 4. Лекция 13ВВОДНАЯ ЧАСТЬ2. Учебники:Аликберова, Лидин, Молочко, ЛогиноваЛидин, Молочко, АндрееваЛидин, Аликберова, Логинова
- 5. Лекция 14ВВОДНАЯ ЧАСТЬ3. Основная литература:Некрасов.Основы общей химии(в 2-х томах)Неорганическая химия(под ред. Третьякова)(в 3-х томах)Стёпин, Цветков.Неорганическая химия
- 6. Лекция 15ВВОДНАЯ ЧАСТЬ4. Дополнительная литература:(под ред. Равделя)1.
- 7. 6Лекция 1Химический элемент – совокупность атомовс одинаковым
- 8. Лекция 17I. Химический элемент. ПСХЭ. Периодический закон.Периодичность
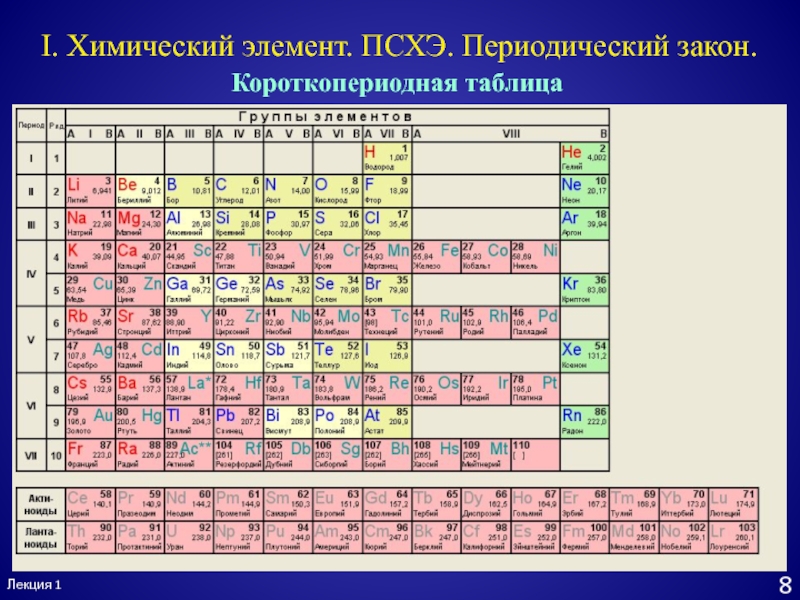
- 9. Лекция 18I. Химический элемент. ПСХЭ. Периодический закон.Короткопериодная таблица
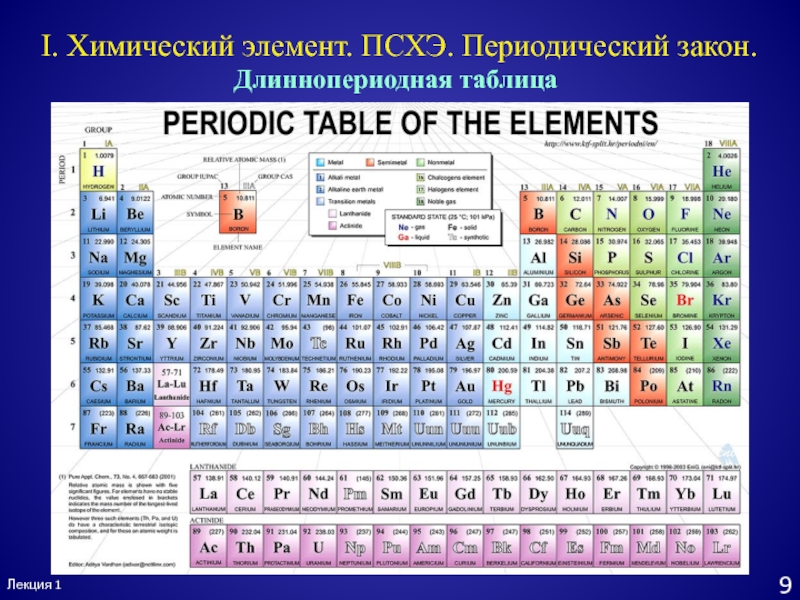
- 10. Лекция 19I. Химический элемент. ПСХЭ. Периодический закон.Длиннопериодная таблица
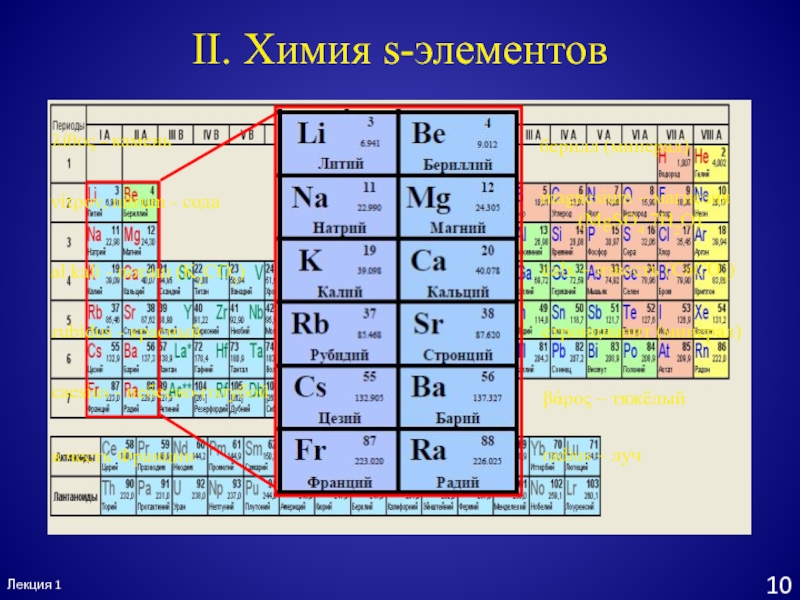
- 11. Лекция 110II. Химия s-элементовβάρος – тяжёлыйберилл (минерал)magnesium
- 12. Лекция 111 1. Общая характеристика s-элементов. 2. Кислородные соединения s-элементов (оксиды, гидроксиды). 3. Химия растворов.II. Химия s-элементов
- 13. Лекция 112II. Химия s-элементов. Общая характеристика.1. Общая
- 14. Лекция 113II. Химия s-элементов. Общая характеристика.1.1. Строение
- 15. Лекция 1141.2. Физико-химические свойства простых веществII. Химия
- 16. Лекция 1151.4. Физико-химические свойства простых веществII. Химия
- 17. Лекция 1161.2. Физико-химические свойства простых веществII. Химия
- 18. Лекция 117II. Химия s-элементов. Общая характеристика.1.3. Химические
- 19. Лекция 118II. Химия s-элементов. Общая характеристика.1.3. Химические
- 20. Лекция 119Б). Основные свойства оксидов и гидроксидов.Г).
- 21. 2 период: очень маленький размер атомов, отсутствие
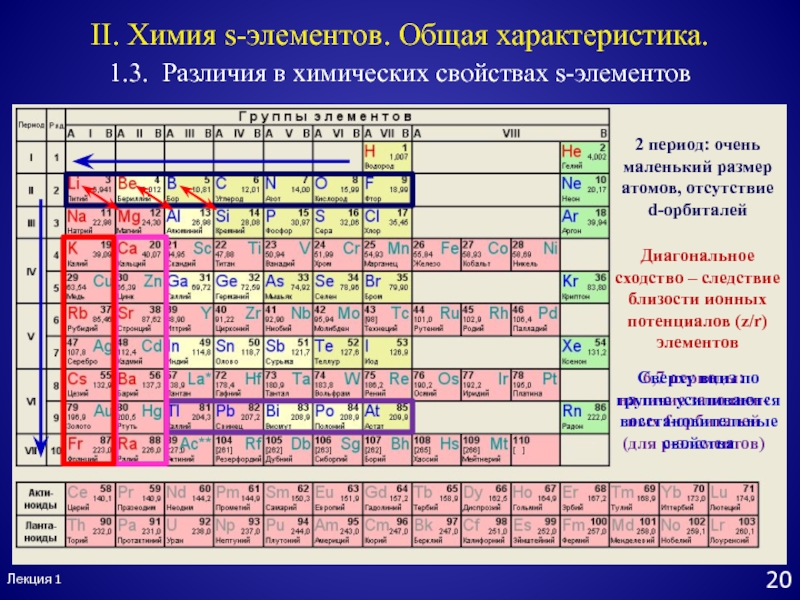
- 22. Лекция 1211.3. Различия в химических свойствах s-элементовII.
- 23. Лекция 1221.3. Различия в химических свойствах s-элементовII.
- 24. Лекция 1231.3. Различия в химических свойствах s-элементовII.
- 25. Лекция 1241.3. Различия в химических свойствах s-элементовII.
- 26. Лекция 1251.4. Химические свойства простых веществII. Химия
- 27. Лекция 1261.4. Химические свойства простых веществII. Химия
- 28. Лекция 1271.4. Химические свойства простых веществII. Химия
- 29. Лекция 128АТОМНО-ЭМИССИОННАЯ СПЕКТРОСКОПИЯ 1.4. Химические свойства простых
- 30. Лекция 1291.5. Нахождение в природеII. Химия s-элементов.
- 31. Лекция 1301.5. Нахождение в природеII. Химия s-элементов.
- 32. Лекция 1311.6. ПолучениеII. Химия s-элементов. Общая характеристика.Li:
- 33. Лекция 1321.6. ПолучениеII. Химия s-элементов. Общая характеристика.К:
- 34. Лекция 1331.6. ПолучениеII. Химия s-элементов. Общая характеристика.Be:
- 35. Лекция 1341.6. ПолучениеII. Химия s-элементов. Общая характеристика.Sr:
- 36. Лекция 1351.7. ПрименениеII. Химия s-элементов. Общая характеристика.Li:
- 37. Лекция 1361.7. ПрименениеII. Химия s-элементов. Общая характеристика.Be:
- 38. Лекция 137II. Химия s-элементов. Кислородные соединения.2. Кислородные
- 39. Лекция 138II. Химия s-элементов. Кислородные соединения.2.2. ГидроксидыБелые
- 40. Лекция 139MOH + H3O+ = 2M+ +
- 41. Лекция 140Б. Химические свойстваII. Химия s-элементов. Кислородные
- 42. Лекция 141Б. Химические свойства (продолжение)II. Химия s-элементов.
- 43. Лекция 142II. Химия s-элементов. Химия растворов.3. Химия
- 44. Лекция 143Условие выпадения осадка малорастворимого электролита.Определите, выпадет
- 45. Лекция 144II. Химия s-элементов. Химия растворов.Механизм роста
- 46. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Московский Государственный Университет Тонких Химических Технологий
им. М.В. Ломоносова
ХИМИЯ ЭЛЕМЕНТОВ
Лектор: ст.
преп., к.х.н. Дорохов Андрей Викторович
Слайд 2ЛЕКЦИЯ №1
Вводная часть.
Химический элемент. Периодическая система химических элементов
им.
Д.И. Менделеева. Периодический закон.
3. Химия s-элементов (I Aи IIA группы):
3.1.
Общая характеристика s-элементов. Свойства простых веществ.3.2. Кислородные соединения s-элементов .
3.3. Малорастворимые соединения s-элементов.
1
Лекция 1
Слайд 3Лекция 1
2
ВВОДНАЯ ЧАСТЬ
1. Список необходимых принадлежностей:
Толстая тетрадь (А5, 96 л)
для лекций
Толстая тетрадь (A4) – лабораторный журнал
Тетрадь для семинаров (А5,
48 л)Две тонких тетради (А5, 18 л) для домашних работ
Калькулятор
ХАЛАТ
УЧЕБНИКИ
Слайд 4Лекция 1
3
ВВОДНАЯ ЧАСТЬ
2. Учебники:
Аликберова, Лидин, Молочко, Логинова
Лидин, Молочко, Андреева
Лидин, Аликберова,
Логинова
Слайд 5Лекция 1
4
ВВОДНАЯ ЧАСТЬ
3. Основная литература:
Некрасов.
Основы общей химии
(в 2-х томах)
Неорганическая химия
(под
ред. Третьякова)
(в 3-х томах)
Стёпин, Цветков.
Неорганическая химия
Слайд 6Лекция 1
5
ВВОДНАЯ ЧАСТЬ
4. Дополнительная литература:
(под ред. Равделя)
1. Дж. Хьюи. Неорганическая
химия (в 2-х томах).
2. Шрайвер, Эткинс. Неорганическая химия (в 2-х
томах).3. Коттон, Уилкинсон. Современная неорганическая химия (в 3-х томах).
4. Турова. Неорганическая химия в таблицах.
5. Анорганикум (в 2-х томах).
Слайд 76
Лекция 1
Химический элемент – совокупность атомов
с одинаковым зарядом ядра.
I. Химический
элемент. ПСХЭ.
Периодический закон.
Химические свойства элементов
определяются электронным строением их атомов
с
одинаковым количеством электроновСлайд 8Лекция 1
7
I. Химический элемент. ПСХЭ. Периодический закон.
Периодичность в электронном
строении атома
Периодичность
химических
свойств элементов
ПЕРИОДИЧЕСКИЙ ЗАКОН (Д.И. Менделеев, 1869 г.)
«Свойства простых веществ, а
также формы и свойства соединений элементов находятся в периодической зависимости от зарядов ядер их атомов»ПСХЭ
им. Д.И. Менделеева
Слайд 11Лекция 1
10
II. Химия s-элементов
βάρος – тяжёлый
берилл (минерал)
magnesium – магнезия
(MgSO4∙7H2O)
calx
– известь (CaCO3)
стронцианит (минерал)
radius – луч
caesius - небесно-голубой
λίθος - камень
νίτρον,
nitrum - содаal kali - поташ (K2CO3)
rubidus - красный
в честь Франции
Слайд 12Лекция 1
11
1. Общая характеристика s-элементов.
2. Кислородные соединения s-элементов (оксиды, гидроксиды).
3.
Химия растворов.
II. Химия s-элементов
Слайд 13Лекция 1
12
II. Химия s-элементов. Общая характеристика.
1. Общая характеристика элементов
1.1.
Строение атома (электронное).
1.2 . Физико-химические свойства простых веществ.
1.3. Химические свойства,
общие для всех элементов группы.1.4. Различия в химических свойствах элементов одной группы.
1.5. Химические свойства простых веществ (отношение к H2O, H3O+, OH-, O2, Hal2).
1.6. Распространённость в природе. История открытия. Методы получения.
1.7. Применение.
Слайд 14Лекция 1
13
II. Химия s-элементов. Общая характеристика.
1.1. Строение атома (валентные подуровни).
I
(IA)
Li, Na, K. Rb, Cs
II (IIA)
Be, Mg, Ca, Sr, Ba
ns1
ns2
Степени
окисления: 0, +1Степени окисления: 0, +2
Простые вещества – очень сильные восстановители!
Простые вещества – металлы!
Соединения Э+I (Э+II) – как правило, ионные (кроме Be)
Электронов мало склонность отдавать электроны
Слайд 15Лекция 1
14
1.2. Физико-химические свойства простых веществ
II. Химия s-элементов. Общая характеристика.
Na
tпл
= 97.83 oC
d = 0.968 г/см3
Li
tпл = 179 oC
d
= 0.534 г/см3K
tпл = 63.55 oC
d = 0.862 г/см3
Rb
tпл = 39 oC
d = 1.532 г/см3
Cs
tпл = 28.5 oC
d = 1.90 г/см3
Слайд 16Лекция 1
15
1.4. Физико-химические свойства простых веществ
II. Химия s-элементов. Общая характеристика.
Be
tпл
= 1285 oC
d = 1.85 г/см3
Ca
tпл = 851 oC
d
= 1.54 г/см3Ra
tпл = 700 oC
d = 5.5 г/см3
Sr
tпл = 770 oC
d = 2.63 г/см3
Mg
tпл = 651 oC
d = 1.74 г/см3
Ba
tпл = 710 oC
d = 3.76 г/см3
Слайд 17Лекция 1
16
1.2. Физико-химические свойства простых веществ
II. Химия s-элементов. Общая характеристика.
Электроотрицательность
– условная величина, характеризующая относительную способность атома
приобретать отрицательный заряд.
Потенциал
ионизации – потенциал, необходимый для удаления электрона (в основном состоянии)из атома на бесконечность.
Потенциал ионизации – количественная мера электроположительности атома (способности приобретать
положительный заряд).
Электродный потенциал – потенциал между металлическим электродом и раствором электролита:
(измеренный относительно СВЭ)
IA: М+ +1ē = Mо
IIA: M2+ + 2ē = Mо
Электродный потенциал – количественная мера окислительно-восстановительной способности соединения.
Слайд 18Лекция 1
17
II. Химия s-элементов. Общая характеристика.
1.3. Химические свойства, общие для
всех элементов групп
A). Сильные восстановительные свойства простых веществ
восстановление водорода из воды и кислот-неокислителей:M + H2O = H2↑ + MOH
(все, кроме Li, - со взрывом!!!)
M + 2H2O = H2↑ + M(OH)2
вытеснение менее активных металлов из их оксидов и солей (твёрдых!):
(Mg – при нагревании)
M + H2SO4(р) = H2↑ + M2SO4
(c воспламенением или взрывом!!!)
M + 2HCl = H2↑ + MCl2
(очень бурно!)
С кислотами-окислителями реакции идут с воспламенением или взрывом
с образованием смеси продуктов с преобладанием наиболее восстановленных форм.
Na + H2SO4 (к) H2O + Na2SO4 + H2S (S, Na2S, SO2, H2)
Слайд 19Лекция 1
18
II. Химия s-элементов. Общая характеристика.
1.3. Химические свойства, общие для
всех элементов групп
A). Сильные восстановительные свойства простых веществ (продолжение)
взаимодействие с большинством неметаллов:MH + H2O = MOH + H2
M3P + 3H2O = 3MOH + PH3
MH2 + 2H2O = M(OH)2 + H2
M3P2 + 6H2O = 3M(OH)2 + 2PH3
Гидриды
Фосфиды
(при растирании или нагревании)
Слайд 20Лекция 1
19
Б). Основные свойства оксидов и гидроксидов.
Г). Растворимость в жидком
аммиаке.
M + (x+y)NH3(ж) = [M(NH3)x]+ + ē·(NH3)y
тёмно-синие жидкости
MOH +
H3O+ = M+ + 2H2OMO + 2H3O+ = M2+ + 3H2O
II. Химия s-элементов. Общая характеристика.
1.2. Химические свойства, общие для всех элементов групп
В). Образование амальгам.
xNa + yHg = “NaxHgy” + Q
NaHg2, Na3Hg2, Na3Hg и др.
твёрдые
жидкие
(получение NaOH электролизом раствора NaCl со ртутным катодом)
Кроме бериллия! Бериллий – амфотерен!
MOH = M+ + OH-
Слайд 212 период: очень маленький размер атомов, отсутствие
d-орбиталей
6,7 периоды: наличие
заполнен-ных f-орбиталей (для p-элементов)
Диагональное сходство – следствие близости ионных потенциалов
(z/r) элементовЛекция 1
20
1.3. Различия в химических свойствах s-элементов
II. Химия s-элементов. Общая характеристика.
Сверху вниз по группе усиливаются восстановительные свойства
Слайд 22Лекция 1
21
1.3. Различия в химических свойствах s-элементов
II. Химия s-элементов. Общая
характеристика.
A). Взаимодействие с кислородом
4Li + O2 = 2Li2O
2Na + O2
= Na2O2K(Rb,Cs) + O2 = K(Rb,Cs)O2
оксид лития
пероксид натрия
надпероксид калия
2M + O2 = 2MO
Б). Взаимодействие с азотом
6Li + N2 = 2Li3N
Нитриды
3Mg + N2 = Mg3N2
Остальные s-элементы с азотом практически не взаимодействуют
Li3N + 3H2O = 3LiOH + NH3
Mg3N2 + 3H2O = 3Mg(OH)2 + 2NH3
t
t
Слайд 23Лекция 1
22
1.3. Различия в химических свойствах s-элементов
II. Химия s-элементов. Общая
характеристика.
В). Малорастворимые соединения:
Li, Mg
гидроксиды: LiOH, Mg(OH)2;
фториды: LiF, MgF2;
карбонаты: Li2CO3, MgCO3;
фосфаты: Li3PO4, Mg3(PO4)2
Na
перхлорат: NaClO4;
гексагидроксоантимонат: Na[Sb(OH)6];
цинкуранилацетат: Na[Zn(UO2)3(H2O)6(CH3COO)9]
K, Rb,
Csперхлораты: MClO4;
хлораты: MClO3;
гексанитрокобальтаты: M3[Co(NO2)6]
тетрафенилбораты: M[B(C6H5)4]
гидротартраты: MHC4H4O6
Слайд 24Лекция 1
23
1.3. Различия в химических свойствах s-элементов
II. Химия s-элементов. Общая
характеристика.
В). Малорастворимые соединения (продолжение)
Ca, Sr, Ba
гидроксиды: M(OH)2
карбонаты: MCO3
оксалаты: MC2O4
фториды: MF2
сульфиды: MS
увеличение растворимости в ряду Ca
Baфосфаты: M3(PO4)2
сульфаты: MSO4
хроматы: MCrO4
уменьшение растворимости в ряду Ca Ba
Слайд 25Лекция 1
24
1.3. Различия в химических свойствах s-элементов
II. Химия s-элементов. Общая
характеристика.
В). Малорастворимые соединения (продолжение)
Хроматный метод разделения катионов ЩЗМ
Произведения растворимости (ПР)
хроматов ЩЗМCaCrO4 SrCrO4 SrCrO4
растворим 2.7·10-5 1.1·10-10
1. Ca2+ + CrO4 ≠
Sr2+ + CrO42- = SrCrO4↓
Ba2+ + CrO42- = BaCrO4↓
SrCrO4(т) + 2CH3COOH = SrCr2O7 + (CH3COO)2Sr + H2O
BaCrO4(т) + 2CH3COOH ≠
Хромат бария растворим только в сильных кислотах!
Слайд 26Лекция 1
25
1.4. Химические свойства простых веществ
II. Химия s-элементов. Общая характеристика.
A).
На воздухе быстро окисляются
4Li + O2 = 2Li2O
6Li + N2
= 2Li3N2Na + O2 = Na2O2
K(Rb,Cs) + O2 = K(Rb,Cs)O2
2M + O2 = 2MO
3Mg + N2 = Mg3N2
Б). Бурно реагируют с водой и кислотами
M + H2O = H2↑ + MOH
M + 2H2O = H2↑ + M(OH)2
M + H2SO4(р) = H2↑ + M2SO4
M + 2HCl = H2↑ + MCl2
ЩМ и ЩЗМ хранят под слоем не смешивающегося с водой инертного растворителя
(керосин, вазелиновое масло) или в запаянных ампулах с инертной атмосферой.
(цезий и рубидий самовоспламеняются)
(часто с воспламенением или взрывом)
Слайд 27Лекция 1
26
1.4. Химические свойства простых веществ
II. Химия s-элементов. Общая характеристика.
В).
Энергично реагируют с галогенами:
2M + Hal2 = 2MHal + Q
M
+ Hal2 = MHal2 + Qt
t
и другими неметаллами:
t
Обращение со щелочными и щелочноземельными металлами
требует неукоснительного соблюдения правил техники безопасности!
Слайд 28Лекция 1
27
1.4. Химические свойства простых веществ
II. Химия s-элементов. Общая характеристика.
Г).
Окрашивание пламени растворами солей ЩМ и ЩЗМ
Пламя – низкотемпературная плазма
(ионы, электроны).Процессы, происходящие при внесении раствора соли в пламя (плазму):
Атомизация:
Na+ + ē Na*
Излучательный переход атома из возбуждённое состояние в основное:
Na* Na + h
Энергии излучения h характеристичны для каждого атома.
E
h
Слайд 29Лекция 1
28
АТОМНО-ЭМИССИОННАЯ СПЕКТРОСКОПИЯ
1.4. Химические свойства простых веществ
II. Химия s-элементов.
Общая характеристика.
Г). Окрашивание пламени растворами солей ЩМ и ЩЗМ
ЛИТИЙ
НАТРИЙ
КАЛИЙ
РУБИДИЙ
ЦЕЗИЙ
КАЛЬЦИЙ
СТРОНЦИЙ
БАРИЙ
Бунзен, Кирхгоф.
1859 г.Слайд 30Лекция 1
29
1.5. Нахождение в природе
II. Химия s-элементов. Общая характеристика.
ЛИТИЙ: 6.5·10-3
%
Основные минералы: сподумен (LiAl[Si2O6]), лепидолит (KLi1.5Al1.5[Si3AlO10](F, OH)2), цинвальдит (KLi(Fe,Mg)Al[Si3AlO10](F, OH)2).
НАТРИЙ:
2.64% - 6 место в земной коре среди всех элементовОсновные минералы: галит (NaCl), мирабилит (Na2SO4·10H2O), чилийская селитра (NaNO3), криолит (3NaF·AlF3), бура (Na2B4O7·10H2O).
Натрий – незаменимый элемент для живых организмов.
КАЛИЙ: 2.40% - 7 место в земной коре среди всех элементов
Основные минералы: сильвин (КCl), карналлит (KCl·MgCl2·6H2O), каинит (KCl·MgSO4·3H2O), полевые шпаты (алюмосиликаты).
Калий – незаменимый элемент для живых организмов.
РУБИДИЙ: 0.031%, в рассеянном виде.
Собственных минералов не образует. Сопутствующий в алюмосиликатах.
Основной источник – лепидолит, цинвальдит (добыча попутно с литием).
ЦЕЗИЙ: 7·10-4 %, редкий элемент, в рассеянном виде.
Собственных минералов не образует. Сопутствующий в алюмосиликатах.
Основной источник – лепидолит, цинвальдит (добыча попутно с литием).
Слайд 31Лекция 1
30
1.5. Нахождение в природе
II. Химия s-элементов. Общая характеристика.
БЕРИЛЛИЙ: 6·10-4%,
редкий элемент
Основной минерал: берилл (Be3Al2[Si6O18])
Разновидности: фенакит, хризоберил, александрит, аквамарин, изумруд.
КАЛЬЦИЙ:
3.6% - 5 место в земной коре среди всех элементовОсновные минералы: кальцит, арагонит, мрамор (CaCO3), ангидрит (CaSO4), гипс (CaSO4·2H2O), флюорит (CaF2), апатит (Ca5(PO4)3 (F, Cl)).
Кальций – незаменимый элемент для живых организмов.
СТРОНЦИЙ: 0.04%, в рассеянном виде
Основные минералы: стронцианит (SrCO3), целестин (SrSO4).
БАРИЙ: 0.05%,
Основные минералы: барит (BaSO4), витерит (BaCO3).
РАДИЙ: 10-10 %, редкий элемент, в рассеяном виде
В урановых рудах как продукт распада урана или тория.
К настоящему времени добыто всего около 1.5 кг. радия.
Слайд 32Лекция 1
31
1.6. Получение
II. Химия s-элементов. Общая характеристика.
Li: открыт Юханом Арфведсоном
в 1817г.,
впервые получен Хемфри Дэви
в 1818 г. электролизом оксида лития.Современные методы получения:
Электролиз расплава LiCl (с добавлением KCl или BaCl2).
Na: впервые получен Хемфри Дэви в 1807 г. электролизом расплава NaOH.
Современные методы получения:
Электролиз расплава NaCl (с добавлением KCl, NaF или CaCl2).
Электролиз расплава NaOH
Электролизёр Даунса.
Слайд 33Лекция 1
32
1.6. Получение
II. Химия s-элементов. Общая характеристика.
К: впервые получен Х.
Дэви в 1807 г. электролизом твёрдого влажного КOH.
Современные методы получения:
Na(ж)
+ КОН(ж) К(ж) + NaOH(ж) (380-440 оС)Na(г) + KCl(ж) К(г) + NaCl(ж) (760-800 оС)
2Al + 6KCl + 4CaO = 6K↑ + 3CaCl2 + CaAl2O4 (900 оС)
Rb: впервые открыт спектрально Робертом Бунзеном и Густавом Кирхгофом в 1861 г.,
получен Бунзеном в 1863 г. восстановлением гидротартрата рубидия углеродом.
Современные методы получения:
2RbCl + Ca = CaCl2 + 2Rb↑ (700-800 оС)
Rb2CrO4 + Zr = Rb↑ + ZrCrO4 (850 оС)
2RbN3 = 3N2 + Rb (390 – 500 оС, вакуум)
Cs: впервые открыт спектрально Бунзеном и Кирхгофом в 1860 г.,
получен Сеттербергом в 1862 г. электролизом расплава CsCN.
Современные методы получения: аналогично рубидию.
Слайд 34Лекция 1
33
1.6. Получение
II. Химия s-элементов. Общая характеристика.
Be: открыт Луи Вокленом
в 1798 г.,
впервые получен Ф. Вёлером и А. Бюсси
в 1828 г. восстановлением BeCl 2 калием.Современные методы получения:
Электролиз расплава BeCl2 (в смеси с NaCl при 350 оС)
BeF2 + Mg = MgF2
Mg: впервые получен А. Бюсси в 1828 г. восстановлением MgCl 2 калием .
Современные методы получения:
Электролиз MgCl2 (в смеси с NaCl, KCl, CaCl2 при 720-750 оС)
MgO + C Mg + CO (2100 оС)
MgO + CaO + Si = Mg + CaSiO3 (1280 – 1300 оС, вакуум)
Ca: впервые получен Х. Дэви в 1808 г электролизом.
Современные методы получения:
Электролиз расплава CaCl2 (в смеси с NaCl при 350 оС)
6CaO + 3Al = Ca↑ + 3CaAl2O4 (1200 оС, вакуум)
Слайд 35Лекция 1
34
1.6. Получение
II. Химия s-элементов. Общая характеристика.
Sr: открыт Кроуфордом в
1790 г., впервые получен Х. Дэви электролизом Sr(OH)2.
Современные методы получения:
4SrO
+ 2Al = Sr↑ + SrAl2O4 (1100-1150 оС, вакуум)Ba: открыт Карлом Шееле в 1774 г., впервые получен Х. Дэви в 1808 г. электролизом.
Современные методы получения: аналогично стронцию.
Ra: открыт Марией Склодовской-Кюри и Пьером Кюри в 1898 г . в урановой смоляной руде, впервые получен Марией Кюри и Дебьерном в 1910 г. электролизом RaCl2 .
Современные методы получения:
Электролиз раствора RaCl2 (со ртутным катодом)
Ra(N3)2 = 3N2 + Ra (180-250 оС, вакуум)
Слайд 36Лекция 1
35
1.7. Применение
II. Химия s-элементов. Общая характеристика.
Li: ● химические источники
тока
● ядерная энергетика (получение трития, теплоноситель)
● сплавы для авиакосмической промышленности
●
металлургия (раскисление и десульфуризация металлов)Na: ● ядерная энергетика (жидкий натрий - теплоноситель)
● медицина (физиологический раствор – 0.5% р-р NaCl)
● производство стёкол, бумаги (Na2SO4·10H2O)
● натриевые лампы
● моющие средства
● производство хлора и его соединений
● пищевая промышленность (NaCl, NaHCO3)
К: ● регенерация воздуха (KO2)
● медицина
● ядерная энергетика (жидкий калий - теплоноситель)
● пиротехника (KClO3), дымный порох (KNO3).
● производство стёкол, моющих средств
Rb: ● фотоэлементы; газопоглотитель в вакуумных лампах.
Cs: ● фотоэлементы, МГД-генераторы, ионные двигатели ракет
Слайд 37Лекция 1
36
1.7. Применение
II. Химия s-элементов. Общая характеристика.
Be: ● ренгеновские трубки
●
сплавы для авиакосмической промышленности
Mg: ● необходимый для жизнедеятельности растений микроэлемент
● металлургия
(магнийтермия)● сверхлёгкие сплавы для авиакосмической промышленности
● производство огнеупорных материалов, стройматериалов
● пиротехника
● медицина
Ca: ● необходимый для жизнедеятельности элемент
● производство стройматериалов, стекла и бумаги
● медицина
● кальцийтермическое получение металлов
● металлургия (получение сплавов)
● оптика (флюорит, исландский шпат)
Sr: ● фотоэлементы и люминофоры; атомные электрические батареи
Ba: ● пиротехника (BaO2)
● медицина (BaSO4 – рентгеноскопия ЖКТ)
Соли Li, Na, K, Ca, Sr, Ba – в пиротехнике для получения цветных огней.
Слайд 38Лекция 1
37
II. Химия s-элементов. Кислородные соединения.
2. Кислородные соединения
2.1. Оксиды
Белые тугоплавкие
кристаллические вещества с ионной структурой.
А. Получение
Б. Химические свойства
1) Взаимодействие с
водой (кроме BeO):Li2O + H2O = 2LiOH MO + H2O = M(OH)2
2) Основные свойства (кроме BeO)
Li2O + 2H3O+ = 2Li+ + 3H2O MO + CO2 = MCO3
t
t
Слайд 39Лекция 1
38
II. Химия s-элементов. Кислородные соединения.
2.2. Гидроксиды
Белые кристаллические вещества с
ионной структурой.
А. Получение
В промышленности:
MO + H2O = M(OH)2
В лаборатории:
M2+ + 2OH- = M(OH)2↓MO + H2O = M(OH)2
Электролиз водных растворов солей
Б. Растворимость
LiOH – малорастворим.
LiOH(т) Li+ + OH-
ПР = [Li+][OH-] = 4·10-2 (L = 0.2 моль/л).
Остальные – хорошо растворимы
(до 15 моль/л и выше)
Малорастворимы.
M(OH)2(т) M2+ + 2OH-
ПР = [M2+][OH-]2
Be Mg Ca Sr Ba
ПР 8·10-22 6·10-10 6·10-6 3·10-4 5·10-3
Слайд 40Лекция 1
39
MOH + H3O+ = 2M+ + 2H2O M(OH)2 + 2H3O+
= M2+ + H2O
M2O + SO3 = M2SO4 M(OH)2 + CO2
= MCO3↓+ H2OBe(OH)2 – амфотерный:
Be (OH)2 + 2H3O+ = Be2+ + 3H2O
Be(OH)2 + 2OH- = [Be(OH)4]2-
В. Химические свойства
1) Термическое разложение:
MOH ≠ M(OH)2 = MO + H2O
(плавятся без разложения) (разлагаются при нагревании)
2) Основные свойства (кроме Be(OH)2)
MOH = M+ + OH- M(OH)2 = M+ + 2OH-
(сильные основания, кроме Mg(OH)2)
II. Химия s-элементов. Кислородные соединения.
2.2. Гидроксиды
Слайд 41Лекция 1
40
Б. Химические свойства
II. Химия s-элементов. Кислородные соединения.
2.2. Пероксиды, надпероксиды,
озониды
А. Получение
2Na + O2 = Na2O2
2BaO + O2 = 2BaO2(избыток O2, 270 – 370 oC)
K + O2 = KO2
4KOH + 4O3 = 4KO3 + 2H2O + O2
1). Взаимодействие с водой:
Na2O2 + H2O NaOH + NaHO2 обратимый гидролиз
4KO2 + 2H2O = 4KOH + 3O2 (выше 20 oC) ОВР
4KO3 + 2H2O = 4KOH + 5O2 ОВР
2). Пероксиды, надпероксиды и озониды – сильнейшие окислители:
3Na2O2 + Al = 2NaAlO2 + 2Na2O BaO2 + Mg = BaO + MgO
2KO2 + S = K2SO4
C металлами и органическими веществами – с воспламенением или со взрывом!
Слайд 42Лекция 1
41
Б. Химические свойства (продолжение)
II. Химия s-элементов. Кислородные соединения.
2.2. Пероксиды,
надпероксиды, озониды
3). Взаимодействие с оксидами углерода:
2Na2O2 + 2CO2 = 2Na2CO3
+ O2 2BaO2 + 2CO2 = 2BaCO3 + O24KO2 + 2CO2 = 2K2CO3 + 3O2
4KO3 + 2CO2 = 2K2CO3 + 5O2
Na2O2 + CO = Na2CO3
2KO2 + CO = K2CO3 + O2
2KO3 + CO = K2CO3 + 2O2
Регенерация воздуха в подводных лодках, космических кораблях, танках-амфибиях, убежищах. Дыхательные аппараты пожарных, горноспасателей, подводников.
Слайд 43Лекция 1
42
II. Химия s-элементов. Химия растворов.
3. Химия растворов
Произведение растворимости. Растворимость.
AmBn
(т) mAn+ + nBm- равновесие осадок - раствор
ПР = [An+]m[Bm-]n
- произведение растворимостиLi2CO3 (т) 2Li+ + CO32-
ПР = [Li+]2[CO32-] = 1.9·10-3
Растворимость L = ?
Решение:
Li2CO3 (т) 2Li+ + CO32-
L 2L L
ПР = [Li+]2[CO32-] = (2L)2·L = 4L3
L = (ПР/4)1/3 = (1.9·10-3/4)1/3 = 0.078 моль/л.
Слайд 44Лекция 1
43
Условие выпадения осадка малорастворимого электролита.
Определите, выпадет ли осадок фосфата
кальция при сливании 50 мл раствора хлорида бария с концентрацией
10-3 моль/л и 10 мл раствора фосфата натрия с концентрацией 10-2 моль/л.Решение:
3BaCl2 + 2Na3PO4 = 2Ba3(PO4)2 ↓+ 6NaCl
Ba3(PO4)2 (т) 3Ba2+ + 2PO43-
ПР = [Ba2+]3[PO43-]2 = 6.0·10-39
Условие выпадения осадка:
II. Химия s-элементов. Химия растворов.
Слайд 45Лекция 1
44
II. Химия s-элементов. Химия растворов.
Механизм роста сталактитов и сталагмитов.
в
толще почвы и горных пород:
Ca(CO3)2(т) + CO2 + H2O =
2Ca(HCO3)2 растворение известнякав пещерах:
Ca(HCO3)2 = CaCO3↓ + CO2↑ + H2O↑ осаждение известняка
















![Московский Государственный Университет Тонких Химических Технологий
им. М.В Лекция 119Б). Основные свойства оксидов и гидроксидов.Г). Растворимость в жидком аммиаке.M Лекция 119Б). Основные свойства оксидов и гидроксидов.Г). Растворимость в жидком аммиаке.M + (x+y)NH3(ж) = [M(NH3)x]+ + ē·(NH3)yтёмно-синие](/img/thumbs/ef56afe0fbd94bbda8be15da84172d62-800x.jpg)








![Московский Государственный Университет Тонких Химических Технологий
им. М.В Лекция 1291.5. Нахождение в природеII. Химия s-элементов. Общая характеристика.ЛИТИЙ: 6.5·10-3 %Основные Лекция 1291.5. Нахождение в природеII. Химия s-элементов. Общая характеристика.ЛИТИЙ: 6.5·10-3 %Основные минералы: сподумен (LiAl[Si2O6]), лепидолит (KLi1.5Al1.5[Si3AlO10](F, OH)2),](/img/thumbs/0c09315a31a9ba727c437ab60bbb37d6-800x.jpg)
![Московский Государственный Университет Тонких Химических Технологий
им. М.В Лекция 1301.5. Нахождение в природеII. Химия s-элементов. Общая характеристика.БЕРИЛЛИЙ: 6·10-4%, редкий Лекция 1301.5. Нахождение в природеII. Химия s-элементов. Общая характеристика.БЕРИЛЛИЙ: 6·10-4%, редкий элементОсновной минерал: берилл (Be3Al2[Si6O18])Разновидности: фенакит, хризоберил,](/img/tmb/3/286252/e47ebf44f9f8e59be6be05741d36ef48-800x.jpg)

































