Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Московский Государственный Университет Тонких Химических Технологий им. М.В
Содержание
- 1. Московский Государственный Университет Тонких Химических Технологий им. М.В
- 2. ЛЕКЦИЯ №2Химия p-элементов. Общие сведения.Химия галогенов. 3.1. Общая
- 3. Радиус атома,металличностьЭлектроотрицательность,потенциал ионизацииЛекция 2I. Химия p-элементов. Общие сведения.ns2np1ns2np5
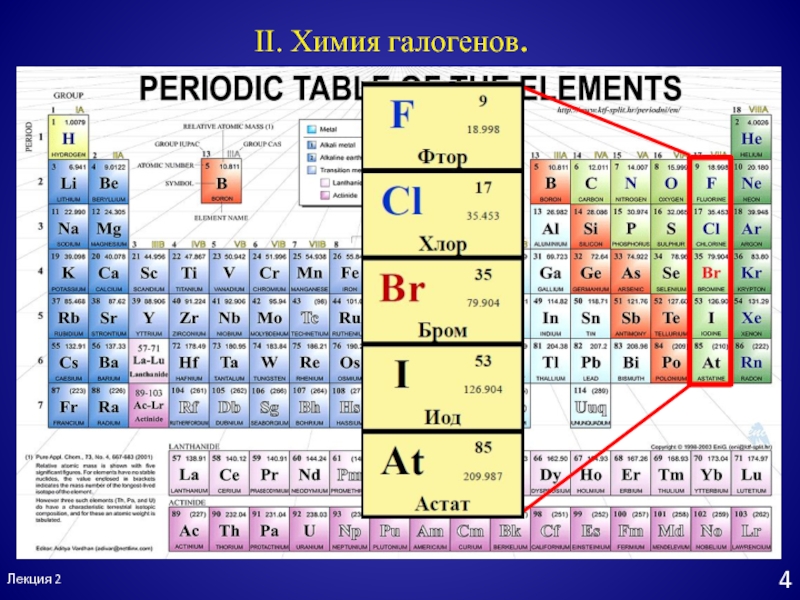
- 4. Галогены – «рождающие соль»άλός- сольγεννάω - рождатьφθόρος
- 5. Лекция 2 1. Общая характеристика галогенов. 2. Галогеноводороды. 3. Кислородные соединения галогенов.II. Химия галогенов.
- 6. Лекция 2II. Галогены. Общая характеристика.1. Общая характеристика
- 7. Лекция 2II. Химия галогенов. Общая характеристика.1.1. Строение
- 8. Лекция 21.2. Физико-химические свойства простых веществII. Химия
- 9. Лекция 21.2. Физико-химические свойства простых веществII. Химия
- 10. Лекция 2II. Химия галогенов. Общая характеристика.1.3. Химические
- 11. Лекция 2Б). Кислотные свойства растворов галогеноводородовHHal +
- 12. 2 период: очень маленький размер атомов, отсутствие
- 13. Лекция 21.3. Различия в химических свойствах галогеновII.
- 14. Лекция 21.3. Различия в химических свойствах галогеновII.
- 15. Лекция 21.3. Различия в химических свойствах галогеновII.
- 16. Лекция 21.4. Химические свойства простых веществII. Химия
- 17. Лекция 2Г). Энергично реагируют с металламии неметалламиОбращение
- 18. Лекция 21.5. Нахождение в природеII. Химия галогенов.
- 19. Лекция 21.6. ПолучениеII. Химия галогенов. Общая характеристика.F2:
- 20. Лекция 21.6. ПолучениеII. Химия галогенов. Общая характеристика.Cl2:
- 21. Лекция 21.6. ПолучениеII. Химия галогенов. Общая характеристика.Br2:
- 22. Лекция 21.6. ПолучениеII. Химия галогенов. Общая характеристика.At2:
- 23. Лекция 21.7. ПрименениеII. Химия галогенов. Общая характеристика.F:
- 24. Лекция 2II. Химия галогенов. Галогеноводороды.2. ГалогеноводородыА. Физико-химические
- 25. Лекция 2Б. ПолучениеHF В промышленности: CaF2 + H2SO4(конц) =
- 26. Лекция 2Б. ПолучениеII. Химия галогенов. Галогеноводороды.HBr и
- 27. Лекция 2В. Химические свойстваII. Химия галогенов. Галогеноводороды.1)
- 28. Лекция 2В. Химические свойстваII. Химия галогенов. Галогеноводороды.2).
- 29. Лекция 2В. Химические свойстваII. Химия галогенов. Галогеноводороды.4).
- 30. Лекция 2II. Химия галогенов. Кислородные соединения.3. Кислородные соединения3.1. ОксидыА. Строение и физико-химические свойства
- 31. Лекция 2O-II [He]2s22p6 донорCl+I
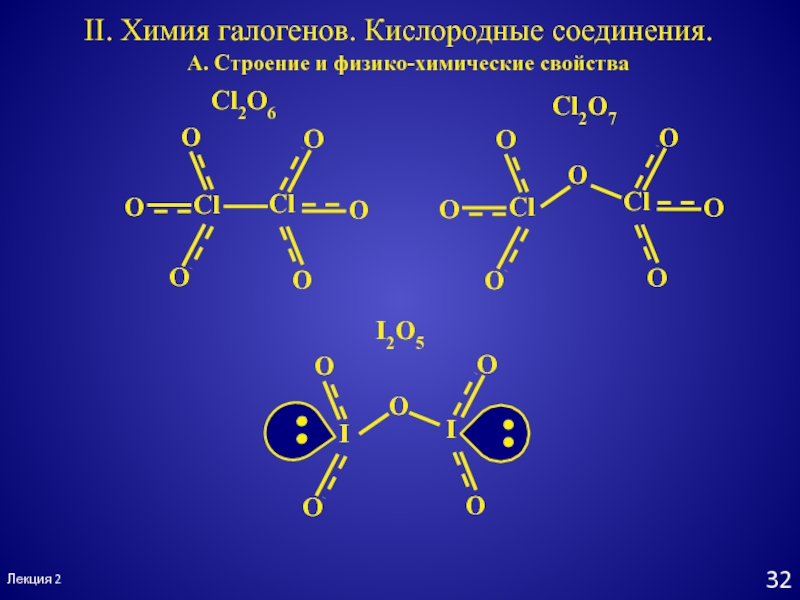
- 32. Лекция 2II. Химия галогенов. Кислородные соединения.А. Строение и физико-химические свойстваCl2O6Cl2O7I2O5
- 33. Лекция 2Б. ПолучениеII. Химия галогенов. Оксиды.
- 34. Лекция 2В. Химические свойстваII. Химия галогенов. Оксиды.1).
- 35. Лекция 2II. Химия галогенов. Кислородные соединения.3.1. Кислородные
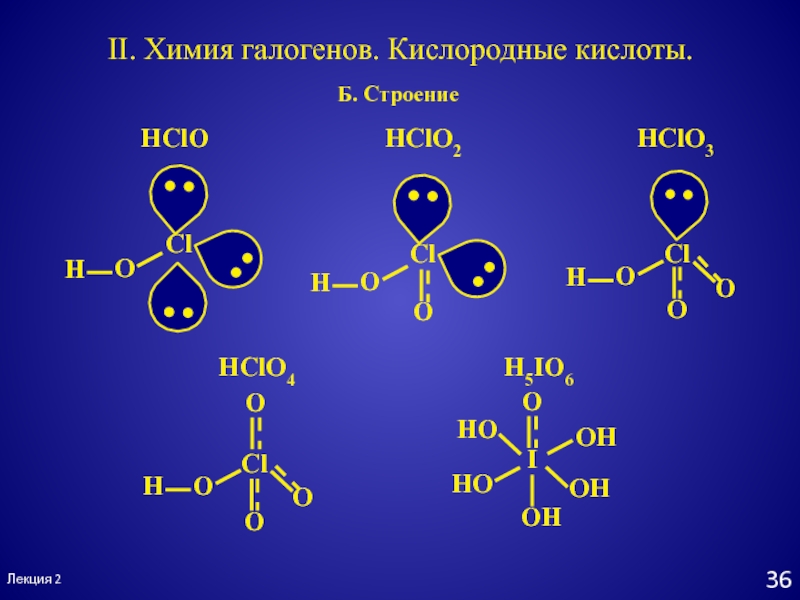
- 36. Лекция 2Б. СтроениеII. Химия галогенов. Кислородные кислоты.HClOHClO2HClO3HClO4H5IO6
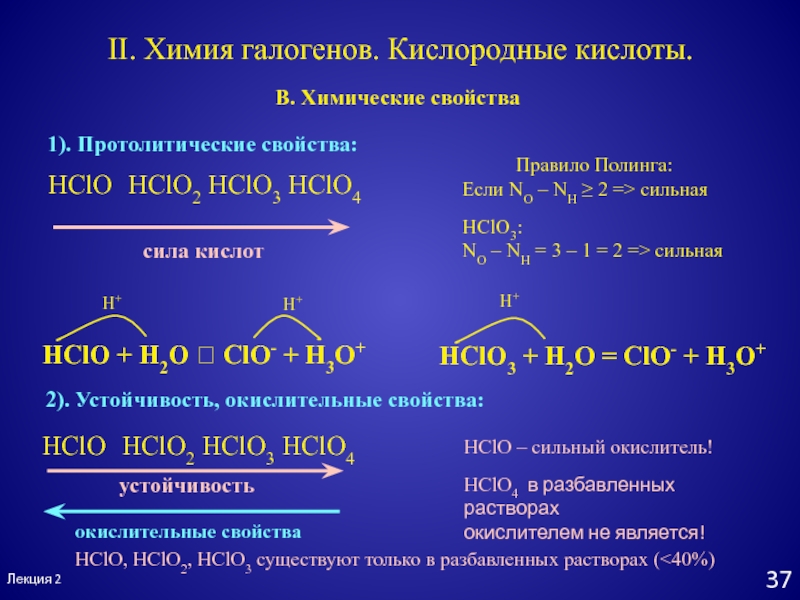
- 37. Лекция 2II. Химия галогенов. Кислородные кислоты.В. Химические
- 38. Лекция 2II. Химия галогенов. Кислородные кислоты.В. Химические
- 39. Лекция 2II. Химия галогенов. Кислородные кислоты.В. Химические
- 40. Лекция 2II. Химия галогенов. Кислородные кислоты.В. Химические
- 41. Лекция 2II. Химия галогенов. Кислородные кислоты.Г. ПолучениеHal2
- 42. Лекция 2II. Химия галогенов. Кислородные кислоты.Г. ПолучениеClO3-
- 43. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Московский Государственный Университет Тонких Химических Технологий
им. М.В. Ломоносова
ХИМИЯ ЭЛЕМЕНТОВ
Лектор: ст.
преп., к.х.н. Дорохов Андрей Викторович
Слайд 2ЛЕКЦИЯ №2
Химия p-элементов. Общие сведения.
Химия галогенов.
3.1. Общая характеристика галогенов. Свойства
простых веществ.
3.2. Галогеноводороды.
3.3. Кислородные соединения галогенов.
1
Лекция
2Слайд 3Радиус атома,
металличность
Электроотрицательность,
потенциал ионизации
Лекция 2
I. Химия p-элементов. Общие сведения.
ns2np1
ns2np5
Слайд 4Галогены – «рождающие соль»
άλός- соль
γεννάω - рождать
φθόρος - разрушение
χλωρός -
зелёный
βρῶμος - зловоние
ἰώδης- фиолетовый
ἄστατος- неустойчивый
Лекция 2
II. Химия галогенов.
Слайд 5Лекция 2
1. Общая характеристика галогенов.
2. Галогеноводороды.
3. Кислородные соединения галогенов.
II. Химия
галогенов.
Слайд 6Лекция 2
II. Галогены. Общая характеристика.
1. Общая характеристика элементов
1.1. Строение
атома (электронное).
1.2 . Физико-химические свойства простых веществ.
1.3. Химические свойства, общие
для всех элементов группы.1.4. Различия в химических свойствах элементов одной группы.
1.5. Химические свойства простых веществ (отношение к H2O, H3O+, OH-, O2, Hal2).
1.6. Распространённость в природе. История открытия. Методы получения.
1.7. Применение.
Слайд 7Лекция 2
II. Химия галогенов. Общая характеристика.
1.1. Строение атома (валентные подуровни).
XVII
(VIIA)
F, Cl, Br. I, At
ns2np5
E
1. Степени окисления: все от -I
до +VII (кроме F); устойчивые – нечётные;наиболее устойчивая степень окисления: -I.
Простые вещества – очень сильные окислители!
Простые вещества – неметаллы!
2. До завершения подуровня не хватает одного электрона склонность
принимать электроны.
3. Простые вещества – двухатомные (Hal2).
4. Соединения Э-I – как правило, ионные.
Слайд 8Лекция 2
1.2. Физико-химические свойства простых веществ
II. Химия галогенов. Общая характеристика.
Cl2
tк
= -33.6 oC
d = 3.214 г/см3
F2
tк = -188 oC
d =
1.693 г/см3Br2
tк = 58.8 oC
d = 3.102 г/см3
I2
tпл = 113.5 oC
d = 4.940 г/см3
At2
tпл = 302 oC
Период полураспада: ~ 8 ч.
Максимальное количество: ~ 2∙10-9 г
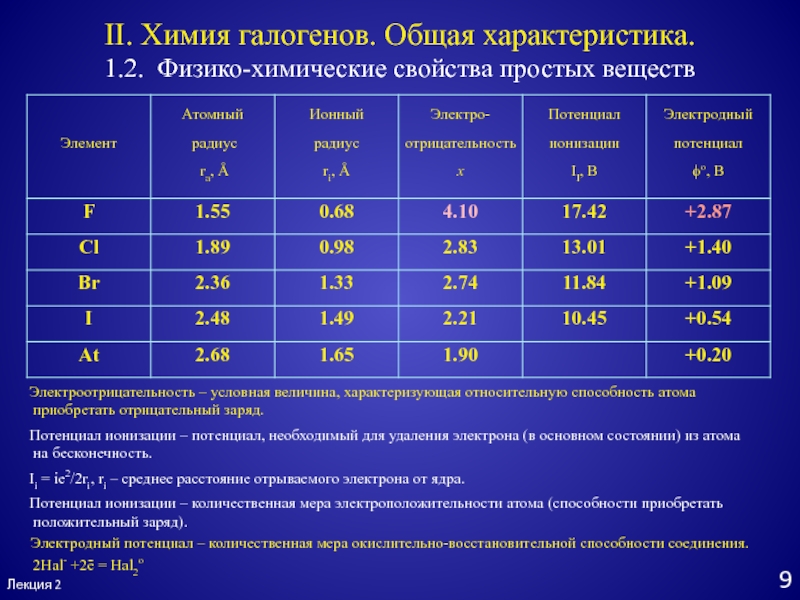
Слайд 9Лекция 2
1.2. Физико-химические свойства простых веществ
II. Химия галогенов. Общая характеристика.
Электроотрицательность
– условная величина, характеризующая относительную способность атома
приобретать отрицательный заряд.
Потенциал
ионизации – потенциал, необходимый для удаления электрона (в основном состоянии) из атомана бесконечность.
Ii = ie2/2ri, ri – среднее расстояние отрываемого электрона от ядра.
Потенциал ионизации – количественная мера электроположительности атома (способности приобретать
положительный заряд).
2Hal- +2ē = Hal2о
Электродный потенциал – количественная мера окислительно-восстановительной способности соединения.
Слайд 10Лекция 2
II. Химия галогенов. Общая характеристика.
1.3. Химические свойства, общие для
всех элементов групп
A). Сильные окислительные свойства простых веществ
окисление металлов:
Cl2 +
Cu = CuCl2Br2 + Al = AlBr3
окисление неметаллов (кроме O2 и N2):
t
H2O
5Cl2 + 2P = 2PCl5
5Cl2 + 2Sb = 2SbCl5
2S + Br2 = S2Br2
окисление других веществ:
Hal2 + H2S = S + 2HHal
SO32- + 2Hal2 + H2O = SO42- + 2Hal- + 2H+
окисление некоторых органических веществ (например, скипидар) –
с воспламенением, фтор – со взрывом!)
(с воспламенением)
(хлор, бром - с воспламенением,
фтор – со взрывом!)
Слайд 11Лекция 2
Б). Кислотные свойства растворов галогеноводородов
HHal + H2O = Hal-
+ H3O+
(Hal = Cl, Br, I)
II. Химия галогенов. Общая характеристика.
1.2.
Химические свойства, общие для всех элементов группHF + H2O F- + H3O+
В). Кислотные свойства оксидов
Сl2O7 + 2NaOH = NaClO4 + H2O
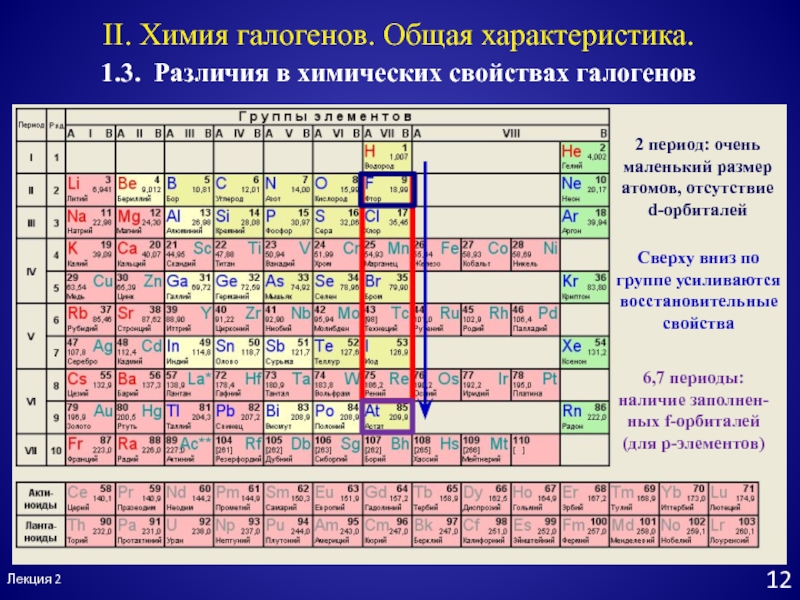
Слайд 122 период: очень маленький размер атомов, отсутствие
d-орбиталей
Сверху вниз по
группе усиливаются восстановительные свойства
Лекция 2
1.3. Различия в химических свойствах галогенов
II.
Химия галогенов. Общая характеристика.6,7 периоды: наличие заполнен-ных f-орбиталей (для p-элементов)
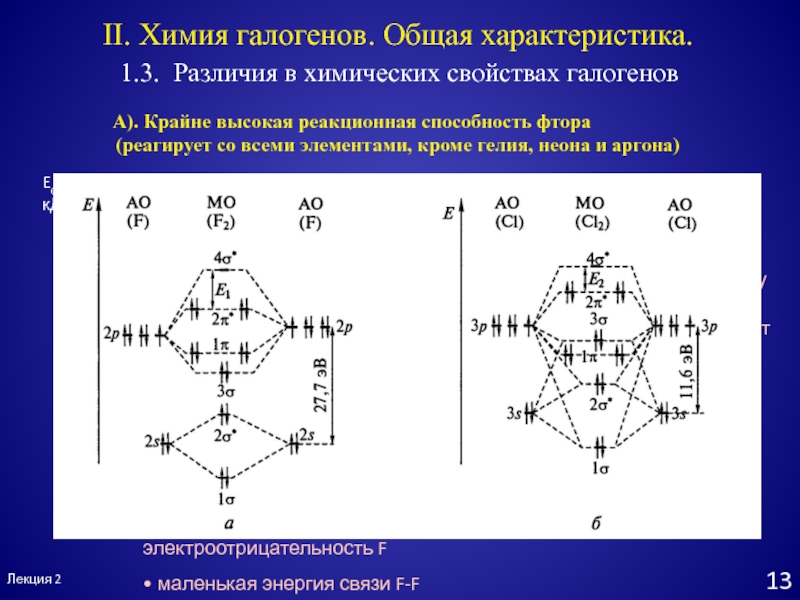
Слайд 13Лекция 2
1.3. Различия в химических свойствах галогенов
II. Химия галогенов. Общая
характеристика.
A). Крайне высокая реакционная способность фтора
(реагирует со всеми элементами, кроме
гелия, неона и аргона)Энергия связи Hal-Hal
Eсв, кДж/моль
F2
Cl2
Br2
I2
• очень маленький размер атомов F
(сильное отталкивание электронов)
• большая разница в энергии между
s- и p- орбиталями фтора
(2s – орбитали фтора не участвуют
в образовании связи галоген-галоген)
• высокая электроотрицательность F
• маленькая энергия связи F-F
с ростом длины связи
её прочность падает
Слайд 14Лекция 2
1.3. Различия в химических свойствах галогенов
II. Химия галогенов. Общая
характеристика.
Б). Взаимодействие с водой
2F2 + H2O(ж) = OF2 + 2HF
(от 0 до 90 оС)2F2 + 2H2O(г) = O2 + 4HF (выше 90 оС)
F2 + H2O(к) = HOF + HF (ниже 0 оС)
фторид
кислорода
Фторооксигенат (0)
водорода
Cl2 + H2O(ж) HClO + HCl (на холоду)
3Cl2 + 3H2O(ж) = HClO3 + 5HCl (при нагревани)
Бром – аналогично хлору.
Иод с водой практически не взаимодействует.
хлорноватистая
кислота
хлорноватая
кислота
окисление
воды
дисмутация
галогена
Раствор хлора в воде – хлорная вода. Cl2(aq)
Слайд 15Лекция 2
1.3. Различия в химических свойствах галогенов
II. Химия галогенов. Общая
характеристика.
В). Вытеснение более электроположительного галогена
более электроотрицательным
из галогенидовCl2 + 2NaBr = Br2 + 2NaCl
Br2 + NaI = I2 + 2NaBr
Галоген, стоящий в группе выше,
вытесняет нижестоящий.
Г). Фтор разъедает стекло
F2 + SiO2 = SiF4 + O2
Изделия для работы со фтором изготовляют из никеля и его сплавов, меди,
нержавеющей стали.
восстановительные
свойства
Слайд 16Лекция 2
1.4. Химические свойства простых веществ
II. Химия галогенов. Общая характеристика.
А).
С компонентами воздуха не взаимодействуют (кроме фтора)
Б). Реагируют с водой
и растворами щелочейCl2 + H2O(ж) HClO + HCl (на холоду)
3Cl2 + 3H2O(ж) = HClO3 + 5HCl (при нагревани)
Бром – аналогично хлору.
Иод с водой практически не взаимодействует.
Но растворяется в иодиде калия: I2 (т) + KI = K[I(I2)]
Cl2 + NaOH = NaClO + NaCl + H2O (на холоду)
3Cl2 + 6KOH = KClO3 + 5KCl + 3H2O (при нагревани)
Бром – аналогично хлору.
3I2 + 6NaOH = NaIO3 + 5NaI + 3H2O (при любой температуре)
гипохлорит
натрия
хлорат
калия
иодат
натрия
Слайд 17Лекция 2
Г). Энергично реагируют с металлами
и неметаллами
Обращение с галогенами требует
неукоснительного соблюдения
правил техники безопасности!
1.4. Химические свойства простых веществ
II. Химия
галогенов. Общая характеристика.Cl2 + Cu = CuCl2
Br2 + Al = AlBr3
(с воспламанением)
5Cl2 + 2P = 2PCl5
5Cl2 + 2Sb = 2SbCl5
3Cl2 + I2 = 2ICl3
В). С кислотами-неокислителями не взаимодействуют
Д). Галогены крайне токсичны!
Слайд 18Лекция 2
1.5. Нахождение в природе
II. Химия галогенов. Общая характеристика.
ФТОР: 0.065%
Основные
минералы: флюорит (CaF2), фторапатит (Ca5(PO4)3), криолит (Na3AlF6).
Незаменимый элемент для
животных (входит в состав костной ткани).ХЛОР: 0.045%
Основные минералы: галит (NaCl), сильвин (КCl), сильвинит (NaCl ·KCl) карналлит (KCl·MgCl2·6H2O), каинит (КСд·MgSO4·3H2O), бишофит (MgCl2·6H2O) и др. В виде хлоридов – основной компонент морской воды.
Незаменимый элемент для жизнедеятельности живых организмов.
БРОМ: 1.6·10-4 %, редкий элемент, в рассеянном виде.
Собственных минералов не образует. Присутствует в природных и буровых водах; концентрируется в некоторых водорослях.
ИОД: 3·10-5 %, редкий элемент, в рассеянном виде.
Собственных минералов не образует. Встречается в буровых водах; концентрируется некоторыми организмами (например, водорослями).
Незаменимый микроэлемент для жизнедеятельности человека.
Слайд 19Лекция 2
1.6. Получение
II. Химия галогенов. Общая характеристика.
F2: впервые получен А.
Муассаном в 1886 г. электролизом HF.
Современные методы получения:
Промышленный метод -
электролиз расплава KHF2 или KH2F3:анод (никелевая сетка): 2HF + 2ē = H2↑ + 2F-
катод (угольный): 2F- -2ē = F2↑
Лабораторные методы:
2CoF3 = 2CoF2 + F2↑
K3[NiF6] = 2KF + NiF2 + F2↑
K3[NiF6] + 2HF(ж) = 2KHF2 + NiF2 + F2↑
K3[MnF6] + TiF4 = K2[TiF6] + MnF2 + F2
t
t
t
Слайд 20Лекция 2
1.6. Получение
II. Химия галогенов. Общая характеристика.
Cl2: впервые получен Карлом
Шееле в 1774 г. при взаимодействии MnO2 с HCl.
Современные методы
получения:Промышленный метод - электролиз раствора NaCl:
анод (графит): 2H2O + 2ē = H2↑ + 2OH-
катод (сталь или ртуть): 2Cl- -2ē = Cl2↑
Лабораторные методы:
2KMnO4 (т)+ 16HCl(конц) = 5Cl2↑ + 2MnCl2 + 2KCl + 8H2O
MnO2 (т) + 4HCl(конц) = Cl2↑ + MnCl2 + 2H2O
PbO2 (т) + 4HCl = Cl2↑ + PbCl2 + 2H2O
2KClO3 (т) + 12HCl = 5Cl2↑ + 2KCl + 6H2O
t
t
Слайд 21Лекция 2
1.6. Получение
II. Химия галогенов. Общая характеристика.
Br2: открыт Антуаном Баларом
в 1826 г. в рассолах средиземноморских соляных промыслов.
Современные методы
получения:Промышленный метод - обработка природных и буровых вод хлором:
Cl2 + Br- = Br2↑ + 2Cl-
Лабораторный метод:
MnO2 (т) + 2NaBr (т) + 3H2SO4 (конц) = Br2↑ + MnSO4 + 2NaHSO4 + 2H2O
I2: впервые получен Бернаром Куртуа в 1811 г. из золы морских водорослей.
Современные методы получения:
Промышленный метод:
2I- + 2NaNO2 + 4H3O+ = I2↓ + 2Na+ + 2NO↑ + 6H2O
Лабораторные методы:
2NaI + 2H2SO4(р) + 2NaNO2 = I2↓ + 2Na2SO4 + 2NO↑ + 4H2O
5KI + KIO3 + 3H2SO4(р) = 3I2↓ + 3K2SO4 + 3H2O
Слайд 22Лекция 2
1.6. Получение
II. Химия галогенов. Общая характеристика.
At2: существование элемента предсказано
Д.И. Менделеевым («экаиод»).
Впервые получен в
1940 Д. Корсоном, К. Маккензи и Э. Сегре (США).Астат является наиболее редким элементом среди всех, обнаруженных в природе. В поверхностном слое земной коры толщиной 1.6 км содержится всего 70 мг астата.
Современные методы получения:
Облучение висмута или тория высокоэнергетическими α-частицами.
Слайд 23Лекция 2
1.7. Применение
II. Химия галогенов. Общая характеристика.
F: ● ядерная энергетика
(UF6)
● электротехника (SF6)
● производство фторопластов, хладагентов (фреонов)
● ракетное топливо (фториды
галогенов и кислорода)Cl: ● органический синтез (полимеры, пестициды, фреоны и т.д.)
● цветная металлургия (извлечение, разделение и очистка металлов)
● дезинфицирующие и отбеливающие средства (NaClO, Ca(ClO)2)
● производство спичек (KClO3)
● производство пестицидов, гербицидов, дефолиантов
● пиротехника (KClO4, KClO3, NaClO3)
● пищевая промышленность, медицина (NaCl)
● СДЯВ (БОВ) (например, фосген: COCl2)
Br: ● медицина («бром » – KBr)
● производство фотоматериалов (AgBr)
I: ● медицина
● цветная металлургия (рафинирование металлов)
● галогенные лампы
Слайд 24Лекция 2
II. Химия галогенов. Галогеноводороды.
2. Галогеноводороды
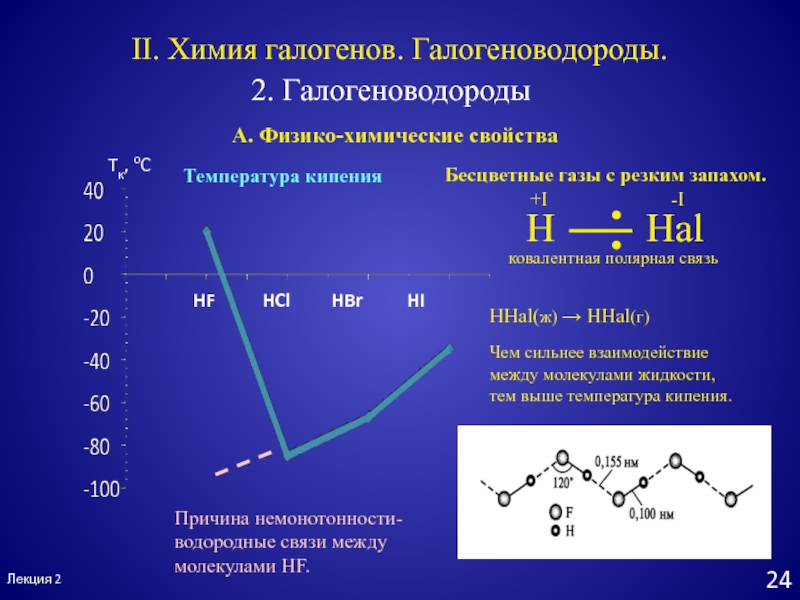
А. Физико-химические свойства
Причина немонотонности-
водородные связи
между
молекулами HF.
Дальнейший монотонный рост-
результат увеличения массы и
размера молекул HHal и,
как следствие, усиление взаимодей-
ствия между ними.
Температура кипения
HHal(ж) → HHal(г)
Чем сильнее взаимодействие
между молекулами жидкости,
тем выше температура кипения.
Бесцветные газы с резким запахом.
Слайд 25Лекция 2
Б. Получение
HF В промышленности:
CaF2 + H2SO4(конц) = CaSO4↓ + 2HF↑
(150-300 oC)
В лаборатории:
CaF2 + H2SO4 = CaSO4↓ + 2HF↑
KHF2
= KF + HF↑HCl В промышленности:
Cl2 + H2 = 2HCl↑ (сжигание хлора в избытке водорода)
Хлорирование углеводородов (побочный продукт)
В лаборатории:
NaCl + H2SO4(конц) = NaHSO4 + HCl↑
HBr В промышленности и в лаборатории:
HI 2P + 3Hal2 = 2PHal3; PHal3 + 3H2O = 3HHal↑ + H2PHO3
SO2 + Hal2 + 2H2O = 2HHal↑ + H2SO4
BaS + 4Hal2 + 4H2O = 8HHal↑ + BaSO4↓
H2S + Hal2 = 2HHal + S↓ (в присутствии воды)
II. Химия галогенов. Галогеноводороды.
t
t
Слайд 26Лекция 2
Б. Получение
II. Химия галогенов. Галогеноводороды.
HBr и HI нельзя получить
таким же методом, что и НСl!
2NaBr + 3H2SO4(конц) = Br2↓
+ SO2↑ + 2NaHSO4 + 2H2O8KI + 9H2SO4(конц) = 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
KHal + H3PO4 = HHal↑ + KH2PO4
(Hal = Cl, Br, I)
t
Слайд 27Лекция 2
В. Химические свойства
II. Химия галогенов. Галогеноводороды.
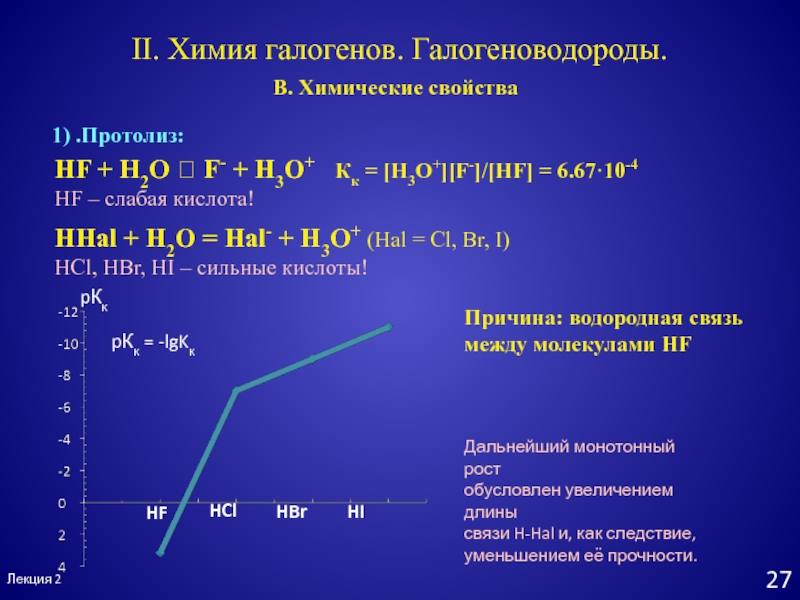
1) .Протолиз:
HHal + H2O
= Hal- + H3O+ (Hal = Cl, Br, I)
HCl, HBr,
HI – сильные кислоты!HF + H2O F- + H3O+ Кк = [H3O+][F-]/[HF] = 6.67·10-4
HF – слабая кислота!
Причина: водородная связь
между молекулами HF
HF
HCl
HBr
HI
pКк
pКк = -lgKк
Дальнейший монотонный рост
обусловлен увеличением длины
связи H-Hal и, как следствие,
уменьшением её прочности.
Слайд 28Лекция 2
В. Химические свойства
II. Химия галогенов. Галогеноводороды.
2). Взаимодействие с металлами:
HF
+ Zn = ZnF2 + H2
6HCl + 2Al = 2AlCl3
+ 3H24HI + Hg = H2[HgI4] + 2H2
Галогеноводородные кислоты-
кислоты – неокислители!
3). Взаимодействие с основными и амфотерными оксидами
и гидроксидами и гидроксокомплексами:
3HF + AlO(OH) = AlF3 + 2H2O
6HCl + Fe2O3 = 2FeCl3 + 3H2O
4HBr + Na2[Zn(OH)4] = 2NaBr + ZnBr2 + 4H2O
Слайд 29Лекция 2
В. Химические свойства
II. Химия галогенов. Галогеноводороды.
4). Восстановительные свойства (кроме
HF):
4HCl + MnO2(т) = MnCl2 + 2H2O + Cl2↑ (аналогично
HBr и HI)6HBr + H2SO4(конц) = 3Br2↑ + S↓ + 4H2O (аналогично HI)
4HI + O2 = 2I2 + 2H2O (только HI)
Восстановительные свойства
5). HF разъедает стекло:
4HF(г)+ SiO2(т) = SiF4↑ + 2H2O
6HF(р-р) + SiO2(т) = H2[SiF6] + 2H2O
гексафторосиликат
водорода
t
Слайд 30Лекция 2
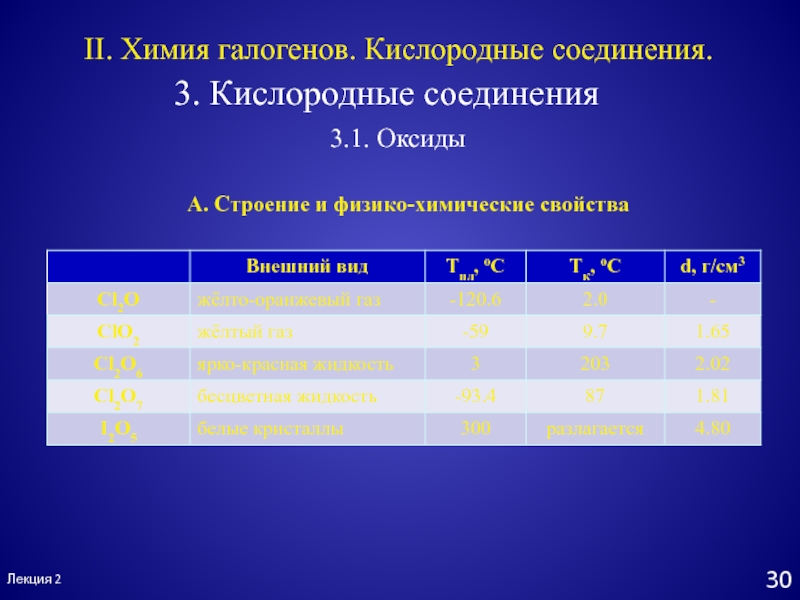
II. Химия галогенов. Кислородные соединения.
3. Кислородные соединения
3.1. Оксиды
А. Строение
и физико-химические свойства
Слайд 31Лекция 2
O-II [He]2s22p6 донор
Cl+I [Ne]3s22p4
акцептор
Cl2O
ClO2
Cl+IV [Ne]3s22p1 акцептор
O-II
[He]2s22p6 донорII. Химия галогенов. Кислородные соединения.
А. Строение и физико-химические свойства
Слайд 32Лекция 2
II. Химия галогенов. Кислородные соединения.
А. Строение и физико-химические свойства
Cl2O6
Cl2O7
I2O5
Слайд 34Лекция 2
В. Химические свойства
II. Химия галогенов. Оксиды.
1). Оксиды термически неустойчивы:
2Cl2O
= Cl2 + O2
2ClO2 = Cl2 + O2
Cl2O6 = Cl2
+ 3O22Cl2O7 = 2ClO2 +3O2
оксиды с чётными степенями
окисления галогенов
диспропорционируют
2). Взаимодействие с водой и растворами щелочей:
Cl2O + H2O 2HClO
ClO2 +H2O = HClO2 + HClO3
Cl2O6 +H2O = HClO3 + HClO4
Cl2O7 + H2O = 2HClO4
I2O5 + H2O = 2HIO3
обычно со взрывом!
В реакциях со щелочами образуются соли соответствующих кислот.
3). Все оксиды галогенов – сильные окислители.
I2O5 + 5СO = 5СO2 + I2
t
t
t
t
Слайд 35Лекция 2
II. Химия галогенов. Кислородные соединения.
3.1. Кислородные кислоты галогенов
А. Номенклатура
HClO HClO2
HClO3 HClO4хлорноватистая хлористая хлорноватая хлорная
КClO КClO2 КClO3 КClO4
гипохлорит хлорит хлорат перхлорат
калия калия калия калия
HBrO - HBrO3 HBrO4
бромноватистая бромноватая бромная
КBrO КBrO2 КBrO3 КBrO4
гипобромит бромит бромат пербромат
калия калия калия калия
- - HIO3 HIO4 H5IO6
иодноватая иодная ортоиодная
КIO3 КIO4 K5IO6
иодат периодат ортопериодат
калия калия
Слайд 37Лекция 2
II. Химия галогенов. Кислородные кислоты.
В. Химические свойства
HClO HClO2 HClO3 HClO4
сила кислот
Правило Полинга:
Если
NO – NH ≥ 2 => сильная
HClO3:
NO – NH =
3 – 1 = 2 => сильнаяHClO + H2O ClO- + H3O+
HClO3 + H2O = ClO- + H3O+
H+
H+
H+
1). Протолитические свойства:
2). Устойчивость, окислительные свойства:
HClO HClO2 HClO3 HClO4
устойчивость
окислительные свойства
HClO – сильный окислитель!
HClO4 в разбавленных растворах
окислителем не является!
HClO, HClO2, HClO3 существуют только в разбавленных растворах (<40%)
Слайд 38Лекция 2
II. Химия галогенов. Кислородные кислоты.
В. Химические свойства
2). Устойчивость, окислительные
свойства (продолжение):
2HClO + NaClO = NaClO3 + 2HCl
HClO, HClO2
– сильные окислители2HClO4 + Mg = Mg(ClO4)2 + H2
HClO4 – в растворах не является окислителем:
H5IO6 – сильный окислитель
Безводные HClO4 и HBrO4– сильнейшие окислители!
(реакции протекают со взрывом!)
5H5IO6 + 2MnSO4 = 2HMnO4 + 5HIO3 + 2H2SO4 + 7H2O
Термодинамически: ClO4- < BrO4- > H2IO63-
Кинетически: ClO4- и BrO4- реагируют
очень медленно!
Слайд 39Лекция 2
II. Химия галогенов. Кислородные кислоты.
В. Химические свойства
2). Устойчивость, окислительные
свойства (продолжение):
Соли кислородных кислот – менее сильные окислители, чем сами
кислоты (ионное строение, устойчивость выше)HalO3- – окислительные свойства проявляются только в кислотной среде
KClO3 + 6HCl = 3Cl2 + KCl + 3H2O
KIO3 + 5KI + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O
Твёрдые галогенаты и пергалогенаты - сильные окислители!
10KClO3(т) + 3P4(т) = 10KCl + 3P4O10
KClO4(т) + K2S(т) = K2SO4 + KCl
2NaClO + 4NaOH + MnCl2 = Na2MnO4 + 4NaCl + 2H2O
Гипогалогениты – сильные окислители
Перхлораты и перброматы в растворе окислителями не являются.
(cо взрывом!)
Слайд 40Лекция 2
II. Химия галогенов. Кислородные кислоты.
В. Химические свойства
2). Термическое разложение
кислот и их солей
4KClO3 KCl + 3KClO4
2KClO3 2KCl + 3O2
t>100oC,
MnO2t>400oC
(Cr2O3, CuO, Fe2O3 и др.)
KClO4 KCl + 2O2
t>550oC
Устойчивость солей выше,
чем соответствующих кислот
2NaIO3 2NaI + 3O2
600oC
Устойчивость пергалогенатов
выше, чем галогенатов
Слайд 41Лекция 2
II. Химия галогенов. Кислородные кислоты.
Г. Получение
Hal2 + HgO +
H2O = HgHal2·2HgO↓ + HHalO
CaCO3 + 2Cl2 + H2O =
2HClO + CaCl2 + CO2Ca(OH)2 + Cl2 = CaCl(OCl) + H2O
2NaOH(р-р) + Cl2 = NaCl + NaClO + H2O (на холоду)
хлорная известь
жавелевая вода
2ClO2 + Ba(OH)2 + H2O2 = Ba(ClO2)2 + 2H2O + O2↑
2ClO2 + PbO + 2NaOH = PbO2↓ + 2NaClO2 + H2O
Ba(ClO2)2 + H2SO4 = BaSO4↓ + 2HClO2
Cl- + 3H2O - 5ē = ClO3- + 6H+ (электролиз)
Cl2 + 6OH- = ClO3- + 5Cl- + 3H2O
Ba(ClO3)2 + H2SO4 = HClO3 + BaSO4
I2 + 10HNO3(конц) = 2HIO3 + 10NO2↑ + 4H2O
I2 + 5H2O2 = 2HIO3 + 4H2O
t
t
t
Слайд 42Лекция 2
II. Химия галогенов. Кислородные кислоты.
Г. Получение
ClO3- + H2O -
2ē = ClO4- + 2H+ (электролиз)
NaBrO3 + F2 + 2NaOH
= NaBrO4 + 2NaF + H2ONaClO4(конц) + HCl(конц) = HClO4 + NaCl↓
KClO4 + H2SO4 = HClO4 + KHSO4
NaIO3 + 4NaOH + Cl2 = Na3H2IO6↓ + 2NaCl + H2O
2Na3H2IO6 + Ba(NO3)2 = Ba3(H2IO6)2↓ + 6NaNO3
Ba3(H2IO6)2 + 3H2SO4 = 2H5IO6 + 3BaSO4↓
t
t






















![Московский Государственный Университет Тонких Химических Технологий
им. М.В Лекция 2O-II [He]2s22p6 донорCl+I [Ne]3s22p4 акцепторCl2OClO2Cl+IV [Ne]3s22p1 Лекция 2O-II [He]2s22p6 донорCl+I [Ne]3s22p4 акцепторCl2OClO2Cl+IV [Ne]3s22p1](/img/thumbs/14218810bef3d6a04bf852b16286dc55-800x.jpg)