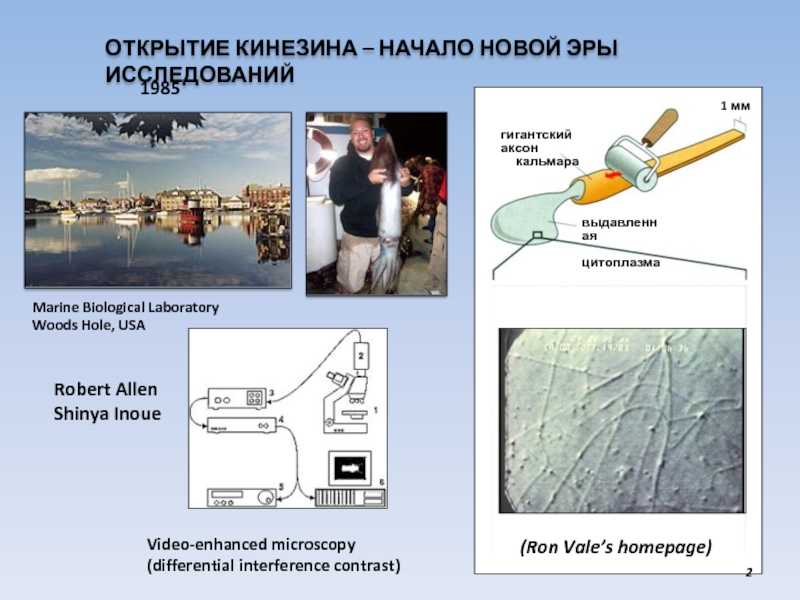
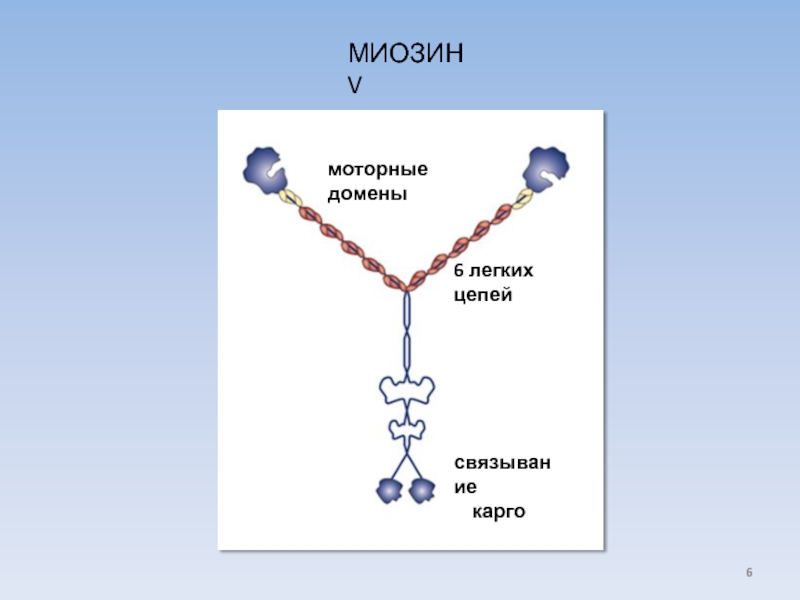
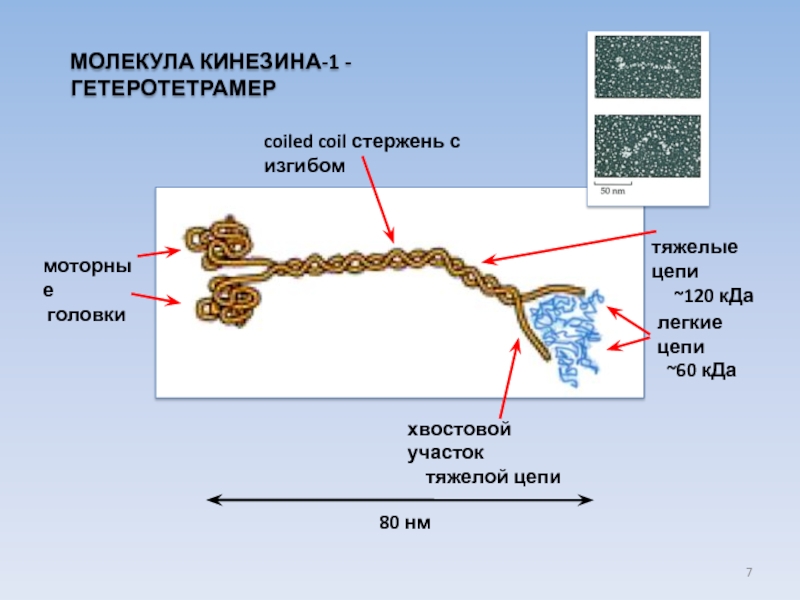
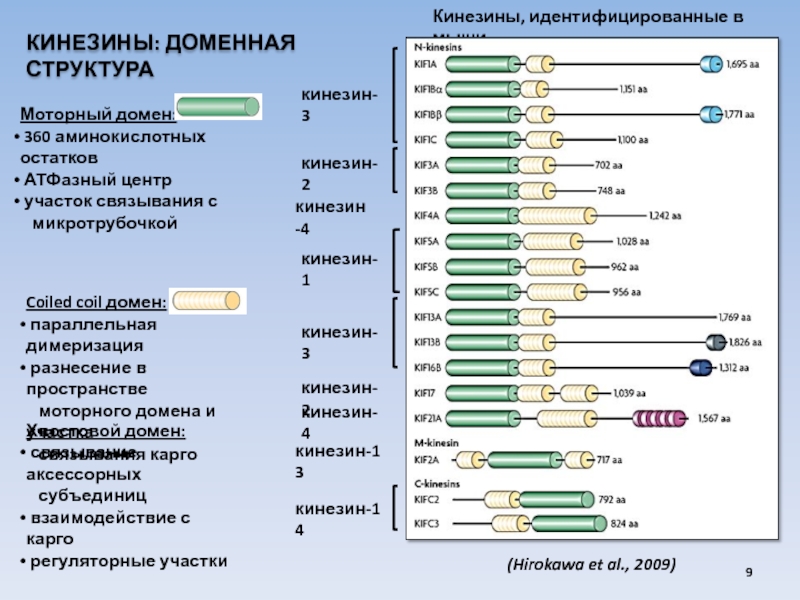
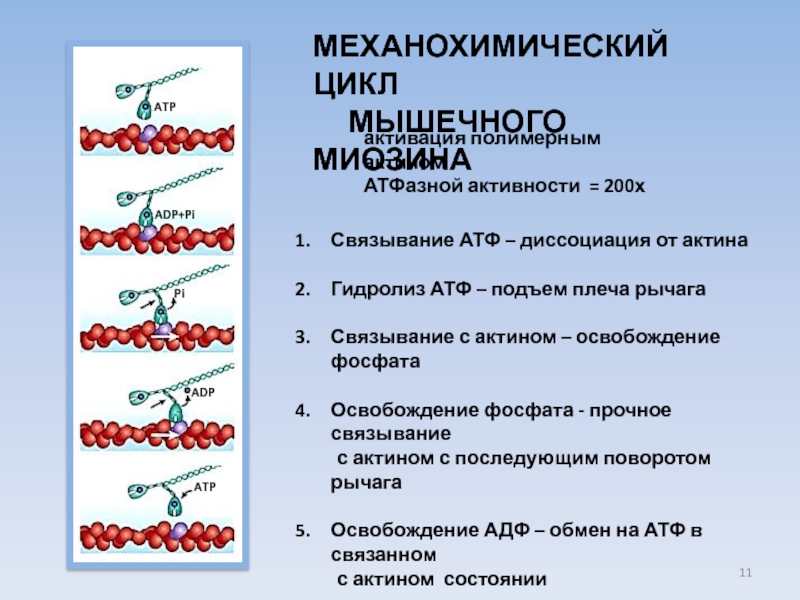
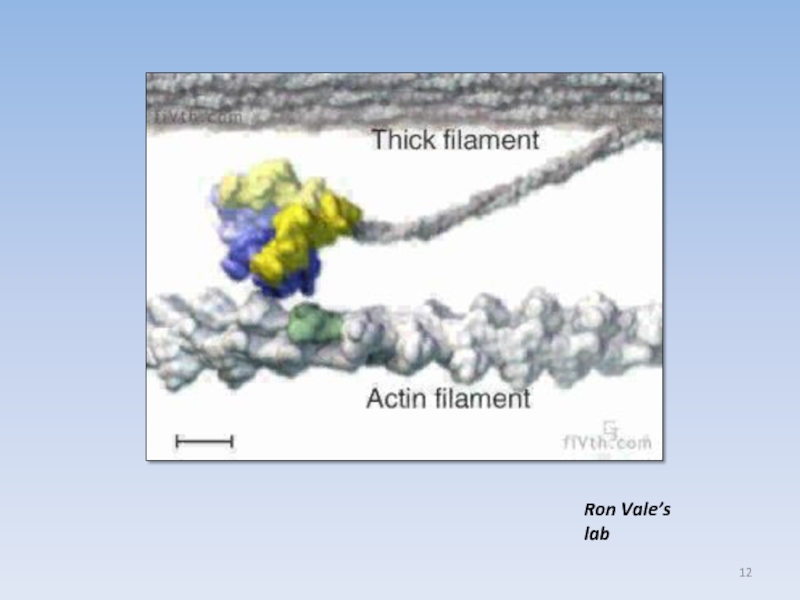
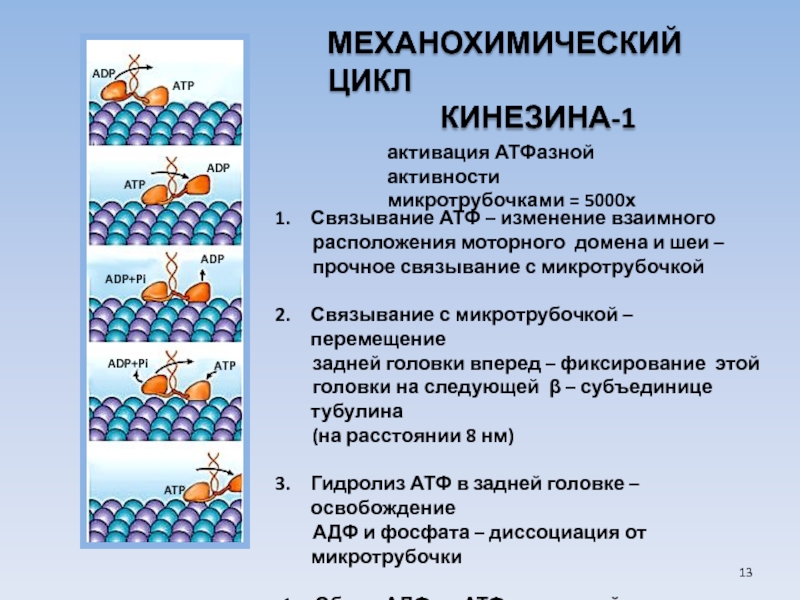
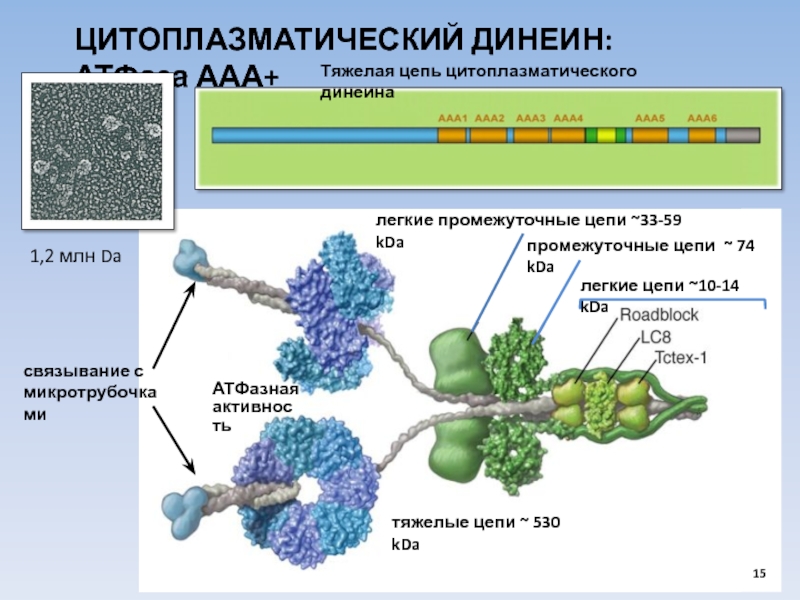
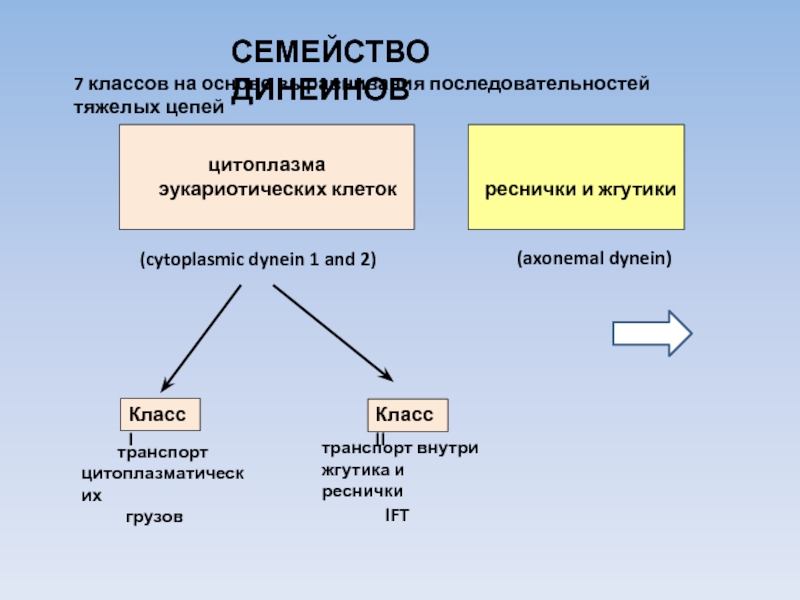
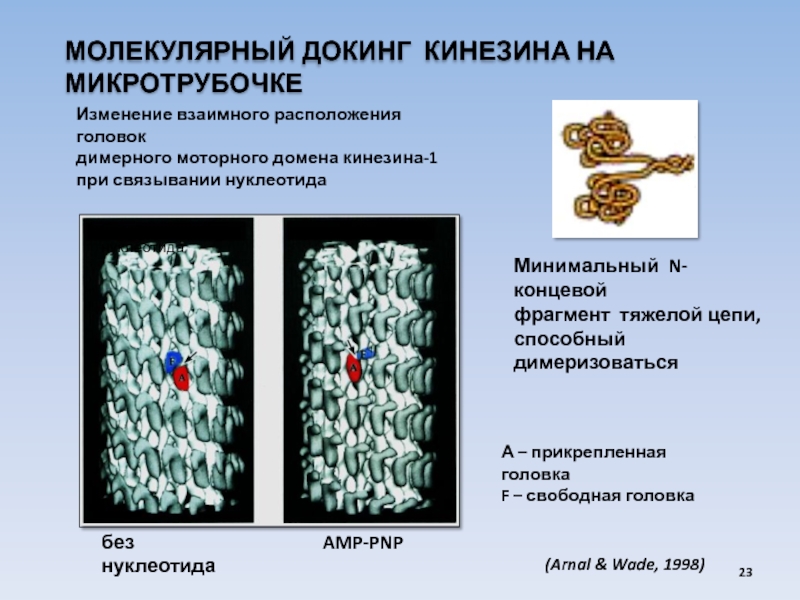
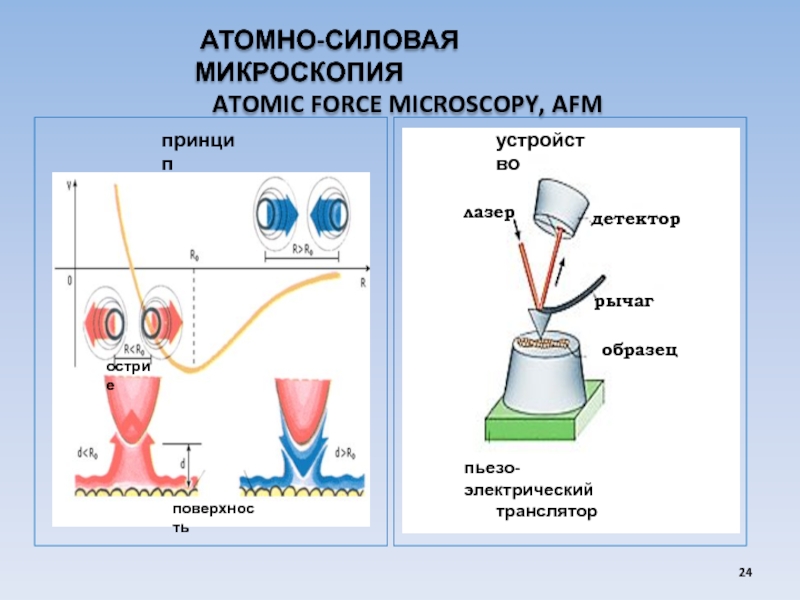
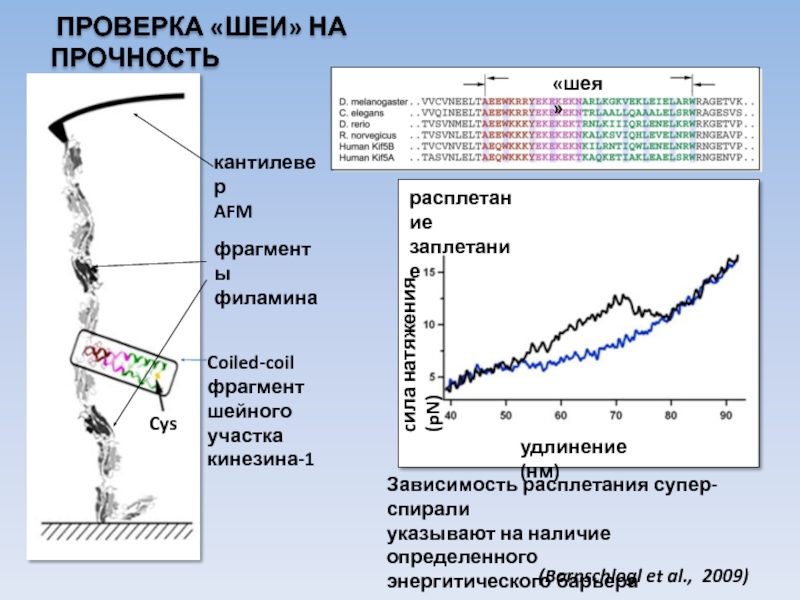
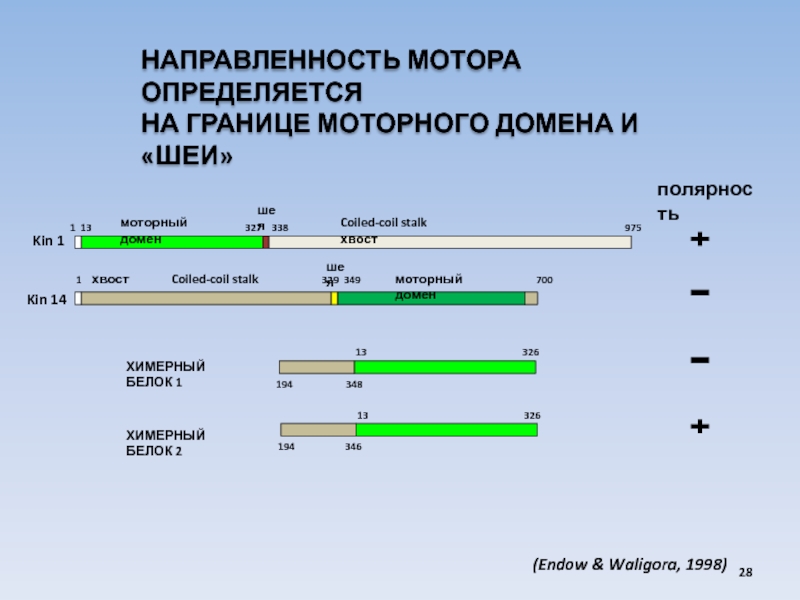
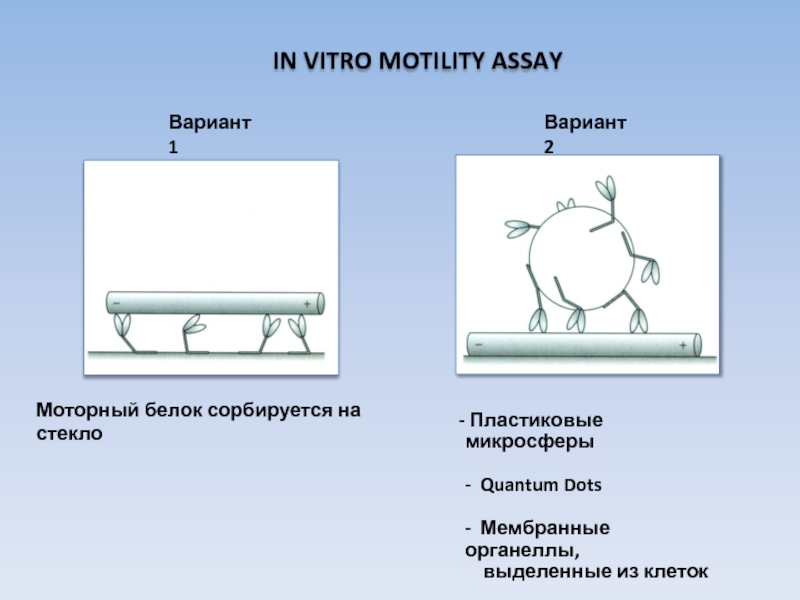
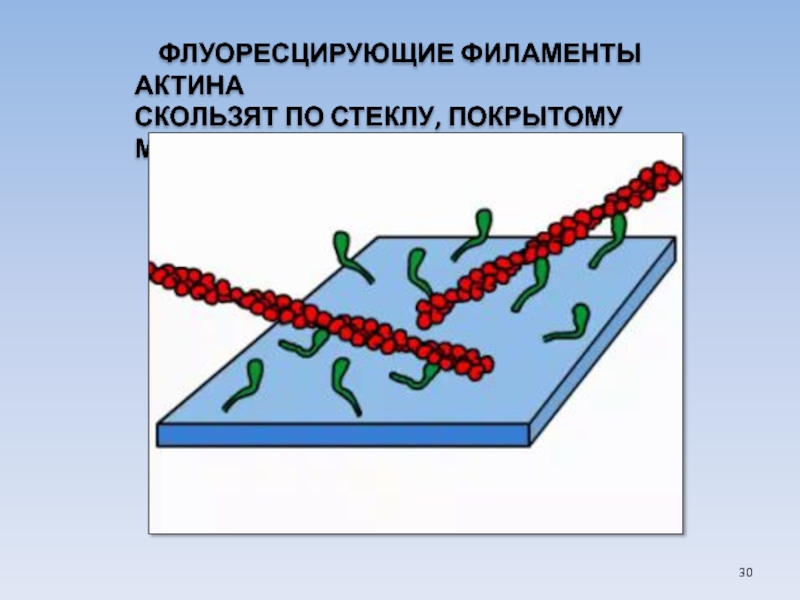
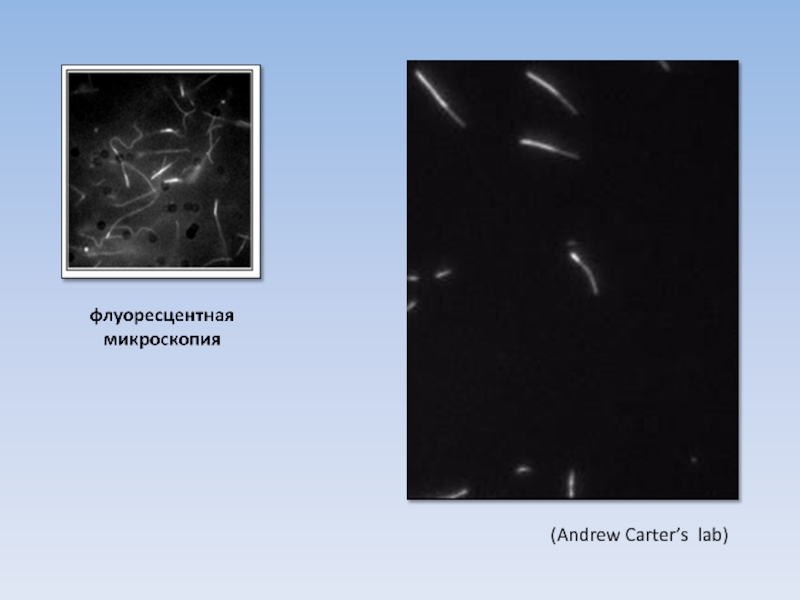
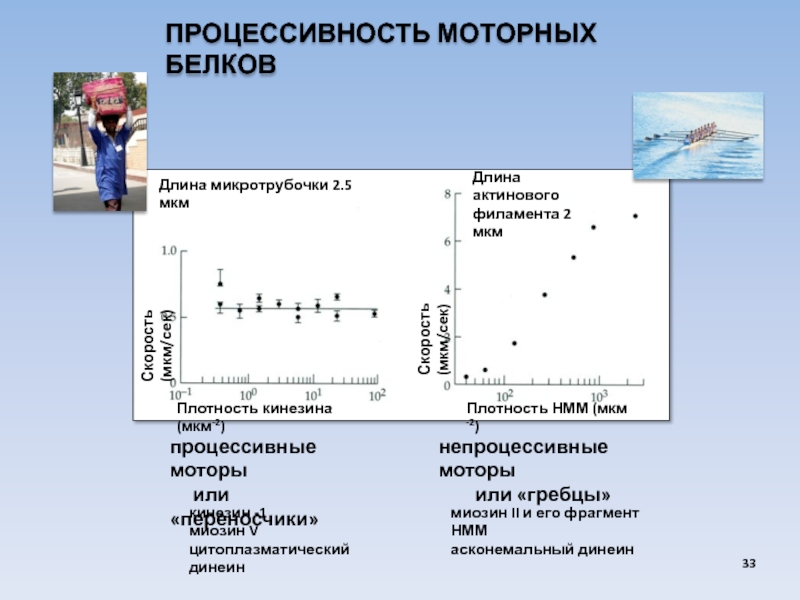
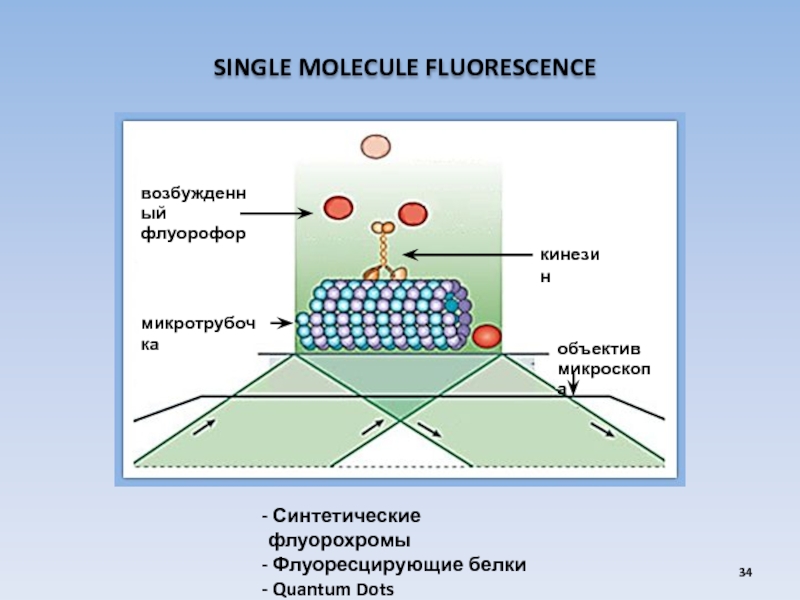
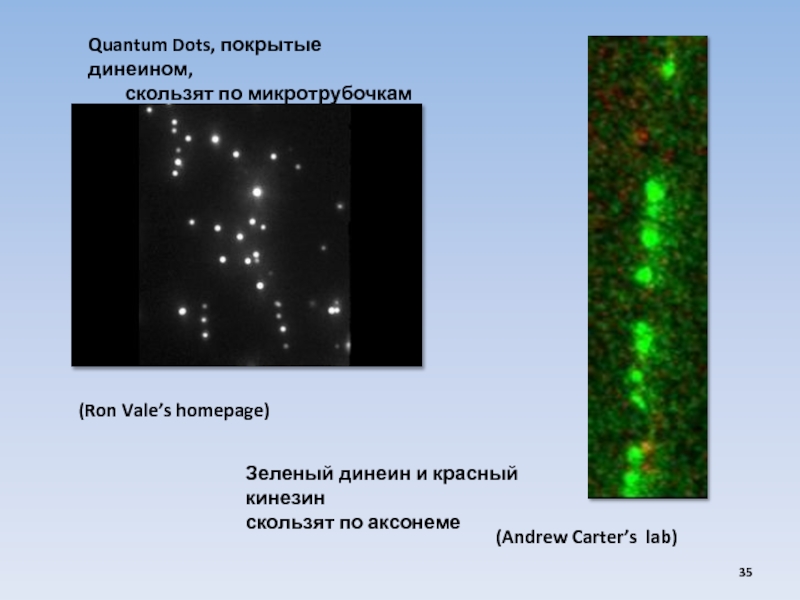
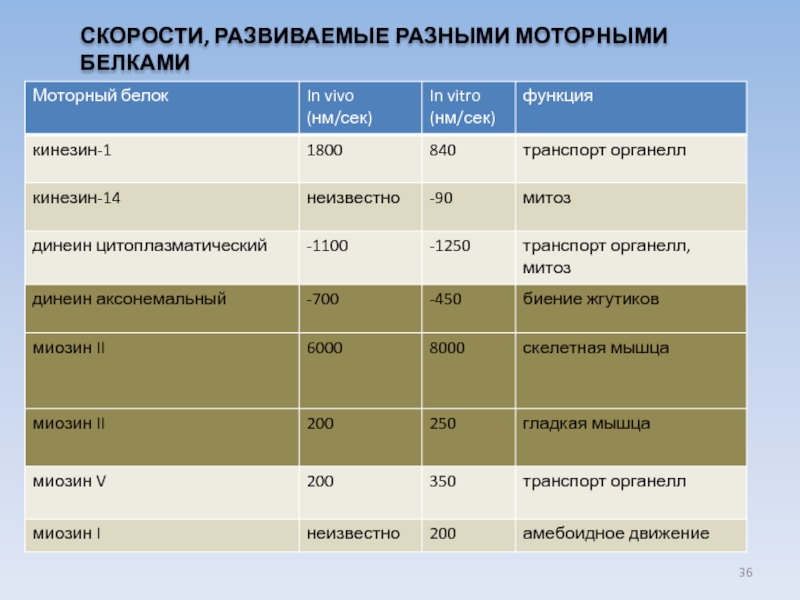
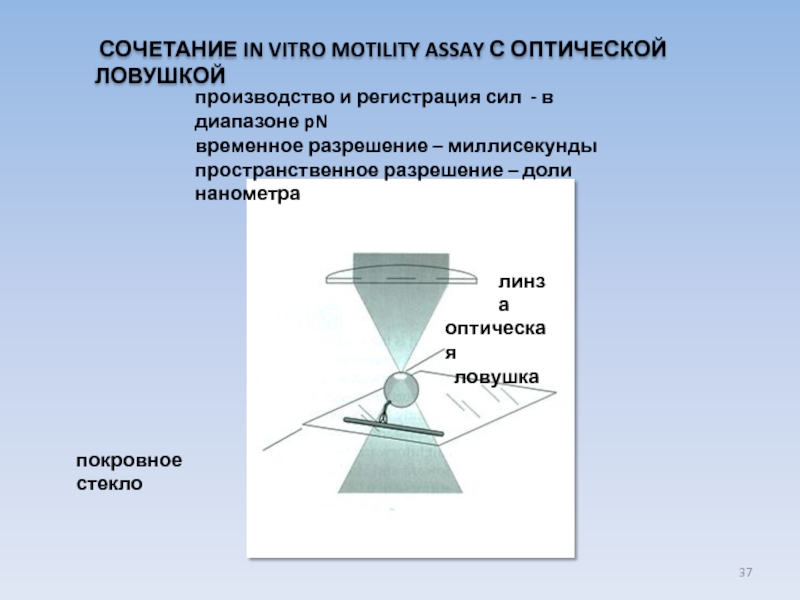
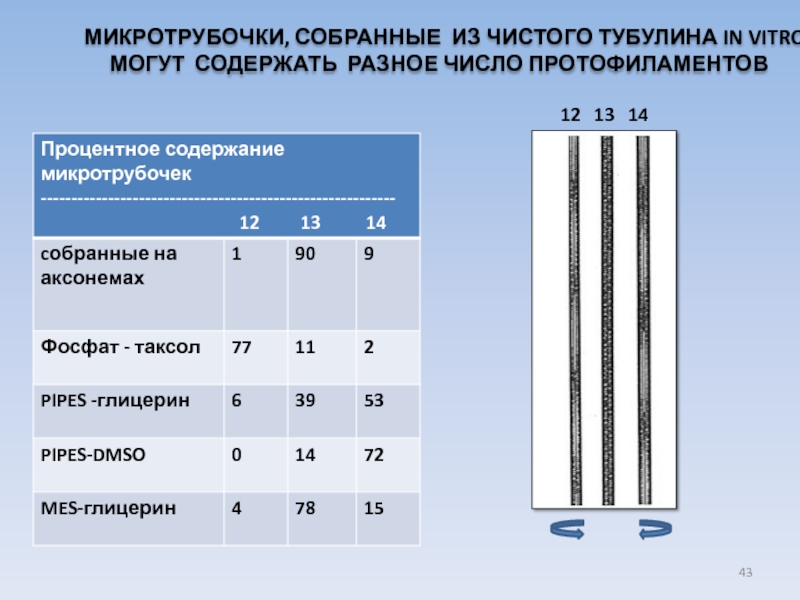
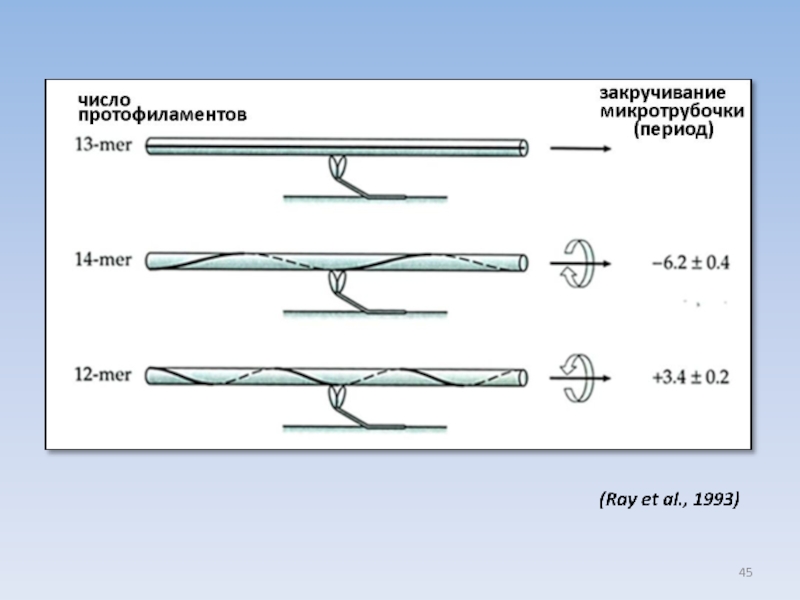
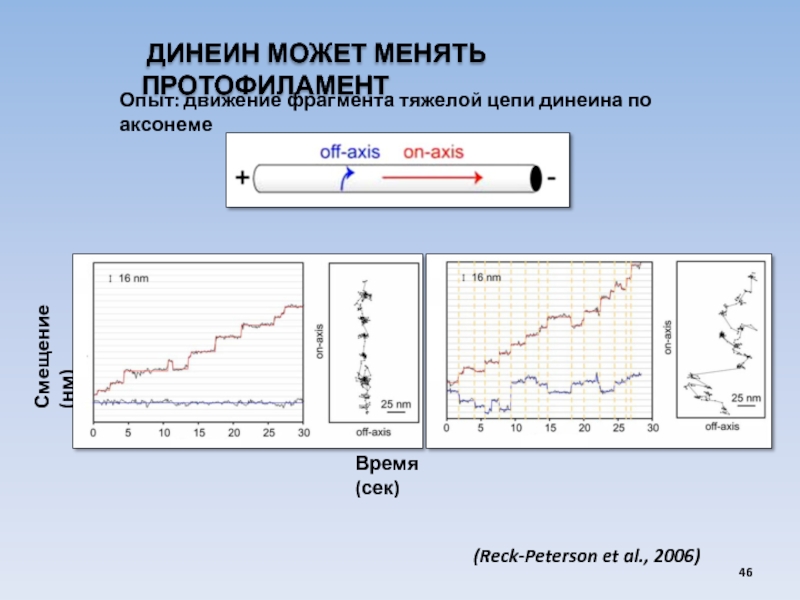
USA
1 мм
выдавленная
цитоплазма
гигантский аксон
кальмара
Video-enhanced microscopy
(differential
interference contrast)1985
(Ron Vale’s homepage)
Robert Allen
Shinya Inoue