Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
№ 17. ПЕПТИДЫ и Белки
Содержание
- 1. № 17. ПЕПТИДЫ и Белки
- 2. ПептидыПептиды — соединения, построенные из нескольких остатков -аминокислот, связанных амидной (пептидной) связью - C(=O)-NH-
- 3. (греч. Πεπτος, peptós
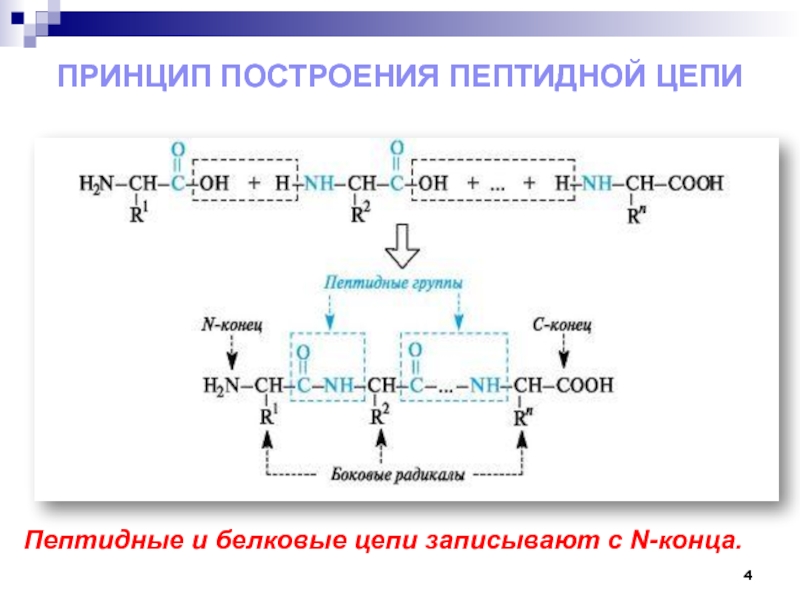
- 4. Принцип построения пептидной цепиПептидные и белковые цепи записывают с N-конца.
- 5. Основные функции пептидов:регуляторная (рилизинг-факторы или либерины, нейромедиаторы);гормональная
- 6. Слайд 6
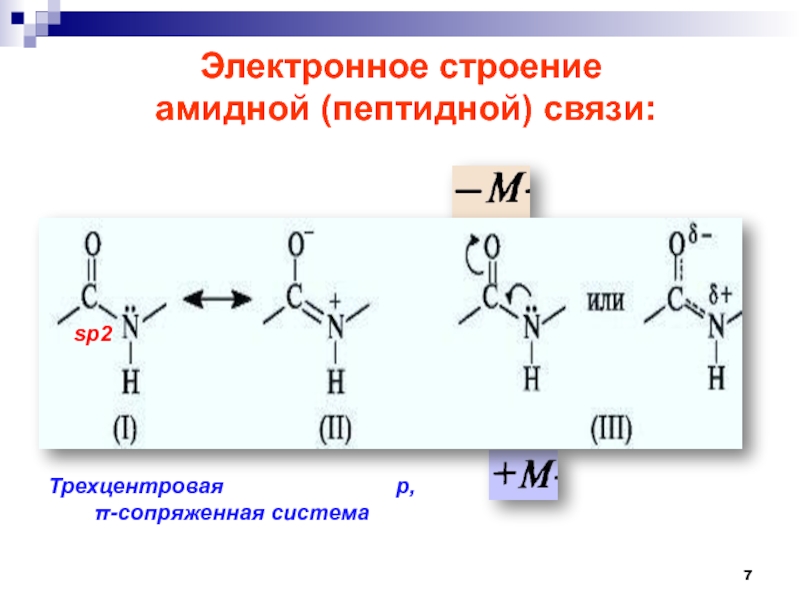
- 7. Электронное строение амидной (пептидной) связи: sp2Трехцентровая
- 8. Плоскостное расположение пептидной группы -CO-NH- и α-атомов
- 9. Взаимное положение плоскостей пептидных групп в полипептидной цепиαααRR*R**1080Сα-N и Сα-Сsp2
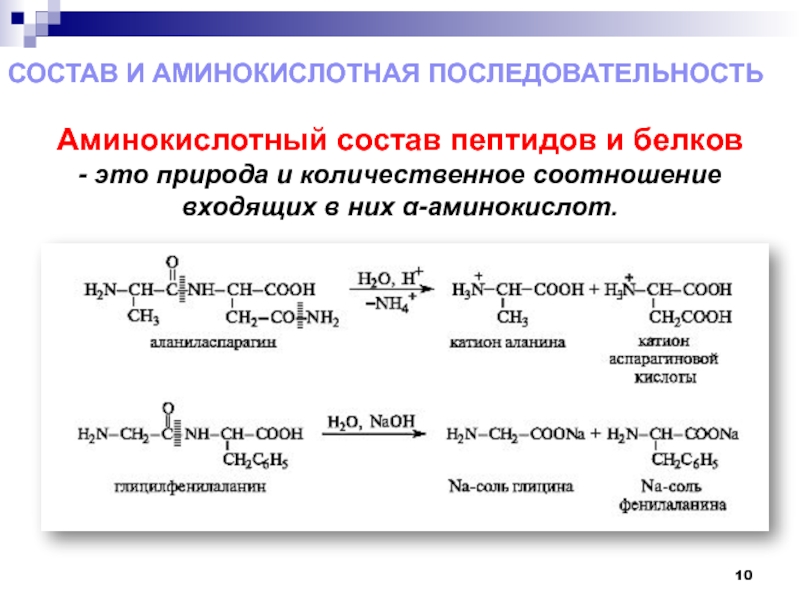
- 10. Состав и аминокислотная последовательностьАминокислотный состав пептидов и
- 11. Первичная структура пептидов и белков - это аминокислотная последовательность, т. е. порядок чередования α-аминокислотных остатков.
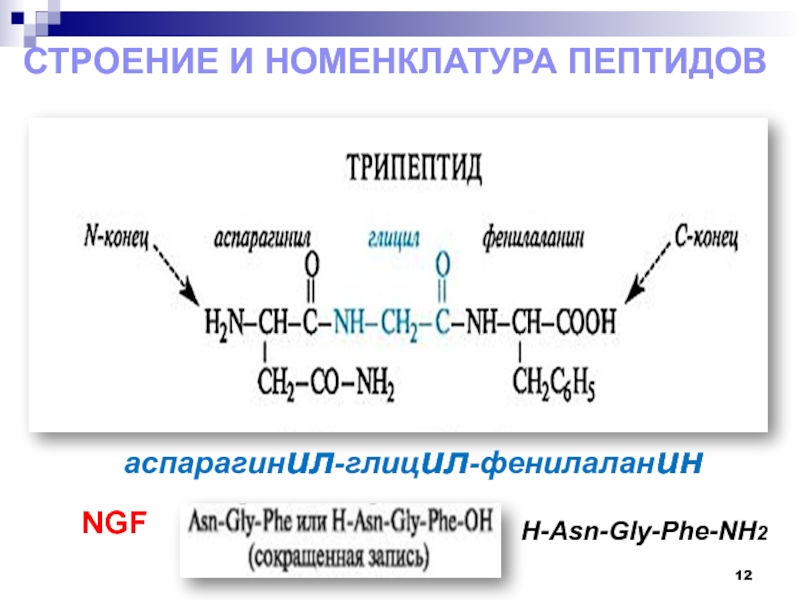
- 12. NGFСтроение и номенклатура пептидоваспарагинил-глицил-фенилаланинН-Asn-Gly-Phe-NH2
- 13. ДипептидыОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ ПЕПТИДОВсодержится в мышцах животных и человека Карнозин (β-аланил-L-гистидин) необычная АК- β-аланин
- 14. Аспартампочти в 200 раз более сладкий, чем сахарозаH- Asp- Phe - OMeE951
- 15. Аспартам метиловый эфир L-Аспартил-L-ФенилаланинаБольшое количество токсикологических и
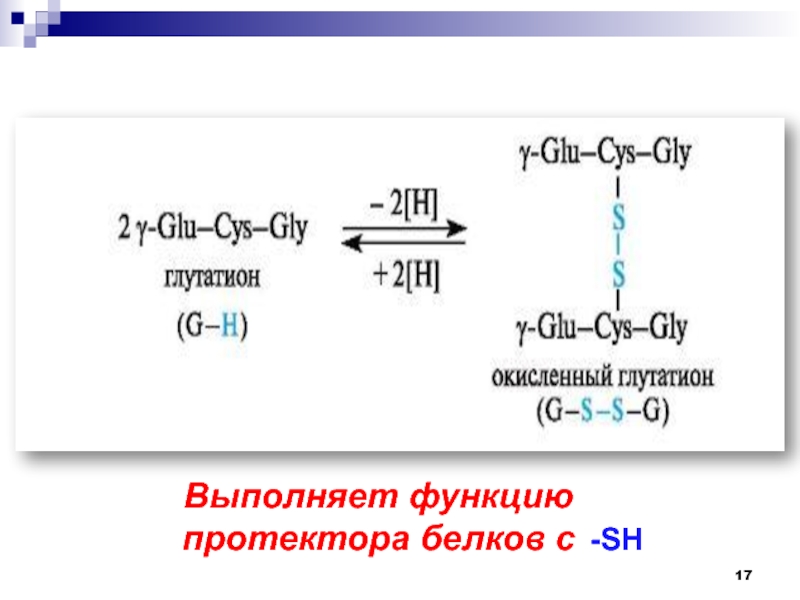
- 16. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ ПЕПТИДОВГлутатион участвует в ряде окислительно-восстановительных процессов
- 17. Выполняет функцию протектора белков с -SH
- 18. ТафтсинСеланк — (Thr-Lys-Pro-Arg-Pro-Gly-Pro, лекарственный препарат, обладающий наиболее
- 19. Селанк – первый в мире пептидный анксиолитик
- 20. Нейропептиды (опиатные пептиды). пептиды, содержащиеся в головном
- 21. НейропептидыDSIP
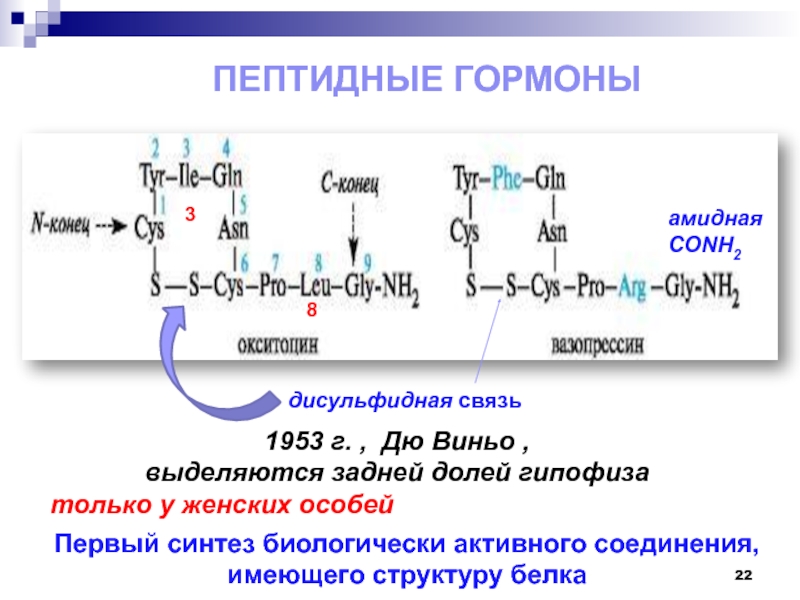
- 22. Пептидные гормоны38дисульфидная связьамидная CONH21953 г. , Дю
- 23. Окситоцин (1954) вызывает сокращение гладких мышц матки
- 24. Слайд 24
- 25. Даларгин - синтетический аналог энкефалинов,биологически активных
- 26. Применяется Даларгин при обострении язвенной болезни желудка
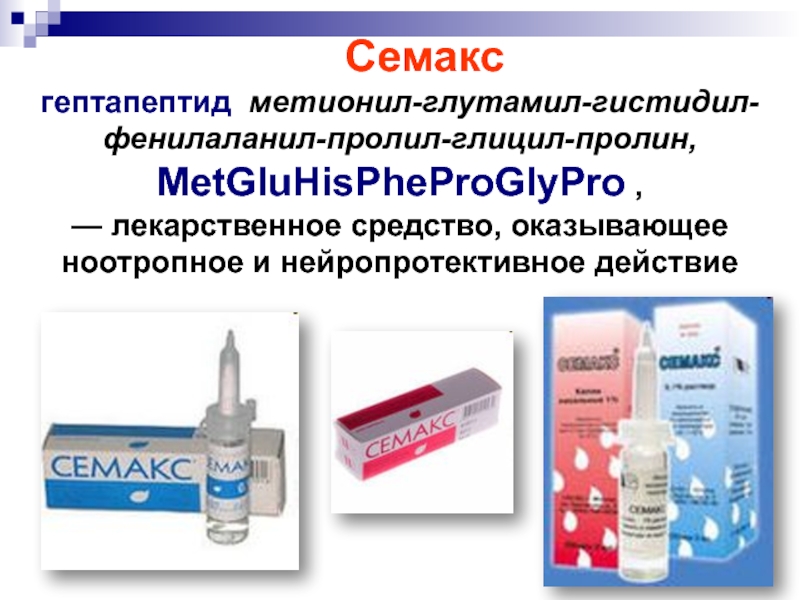
- 27. Семакс гептапептид метионил-глутамил-гистидил-фенилаланил-пролил-глицил-пролин, MetGluHisPheProGlyPro , — лекарственное средство, оказывающее ноотропное и нейропротективное действие
- 28. Пептид АКТГ4-10 («Семакс») обладает нейроспецифическим эффектом в
- 29. Слайд 29
- 30. Инсулин 1943 г. , Ф. Сенгер приступил
- 31. Шесть молекул инсулина ассоциированы в гексамер (видны
- 32. Слайд 32
- 33. при стрессе и заболеваниях нервной системы; при
- 34. Пептидные токсиныАпамин - токсичный компонент яда пчел и сильно воздействует на ЦНСНейротоксин из морского моллюска Конотоксин
- 35. Принципиальная схема синтеза пептида
- 36. ИСКУССТВЕННЫЙ СИНТЕЗ ПЕПТИДОВСхема синтеза дипептида аланил-валина:Первый
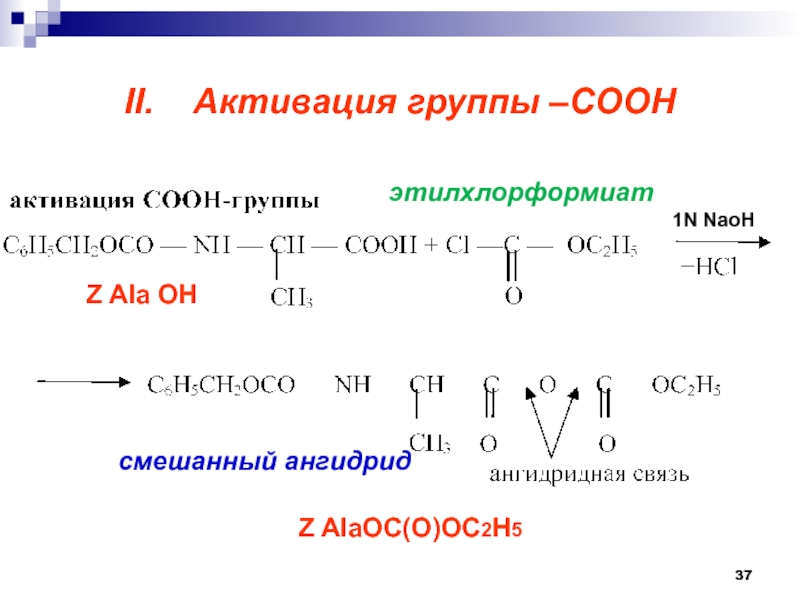
- 37. II. Активация группы –СООНэтилхлорформиатZ Ala OH Z AlaOC(O)OC2H5 1N NaoHсмешанный ангидрид
- 38. Второй компонент – С-концевая аминокислота валинIII. Защита группы –СООНVal Val OEt 1 экв.1N NaOH
- 39. IV. Образование амидной связиZ Ala OC(O)OC2H5O Val OEt Z Ala Val OEt
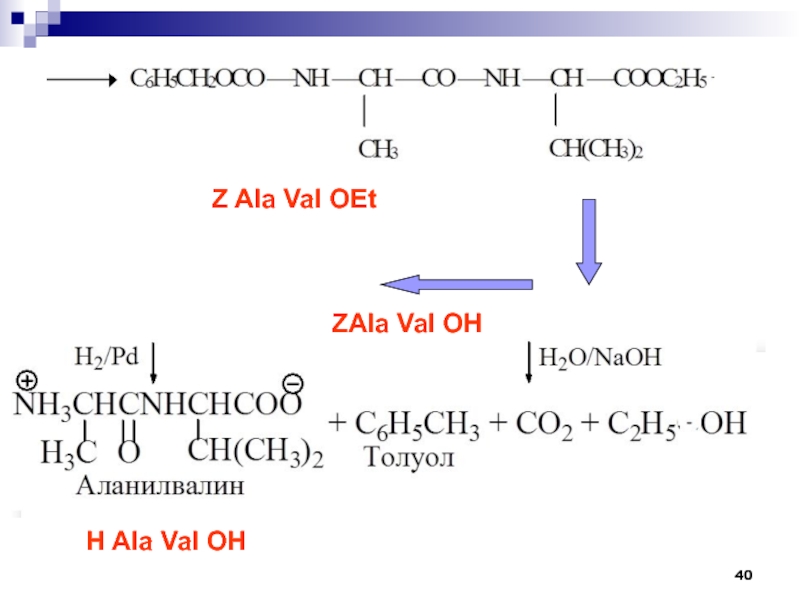
- 40. Z Ala Val OEtZAla Val OH H Ala Val OH
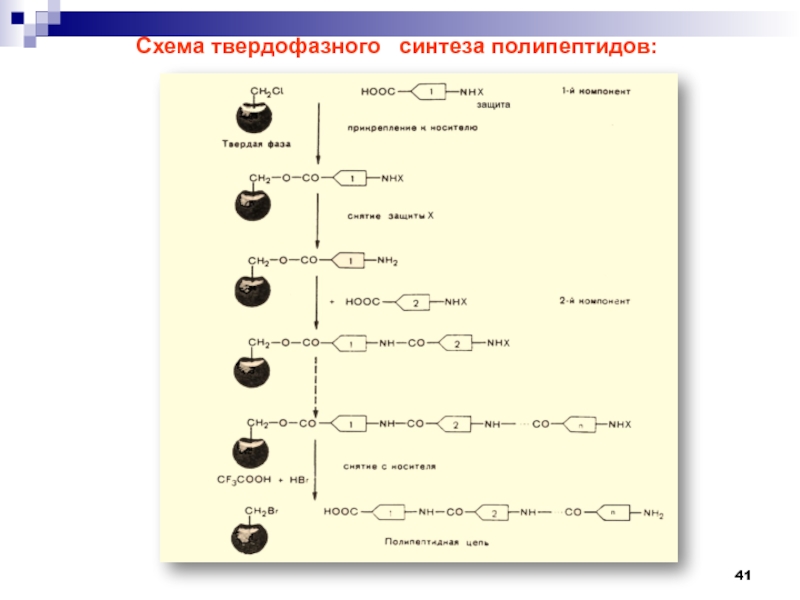
- 41. Схема твердофазного синтеза полипептидов:
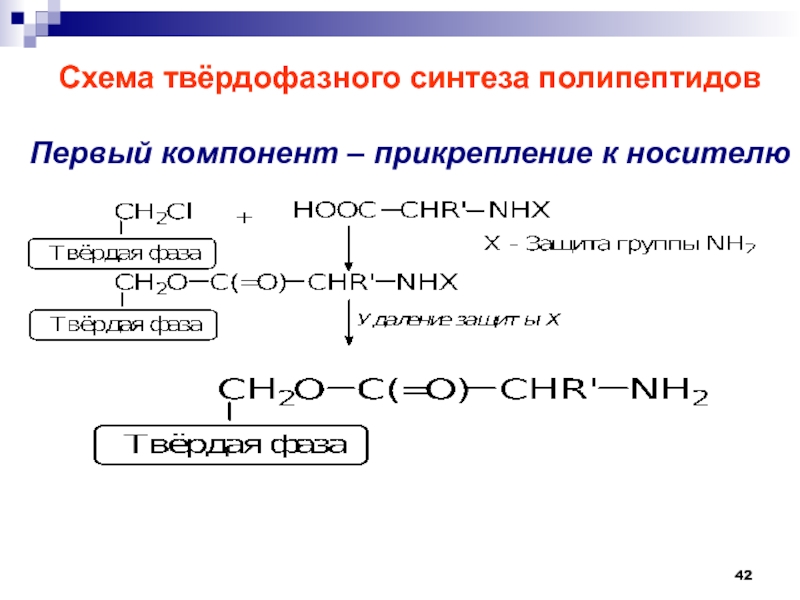
- 42. Схема твёрдофазного синтеза полипептидовПервый компонент – прикрепление к носителю
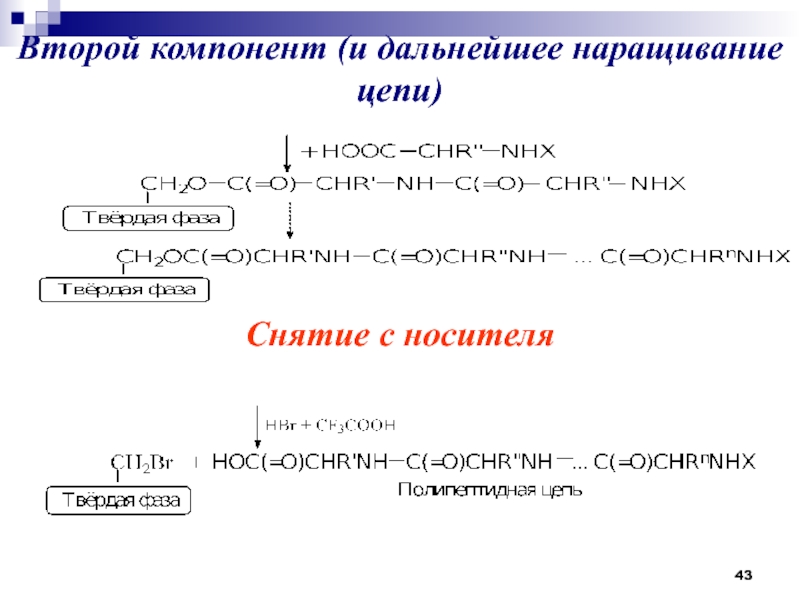
- 43. Второй компонент (и дальнейшее наращивание цепи)Снятие с носителя
- 44. Слайд 44
- 45. Строительная (пластическая) – белки участвуют в образовании
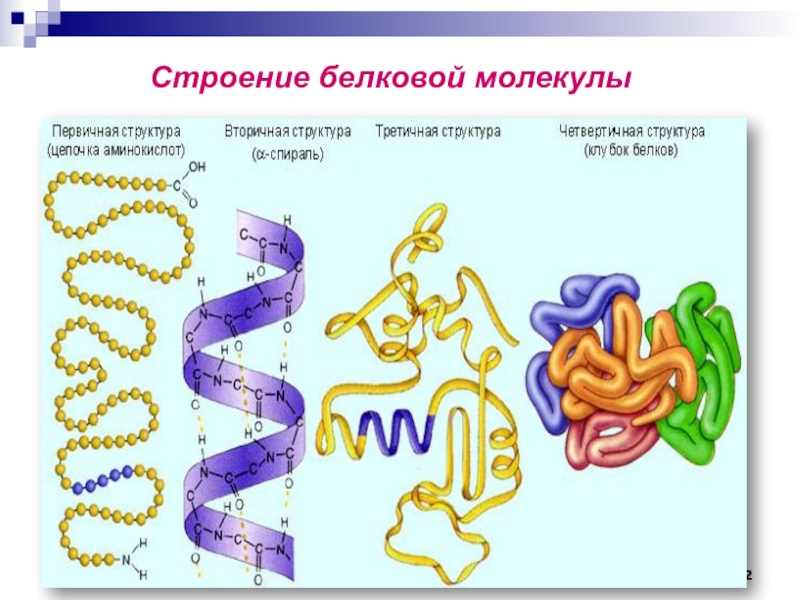
- 46. Степень организации белковых молекул
- 47. Первичная структура пептидов и белков.Аминокислотный состав пептидов
- 48. Белки в медицине.Серповидноклеточная анемия – наследственная болезнь,
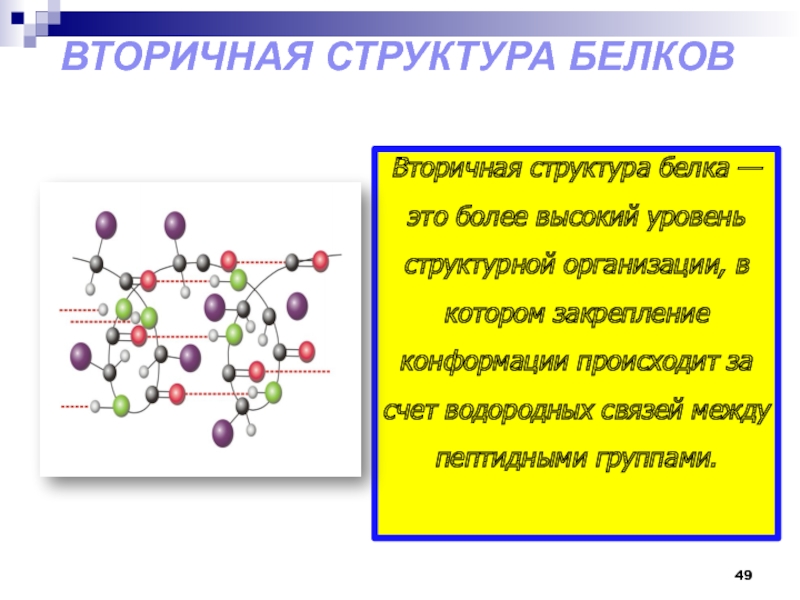
- 49. Вторичная структура белков Вторичная
- 50. Лайнус Карл
- 51. a-спираль молекулы белкаНа один виток спирали
- 52. Водородные связиостаток АК образует водородную связь с
- 53. -Структура (Анти) параллельный -складчатый слой (лист)«меха аккордеона»Межцепочечные Н-связи
- 54. Слайд 54
- 55. b-структура белка
- 56. Вторичная структура белков А
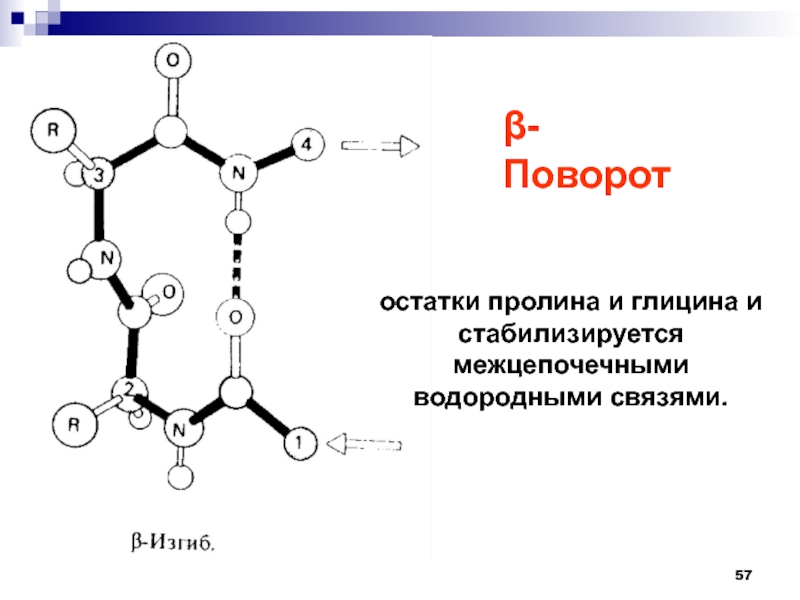
- 57. остатки пролина и глицина и стабилизируется межцепочечными водородными связями.-Поворот
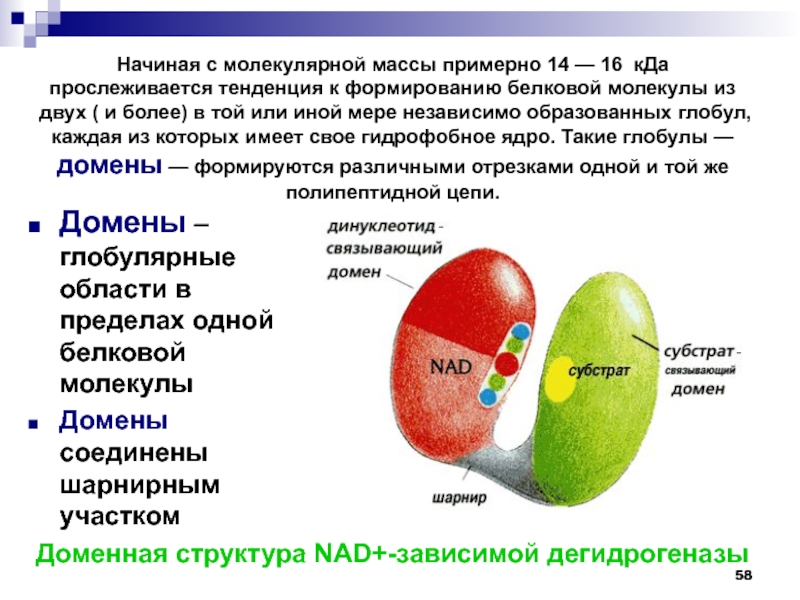
- 58. Домены – глобулярные области в пределах одной
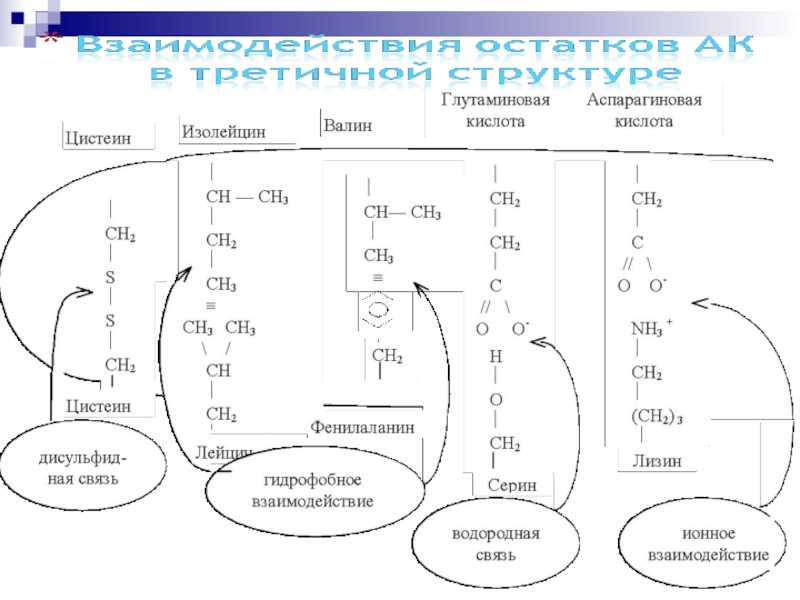
- 59. Полипептидная цепь, включающая элементы той или иной
- 60. молекула приобретает форму компактного клубка – глобулярные
- 61. Слайд 61
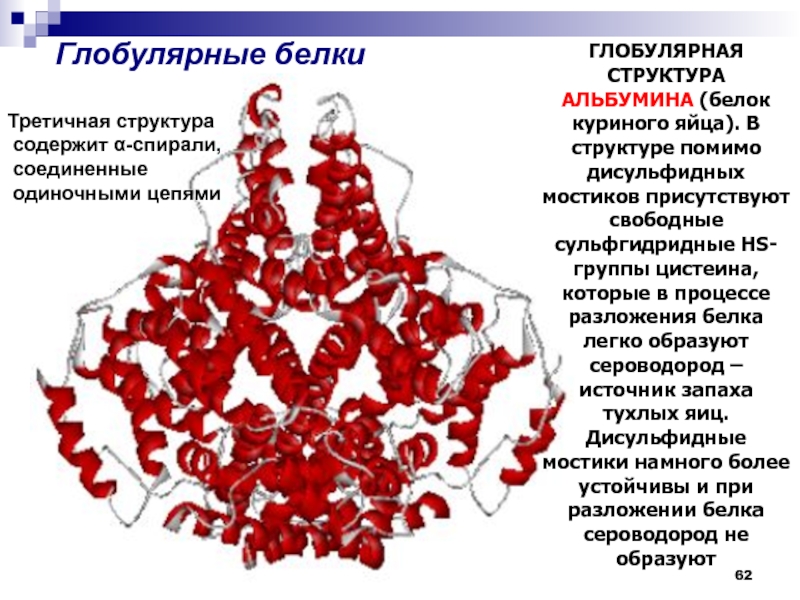
- 62. Глобулярные белкиГЛОБУЛЯРНАЯ СТРУКТУРА АЛЬБУМИНА (белок
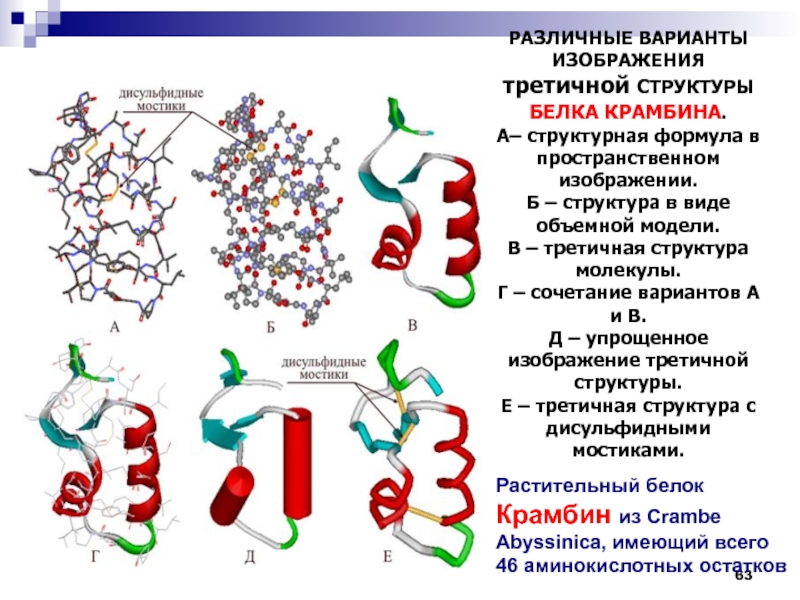
- 63. РАЗЛИЧНЫЕ ВАРИАНТЫ ИЗОБРАЖЕНИЯ третичной СТРУКТУРЫ
- 64. Фибриллярные белкиФИБРИЛЛЯРНЫЙ БЕЛОК ФИБРОИН
- 65. НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА ФИБРИЛЛЯРНОГО БЕЛКА КОЛЛАГЕНА.
- 66. Молекула коллагена представляет собой правозакрученную спираль из
- 67. от греч. lýsis — растворение, распад и
- 68. Сериновая протеаза - трипсинРодопсинфермент класса гидролаз, катализирующий
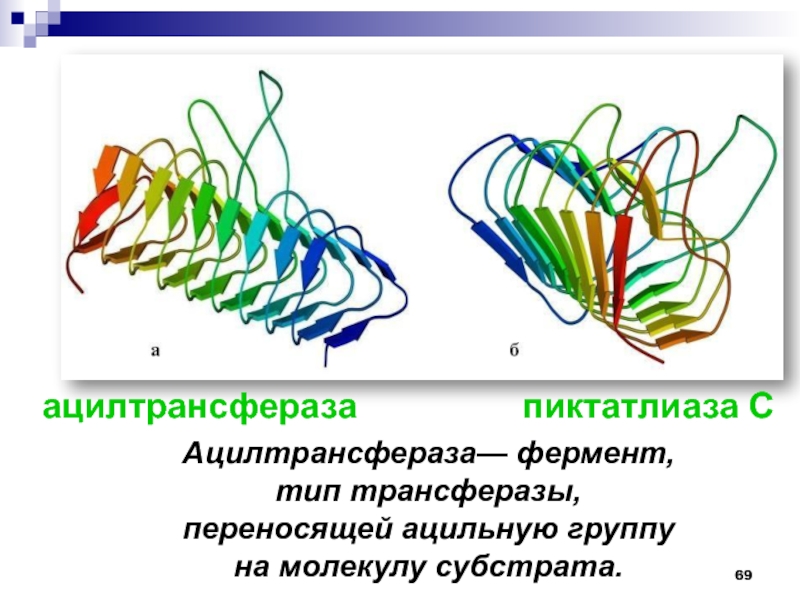
- 69. ацилтрансфераза
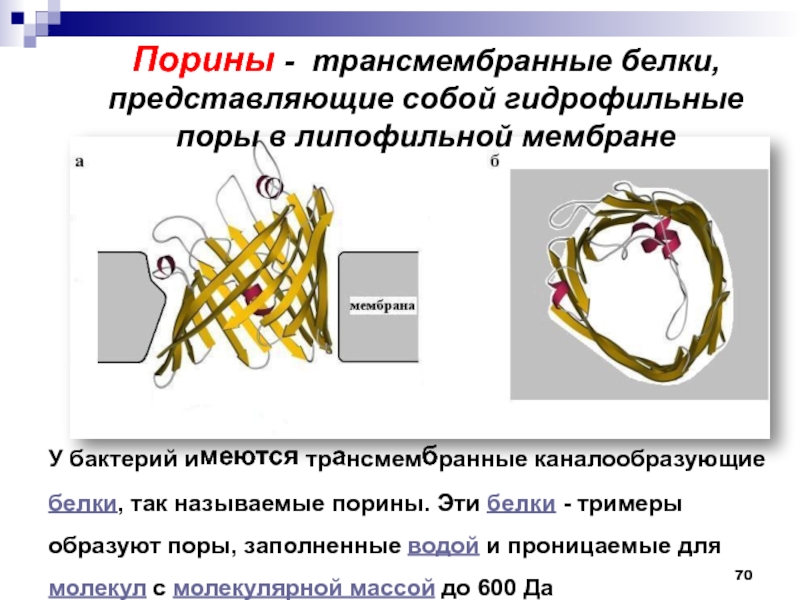
- 70. У бактерий имеются трансмембранные каналообразующие белки, так
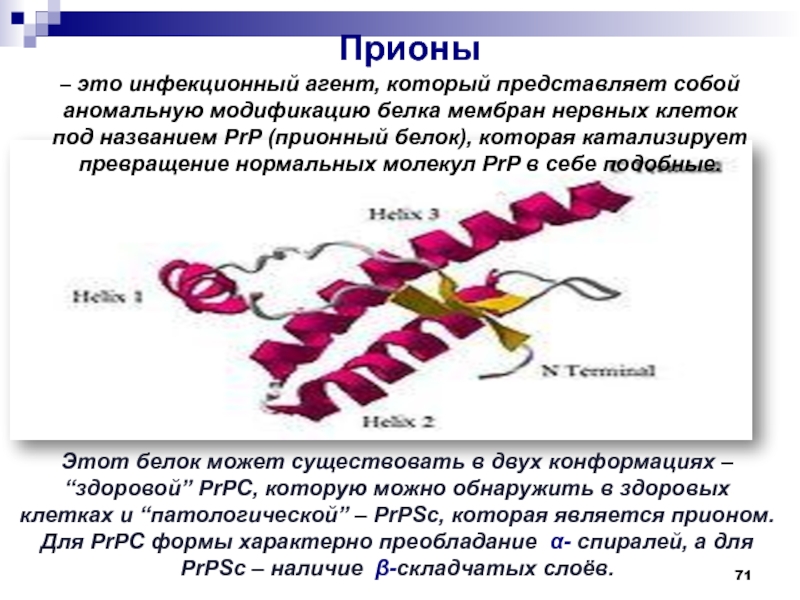
- 71. Этот белок может существовать в двух конформациях
- 72. Губчатые энцефалопатии* Синдром Крейцфельда-Якоба * синдром Герсманна–Штройслера–Шейнкера
- 73. Проявляется болезнь медленно прогрессирующими нарушениями памяти и
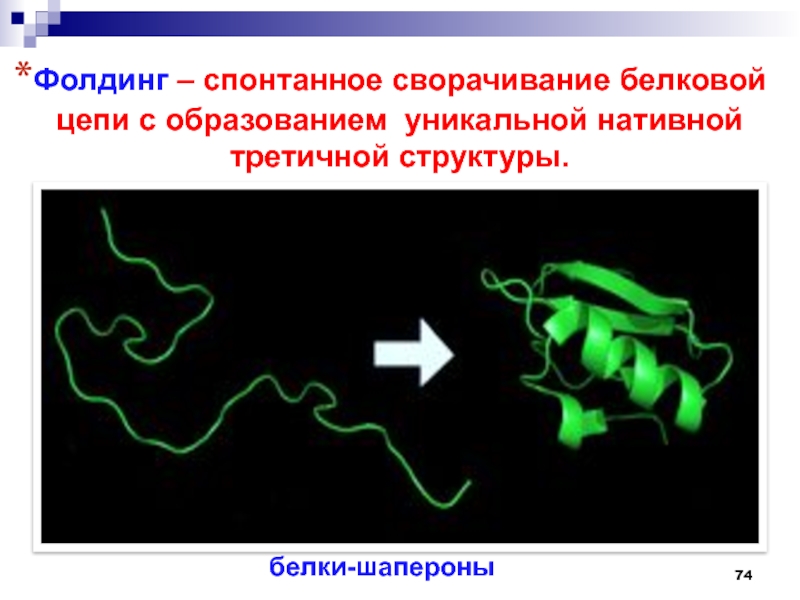
- 74. Фолдинг – спонтанное сворачивание белковой цепи с образованием уникальной нативной третичной структуры.белки-шапероны
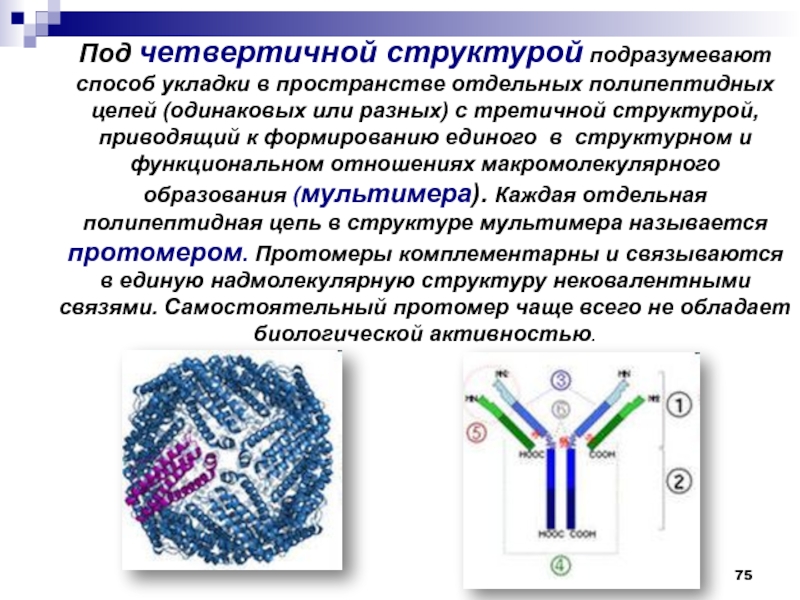
- 75. Под четвертичной структурой подразумевают способ укладки в
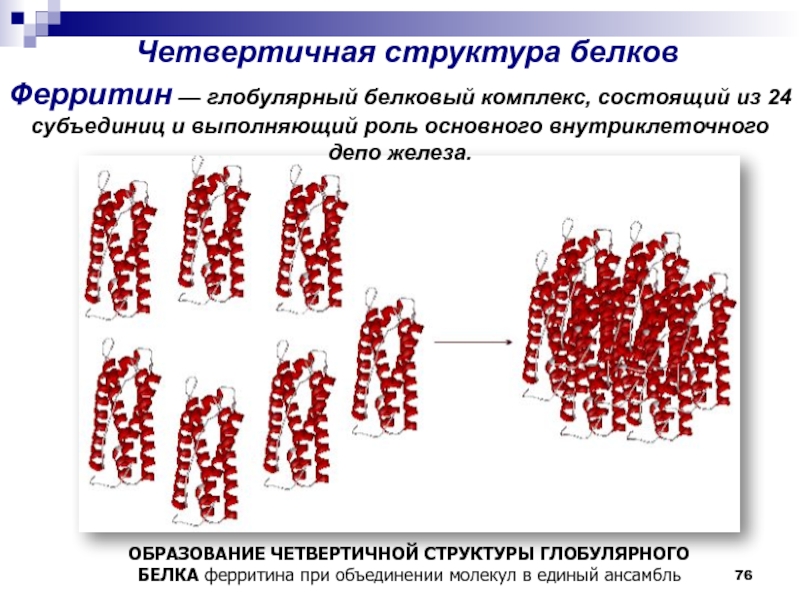
- 76. Четвертичная структура белков ОБРАЗОВАНИЕ ЧЕТВЕРТИЧНОЙ
- 77. вирус табачной мозаики:2130 одинаковых молекул белка
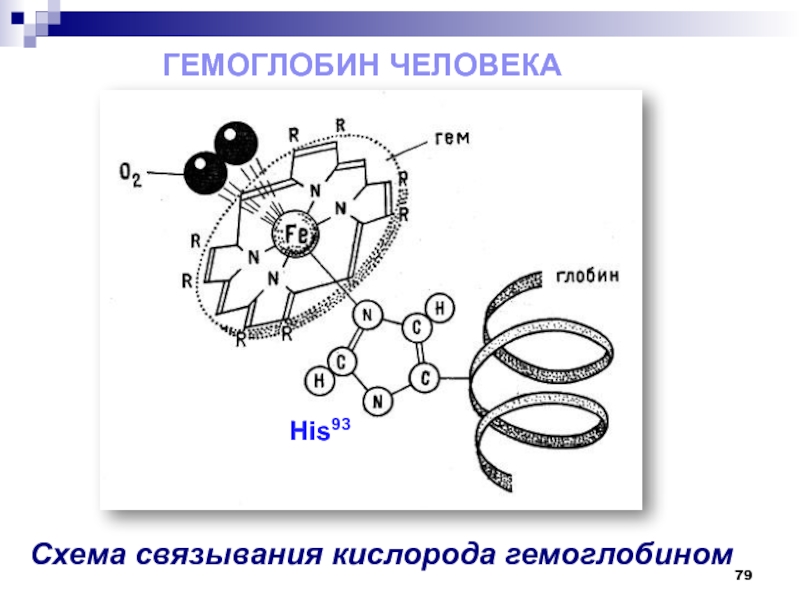
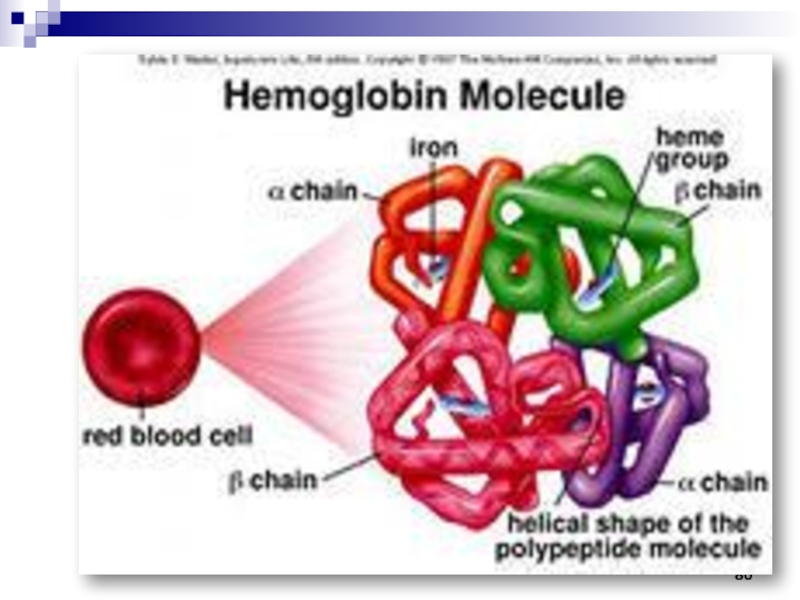
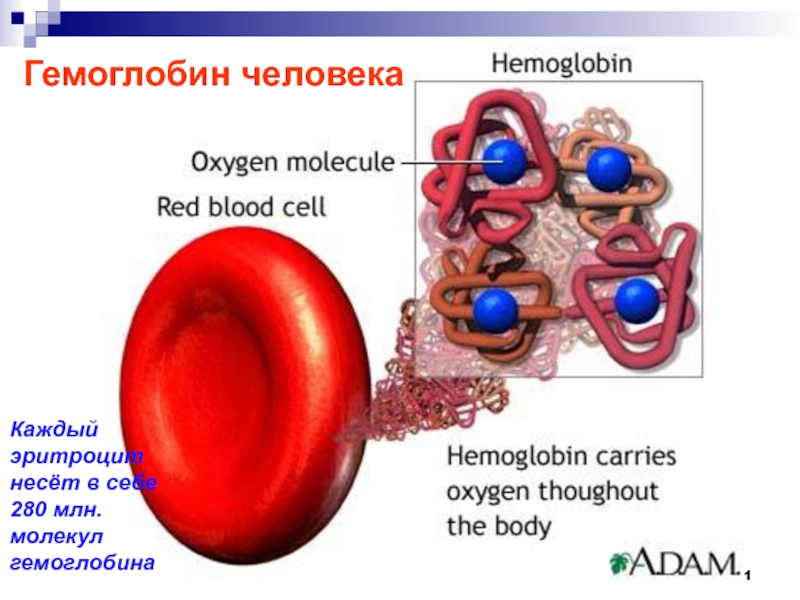
- 78. Гемоглобин выполняет роль переносчика кислорода от
- 79. Гемоглобин человека Схема связывания кислорода гемоглобином His93
- 80. Слайд 80
- 81. Гемоглобин человека Каждый эритроцит несёт в себе 280 млн. молекул гемоглобина
- 82. Строение белковой молекулы
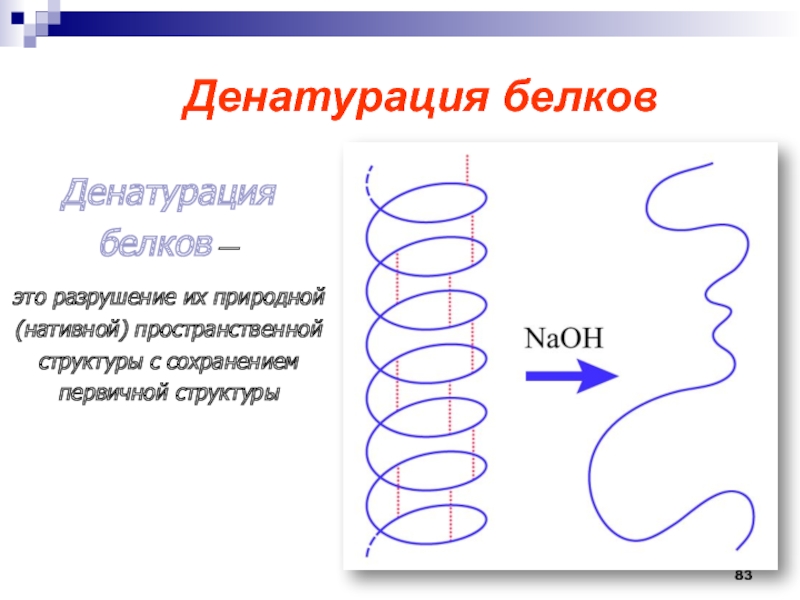
- 83. Денатурация белковДенатурация белков — это
- 84. Денатурированный белок теряет свои биологические свойства.
- 85. По данным Всемирной организации здравоохранения примерно половина
- 86. Цветные реакции на белки1. Ксантопротеиновая – взаимодействие
- 87. Спасибо!!!
- 88. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Пептиды
Пептиды — соединения, построенные из нескольких остатков -аминокислот, связанных амидной
(пептидной) связью - C(=O)-NH-
Слайд 3 (греч. Πεπτος, peptós — сваренный, переваренный,
питательный).
Термин «пептиды» (Э. Фишер)
пептоны (продукты расщепления белков пепсином)
+ конечные буквы названия углеводов полисахариды. ФИШЕР (Fischer), Эмиль
1852 г. –1919 г.
Нобелевская премия
по химии, 1902 г.
Пептиды
Слайд 5Основные функции пептидов:
регуляторная (рилизинг-факторы или либерины, нейромедиаторы);
гормональная (окситоцин, вазопрессин, брадикинин,
гастрин и др.);
антибиотическая (грамицидин А, В, С, S; актиномицин D
и др.);антиоксидантная (глутатион и др.);
регуляторы митоза (факторы роста);
функция витаминов (фолиевая кислота);
пептидные алкалоиды (эрготамин и др.);
токсическая (фаллоидин, аманитин и др.).
Слайд 6 Классификация пептидов:
В
зависимости от числа аминокислотных остатков различают ди-, три-, тетра –
и т.п. пептиды;
* Пептиды - с Мол. массой не более
10 000 у.е. ( ~ 100 АК остатков):
олигопептиды - не более 10 АК остатков; полипептиды - до 100 АК остатков.
* Белки - с Мол. массой, большей 10 000 у.е.
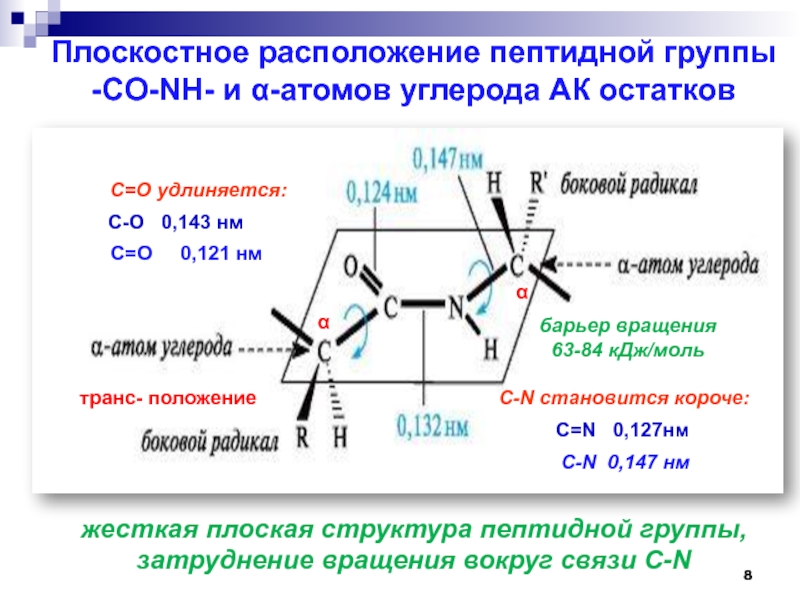
Слайд 8Плоскостное расположение пептидной группы -CO-NH- и α-атомов углерода АК остатков
С-О
0,143 нм
С=О 0,121 нм
α
α
C=N 0,127нм
барьер вращения
63-84 кДж/моль
С-N 0,147 нм
жесткая плоская структура пептидной группы,
затруднение вращения вокруг связи С-N
С=О удлиняется:
С-N становится короче:
транс- положение
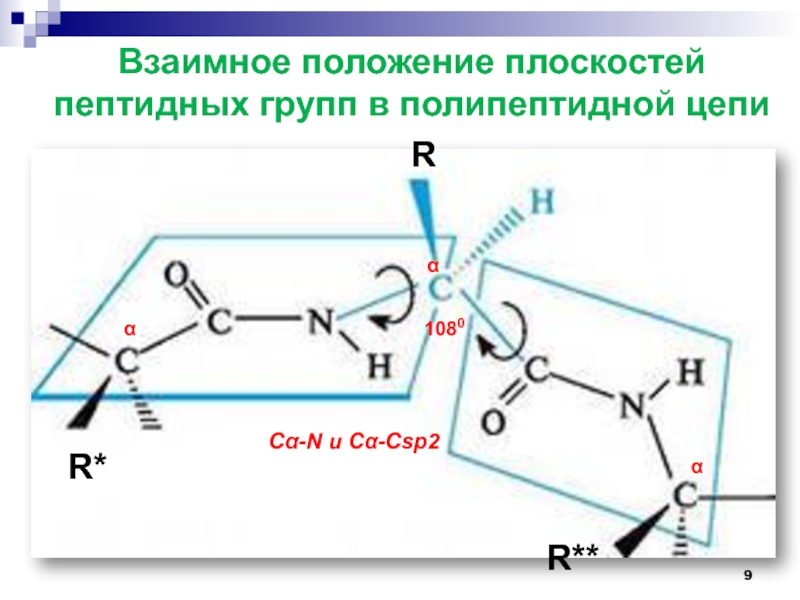
Слайд 9Взаимное положение плоскостей пептидных групп в полипептидной цепи
α
α
α
R
R*
R**
1080
Сα-N и Сα-Сsp2
Слайд 10Состав и аминокислотная последовательность
Аминокислотный состав пептидов и белков - это
природа и количественное соотношение входящих в них α-аминокислот.
Слайд 11Первичная структура пептидов и белков
- это аминокислотная последовательность, т.
е. порядок чередования α-аминокислотных остатков.
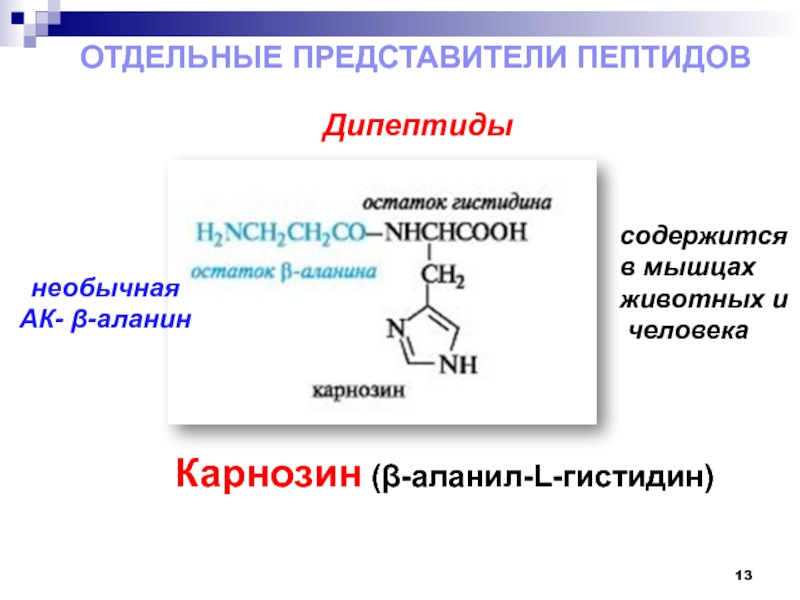
Слайд 13Дипептиды
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ ПЕПТИДОВ
содержится
в мышцах
животных и
человека
Карнозин (β-аланил-L-гистидин)
необычная
АК- β-аланин
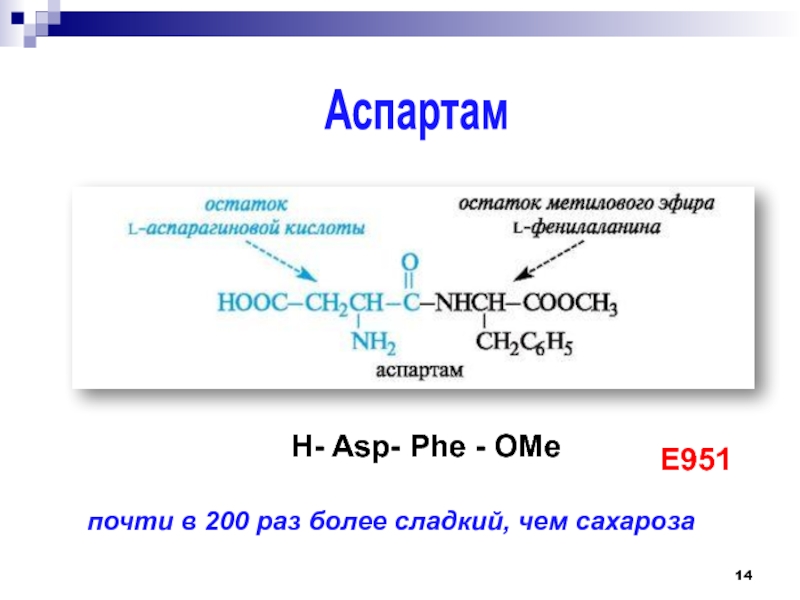
Слайд 15Аспартам
метиловый эфир L-Аспартил-L-Фенилаланина
Большое количество токсикологических и клинических исследований аспартама
подтверждают его безвредность, если дневная доза не превышает 50 мг на
килограмм массы. В Европе установлен максимум: 40 мг на килограмм массы в день. Практически 40 мг/кг массы тела для человека массой 70 кг значат примерно 266 таблеток синтетического подслащивающего средства или 26,6 л колы в один день.подсластитель
E951
Слайд 16ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ ПЕПТИДОВ
Глутатион участвует в ряде окислительно-восстановительных процессов
Слайд 18Тафтсин
Селанк — (Thr-Lys-Pro-Arg-Pro-Gly-Pro, лекарственный препарат, обладающий наиболее выраженной анксиолитической активностью
(противотревожным действием).
антибактериальная, противоопухолевая и противовирусная защита организма.
Слайд 19Селанк – первый в мире пептидный анксиолитик с уникальным сочетанием
психотропной активности: антидепрессивной, антиастенической и ноотропной
«Селанк можно применять и здоровым
людям. Я, кстати, считаю, что это даже нужно. Ведь нервозность общества из-за урбанизации только возрастает»- Академик РАН Н. Ф. МясоедовСлайд 20Нейропептиды (опиатные пептиды). пептиды, содержащиеся в головном мозге.
1975 г.
TyrGlyGlyPheMet
метионин-энкефалинTyrGlyGlyPheLeu лейцин-энкефалин
оказывают обезболивающее действие и используются как лекарственные средства.
контролируют деятельность эндокринных желез в организме человека;
- влияют на эмоциональное состояние
(Любовь, творчество, слава, власть)
Слайд 22Пептидные гормоны
3
8
дисульфидная связь
амидная
CONH2
1953 г. , Дю Виньо ,
выделяются задней долей гипофиза
только у женских особей
Первый синтез биологически активного
соединения, имеющего структуру белка Слайд 23Окситоцин (1954) вызывает сокращение гладких мышц матки и в меньшей
степени — мышц мочевого пузыря и кишечника, стимулирует отделение молока
молочными железами.воздействие на психоэмоциональную сферу мужчин
Слайд 24
Вазопрессин
(от лат. vas – cocyд и presso – давлю),
вызывает - сужение сосудов (действуя на гладкие мышцы их стенок);
- повышение кровяного давления (прессорный эффект), -- антидиуретический эффект - поддерживает на должном уровне обратное всасывание воды в прямых канальцах почек, уменьшает количество выделяющейся мочи.
Слайд 25 Даларгин
- синтетический аналог энкефалинов,биологически активных веществ из класса
эндогенных опиоидных пептидов, оказывающих влияние практически на все функции органов
пищеварительного тракта.Tyr-D-Ala-Gly-Phe-Leu-Arg
Слайд 26Применяется Даларгин при обострении язвенной болезни желудка и двенадцатиперстной кишки,
ускоряет заживление язвы; панкреатите, панкреанекрозе. а так же при нарушениях
психического состояния при алкоголизмеСлайд 27 Семакс
гептапептид метионил-глутамил-гистидил-фенилаланил-пролил-глицил-пролин, MetGluHisPheProGlyPro ,
— лекарственное средство,
оказывающее ноотропное и нейропротективное действие
Слайд 28Пептид АКТГ4-10 («Семакс») обладает нейроспецифическим эффектом в отношении ЦНС, влияет
на процессы, связанные с формированием памяти и обучением, обладающий ноотропным,
нейрометаболическим, нейропротективным, противоишемическим, антигипоксическим, антиоксидантным действием.Препарат усиливает внимание при обучении и анализе информации, улучшает консолидацию памятного следа, улучшает адаптацию организма к гипоксии, церебральной ишемии, наркозу и другим повреждающим воздействиям. Препарат практически не токсичен при однократном и длительном введении.
Слайд 29
Инсулин (от лат. insula — остров)
— гормон, ответственный
за контроль метаболизма углеводов, жиров и белков, вырабатывается -клетками поджелудочной железы.
С недостатком инсулина в организме связаны серьезные нарушения углеводного обмена (сахарный диабет).
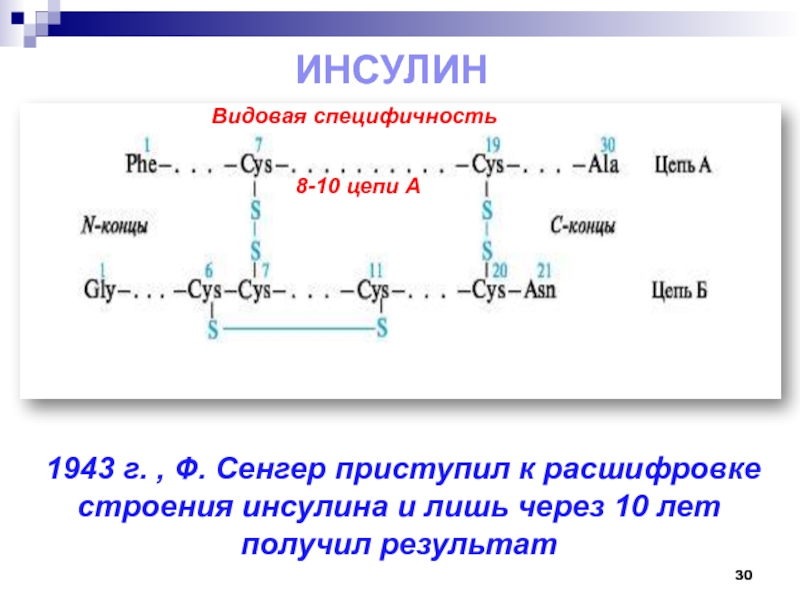
Слайд 30Инсулин
1943 г. , Ф. Сенгер приступил к расшифровке строения
инсулина и лишь через 10 лет получил результат
8-10 цепи А
Видовая
специфичность Слайд 31Шесть молекул инсулина ассоциированы в гексамер (видны три симметричные оси).
Молекулы удерживают вместе остатки гистидина, связанные ионами цинка. Введенный инсулин
находится под кожей в виде гексамера, постепенно распадаясь на биологически активные мономеры, поступающие в кровоток.NPH-инсулины Длительного действия
16-18 час. , «Изофан»
Слайд 32 Биолан
комплекс веществ
пептидной группы, природных нейропротекторных аминокислот и пептидов, оптимально сбалансированных и
необходимых для нормального и стабильного функционирования нервной системы и организма человека.- TrpAlaGlyGlyAspAlaSerGlyGlu -
Delta sleep inducng peptide, DSIP
Слайд 33при стрессе и заболеваниях нервной системы;
при хронической усталости, депрессии,
раздражительности, бессоннице;
в экстремальных ситуациях;
для повышения физической и умственной
работоспособности; для улучшения памяти, концентрации внимания, способности к обучению;
для укрепления иммунной системы, повышения сопротивляемости организма;
для ускорения выздоровления после заболеваний;
для повышения адаптационных возможностей организма;
для защиты от стрессов сердечно-сосудистой, дыхательной и эндокринной систем;
для уменьшения побочных явлений химио- и радиотерапии при лечении онкологических заболеваний;
при лечении алкоголизма и наркомании, при отвыкании от курения;
для защиты организма от воздействия экологических загрязнений.
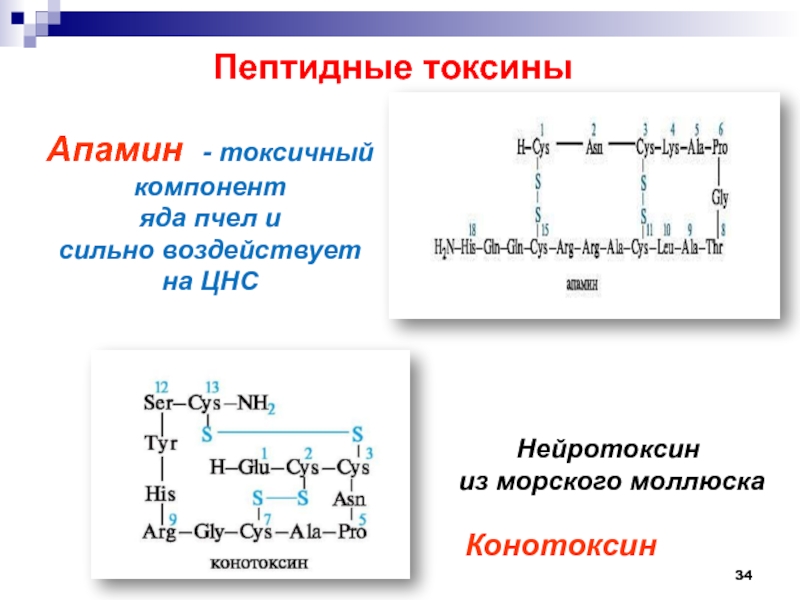
Слайд 34Пептидные токсины
Апамин - токсичный компонент
яда пчел и
сильно воздействует
на ЦНС
Нейротоксин
из морского моллюска
Конотоксин
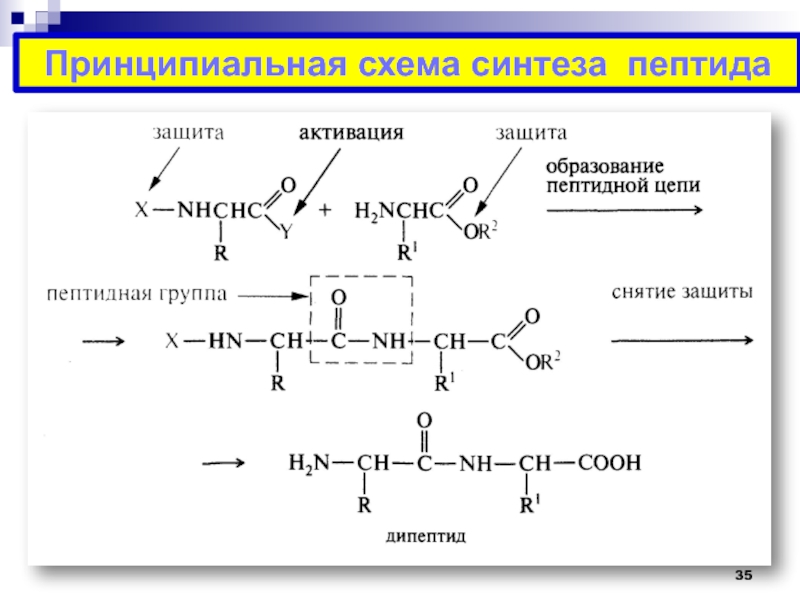
Слайд 36ИСКУССТВЕННЫЙ СИНТЕЗ ПЕПТИДОВ
Схема синтеза дипептида аланил-валина:
Первый компонент – N-концевая
аминокислота аланин
I. Защита группы –NH2
Z Ala OH
ZCl
Ala
2
экв. 1N NaoHСлайд 38Второй компонент
– С-концевая аминокислота валин
III. Защита группы –СООН
Val
Val
OEt
1 экв.1N NaOH
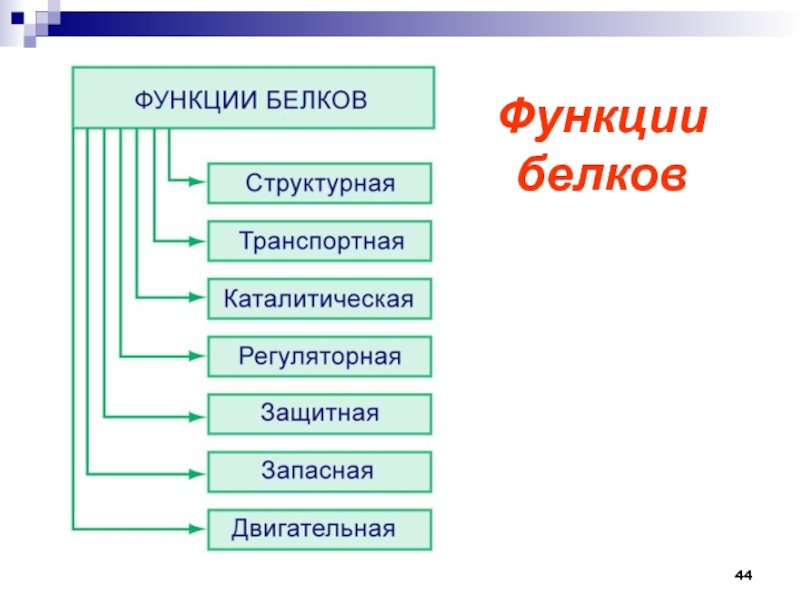
Слайд 45Строительная (пластическая) – белки участвуют в образовании оболочки клетки, органоидов
и мембран клетки.
Каталитическая – все клеточные катализаторы – белки
(активные центры фермента). Двигательная – сократительные белки вызывают всякое движение.
Транспортная – белок крови гемоглобин присоединяет кислород и разносит его по всем тканям.
Защитная – выработка белковых тел и антител для обезвреживания чужеродных веществ.
Энергетическая – 1 г белка эквивалентен 17,6 кДж.
Рецепторная – реакция на внешний раздражитель
Функции белков
Слайд 47Первичная структура пептидов и белков.
Аминокислотный состав пептидов и белков -
это природа и количественное соотношение входящих в них α-аминокислот.
Первичная структура
пептидов и белков –это аминокислотная последовательность,
т. е. порядок чередования α-аминокислотных остатков.
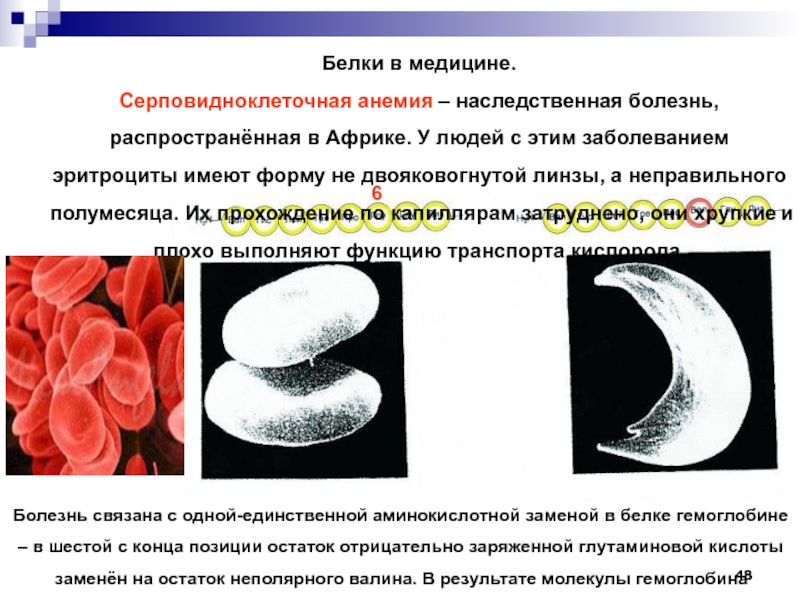
Слайд 48Белки в медицине.
Серповидноклеточная анемия – наследственная болезнь, распространённая в Африке.
У людей с этим заболеванием эритроциты имеют форму не двояковогнутой
линзы, а неправильного полумесяца. Их прохождение по капиллярам затруднено, они хрупкие и плохо выполняют функцию транспорта кислорода.Болезнь связана с одной-единственной аминокислотной заменой в белке гемоглобине – в шестой с конца позиции остаток отрицательно заряженной глутаминовой кислоты заменён на остаток неполярного валина. В результате молекулы гемоглобина слипаются в цепочки.
6
Слайд 49
Вторичная структура белков
Вторичная структура белка — это более
высокий уровень структурной организации, в котором закрепление конформации происходит за
счет водородных связей между пептидными группами.Слайд 50 Лайнус Карл
Полинг
1901—1994
выдающийся американский химик и физик, общественный деятель.
Нобелевская
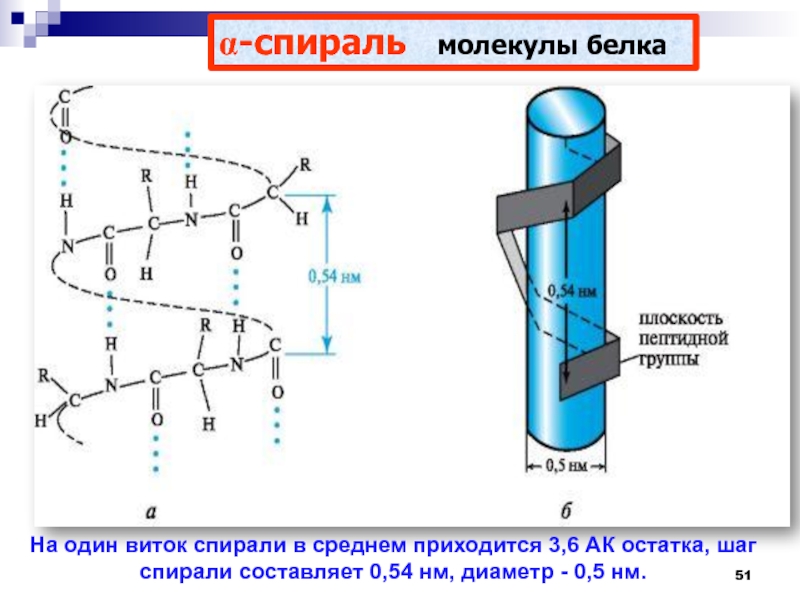
премия по химии (1954), Нобелевская премия Мира (1962) Слайд 51a-спираль молекулы белка
На один виток спирали в среднем приходится
3,6 АК остатка, шаг спирали составляет 0,54 нм, диаметр -
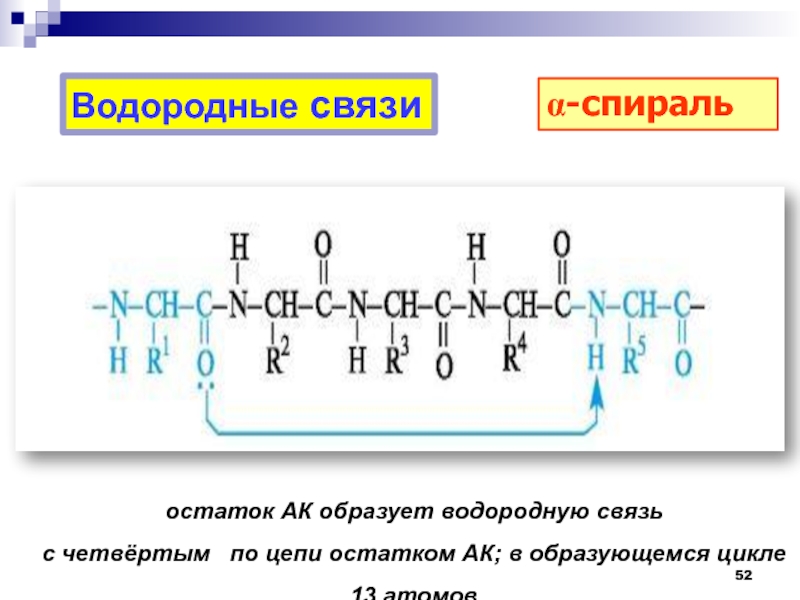
0,5 нм.Слайд 52Водородные связи
остаток АК образует водородную связь
с четвёртым по
цепи остатком АК; в образующемся цикле 13 атомов
a-спираль
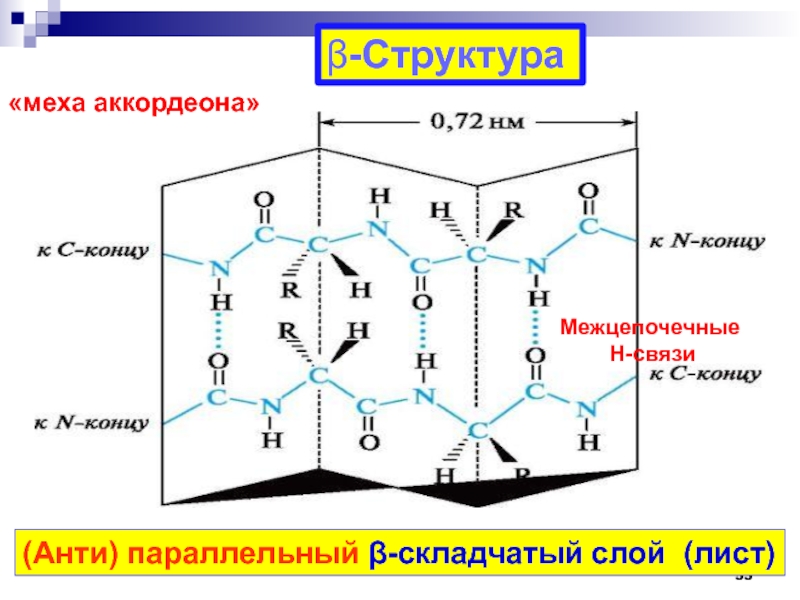
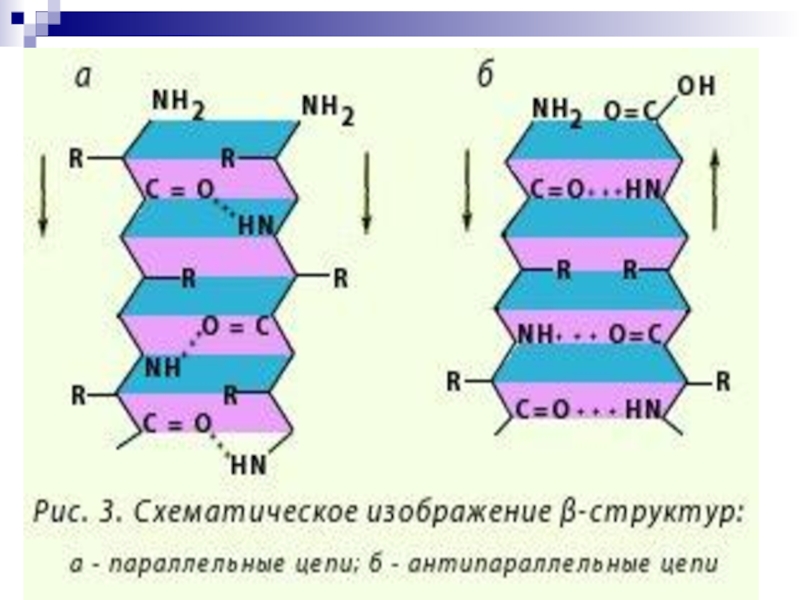
Слайд 53-Структура
(Анти) параллельный -складчатый слой (лист)
«меха аккордеона»
Межцепочечные
Н-связи
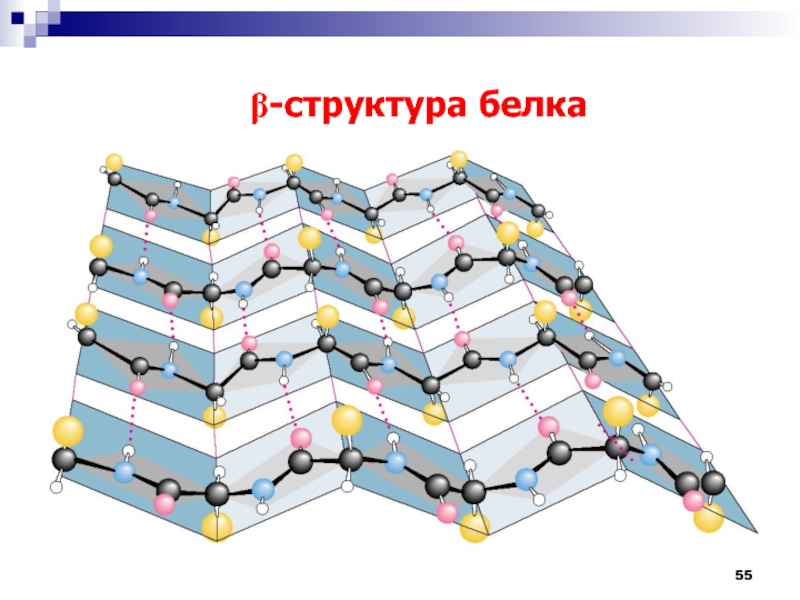
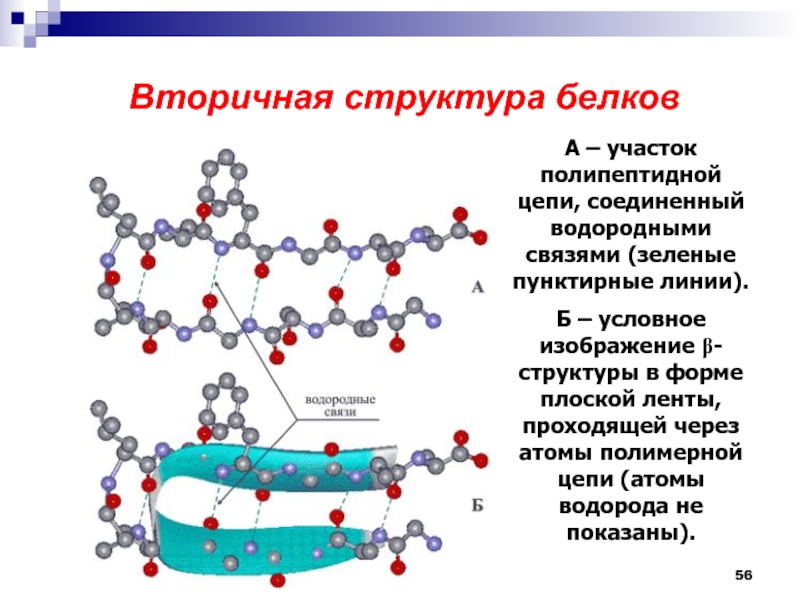
Слайд 56
Вторичная структура белков
А – участок полипептидной цепи, соединенный
водородными связями (зеленые пунктирные линии).
Б – условное изображение b-структуры
в форме плоской ленты, проходящей через атомы полимерной цепи (атомы водорода не показаны). Слайд 58Домены – глобулярные области в пределах одной белковой молекулы
Домены соединены
шарнирным участком
Доменная структура NAD+-зависимой дегидрогеназы
Начиная с молекулярной массы примерно 14
— 16 кДа прослеживается тенденция к формированию белковой молекулы из двух ( и более) в той или иной мере независимо образованных глобул, каждая из которых имеет свое гидрофобное ядро. Такие глобулы — домены — формируются различными отрезками одной и той же полипептидной цепи. Слайд 59Полипептидная цепь, включающая элементы той или иной вторичной структуры, способна
вся целиком укладываться определенным образом в пространстве, т.е. приобретает
третичную структуру. При этом во взаимодействие вступают боковые радикалы -аминокислотных остатков, находящиеся в линейной полипептидной цепи на значительном удалении друг от друга, но сближенные в пространстве за счет изгибов цепиСлайд 60молекула приобретает форму компактного клубка – глобулярные белки
(globules, лат.
шарик, эллипсоид вращения),
мало Н-связей, растворимы в воде.
Нитевидная форма –
фибриллярные белки, (fibra, лат. волоконце), много межцепочечных Н-связей, нерастворимы в воде .Третичная структура
Третичной структурой белка называется способ укладки полипептидной цепи в пространстве
Слайд 62
Глобулярные белки
ГЛОБУЛЯРНАЯ СТРУКТУРА АЛЬБУМИНА (белок куриного яйца). В структуре помимо
дисульфидных мостиков присутствуют свободные сульфгидридные HS-группы цистеина, которые в процессе
разложения белка легко образуют сероводород – источник запаха тухлых яиц. Дисульфидные мостики намного более устойчивы и при разложении белка сероводород не образуютТретичная структура
содержит α-спирали,
соединенные
одиночными цепями
Слайд 63
РАЗЛИЧНЫЕ ВАРИАНТЫ ИЗОБРАЖЕНИЯ третичной СТРУКТУРЫ БЕЛКА КРАМБИНА.
А– структурная формула
в пространственном изображении.
Б – структура в виде объемной модели.
В – третичная структура молекулы.
Г – сочетание вариантов А и В.
Д – упрощенное изображение третичной структуры.
Е – третичная структура с дисульфидными мостиками.
Растительный белок Крамбин из Crambe Abyssinica, имеющий всего 46 аминокислотных остатков
Слайд 64
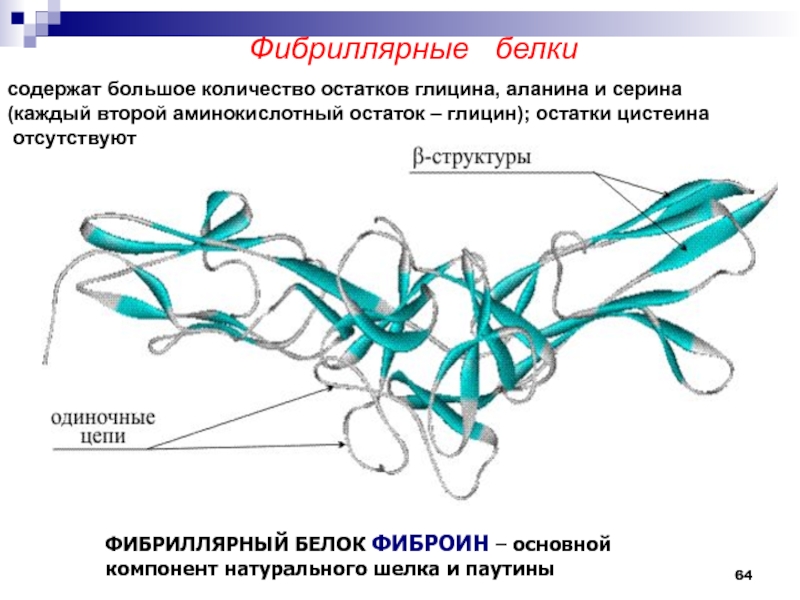
Фибриллярные белки
ФИБРИЛЛЯРНЫЙ БЕЛОК ФИБРОИН – основной компонент натурального шелка
и паутины
содержат большое количество остатков глицина, аланина и серина
(каждый второй аминокислотный остаток – глицин); остатки цистеина
отсутствуют
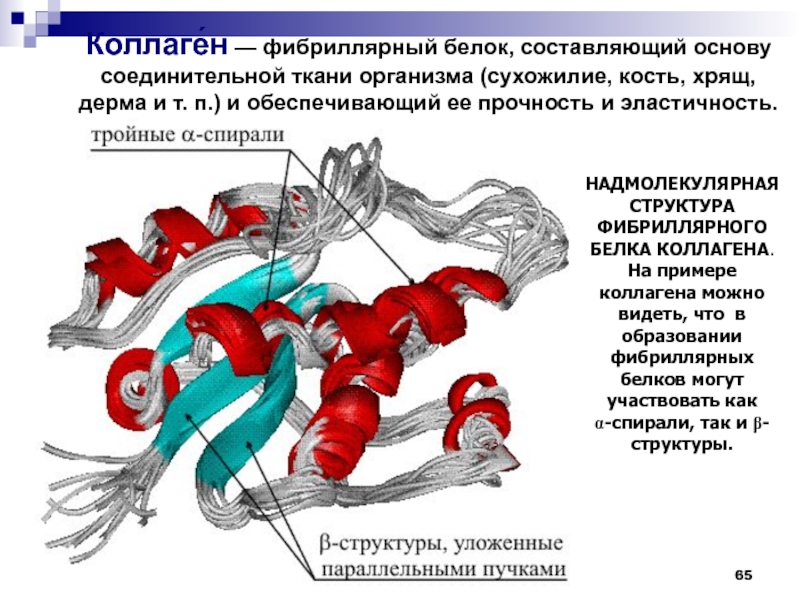
Слайд 65
НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА ФИБРИЛЛЯРНОГО БЕЛКА КОЛЛАГЕНА. На примере коллагена можно видеть,
что в образовании фибриллярных белков могут участвовать как a-спирали, так
и b-структуры.Коллаге́н — фибриллярный белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и т. п.) и обеспечивающий ее прочность и эластичность.
Слайд 66Молекула коллагена представляет собой правозакрученную спираль из 3 α-цепей (тропоколлаген).
Один виток спирали α-цепи содержит три аминокислотных остатка -Gly-Pro-HyPro-
Молекулярная
масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм. Троично-спиральная модель
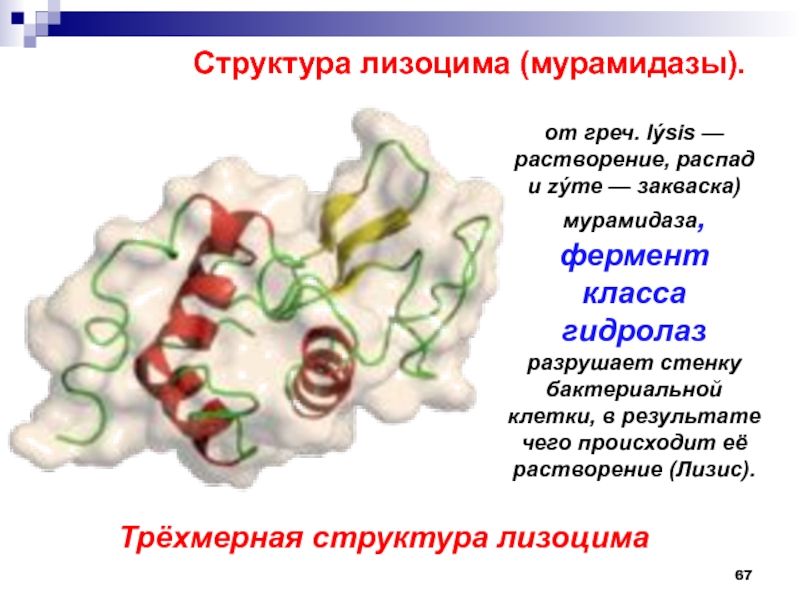
Слайд 67от греч. lýsis — растворение, распад и zýme — закваска)
мурамидаза, фермент класса гидролаз разрушает стенку бактериальной клетки, в результате
чего происходит её растворение (Лизис).Структура лизоцима (мурамидазы).
Трёхмерная структура лизоцима
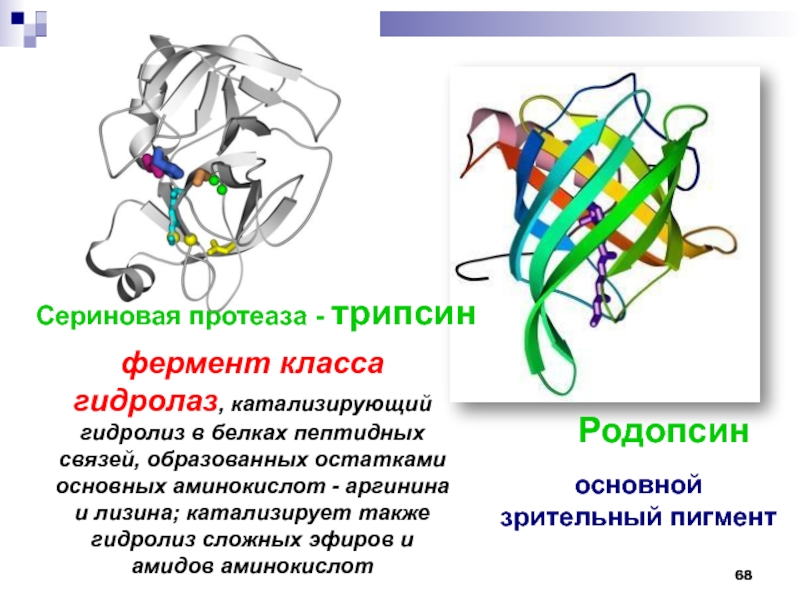
Слайд 68Сериновая протеаза - трипсин
Родопсин
фермент класса гидролаз, катализирующий гидролиз в белках
пептидных связей, образованных остатками основных аминокислот - аргинина и лизина;
катализирует также гидролиз сложных эфиров и амидов аминокислотосновной
зрительный пигмент
Слайд 69ацилтрансфераза
пиктатлиаза С
Ацилтрансфераза— фермент, тип трансферазы,
переносящей ацильную группу на молекулу субстрата.Слайд 70У бактерий имеются трансмембранные каналообразующие белки, так называемые порины. Эти
белки - тримеры образуют поры, заполненные водой и проницаемые для
молекул с молекулярной массой до 600 ДаПорины - трансмембранные белки, представляющие собой гидрофильные поры в липофильной мембране
Слайд 71Этот белок может существовать в двух конформациях – “здоровой” PrPC,
которую можно обнаружить в здоровых клетках и “патологической” – PrPSc,
которая является прионом. Для PrPC формы характерно преобладание α- спиралей, а для PrPSc – наличие β-складчатых слоёв.Прионы
– это инфекционный агент, который представляет собой аномальную модификацию белка мембран нервных клеток под названием PrP (прионный белок), которая катализирует превращение нормальных молекул PrP в себе подобные.
Слайд 72Губчатые энцефалопатии
* Синдром Крейцфельда-Якоба
* синдром Герсманна–Штройслера–Шейнкера
* хроническая
семейная бессонница,
* болезнь куру (связана с ритуальным каннибализмом
народности Форе в восточной части Новой Гвинеи)* скрепи
дегенеративное изменение мозга под воздействием
инфекции или аномальных белков - ПРИОНОВ
* коровье бешенство
Лечения прионных инфекций не существует.
Слайд 73Проявляется болезнь медленно прогрессирующими нарушениями памяти и мыслительных функций (деменцией),
которые в итоге приводят к смерти.
Образование прионов может произойти
спонтанно, быть результатом наследуемой мутации соответствующего гена или возникнуть при попадании прионов извне – при нейрохирургических манипуляциях, каннибализме и употреблении в пищу мозга больных животных.В результате перерождения ткань мозга повреждается с образованием
множества небольших полостей, из-за чего мозговое вещество больных
напоминает губку.