Слайд 1Научный руководитель:
Ст. преподаватель кафедры
экологии, биологии и природных ресурсов
Е. В. Гринберг
МИНИСТЕРСТВО
НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФГБОУ ВО «САХАЛИНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
ИНСТИТУТ
ЕСТЕСТВЕННЫХ НАУК И ТЕХНОСФЕРНОЙ БЕЗОПАСНОСТИ КАФЕДРА ЭКОЛОГИИ, БИОЛОГИИ И ПРИРОДНЫХ РЕСУРСОВ
Презентация по дисциплине:
«Практикум по БОР»
На тему: «Фитофильные рыбы»
Работу выполнила:
Студентка III курса, группа 301 Направление «Водные биоресурсы
и аквакультура» Пак Кристина Дмитриевна
Слайд 2Актуальность
Теория экологических групп Крыжановского является
обобщающей
рыб С. Г. в
экологической эмбриологии рыб
и важна для
искусственного рыборазведения. Любая биотехника
невозможна организма
без понимания рыб с условиями
рыборазведения взаимоотношения окружающей среды.
Знание экологической специфики
рыб имеет большое значение для разработки рыбоводно- мелиоративных мероприятий, улучшающих
условия размножения рыб, а также позволяет обоснованно проводить работы по акклиматизации и рыбоводству.
Слайд 3Цель и задачи
Цель работы – углубить и закрепить теоретические знания
о специфике строения половых клеток, раннего онтогенеза, условий абиотики и
биотики в период нереста и о воспроизводительном поведении рыб, относящихся к фитофильной экологической группе.
Для достижения цели необходимо выполнить следующие задачи:
Ознакомиться с особенностями эмбрионального и постэмбрионального развития рыб фитофильной группы;
Установить какие виды рыб относят к фитофилам;
Выяснить технологию искусственного воспроизодства на основе специфики развития в естественных условиях;
Рассмотреть классификацию способов размножения у рыб по Е. К. Балону.
Слайд 4Определение понятия
Фитофилы – рыбы, которые размножаются среди растений, откладывают свою
икру в стоячей или слаботекущей воде на вегетирующую (свежезеленую) или
на отмершую растительность. К этой группе относят рыб с весенне – летним нерестом (карповые, окуневые и др.).
Слайд 5Некоторые виды рыб – представители фитофильной группы
К пресноводным фитофилам относят: сазан,
лещ, плотва, линь, щука, язь, окунь, судак, ерш и др.
Среди
морских рыб на растения откладывают икру
приклеивают икру к тихоокеанская и
атерина, сарган, густо растительному субстрату беломорская сельди.
Слайд 6Некоторые виды рыб – представители фитофильной группы
Рис. 1 – Фото
сазана (лат. Cyprinus carpio).
Слайд 7Рис. 2 – Фото линя (лат. Tinca tinca).
Слайд 8Рис. 3 – Фото речного окуня (лат. Perca fluviatilis).
Слайд 9Рис. 4 – Фото атерины южноевропейской (лат. Atherina boyeri).
Слайд 10Икра некоторых фитофильных рыб
Рис. 5 – Фото кладки икры фитофильной
рыбы – скалярии.
Слайд 11Рис. 6 – Фото кладки икры речного окуня.
Слайд 12Морфологические признаки икры (на примере обыкновенного карпа)
Икра обыкновенного карпа имеет
зеленоватый цвет, очень клейкая, так как в природе она прикрепляется
на корни растений или другие предметы расположенные под водой.
Основная масса плазмы икринки отделена от желтка и расположена на анимальном полюсе. При попадании икринок в воду плазма еще больше концентрируется на анимальном полюсе в виде бластодиска, где происходят основные жизненные процессы развивающегося яйца – дробление, гаструляция и закладка органов. И этой частью яйцо постоянно ориентировано вверх внутри оболочки. Таким образом, анимальная часть яйца с развивающимся бластодиском оказывается в более благоприятных условиях дыхания, чем вегетативная, обращенная вниз.
Зрелые икринки имеют диаметр 1,0 – 1,5 мм.
Плодовитость высокая – до 1,5 млн икринок.
Слайд 13Рис. 7 – Фото икринок обыкновенного карпа.
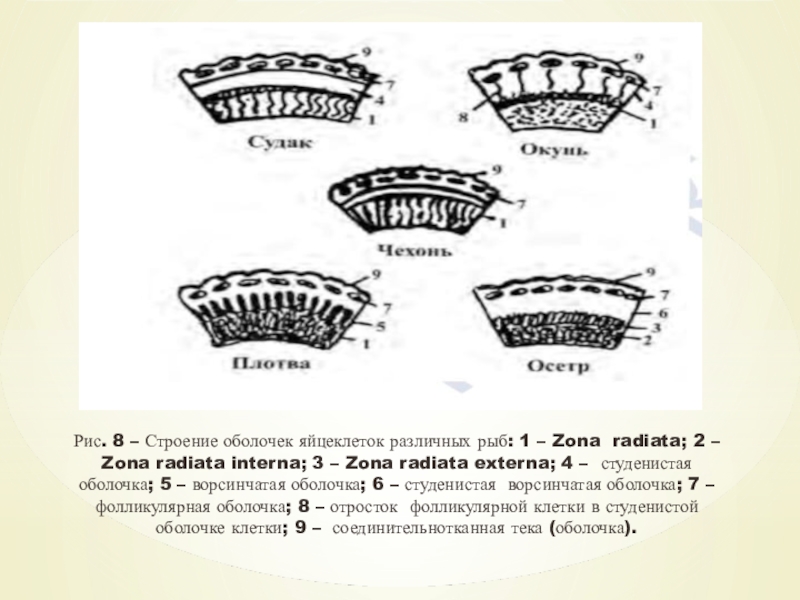
Слайд 14Особенности строения яйцевых оболочек фитофилов
Строение яйцевых оболочек рыб тесно связано
с экологией их нереста. Наиболее просто устроена оболочка у рыб,
выметывающих икру в толщу воды (например, чехонь, белый амур). Она представлена только одной первичной (или собственной) оболочкой, называющейся лучистой зоной (Zona radiata).
Сложнее устроена
оболочка
у
рыб
с
приклеивающейся икрой. У многих рыб поверх лучистой зоны имеется студенистая оболочка вторичного происхождения, сравнительно тонкая, как, например, у судака или очень толстая, как у окуня. В воде эта оболочка набухает и приклеивается к субстрату.
же функцию выполняет
У других рыб такую ворсинчатая оболочка
вторичного происхождения,
например, у плотвы.
Слайд 15Очень сложно построены оболочки у осетровых. У них имеются две
лучистые зоны – внутренняя и внешняя (Zona radiata interna и
z.r. externa), а также вторичная студенисто-ворсинчатая оболочка, приклеивающаяся к субстрату. Существование двух лучистых зон связывают с амортизационными свойствами икры, на которую может оказывать механические воздействия перекатывающаяся по дну галька.
Слайд 16Рис. 8 – Строение оболочек яйцеклеток различных рыб: 1 –
Zona radiata; 2 – Zona radiata interna; 3 – Zona
radiata externa; 4 – студенистая оболочка; 5 – ворсинчатая оболочка; 6 – студенистая ворсинчатая оболочка; 7 – фолликулярная оболочка; 8 – отросток фолликулярной клетки в студенистой оболочке клетки; 9 – соединительнотканная тека (оболочка).
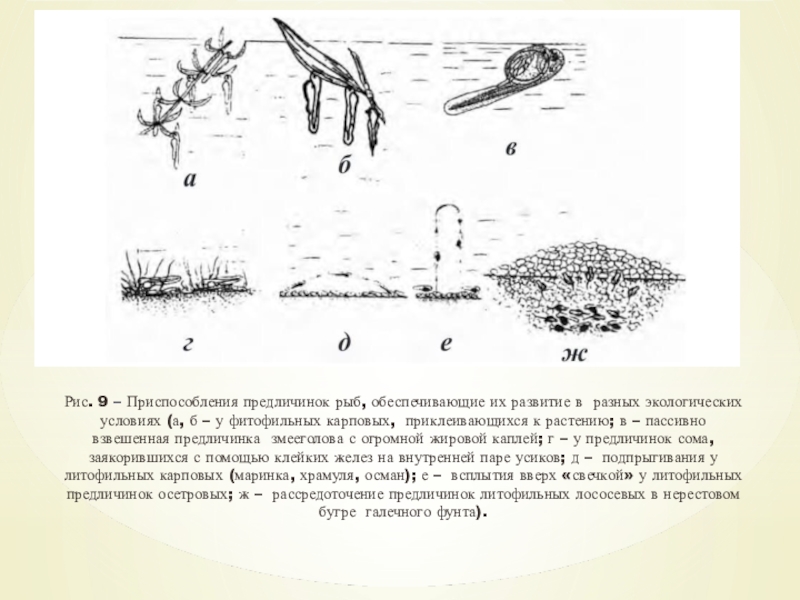
Слайд 17Приспособления к развитию у предличинок фитофильных рыб
Для вылупившихся предличинок фитофильных
рыб характерен способ развития в подвешенном состоянии (рис. 9, а).
Вылупившиеся из оболочки предличинки фитофильных рыб всплывают вверх, а поскольку они снабжены специальными органами приклеивания, то они, натыкаясь на стебли и листья растений в воде, приклеиваются к ним теменной частью головы (рис. 9, б).
У вьюновых рыб мощный железистый орган приклеивания развит на переднем конце головы предличинки (рис. 9, в). Предличинки обыкновенного сома приклеиваются внутренней парой усиков (рис. 9, г).
Слайд 18Рис. 9 – Приспособления предличинок рыб, обеспечивающие их развитие в
разных экологических условиях (а, б – у фитофильных карповых, приклеивающихся
к растению; в – пассивно взвешенная предличинка змееголова с огромной жировой каплей; г – у предличинок сома, заякорившихся с помощью клейких желез на внутренней паре усиков; д – подпрыгивания у литофильных карповых (маринка, храмуля, осман); е – всплытия вверх «свечкой» у литофильных предличинок осетровых; ж – рассредоточение предличинок литофильных лососевых в нерестовом бугре галечного фунта).
Слайд 19Биотехника выращивания фитофильных рыб (на примере карповых)
Основные этапы искусственного воспроизводства
:
Выбор будущих производителей карпа
При выборе будущего производителя необходимо тщательно рассмотреть
форму, распределение чешуи, состояние здоровья и развитие половых органов.
Введение в подходящих производителей гонадотропных гормонов
Инъекции гонадотропного гормона, полученные из сухого гипофиза вызывают окончательное созревание и овуляцию спящей икры. Эти инъекции заменяют стимулирующее воздействие, которое в естественном процессе были бы необходимы из окружающей среды.
Слайд 203. Получение и осеменение икры карпа
Получать половые продукты начинают через
18-20 часов после разрешающей инъекции. За 30-40 мин до получения
икры отцеживают сперму самцов в сухие боксы, закрывают их крышками и хранят в темноте в термосе со льдом или в холодильнике. Икру отцеживают в мерную эмалированную или стеклянную посуду, причем строго следят, чтобы вместе с ней в посуду не попала вода, затем икру взвешивают или определяют ее объем и ставят в прохладное место, накрыв влажным полотенцем или марлей. Отцеживание икры прекращают, когда появляются комки слипшейся икры и сгустки крови.
Осеменяют икру карпа сухим способом в эмалированных или полиэтиленовых тазах. Для осеменения икры одной самки используют сперму от 3-4 самцов в количестве 1,5-2,0 см3 на 1 кг икры. Добавление воды способствует активизации сперматозоидов, что повышает процент оплодотворения икры, который зависит от индивидуальных особенностей производителей и составляет 82-98%.
Слайд 214. Обесклеивание икры
После осеменения икру нужно обесклеить. Для этого можно
использовать препарат ПАС-Г, порошок талька, цельное молоко, зубной порошок. Обесклеивают
икру в 8- литровых аппаратах Вейса, в которых, в дальнейшем икру инкубируют, в течение 30 мин. Перед загрузкой икры в аппарат наливают 2 л обесклеивающего раствора, снизу подают сжатый воздух и помещают 500-600 тыс.шт. икринок (примерно 0,8-1,0 кг).
После завершения обесклеивания икры подачу воздуха прекращают и в аппарат Вейса подают воду, постепенно увеличивая ее расход. Отходы, образующиеся при обесклеивании икры, и рабочий раствор удаляют из аппарата через водосливные шланги и водоотводящие лотки.
Слайд 225. Инкубация икры карпа
Наиболее распространенным аппаратом для инкубации икры карпа
является аппарат Вейса. Инкубацию икры карпа обычно проводят при температуре
воды 20-22°С. При использовании аппаратов Вейса икру от каждой самки помещают в отдельный аппарат, причем время между загрузкой первого и последнего аппаратов, расположенных на одной рыбоводной стойке, не должно превышать 4 ч, чтобы был одновременный переход предличинок, находящихся в одном лотке, на внешнее питание.
Уход за икрой во время инкубации заключается в контроле за ее развитием, в регулировании водоподачи, в борьбе с сапролегниозом и отборе мертвой икры. Уже на 3-и сутки после закладки икры в аппараты необходимо начинать удаление мертвой икры. Для этого уменьшают водообмен, в результате мертвые икринки всплывают на поверхность, откуда их удаляют с помощью сифонной трубки, после чего в аппаратах вновь устанавливают нормальный водообмен. Круглосуточно наблюдают за температурой воды. При оптимальной температуре 22°С инкубация длится 72 ч.
Слайд 236. Выдерживание предличинок карпа
Вылупление эмбрионов карпа, инкубируемых в аппаратах Вейса,
проходит на рамках, устанавливаемых в лотках для выдерживания личинок на
глубине 5-6 см от поверхности воды. Перед загрузкой рамок икрой лоток заполняют водой с температурой на 2°С выше, чем в аппаратах Вейса. При появлении первых предличинок в аппарате Вейса икру широким сифоном переливают в таз и переносят на рамки по 250-300 тыс. икринок на каждую. Выход предличинок из оболочек проходит в течение 20-30 мин. Температура воды в лотке не должна быть ниже, чем в аппаратах Вейса.
Выдерживание вылупившихся личинок на рамках в стеклопластиковых лотках при температуре воды 22°С осуществляют в течение 1-2 суток, при 20°С - 3 суток. Переход личинок на смешанное питание свидетельствует о том, что плавательный пузырь заполнен воздухом. С этого момента их можно пересаживать в пруды для подращивания или начинать кормить. Учет выдержанных и перешедших на внешнее питание личинок осуществляют эталонным способом.
Слайд 247. Подращивание личинок карпа
Более удобны в эксплуатации для подращивания личинок
карпа – бассейны. Они компактны и для их установки требуется
меньшая площадь.
Плотность посадки личинок карпа на подращивание определяется планируемой длительностью подращивания личинок, их конечной массой, типом емкости, в которой проводится подращивание личинок, вида и количества корма и др. Продолжительность подращивания определяется температурой воды. При температуре 20-25°С она составляет 15-13 суток, при 26-28°С – 12-10 суток. При подращивании до стандартной массы 20-30 мг практикуется плотность посадки в пределах 150-200 тыс./м3. Выход личинок при такой плотности посадки обычно более 70 %.
Одним из важнейших значительной степени
факторов, от которого в зависит успех заводского
подращивания
личинок, является обеспечение их
полноценной пищей. Имеются различные подходы к решению этой проблемы.Обеспечение личинок пищей заключается в культивировании различных форм пресноводных беспозвоночных.
Слайд 25Важным направлением является разработка рецептов искусственных кормов, заменяющих полностью или
частично живые корма. Разработано много рецептов комбикормов, которые могут использоваться
для кормления личинок рыб, с добавлением живых кормов. Наилучшие результаты получают при сочетании живых и искусственных кормов, в качестве которых используют кормовые смеси, состоящие из компонентов животного происхождения, с добавлением гидролизных дрожжей. Первые десять дней смесь вносят в виде суспензии по поверхности воды 10-12 раз в сутки, в количестве, равном общему весу личинок. В последующие 10 дней норму уменьшают до 50 %, а при дальнейшем подращивании – до 30 % от веса личинок. С пятнадцатидневного возраста малькам дают корм в виде густой массы, которую наносят на металлические сеточки или керамические осколки. После 20 дней подращивания личинок живой корм им уже не дают, но в кормовые смеси добавляют фосфатиды, кормовые дрожжи, рыбий жир, витамины, сок зеленой растительности или суспензию из хлореллы.
Нормы внесения сухих искусственных кормов составляют 50-100% от массы тела личинок при их подращивании. Кратность внесения кормов составляет не менее 10-12 раз в сутки. Для кормления личинок можно использовать различные автокормушки. Сочетание высококачественных рационов кормления с многократным внесением корма способствует лучшему использованию корма личинками, повышая эффективность выращивания.
Учет подрощенной молоди ведут эталонным способом или при помощи счетного аппарата “ИДА”. Перевозку молоди в выростные пруды осуществляют в полиэтиленовых пакетах. Выпуск молоди в пруды проводят после выравнивания температуры воды в пакетах и в пруду.

Слайд 268. Выращивание сеголеток карпа
Технология получения стандартных сеголетков карпа в выростных прудах включает следующие процессы: подготовку
и залитие выростных прудов водой,
посадку в них
неподрощенных
личинок или подрощенной молоди и выращивание сеголетков, спуск выростных прудов,
вылов и учет сеголетков. Основная задача выращивания молоди в выростных прудах - получение сеголетков определенной массы и упитанности, обеспечивающих благоприятный исход зимовки и хороший прирост на второе лето.
Слайд 27Классификация способов размножения (гильдий) у круглоротых и рыб (по Е.
К. Балону)
Слайд 28Классификация способов размножения (гильдий) у круглоротых и рыб (по Е.
К. Балону) (продолжение)
Слайд 29Классификация способов размножения (гильдий) у круглоротых и рыб (по Е.
К. Балону) (продолжение)
Слайд 30Заключение
В процессе выполнения данной работы ознакомились с особенностями эмбрионального и постэмбрионального развития рыб фитофильной группы.
какие виды рыб относят к
Установили фитофилам.
Выяснили
технологию искусственного
воспроизодства фитофильных
рыб на основе
специфики развития в естественных условиях.
Рассмотрели классификацию способов размножения
у рыб по Е. К. Балону.